Penicillin
und Lyme-Borreliose |
| G. Stanek
Klin. Institut für Hygiene und Medizinische Mikrobiologie,
Abt. Infektionsimmunologie, Medizinische Universität Wien
(Vorstand: Univ.-Prof. Dr. M. Rotter) |
|
|
Vorgeschichte
Im
Jahr 1883 beschrieb Alfred Buchwald (1883) aus Breslau eine
„diffuse, idiopathische Hautatrophie“, die bei einem
36-jährigen Patienten bereits über 16 Jahre bestanden
hatte. Aufgrund der Schilderung des Falles und der histologischen
Bilder handelte es sich dabei um die erstmalige Beschreibung
der chronisch progredienten Dermato-Borreliose Acrodermatitis
chronica atrophicans. Weitere Fallberichte über die atrophische
und auch die entzündliche Phase der Erkrankung kamen dazu.
1902 beschrieben Herxheimer und Hartmann die Entwicklung dieser
Hauterkrankung von einer frühen entzündlichen Phase
in eine späte chronische und benannten das Krankheitsbild
Acrodermatitis chronica atrophicans (ACA). Das gesamte Spektrum
der Erscheinungen wurde in den Jahren danach beschrieben, nämlich
Haarverlust, makuläre Atrophie (Anetoderma), sklerodermieartige
Veränderungen, ulnare Bänder, fibroide Knoten (Herxheimer
& Schmidt 1910) und das typische Erscheinungsbild der chronisch
atrophischen Haut, wie „zerknülltes Zigarettenpapier“
(Abbildung 1). Später wurde beobachtet,
dass einige Patienten an Gelenksschmerzen litten, bevor sich
die ACA entwickelte (Jessner 1921, Ehrmann & Falkenstein
1925), und dass bei mehr als 10% der ACA-Patienten Gelenksveränderungen
vorlagen (Jessner & Loewenstamm 1924).
Histopathologische
Veränderungen wurden ursprünglich schon von Buchwald
(1883) beschrieben. Ehrmann und Falkenstein (1925) veröffentlichten
Studienergebnisse, wobei sie auf eine Analogie der histologischen
Veränderungen bei Syphilis und ACA hinwiesen. Insbesondere
die große Zahl von Plasmazellen und die Ausbreitung der
entzündlichen Infiltrate entlang der perivenösen Lymphgefäße
führten
zu diesem Vergleich. Sie postulierten die kontinuierliche Ausbreitung
des „Virus“ entlang der Gefäße sowie
seine gelegentliche Ausbreitung über die Blutbahn.
Im
Oktober 1909 berichtete Arvid Afzelius (1910) bei einem Dermatologen
treffen in Stockholm über die Entwicklung eines „Erythema
migrans“ bei einer Patientin nach Zeckenstich. Im selben
Jahr beschrieb Wilhelm Balban aus Wien (1910) detailliert die
Entwicklung von annulären Erythemen bei drei Patienten.
1913 beschrieb Benjamin Lipschütz aus Wien einen Fall von
„Erythema chronicum migrans“. Er beobachtete die
Ausbreitung der Hautläsion, die von der Kniekehle ausging,
über sieben Monate. Das Erythem erstreckte sich schließlich
über den Oberschenkel und den Rücken bis zum Nacken
und schwand dann spontan. Lipschütz vermerkte, dass die
histologischen Veränderungen völlig unspezifisch waren
(Lipschütz 1913). Später berichtete Lipschütz
von einem Patienten mit zwei gleichzeitig bestehenden Erythema
migrans-Läsionen (Lipschütz 1923).
Im
Jahr 1911 beschrieb Jean Louis Burckhardt aus Basel erstmals
ein solitäres Lymphozytom (Burckhardt 1911), das bei einer
60-jährigen Frau als erythematöser Plaque (2 x 6 cm)
über einige Wochen am Oberarm zu beobachten war. Histologisch
zeigte sich Lymphgewebe mit Keimzentren, einem Lymphknoten vergleichbar.
Biberstein (1923) verwendete erstmals den Begriff Lymphozytom.
Bo Bäfverstedt aus Stockholm gab in einer Monografie eine
umfassende Darstellung von gutartigen, solitären und
multiplen Pseudolymphomen der Haut. Er fand, dass zwei Drittel
der solitären Lymphozytome im Bereich des Kopfes auftreten
und dass Prädilektionsstellen für solitäre Lymphozytome
Ohrläppchen, Brustwarze, Skrotum und Vulva sind (Bäfverstedt
1943).
Im
Jahr 1922 veröffentlichten Ch. Garin und R. Bujadoux (1922)
einen Bericht über einen 58-jährigen Patienten, Schafzüchter
von Beruf, der nach einem Zeckenstich Mitte Juni 1922 ein markantes
Erythem entwickelte und hierauf etwa einen Monat später
„geradezu von der Krankheit überfallen wurde, in
einer raschen, schmerzhaften, beunruhigenden und in jeder Hinsicht
ungewöhnlichen Art“. Er wurde mit „Schmerzen
in den Beinen, am Rumpf und rechten Arm, begleitet von Lähmungen
und Atrophie des rechten Deltamuskels “ ins Krankenhaus
aufgenommen. Anamnestisch war dieser Patient auffallend leer.
Er wurde „in eine gesunde Familie hineingeboren, war selbst
immer gesund, verheiratet mit einer gesunden Frau, die niemals
eine Fehlgeburt erlitt, ihm drei stets gesunde Söhne gebar
...“. Sein Gesundheitszustand
verschlechterte sich und nahm schließlich innerhalb von
2,5 Monaten einen Spontanverlauf mit Restdefekt, einer Bewegungseinschränkung
des rechten Armes. Der Bericht ist deshalb so interessant, weil
er retrospektiv die erste Schilderung des heute sogenannten
Garin-Bujadoux-Bannwarth-Syndroms gibt. Allerdings stellten
die Autoren noch keinen Zusammenhang mit dem Erythem her. Das
erfolgte erst später durch Sven Hellerström aus Stockholm
(1930), der über einen Patienten berichtete, welcher drei
Monate nach dem Auftreten eines Erythema migrans eine Meningoenzepahlitis
entwickelte.
Im
Jahr 1941 beschrieb Alfred Bannwarth aus München ein Syndrom,
das er mit „Chronisch lymphozytäre Meningitis mit
dem klinischen Bild der Neuralgie oder Neuritis“ umschrieb.
Er unterschied drei Gruppen: Patienten mit intensiven Nervenwurzelschmerzen,
jüngere Patienten mit Fazialislähmung und Patienten
mit chronisch lymphozytärer Meningitis mit zerebralen Symptomen
wie starke Kopfschmerzen und Erbrechen. Gemeinsam war allen
Patienten, dass sie einen entzündlichen Liquor hatten,
eine
lymphozytäre Pleozytose (Abbildung 2).
Typisch für diese Erkrankungen war auch, dass die heftigen
Nervenschmerzen besonders intensiv in der Nacht auftraten. Die
Symptome dieser Meningoradikuloneuritis schwanden erst nach
Wochen oder Monaten. Trotz dieser Einsicht in den Krankheitsverlauf
übersah Bannwarth den kausalen Zusammenhang zwischen Zeckenstich,
Erythema migrans und Meningitis. Er interpretierte die Krankheitserscheinungen
als rheumatisch-allergischen Ursprungs (Bannwarth 1941, 1944).
Bis
in die Mitte der 1940er Jahre waren also die klinischen Bilder
der typischen Erkrankungen von Haut und Nervensystem der heutigen
Lyme-Borreliose bekannt. Darüber hinaus gab es Berichte
über Gelenkserkrankungen und auch über Myalgie, Müdigkeit
und schwere Arthralgie, begleitet von Myokarditis (Stadelman
1934). Die heute charakteristischen Krankheitsbilder wurden
jedoch nicht in einem nosologischen und noch gar nicht in einem
ätiologischen Zusammenhang gesehen.
|
Abbildung 1: Acrodermatitis
chronica atrophicans.
Atrophe, zigarettenpapierartig gefältelte Haut
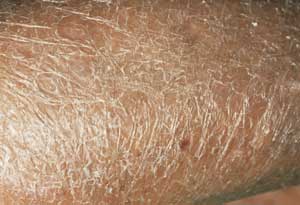
|
Abbildung 2: Lympho-plasmazelluläre
Pleozytose im Liquor cerebrospinalis
bei Meningopolyneuritis Garin-Bujadoux-Bannwarth
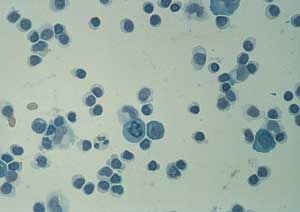
|
|
| Penicillin
betritt die Szene
Penicillin,
eines der ersten Antibiotika und immer noch von größtem
Nutzen, kam nach dem Zweiten Weltkrieg in allgemeine Verwendung.
Von Niels Thyresson in Stockholm wurden 57 Patienten mit ACA
behandelt und über 2 Jahre nachbeobachtet (Thyresson 1949).
Zwanzig Patienten wurden vollständig bis deutlich gebessert,
15 zufriedenstellend und 5 zeigten nur eine geringfügige
Besserung ihrer Hauterkrankung. Dazu beobachtete Thyresson,
dass fibroide Knoten sowie Empfindungsstörungen, die bei
einigen Patienten vorlagen, geschwunden waren. Schließlich
beobachtete er auch eine Normalisierung der Blutsenkungsgeschwindigkeit,
die bei
ACA sehr oft erhöht ist. Der therapeutische Nutzen von
Penicillin wurde durch Ergebnisse anderer Untersucher bestätigt
(Brunner 1951, Götz & Ludwig 1951).
Der Therapie-Erfolg mit Penicillin stellte erneut die Frage
nach den Erregern. Es war nun klar, dass Bakterien eine Rolle
spielen müssen, aber über ihre Natur und Herkunft
gab es noch keine Klarheit. Walter Hauser aus Würzburg
(1955) wertete den klinischen Verlauf von 234 Patienten mit
ACA aus und fand, dass es nicht nur Patienten mit vorausgegangenem
oder begleitendem Erythema migrans gab, sondern stellte fest,
dass die Patienten überwiegend aus Gebieten stammten, in
denen Ixodes ricinus stark verbreitet ist.
In einem Selbstversuch inokulierte Hans Götz von der dermatologischen
Universitätsklinik München sich selbst und drei seiner
Kollegen Haut eines ACA-Patienten. Neben Überempfindlichkeit,
Gelenksschmerzen und Periostschmerzen zeigte sich eine Erythema
migrans-ähnliche Läsion. Alle Symptome schwanden nach
Behandlung mit Antibiotika (Götz 1954/1955). Mit der geografischen
Verbreitung von ACA beschäftigte sich Danda (1963), der
herausfand, dass ACA hauptsächlich in Zentral-, Nord- und
Osteuropa verbreitet ist und nur sehr selten in anderen Gegenden
Europas und den USA.
Hanns Christian Hopf (1966) wies an einem großen Patientengut
nach, dass die periphere Neuropathie vom distalen Typ ein Teil
des klinischen Bildes bei länger bestehender ACA ist. Die
Langzeitbeobachtung einer Gruppe von ACA-Patienten brachte Begleiterscheinungen
zutage wie Arthritis und Arthralgien, Herzerkrankungen und zerebrale
Beteiligung, die Hopf zunächst nicht ursächlich mit
ACA verband. Allerdings konnte er bei einem Patienten mit ACA,
Gewichtsverlust, intermittierendem Herzrasen, Atembeschwerden,
Schwindelanfällen, Lymphknotenschwellung, Milzschwellung,
Veränderungen an Finger- und Zehengelenken, und mit Enzephalitis
zeigen, dass eine parenterale Penicillinbehandlung prompt zur
Besserung führte (Hopf 1966).
Auch das Erythema migrans wurde intensiv studiert und behandelt.
Hollström (1951) berichtete über die erfolgreiche
Penicillin-Behandlung von Patienten mit Erythema migrans einschließlich
eines Patienten mit Meningitis, wobei er, verglichen mit unseren
Dosierungsempfehlungen, sehr niedrige Dosen verwendete. Mit
Erythema migrans wurden ebenfalls Übertragungsversuche
durchgeführt und waren erfolgreich (Binder et al.1955).
Auch multiple Erythema migrans-Läsionen wurden erstmals
beschrieben (Sonck 1965).
Das
Borrelien-Lymphozytom, wie die Lymphadenosis benigna cutis Bäfverstedt
von Klaus Weber spezifischer benannt worden ist (Weber et al.1985),
wurde erstmals 1950 von Bianchi erfolgreich mit Penicillin behandelt.
Bei
Erkrankungen des Nervensystems wurden interessanterweise hauptsächlich
ihr klinischer Verlauf und ihre Liquor-Veränderungen studiert.
Besonders lesenswert sind die detaillierten Beschreibungen von
Schaltenbrand (1967), Bammer und Schenk (1965) und von Hörstrup
und Ackermann (1973). Auf letztere Autoren geht auch die aktuelle
Bezeichnung „Meningopolyneuritis Garin-Bujadoux-Bannwarth“
zurück.
Im
Jahr 1974 beobachtete der Dermatologe Klaus Weber aus München
einen Patienten mit Erythema migrans, der trotz erfolgreicher
Behandlung der Hautläsion mit oralem Penicillin eine Meningitis
entwickelte. Die Meningitis wurde prompt mit hohen Dosen intravenösem
Penicillin geheilt. Damit war für Weber klar, dass ein
Bakterium
für das Erythema migrans und die damit verbundenen Erkrankungen
verantwortlich sein muss. Weber führte Ausschlussstudien
durch, die auf serologischen Testergebnissen beruhten und schloss
Rickettsien, Francisella und andere Bakterien aus und diskutierte
Borrelien als wahrscheinlichste Möglichkeit (Weber 1974).
Weber, dem selbstverständlich wie den anderen Forschern
dieser Zeit die Überträgerrolle von Ixodes-Zecken
bestens bekannt war, hatte also das Rätsel logisch gelöst.
Allerdings stand der Überprüfung ein Dogma der damaligen
Akarologie (Zeckenforschung) im Weg, nämlich, dass Schildzecken
keine Borrelien tragen.
|
| Die
Lyme-Krankheit und die Entdeckung von Borrelien in Schildzecken
Mitte
der 1970er Jahre beobachteten Allen C. Steere und Mitarbeiter
in den Ortschaften Lyme, Old Lyme und East Haddam in Connecticut,
USA, eine Häufung von Gelenkentzündungen bei Kindern,
die nach Zeckenstich und Hauterythem auftraten. Diese neue Arthritis-Form
wurde als Lyme-Arthritis bezeichnet (Steere et al. 1977). Im
Lauf der folgenden Jahre stellte sich die Vielfalt der Erkrankung
heraus, die Haut, Gelenke, Nervensystem, Herz, Augen und andere
Organe umfasst. Ein Student aus Skandinavien gab damals den
Hinweis, dass das expandierende Erythem dem Erythema chronicum
migrans in Europa entspräche (persönl. Mitteilung).
Man dachte in den USA jedoch an eine völlig neue klinische
Entität und nannte sie Lyme-Krankheit (Steere & Malawista
1979).
Die Entdeckung des Erregers der Lyme-Krankheit erfolgte zufällig
Anfang der 1980er Jahre durch Willy Burgdorfer (1982). Bis dahin
galt unter den Akarologen (Zeckenforschern)
der Grundsatz, dass Schildzecken frei von Borrelien seien. Schließlich
wurden mithilfe des von Alan G. Barbour modifizierten Kelly-Kulturmediums
(Kelly 1971, Barbour 1984) die Krankheitserreger aus Haut, Blut
und Liquor von Patienten mit vermuteter Lyme-Krankheit fast
zeitgleich in den USA und in Europa angezüchtet (Ackermann
1983, Benach et al. 1983, Steere et al. 1983, Asbrink 1984,
Pfister H. W. et al. 1984). Die ätiologische Einheit von
Haut-, Nervensystem-, Gelenks- und Herzerkrankungen und Erkrankungen
anderer Organsysteme schien gegeben.
Bald
darauf zeigte sich, dass die Erreger der Schildzecken-Borreliose
in Europa im Vergleich mit den Erregern in den USA sehr heterogen
sind, sich die Krankheitserscheinungen ebenfalls graduell unterscheiden
(Stanek et al. 1985, Wilske et al. 1985).
|
| Der
Borrelia burgdorferi sensu lato-Komplex
Das
ursprünglich als Spirochäte der Lyme-Krankheit bezeichnete
Bakterium wurde 1984 als neue Borrelienart identifiziert und
Borrelia burgdorferi genannt (Johnson et al. 1984).
Diese Borrelie zeigt dasselbe Aufbauprinzip wie andere Organismen
der Spirochäten-Familie. Eine Außenmembran umschließt
Endoflagellen und den Protoplasmazylinder, der von einer Zellmembran
umgeben ist. Sieben bis 12 Endoflagellen entspringen jeweils
an den Enden des Protoplasmazylinders, winden sich um ihn und
enden frei in der Mitte (Abbildung 3). Im
Unterschied zu Gram-negativen Bakterien enthält die Außenmembran
von Borrelia burgdorferi hauptsächlich Lipoproteine
und einen relativ kleinen Anteil an Proteinen mit membranumspannenden
Verbindungen. Borrelien besitzen die Eigenschaft, Strukturen
ihrer Außenmembran umzugestalten,
Antigene zu variieren, um während des Infektionszyklus
einerseits die Kompartimente von Vektoren zu durchsetzen und
andererseits den Abwehrmechanismen im Wirbeltierwirt zu entgehen.
Sehr gut charakterisierte Oberflächenproteine sind die
Lipoproteine OspA (outer surface protein), OspB und OspC, wobei
diese im periplasmatischen Spalt sozusagen deponiert werden
können. Ein Phänomen, das in seinen Details immer
besser verstanden wird, ist der Wechsel der
Expression von Osps. In der ungesogenen Zecke findet sich OspA,
mit dem Borrelien wahrscheinlich an den Epithelzellen des Zecken-Mitteldarms
anhaften. Sobald durch eine Blutmahlzeit die Temperatur im Mitteldarm
ansteigt und sich das pH ändert, wird die OspA-Expression
zugunsten der OspC-Expression unterdrückt (Abbildung
4). Mit OspC an der Oberfläche können Borrelien
den Zeckendarm verlassen, in die Speicheldrüsen und schließlich
in den nächsten Wirbeltierwirt gelangen. Diese Beobachtung
führte zu einem neuen Impfstoffkonzept, bei dem nach Impfung
mit einem OspA-Impfstoff eine ausreichende Konzentration von
OspA-Antikörpern im Blut vorhanden sein muss, um bei der
Blutmahlzeit einer Zecke die in ihrem Mitteldarm vorhandenen
Borrelien abtöten zu können. Mitreguliert werden die
Zellvorgänge der Borrelien durch ein besonderes Genom,
das aus einem linearen Chromsom mit etwa 900 kbp sowie 21 oder
mehr extrachromosomalen Elementen zwischen 56 und 6 kbp, nämlich
linearen und zirkulären Plasmiden besteht.
Abbildung
3: Schematischer Längs- und Querschnitt
durch eine Borrelie. Die Endoflagellen, welche das p41-Antigen
tragen, sind unter der äußeren Zellwand lokalisiert.
Dieses „Design“ erlaubt dem Bakterium auch
in hochviskösen Medien beweglich zu bleiben.
|
Abbildung 4: Schematische
Darstellung der Blutmahlzeit einer Schildzecke. Das aufgenommene
Blut erhöht Temperatur und pH im Mitteldarm der Zecke
und führt, vereinfacht gesprochen, zur Expression
des Oberflächenproteins C (OspC). Mit OspC erfolgt
dann die Ausbreitung der Borrelien in die Speicheldrüsen
und in den Blutwirt.
|
|
|
Wir
unterscheiden heute neben Borrelia burgdorferi sensu
stricto zahlreiche weitere so genannte Genospezies, die sich
geografisch unterschiedlich verteilen (Tabelle
1). Als humanpathogene Arten gelten Borrelia afzelii,
Borrelia burgdorferi sensu stricto, Borrelia garinii,
sowie das noch nicht verbindlich benannte Borrelien-Isolat A14S.
Tabelle
1: Geografische Verbreitung von Borrelia
burgdorferi sensu lato-Genospezies und Schildzecken-Vektoren
(I.= Ixodes, H.= Hyalomma). Die schattierten
Felder markieren Krankheitserreger und ihre Überträger
(modifiziert nach Masuzawa 2004)
| Spezies |
Europa
West-
Russland |
Ost-
Russland |
Nord-
Amerika |
China |
Nepal |
Japan |
| B.
afzelii |
I.
ricinus |
I.
persulcatus |
- |
- |
- |
I.
persulcatus |
B.
burgdorferi
sensu
stricto |
I.
ricinus |
- |
I.
scapularis
I.
pacificus |
- |
- |
- |
B.
garinii
(eurasischer
Typ) |
I.
ricinus |
I.
persulcatus |
- |
- |
- |
I.
persulcatus |
B.
garinii
(asiatischer
Typ) |
- |
I.
persulcatus |
- |
- |
- |
I.
persulcatus |
| a)
Isolat A14S |
I.
ricinus |
- |
- |
- |
- |
- |
| B.
andersonii |
- |
- |
I.
dentatus |
- |
- |
- |
| b)
B. bissettii |
I.
ricinus? |
- |
I.
spinipalpis
I. pacificus |
- |
- |
- |
| B.
japonica |
- |
- |
- |
- |
- |
I.
ovatus |
| c)
B. lusitaniae |
I.
ricinus |
- |
- |
- |
- |
I.
columnae |
| B.
sinica |
- |
- |
- |
I.
ovatus |
- |
- |
| B.
tanukii |
- |
- |
- |
- |
I.
tanuki |
I.
tanuki |
| B.
turcica |
H.
aegyptium |
- |
- |
- |
- |
- |
| B.
turdi |
- |
- |
- |
- |
- |
I.
turdus |
| B.
valaisiana |
I.
ricinus |
- |
- |
- |
- |
- |
B.
valaisiana
-related
|
- |
- |
- |
I.
granulatus |
- |
I.
granulatus |
a)
neue Spezies, der Name B. spielmani wurde
vorgeschlagen
b)
vermutlich auch in Europa verbreitet
c)
vermutlich Krankheitserreger in Portugal und Nordafrika
|
|
|
| Behandlung
der Lyme-Borreliose mit Penicillin Die
Ermittlung der minimalen Hemmkonzentration (MHK) von Antibiotika
gegenüber Borrelien ist methodisch ein weitaus komplizierteres
Unterfangen als die MHK-Bestimmung mit schnell wachsenden Krankheitserregern.
Es wurden Mikrosysteme entwickelt, in denen die Bedingungen
für das Wachstum der Borrelien konstant gehalten werden
konnten. Die MHKs von Penicillin G variierten relativ stark
je nach Borrelienart, überschritten jedoch den Empfindlichkeitsbereich
nicht (Baradaran-Dilmaghani & Stanek 1996, Hunfeldet al.
2000).
Wesentlich für die Beurteilung der Wirksamkeit sind selbstverständlich
die Ergebnisse klinischer Studien. Phenoxymethylpenicillin,
Penicillin V (Spitzy 2000), wurde von Anfang an zur Behandlung
des Erythema migrans sehr erfolgreich eingesetzt (Neumann et
al. 1987). Ergebnisse einer erst kürzlich veröffentlichten
Langzeitbeobachtungs-Studie aus Schweden unterstreichen diese
Aussage neuerlich. 708 Patienten mit Erythema migrans als einzige
Manifestation der Lyme-Borreliose wurden mit Penicillin V (80%),
Doxycyclin (15%) und der Rest mit anderen oralen Antibiotika
behandelt. Die Behandlung erwies sich als äußerst
wirkungsvoll, 98% komplette Heilung mit Penicillin V. In Schweden
wird daher aktuell Phenoxymethylpenicillin zur Behandlung der
frühen Lyme-Borreliose empfohlen, sofern keine Zeichen
einer disseminierten oder eine Ko-Infektion mit anderen von
Zecken übertragbaren Krankheitserregern vorliegt (Bennet
et al. 2003).
Zur Behandlung des solitären Erythema migrans und des Borrelien-Lymphozytoms
(frühe Lyme-Borreliose) wird empfohlen, die Tagesdosis
von Penicillin V auf zwei bis drei Einzelgaben aufzuteilen.
Eine Tagesdosis von 25.000 I.E. Phenoxymethylpenicillin pro
kg Körpergewicht sollte bei Kindern und Erwachsenen nicht
unterschritten werden. Dosierungen bis 6.0 Mega I.E. Phenoxymethylpenicillin
pro Tag werden von Erwachsenen komplikationslos vertragen. Die
Behandlungsdauer ist oft mit 10 Tagen ausreichend, wird gewöhnlich
aber mit 2 Wochen angegeben. Der Effekt einer zweiwöchigen
Gabe von Phenoxymethylpenicillin im Vergleich mit anderen Antibiotika
zur Behandlung des solitären Erythema migrans bei Kindern
und bei Erwachsenen wurde ebenfalls für wirksam befunden
(Strle et al. 1992, Arnez et al. 1999, Arnez et al. 2002). Nach
Ergebnissen einer jüngst präsentierten Studie aus
Österreich erwies sich die Behandlung des Erythema migrans
mit
Penicillin V über zwei Wochen bei Erwachsenen als ebenso
wirksam wie eine über drei Wochen (Aberer et al. 2005).
Auch das
Borrelien-Lymphozytom spricht sehr gut auf eine Behandlung mit
Phenoxymethylpenicillin an (Strleet al. 1996).
Patienten mit Neuroborreliose und schwerer Lyme-Karditis werden
mit Ceftriaxon oder mit Penicillin G intravenös für
2 - 3 Wochen behandelt. Wolfgang Kristoferitsch aus Wien hatte
die seltene Möglichkeit, den Spontanverlauf zahlreicher
Patienten mit Bannwarth-Syndrom mit dem von antibiotisch behandelten
zu studieren, da er bereits Ende der 1970er Jahre sehr intensiv
an der klinischen Symptomatik und an der ursächlichen Klärung
dieses variablen Syndroms arbeitete (Kristoferitsch et al. 1983).
Während im Spontanverlauf etwa 25 Wochen bis zu einer restitutio
ad integrum vergehen, führt die frühe, in den ersten
drei Wochen nach Krankheitsbeginn einsetzende Behandlung mit
geeigneten Antibiotika zu einer sehr raschen Besserung insbesondere
des Schmerzsyndroms (Kristoferitsch et al. 1987, Kristoferitsch
1989).
Falldefinitionen,
Indikationen für Laboratoriums-Untersuchungen, Dosierung
von und Behandlungsdauer mit Penicillinen sind in einem Seminarartikel
zusammengefasst (Stanek & Strle 2003).
|
| Schluss
Penicillin
begleitet die Behandlung der Lyme-Borreliose von Anfang an.
Die Möglichkeit einer gezielten Behandlung hat bei dieser
Infektionskrankheit interessanterweise nicht zu einem Abbruch
der Forschungsaktivitäten geführt. Kürzlich vertraute
mir Allen C. Steere bei der „10th International Conference
on Lyme Borreliosis and Other Tick-Borne Diseases“, die
Mitte September 2005 in Wien
stattgefunden hat, an, dass er vor 20 Jahren dachte –
als ich die erste derartige Konferenz in Wien organisierte –
das sei nun der Abschluss der Lyme Disease-Forschung. Denn es
war alles geklärt, das klinische Spektrum, die Spirochäten-Ätiologie
und die Behandlungsmöglichkeiten. Das Gegenteil war der
Fall. Aufgrund der zahlreichen offenen Fragen, die während
der Konferenz im Jahr 1985 aufkamen, wurden Mediziner und Wissenschafter
verschiedener Fachrichtungen zu Forschungstaten angeregt. Eine
unerwartete Renaissance auf dem Gebiet der Borrelien- und der
Schildzeckenforschung brach an, und wird durch die eben abgeschlossene
Konferenz weiterhin beflügelt werden. Das sich vergrößernde
Europa der EU ermöglicht dazu eine weithin vernetzte Zusammenarbeit.
Mit der Hoffnung auf viele gute Jahre setzte ich hier meinen
Schlusspunkt.
|
Literatur:
| Aberer
E. et al (2005) Comparison of a two- or three-week regimen
and a review of treatment of erythema migrans with phenoxyme-thylpenicillin.
Beitrag P191 bei der 10th Int Conference on Lyme borreliosis
and othertick-borne diseases; Vienna, 11-15 September 2005. |
| Ackermann
R (1983) Erythema chronicum migrans und durch Zecken übertragene
Meningopolyneuritis (Garin-Bujadoux-Bannwarth): Borrelien
Infektionen? Dtsch med Wochenschr 108:577-580. |
| Afzelius
A (1910) Verhandlungen der dermatologischen Gesellschaft
zu Stockholm, 28 Oct 1909. Arch Dermatol Syph 101:404. |
| Arnez
M et al (1999) Comparison of cefuroxime axetil and phenoxymethyl
penicillin for the treatment of children with solitary erythema
migrans. Wien Klin Wochenschr 111:916-922. |
| Arnez
M et al (2002) Solitary erythema migrans in children: comparison
of treatment with azithromycin and phenoxymethylpenicillin.
Wien Klin Wochenschr 114:498-504. |
| Asbrink
E et al (1984) The spirochetal etiology of erythema chronicum
migrans Afzelius. Acta Derm Venereol 64:291-295. |
| Asbrink
E et al (1984) The spirochetal etiology of acrodermatitis
chronica atrophicans Herxheimer. Acta Derm Venereol 64:506-512 |
| Bäfverstedt
B (1943) Über Lymphadenosis benigna cutis. Acta Derm
Venereol (Stockh) (Suppl) 24:1-202. |
| Balban
W (1910) Erythema annulare entstanden durch Insektenstiche.
Arch Dermatol Syph 105:423-430. |
| Bammer
H, Schenk K (1965) Meningo-Myelo-Radikulitis nach Zeckenbiss
mit Erythem. Dtsch Z Nervenheilkd 187:25-34. |
| Bannwarth
A (1941) Chronische lymphocytäre Meningitis, entzündliche
Polyneuritis und „Rheumatismus“. Arch Psychiatr
Nervenkr 113:284-376. |
| Bannwarth
A (1944) Zur Klinik und Pathogenese der „chronischen
lymphocytären Meningitis“. Arch Psychiatr Nervenkr
117:161-185. |
| Baradaran-Dilmaghani
R, Stanek G (1996) In vitro susceptibility of thirty
Borrelia strainsfrom various sources against eight antimicrobial
chemotherapeutics. Infection 24:60-63. |
| Barbour
AG (1984) Isolation and cultivation of Lyme disease spirochetes.
Yale J Biol Med 57:521-525 |
| Benach
JL et al (1983) Spirochetes isolated from the blood of two
patients with Lyme disease. N Engl J Med 308:740-742. |
| Bennet
L et al (2003) Clinical outcome of erythema migrans after
treatment with phenoxymethyl penicillin. Scand J Infect
Dis 35:129-131. |
| Bianchi
GE (1950) Die Penicillinbehandlung der Lymphocytome. Dermatologica
100:270-273. |
| Biberstein
H (1923) Lymphozytome. Zentralbl Hautkr 6:70-71. |
| Binder
E et al (1955) Experimentelle Übertragung des Erythema
chronicum migrans von Mensch zu Mensch. Hautarzt 6:494-496. |
| Brunner
N (1951) Zur Penicillinbehandlung bei Sklerodermie und Akrodermatitis
atrophicans Herxheimer. Hautarzt 2:545-547. |
| Buchwald
A (1883) Ein Fall von diffuser idiopathischer Haut-Atrophie.
Arch Dermatol Syph 10:553-556. |
| Burckhardt
JL (1911) Zur Frage der Follikel- und Keimzentrenbildung
in der Haut. Frankf Z Pathol 6:352-359. |
| Burgdorfer
W et al (1982) Lyme disease – A tick-borne spirochetosis?
Science 216:1317-1319. |
| Danda
J (1963) Die Weltfrequenz der Akrodermatitis chronica atrophicans.
Hautarzt 14:337-340. |
| Ehrmann
S, Falkenstein F (1925) Über Dermatitis atrophicans
und ihre pseudo-sklero-dermatischen Formen. Arch Dermatol
Syph 149:142-175. |
| Garin
C, Bujadoux R (1922) Paralysie par lestiques. J Med Lyon
71 :765-767. |
| Götz
H, Ludwig E (1951) Die Behandlung der Acrodermatitis chronica
atrophicans Herxheimer mit Penicillin. Hautarzt 2:6-14. |
| Götz
H (1954/1955) Die Acrodermatitis chronica atrophicans Herxheimer
als Infektionskrankheit. Hautarzt 5:491-504, 6:249-252. |
| Hellerström
S (1930) Erythema chronicum migrans Afzelii. Acta Derm Venereol
(Stockh) 11:315-321. |
| Herxheimer
K, Hartmann K (1902) Über Acrodermatitis chronica atrophicans.
Arch Dermatol Syph 61:255-300. |
| Herxheimer
K, Schmidt W (1910) Über „strangförmige
Neubildungen bei Acrodermatitis chronica atrophicans“.
Arch Dermatol Syph 105:145-168. |
| Hollström
E (1951) Successful treatment of erythema migrans Afzelius.
Acta Derm Venereol (Stockh) 31:235-243. |
| Hopf
HC (1966) Acrodermatitis chronica atrophicans (Herxheimer)
und Nervensystem. (Monographien aus dem Gesamtgebiete der
Neurologie und Psychiatrie, Vol 114) Springer, Berlin Heidelberg
New York. |
| Hörstrup
P, Ackermann R (1973) Durch Zecken übertragene Meningopolyneuritis
(Garin-Bujadoux, Bannwarth). Fortschr Neurol Psychiatr 41:583-606. |
| Hunfeld
KP et al (2000) New colorimetric microdilution method for
in vitro susceptibility testing of Borrelia
burgdorferi against antimicrobial substances. Eur J
Clin Microbiol Infect Dis 19:27-32. |
| Johnson
R et al (1984) Borrelia burgdorferi sp. nov.: etiologic
agent of Lyme disease. Int J Syst Bacteriol 34:496-497. |
| Jessner
M (1921) Zur Kenntnis der Acrodermatitis chronica atrophicans.
Arch Dermatol Syph 134:478-487. |
| Jessner
M, Loewenstamm A (1924) Bericht über 66 Fälle
von Acrodermatitis chronica atrophicans. Dermatol Wochenschr
79:1169-1177. |
| Kelly
R (1971) Cultivation of Borrelia hermsi. Science
173:443-444. |
| Kristoferitsch
W et al (1983) Meningopolyneuritis (Garin-Bujadoux, Bannwarth).
Clinical aspects and laboratory findings. Nervenarzt 12:640-646. |
| Kristoferitsch
W et al (1987) High-dose penicillin therapy in meningopolyneuritis
Garin-Bujadoux-Bannwarth. Clinical and cerebro-spinal fluid
data. Zentralbl Bakteriol Mikrobiol Hyg 263:357-364. |
| Kristoferitsch
W (1989) Neuropathien bei Lyme-Borreliose. Springer, Wien
New York. |
| Lipschütz
B (1913) Über eine seltene Erythemform (Erythema chronicum
migrans). Arch Dermatol Syph 118:349-356. |
| Lipschütz
B (1923) Weiterer Beitrag zur Kenntnis des Erythema chronicum
migrans. Arch Dermatol Syph 143:365-374. |
| Masuzawa
T (2004) Terrestrial distribution of the Lyme borreliosis
agent Borrelia burgdorferi sensu lato in East Asia.
Jpn J Infect Dis 57:229-235. |
| Neumann
R et al (1987): Treatment and course of erythema chronicum
migrans. Zentralbl Bakteriol Mikrobiol Hyg A 263:372-376. |
| Pfister
HW et al (1984) The spirochetal etiology of lymphocytic
meningo radiculitis of Bannwarth (Bannwarth's syndrome).
J Neurol 231:141-144. |
| Schaltenbrand
G (1967) Durch Arthropoden übertragene Erkrankungen
der Haut und des Nervensystems. Verhandl Dtsch Ges Inn Med
72:975-1006. |
| Sonck
CE (1965) Erythema chronicum migrans with multiple lesions.
Acta Derm Venereol (Stockh) 45:34-36. |
| Spitzy
KH (2000) Die Geschichte des ersten säurestabilen Oralpenicillins
(Penicillin V). Antibiotika Monitor tom. XVI, 4:17-20. |
| Stadelman
R (1934) Ein Beitrag zum Krankheitsbild des Erythema chronicum
migrans Lipschütz. Dissertation Universität Marburg. |
| Stanek
G et al (1985) Differences between Lyme disease and European
arthropod-borne Borrelia infections. Lancet 1(8425):401. |
| Stanek
G, Strle F (2003) Lyme borreliosis.Lancet 362:1639-1647. |
| Steere
AC et al (1977) Lyme arthritis. An epidemic of oligo articular
arthritis in children and adults in three Connecticut communities.
Arthritis Rheum 20:7-17. |
| Steere
AC, Malawista SE (1979) Cases of Lyme disease in the United
States: locations correlated with distribution of Ixodes
dammini. Ann Int Med 91:730-733. |
| Steere
AC et al (1983) The spirochetal etiology of Lyme disease.
N Engl J Med 308:733-740. |
| Strle
F et al (1996) Treatment of borrelial lymphocytoma. Infection
24:80-84. |
| Strle
F et al (1992) Erythema migrans: comparison of treatment
with azithromycin, doxycycline and phenoxymethylpenicillin.
J Antimicrob Chemother 30:543-550. |
| Thyresson
N (1949) The penicillin treatment of acrodermatitis chronica
atrophicans (Herxheimer). Acta Derm Venereol (Stockh) 29:572-621. |
| Weber
K (1974) Erythema-chronicum-migrans-Meningitis – eine
bakterielle Infektionskrankheit? Munch Med Wochenschr 116:1993-1998. |
| Weber
K et al (1985) Das Lymphozytom – eine Borreliose?
Z Hautkr 69:1585-1598. |
| Wilske
et al (1985) Antigenic heterogeneity of European Borrelia
burgdorferi strains isolated from patients and ticks. Lancet
1(8437):1099. |
Anschrift
des Verfassers:
Univ. Prof. Dr. med. Gerold Stanek
Klinisches Institut für Hygiene und Medizinische Mikrobiologie
Abteilung Infektionsimmunologie, Medizinische Universität
Wien
A-1095 Wien, Kinderspitalgasse 15
Email gerold.stanek@meduniwien.ac.at
|
|
|