Antibiotikadosierung
bei Nierenersatzverfahren |
| F. Thalhammer
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
(Leiter: Univ.-Prof. DDr. W. Graninger) |
|
Einleitung
Seit
Einführung der intermittierenden, später auch der
kontinuierlichen Nierenersatztherapie sind beide Therapieverfahren
aus der Patientenversorgung bei akuter und chronischer Niereninsuffizienz
nicht mehr wegzudenken. Damit einhergehend wurden die verwendeten
Dialysemembranen, die wesentlich die Eliminationleistung der
Nierenersatztherapie bestimmen, in Bezug auf Filtrationsleistung,
Oberflächenbeschaffenheit oder Biokompatibilität stetig
weiterentwickelt. Obwohl Infektionen zu den häufigsten
Todesursachen bei chronisch hämodialysepflichtigen Patienten
zählen, und somit die Antibiotikatherapie einen bedeutenden
Pfeiler darstellt, fehlen häufig fundierte Daten zur Elimination
von Antibiotika durch die Nierenersatztherapie.
Die Ursachen
für die geringen durch Studien belegbare Daten sind mannigfaltig:
1) unterschiedliche
Nierenersatzverfahren (intermittierende oder kontinuierliche
Hämodialyse (HD) bzw. Hämofiltration (HF)) mit unterschiedlichen
Blutfluss- und Dialysat- bzw. Ultrafiltrationsraten und daraus
resultierenden unterschiedlichen Filtrations- bzw. Eliminationsleistungen,
2) unterschiedliche Membraneigenschaften,
3) zahlreiche nur fallberichtartige oder veraltete Studien und
4) zusätzlich sind die technischen Angaben (Membrantyp,
Nierenersatzverfahren) in den vorhandenen Literaturstellen häufig
mangelhaft. Diese zahlreichen Variablen erlauben nicht, für
alle Therapieverfahren und/oder Membranen verlässliche
Dosierungsempfehlungen abzugeben.
Diese Komplexität
wurde inzwischen durch einige Studien deutlich demonstriert.
|
| Theoretische
Grundlagen Im
Wesentlichen finden sich vier für die Elimination bestimmende
Faktoren:
a) die
Membran,
b) das Nierenersatzverfahren,
c) das Medikament und
d) der Patient,
die in Tabelle 1 näher ausgeführt
sind.
Zentral im Mittelpunkt steht die Membran mit ihren zahlreichen
Variablen. Neben der Diffusion bei der konventionellen Low-Flux-HD
(Ultrafiltrationskoeffizient Uf <
10) und der Konvektion bei der High-Flux-HD (Uf
> 10), HF bzw. Hämodiafiltration (HDF) spielt bei den
modernen Membranen zunehmend auch die Adsorption eine bedeutende
Rolle in der Elimination einer Substanz. Die Fortschritte in
der Membranentwicklung sind in der Literatur gut dokumentiert:
So wurde von Lee et al. 1984 festgestellt, dass Substanzen mit
einem Molekulargewicht > 500 D und/oder einer hohen Proteinbindung
nicht wesentlich durch eine Low-Flux-HD eliminiert werden. Fünf
Jahre später berichteten Shinaberger et al. über die
effiziente Elimination von Substanzen mit einem Molekulargewicht
> 500 D durch High-Flux-Membranen.
Das Ausmaß der Adsorption ist membranabhängig und
stellt einen nicht unwesentlichen Eliminationsfaktor dar wie
eine Studie mit ß2-Mikroglobulin zeigte. Die Adsorption
selbst ist ein sättigbarer Vorgang, der durch
hydrophobe Wechselwirkungen, Van-der-Waal’sche Bindungen
als auch durch Bindung an die Sekundärmembran zustande
kommt. Diese Sekundärmembran ist ein Proteinfilm auf der
Blutseite des Dialysators, der einerseits die Diffusion reduziert
und andererseits Substanzen durch Adsorption bindet.
Bei chronischen Hämodialysepatienten kann zusätzlich
noch die Resorption von oral verabreichten Medikamenten vermindert
sein, sodass die Bioverfügbarkeit ebenfalls erniedrigt
ist (Tabelle 2). Die frühere Annahme,
die nicht-renale (extrahepatische) Clearance bleibt bei niereninsuffizienten
Patienten unbeeinflusst, ist nicht auf alle Medikamente anwendbar.
Vor allem bei Medikamenten wie Roxithromycin oder Acyclovir,
die einem starken Metabolismus unterworfen sind, ist die nicht-renale
Clearance bei Hämodialysepatienten um 17 bis 85% reduziert.
Tabelle 1: Die Elimination
einer Substanz beeinflussende Faktoren
| Medikamenten-spezifische
Faktoren |
Verfahren-
spezifische Faktoren |
Membran-
spezifische Faktoren |
Patienten-
spezifische Faktoren |
| Molekulargewicht |
| Elektrische
Ladung |
| Proteinbindung |
| Wasserlöslichkeit |
| Fettlöslichkeit |
| Verteilungsvolumen |
| Art
der Elimination |
| Gewebegängigkeit |
|
Intermittierende
Nierenersatztherapie |
-
Konventionelle HD |
| -
High-Efficiency-HD |
| -
High-Flux-HD |
Kontinuierliche
Nierenersatztherapie |
-
Hämofiltration
(CAVH, CVVH) |
-
Hämodialyse
(CAVHD, CVVHD) |
-
Hämodiafiltration
(CAVHDF, CVVHDF) |
-
Ultrafiltration
(SCUF) |
| Dialysatfluss |
| Ultrafiltrationsrate |
| Blutfluss |
|
| Membranmaterial |
| -
Cuprophan |
| -Cellulose
(modifiziert) |
| -
Polysulfon |
| -
Polyacrylnitril |
-
Polymethyl-
methacrylat |
| -
Polyamid |
| Größe
der Oberfläche |
| Porengröße |
| Elektrische
Ladung |
| Ultrafiltrationskoeffizient |
|
| Organfunktionen |
| -
Niere |
| -
Leber |
| -
Herz |
| Fettanteil |
| Komorbidität |
| Zusätzliche
Medikamente |
|
| HD |
Hämodialyse |
CAVHD |
kontinuierliche
arterio-venöse Hämodialyse |
| CAVH |
kontinuierliche
arterio-venöse Hämofiltration |
CAVHDF |
kontinuierliche
arterio-venöse Hämodiafiltration |
| CVVH |
kontinuierliche
veno-venöse Hämofiltration |
SCUF |
langsame
kontinuierliche Ultrafiltration |
|
|
Tabelle
2: Ursachen verminderter Bioverfügbarkeit
der oralen Medikation bei chronischen Hämodialysepatienten
|
• Verlängerte Magenentleerungszeit |
| •
Veränderter Magen-pH |
| •
Verminderte Resorption im Dünndarm |
| •
Verwendung Aluminium-hältiger Antacida |
| -
Magenmotilität herabgesetzt |
| -
verminderte Resorption |
| •
Diabetische Neuropathie |
| •
Erhöhter BUN |
| -
Magen-pH erhöht |
-
pH-abhängige Resorption beeinflusst
|
|
|
Pharmakokinetische
Berechnungen
In der Literatur werden zur Clearance-Berechnung für die
Hämodialyse sowie für die kontinuierliche Hämofiltration
verschiedene Formeln angegeben. Die Clearance beschreibt die
Eliminationsleistung des Therapieverfahrens. Zur Berechnung
der Clearance bei der Hämodialyse (ClHD)
wird die nachfolgende Gleichung herangezogen, wobei vereinfacht
Q dem Blutfluss, CA der Konzentration
im „arteriellen“, zufließenden Blut und CV
der Konzentration im venösen, abfließenden Blut entspricht.
ClHD
(ml/min) = Q • [(CA - CV)/CA]
Eine
mögliche Adsorption einer Substanz an die Membranoberfläche
wird hier insofern berücksichtigt, als dass fehlende Konzentrationen
im Dialysat nicht zu falsch niedrigen Clearanceangaben führen
können. Bei der Berechnung der Clearance-Leistung bei Hämofiltrationsverfahren
wird die Konzentration im Ultrafiltrat (CUF)
als Grundlage herangezogen.
ClHF
(ml/min) = Sc •UFR
Eine
nicht messbare Konzentration im Ultrafiltrat bedeutet somit,
dass die entsprechende Substanz scheinbar nicht eliminiert wird,
auch wenn CV 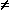 CA ist. Substanzen, die wesentlich durch Adsorption eliminiert
werden, gelten aufgrund dieser Clearance-Formel
fälschlich als nicht dialysabel.
CA ist. Substanzen, die wesentlich durch Adsorption eliminiert
werden, gelten aufgrund dieser Clearance-Formel
fälschlich als nicht dialysabel.
Einfluss
des Dialyseverfahrens und der Flussgeschwindigkeiten auf die
Elimination
Erwartungsgemäß besteht ein Unterschied
in der Elimination einer Substanz, wenn ein intermittierendes
oder kontinuierliches Verfahren bzw. eine arterio-venöse
oder veno-venöse kontinuierliche HD, HF oder HDF angewendet
wird. Zusätzlich wird die Clearance-Leistung auch noch
vom Blutfluss bzw. Dialysatfluss beeinflusst. Das heisst je
höher der Blut- bzw. Dialysatfluss ist, umso größer
fällt die Clearance-Leistung aus.
Bei
fixen Antibiotika-Kombinationen wie Amoxicillin-Clavulansäure,
Piperacillin-Tazobactam oder Imipenem-Cilastatin ist die unterschiedliche
pharmakokinetische Charakteristik bei der Anwendung zu berücksichtigen.
Einerseits kann die antimikrobielle Wirksamkeit beispielsweise
durch verstärkte Elimination von Amoxicillin bei Amoxicillin-Clavulansäure
vermindert sein oder andererseits eine Kumulation auftreten,
wie dies von Tazobactam bzw. Cilastatin bekannt ist.
Einfluss von Membraneigenschaften auf die Elimination
Bei Antibiotika mit geringer therapeutischer Breite können
unterschiedliche Membranen wesentlich die Dosierungsempfehlungen
beeinflussen. Beispielsweise galt für Vancomycin bei Low-Flux-HD
mit einer Cuprophan-Membran eine Dosierung von 1 g Vancomycin/Woche,
während bei einer Polysulfon High-Flux-HD 1 g Vancomycin
nach jeder HD verabreicht werden muss. Auch Teicoplanin galt
lange Zeit als wenig bzw. nicht dialysabel; jedoch auch Teicoplanin
wird durch Polysulfon High-Flux-Membranen signifikant eliminiert.
Neben dem Membranmaterial spielt
auch die Größe der Membranoberfläche eine wesentliche
Rolle, wie dies beispielsweise für Vancomycin, Gentamicin
oder Ofloxacin nachgewiesen wurde.
Bei
der kontinuierlichen Hämofiltration kann die Adsorption
sowie die Sekundärmembranbildung die Elimination von stark
eiweißgebundenen Substanzen signifikant beeinflussen.
In einer eigenen Studie mit Teicoplanin konnten wir zeigen,
dass bei kontinuierlicher HF mit derselben Membran über
einen Zeitraum von 48 Stunden die Elimination in den ersten
24 Stunden deutlich größer ausfällt als in den
folgenden 24 Stunden. Auch dies sollte bei der Dosierung berücksichtigt
werden.
Pharmakodynamik der Antibiotika-Therapie im Rahmen der
Nierenersatztherapie
Betalaktam-Antibiotika wie Penicilline, Cephalosporine oder
Carbapeneme erzielen ihre beste antimikrobielle Wirksamkeit,
wenn der Serumspiegel das Vier- bis Fünffache der minimalen
Hemmhofkonzentration (MHK) über 40-60% des Dosierungsintervalles
(T) beträgt (T > MHK). Ein hoher Spitzenspiegel bringt
keinen zusätzlichen Vorteil. Aminoglykoside hingegen
zeichnen sich durch eine konzentrationsabhängige Abtötungsrate
aus; d.h. je höher der Spitzenspiegel ist, desto besser
die mikrobiologische Wirksamkeit.
Eine Studie unserer Gruppe mit Cephalosporinen konnte nachweisen,
dass eine Dosierung von 2 g Cefpirom bzw. Cefepime parenteral
nach jeder Hämodialyse ausreichend hohe Serumspiegel über
48 h bis 72 h gewährleistet. Dieser Applikationsmodus erlaubt
unter Ausnützung der pharmakokinetischen-pharmakodynamischen
Vorteile eine optimale antimikrobielle Therapie, eine Reduzierung
der Therapiekosten und eine Complianceverbesserung bei den Patienten.
Eine kürzlich publizierte Studie nützte hohe Spitzenspiegel
vor Dialysebeginn bei Aminoglykosiden mit nachfolgender Hämodialyse
aus, um die antimikrobielle Wirksamkeit zu verbessern und die
Toxizität zu minimieren. |
| Antibiotikadosierung
in der Praxis bei Nierenersatztherapie Zum
Anforderungsprofil eines Antibiotikums bei Nierenersatztherapie
zählt neben einer großen therapeutischen Breite (wegen
der zahlreichen Variablen) die Möglichkeit Serumspiegel
zu monitieren, eine primär renale Elimination, um die Gesamtclearance
leichter abschätzen zu können, und eine geringe Dialysierbarkeit
(abhängig vom Molekulargewicht, der elektrischen Ladung
und der Proteinbindung). Dosierungsvorschläge für
einige Antibiotika sind tabellarisch zusammengefasst, ohne dass
jedoch Tabelle 3 den Anspruch auf Vollständigkeit
erhebt. Bei allen Überlegungen zur Antibiotikadosierung
bei Nierenersatzverfahren darf nicht vergessen werden, dass
in den meisten Fällen nicht die Toxizität einer etwaigen
Überdosierung, sondern das Therapieversagen der antimikrobiellen
Therapie aufgrund ungewollter Unterdosierung des Antibiotikums
die größte Gefahr für den Patienten darstellt
(Abbildung 1).
Tabelle 3: Klinische Dosierungsempfehlungen
für einige Antibiotika
| Antibiotikum |
Normal |
CHD |
CVVHF |
|
Penicilline
|
|
|
|
| Amoxicillin/Clavulansäure |
3
x 2,2 – 4,4 g |
1
x 2,2 g |
3
x 2,2 g |
| Ampicillin |
3
x 2,0 – 5,0 g |
2
x 1,0 g |
2
x 1,0 g |
| Flucloxacillin |
3
x 2,0 – 4,0 g |
3
x 1,0 g |
3
x 4,0 g |
| Piperacillin/Tazobactam |
3
x 4,5 – 9,0 g |
2
x 4,5 g |
3
x 4,5 g |
|
| Cephalosporine |
|
|
|
| Cefazolin |
3
x 2,0 g |
1,5
g p. HD |
- |
| Cefepim |
2
– 3 x 2,0 g |
1,0
– 2,0 g pHD |
2
x 2,0 g |
| Cefpirom |
2
– 3 x 2,0 g |
1,0
– 2,0 g pHD |
3
x 2,0 g |
| Ceftazidim |
3
x 2,0 g |
1
x 1,0 g |
3
x 2,0 g |
| Ceftriaxon |
1
x 2,0 – 4,0 g |
1
x 4,0 g |
2
x 2,0 g |
|
| Carbapeneme
& Monobactame |
|
|
|
| Aztreonam |
3
x 1,0 – 2,0 g |
1
x 0,25 – 0,5 g |
3
x 1,0 g |
| Ertapenem |
1
x 1,0 g |
- |
- |
| Imipenem/Cilastatin |
4
x 0,5 g - 3 – 4 x 1,0 g |
3
x 0,25 – 0,5 g |
3
x 1,0 – 2,0 g |
| Meropenem |
3
x 1,0 – 2,0 g |
1
x 0,25 – 0,5 g |
3
x 1,0 – 2,0 g |
|
| Chinolone |
|
|
|
| Ciprofloxacin |
2
– 3 x 400 mg |
2
x 100 mg |
3
x 400 mg |
| Levofloxacin |
1
– 2 x 500 mg |
1
x 125 mg |
1
x 1.000 mg |
| Moxifloxacin |
1
(–2) x 400 mg |
1
x 400 mg |
1
x 400 mg |
|
| Glykopeptide
(Spiegelbestimmung) |
|
|
|
| Teicoplanin |
1
x 12 – 15 mg/kg |
12
mg/kg pHD |
1
x 12 mg/kg |
| Vancomycin |
3
x 0,5 – 1,0 g |
1,0
g pHD |
1
x 1,0 g |
|
| Diverse
Antibiotika |
|
|
|
| Clindamycin |
3
x 900 – 1.200 mg |
3
x 600 – 900 mg |
3
x 600 – 1.200 mg |
| Fosfomycin |
3
x 8,0 g |
4,0
g pHD |
2
x 8,0 g |
| Linezolid |
2
x 600 mg |
2
x 600 mg |
2
x 600 mg |
| Metronidazol |
1
x 1,5 g |
1
x 1,0 g |
1
x 1,5 g |
| Rifampicin |
1
x 10 mg/kg |
1
x 5 mg/kg |
1
x 5 mg/kg |
|
| Antimykotika
|
|
|
|
| Amphotericin
B |
1
x 1,5 mg/kg |
1
x 1,5 mg/kg |
1
x 1,5 mg/kg |
| Caspofungin |
Tg
1: 1 x 70 mg,
ab Tg 2: 1 x 50 mg |
- |
- |
| Fluconazol |
1
x 10 mg/kg |
100
mg pHD |
1
x 10 mg/kg |
| Liposomales
AmB |
1
x 3 – 5 mg/kg |
1
x 2 mg/kg |
1
x 3 – 5 mg/kg |
| Voriconazol |
Tg
1: 2 x 6 mg/kg,
ab Tg 2: 2 x 4 mg/kg |
Tg
1: 2 x 6 mg/kg,
ab Tg 2: 2 x 4 mg/kg |
- |
|
| Virustatika |
|
|
|
| Acyclovir |
3
x 10 mg/kg |
1
x 5 mg/kg |
1
x 5 mg/kg |
| Gancyclovir |
2
x 5 mg/kg |
1
x 1,5 mg/kg |
5
mg/kg/48 h |
|
pHD am Ende der Hämodialyse |
Stand: 7/05
|
|
|
Abbildung
1: Unterdosierung

|
|
| Zusammenfassung
Die
Dosisfindung für Antibiotika bei Hämodialyse oder
Hämofiltration hängt von zahlreichen Faktoren ab,
sodass keine exakten Empfehlungen möglich oder vorhanden
sind. Für zahlreiche Substanzen gibt es überhaupt
keine oder nur alte Daten, die für die modernen Hämodialyse-
und Hämofiltrationsverfahren nicht angewandt werden können.
Die zunehmende Anzahl dialyse- bzw. hämofiltrationspflichtiger
Patienten und das erhöhte Infektionsrisiko dieser Patientengruppe
machen entsprechende Studien und fundierte Dosierungsempfehlungen
wünschenswert. Die Antibiotikatherapie muss daher immer
das gewählte Nierenersatzverfahren, das verwendete Membranmaterial
und die Eigenschaften
des Antibiotikums berücksichtigen. Der behandelnde Arzt
sollte sich hierbei immer der Gefahr einer möglichen Antibiotikaunterdosierung
bewusst sein.
|
Anschrift
des Verfassers:
a.o. Univ.-Prof. Dr. Florian Thalhammer
Univ.-Klinik für Innere Medizin I,
Klin. Abt. für Infektionen und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: florian.thalhammer@meduniwien.ac.at
|
|
|