| Infektionen
im Kindesalter – Unterschiede zwischen Kindern und Erwachsenen |
| J.P. Guggenbichler
Univ.-Klinik für Kinder und Jugendliche der Universität
Erlangen/Nürnberg
(Vorstand: Univ.-Prof. Dr. W. Rascher) |
|
Einleitung
Infektionen
nehmen im Kindesalter eine zentrale Stelle ein. Sie betreffen
sowohl in der Klinik als auch beim niedergelassenen Arzt jedes
Fachgebiet der Kinderheilkunde und sämtliche Organsysteme:
In der Gastroenterologie sind es akute und chronische Durchfallerkrankungen,
die durch virale oder bakterielle Mikroorganismen hervorgerufen
werden, in der Nephrologie handelt es sich um akute und rezidivierende
Harnwegsinfektionen, begünstigt durch funktionelle und
anatomische Störungen des Urogenitaltrakts. In der Pulmonologie
sind es Pneumonien, die erhebliche diagnostische und therapeutische
Probleme aufwerfen. Eine obstruktive Bronchitis bzw. das Intrinsic-Asthma
des Säuglings und Kleinkindes wird häufig durch eine
Infektion mit Respiratory-Syncytial (RS)-Viren, bei ca. 20%
der Patienten auch durch Mycoplasma pneumoniae ausgelöst.
Später ist eine obstruktive (asthmoide) Bronchitis Ausdruck
eines allergischen Geschehens [1]. Die korrekte Differenzialdiagnose
eines allergischen versus infektbedingten Asthmas sowie in der
weiteren Folge die Diagnose einer bakteriellen Superinfektion
bei gestörter mucociliärer Clearance ist für
die Indikation einer antimikrobiellen Therapie wichtig. Vielfach
handelt es sich bei Säuglingen und Kleinkindern um die
klassischen akuten Infektionskrankheiten, die direkt vom Kranken
auf den Gesunden oder indirekt über gesunde Träger
oder kontaminierte Gegenstände durch Tröpfchen-, Schmier-
oder Kontaktinfektion übertragen werden. Primäre bakterielle
Infektionen mit Streptokokken, Pneumokokken, Haemophilus
influenzae, Moraxella catarrhalis oder Neisseria meningitidis,
aber auch Erreger atypischer Infektionen wie Mycoplasma
pneumoniae oder Chlamydia pneumoniae sind in Industrieländern
für ca. 20-30% der Patienten verantwortlich. Der Arzt ist
heute jedoch mit einem geänderten Erregerspektrum und einer
ausgeprägten Resistenzentwicklung konfrontiert. Weltweit
kam es zu einer Zunahme von Infektionen mit Koagulase-positiven
und -negativen Staphylokokken, zur Entwicklung Methicillin-resistenter
Staphylokokken, Penicillin- und Makrolid-resistenter Pneumokokken
sowie Makrolid-resistenter Streptococcus pyogenes-Stämme.
Im Krankenhaus beobachtet man zudem eine Zunahme von multiresistenten
Enterobacteriaceae und Enterokokken [2, 3].
Im
Bereich der Luftwege beginnen Infektionen jedoch meist als virale
Infektionen durch Influenza-, Parainfluenza- oder RS-Viren,
die zu funktionellen Störungen der unspezifischen körpereigenen
Abwehrfunktionen wie der mucociliären Clearance, der Belüftung
von Epitheloberflächen und der Peristaltik führen.
Die Besonderheit in der Kinderheilkunde besteht darin, dass
es nach einer ersten harmlos erscheinenden Virusinfektion zu
schweren bakteriellen Komplikationen kommen kann. Einer Otitis
media bzw. Sinusitis geht regelmäßig eine Virusinfektion
der Nasenschleimhäute voraus [4]. Im Gegensatz zu Erwachsenen,
bei denen die Öffnungen der Nasennebenhöhlen bzw.
der Eustachischen Tuben und die mucociliäre
Clearance trotz einer Schleimhautschwellung erhalten bleiben,
führt dies bei Säuglingen und Kleinkindern wegen der
Enge der Strukturen zu bakteriellen Superinfektionen. Im Säuglings-
und Kleinkindalter kommt es bei 7 - 9 % der Patienten zu einer
bakteriellen Sinusitis, bei Erwachsenen dagegen bei < 2 %.
Auch anatomische Fehlbildungen wie eine Septumdeviation, eine
Muschelhyperplasie oder eine Hyperplasie des lymphatischen Gewebes
des Nasenrachenraums (Tonsillen, Adenoide) führen durch
eine Beeinträchtigung der Belüftung der Schleimhäute
und des Sekretabflusses zu bakteriellen Superinfektionen [5].
Anatomische Fehlbildungen z.B. des Harntrakts geben regelmäßig
Anlass zur bakteriellen Besiedlung und Infektion des Urogenitaltrakts.
Die
Unreife der spezifischen stimulierbaren körpereigenen Abwehrfunktionen
bei Früh- und Neugeborenen, angeborene und erworbene Störungen
der spezifischen Abwehr bei Antikörpermangel oder Granulozytendefekten
sowie funktionelle und anatomische Störungen der körpereigenen
Abwehr führen zu schweren, foudroyant verlaufenden oder
protrahierten Infektionen oft mit multiresistenten Mikroorganismen
[6].
In
der Onkologie bzw. nach Knochenmarktransplantationen ist die
körpereigene Abwehr für Wochen eingeschränkt.
Infektionen spielen z.B. bei der lymphatischen Leukämie
des Kindesalters als Todesursache eine ebenso große Rolle
wie Tumorrezidive. Bei der Behandlung von Früh- und Neugeborenen
sind schwere bakterielle
Infektionen mit multiresistenten nosokomialen Infektionserregern
ein ernstes Problem.
Letztlich
treten Probleme auch als Folgekrankheiten von Infektionen bzw.
in der Differenzialdiagnose nichtinfektiöser Krankheitsbilder
auf. Infektionen sind auch Auslöser schwerer immunologisch
bedingter Krankheitsbilder wie des rheumatischen Fiebers oder
der Post-Streptokokken-Glomerulonephritis. Ein klassisches Beispiel
für ein differenzialdiagnostisches Problem ist auch das
Kawasaki-Syndrom, das zu Beginn mit dem typischen Exanthem und
Enanthem im Rachen, einer massiven Schwellung der Kieferlymphknoten
und dem hohen Fieber einem Scharlach ähnelt, jedoch bei
fehlendem Streptokokkennachweis, der Fieberkontinua, den Lacklippen,
dem Palmarerythem und den Hautabschilferungen an den Finger-
und Zehenkuppen rasch zu diagnostizieren ist [7].
Infektionen
sind nach wie vor weltweit die häufigste Todesursache bei
Säuglingen und Kindern, wobei in den Industrieländern
wegen der verbesserten Ernährungsbedingungen, besserer
Wohnbedingungen sowie der aktiven Immunisierung gegen zahlreiche
virale und bakterielle Mikroorganismen ein Rückgang der
Sterblichkeit zu beobachten ist [8]. Durch den Einsatz wirksamer
Impfstoffe hat sich die Epidemiologie, aber auch das Erregerspektrum
im letzten Jahrzehnt verändert. Polio und Diphtherie sind
weitgehend verschwunden, schwere invasive Infektionen wie die
Meningitis und die Epiglottitis durch H. influenzae
vom Kapseltyp b sowie Keuchhusten weitgehend reduziert. Durch
die Pneumokokkenimpfung wurde auch eine deutliche Reduktion
von Erkrankungen durch Pneumokokken beobachtet. Gleichzeitig
wurde jedoch auch ein Wechsel der häufigsten Pneumokokken-Serotypen
beobachtet,
hin zu Serotypen, die im 7fach-Impfstoff nicht enthalten sind.
|
| Diagnostik
Es
ist wichtig, den Einsatz von antimikrobiellen Substanzen auf
klare Indikationen zu beschränken. Der unkritische Gebrauch
von Antibiotika hat zu einer inzwischen bedrohlichen Zunahme
resistenter Mikroorganismen nicht nur im Krankenhaus geführt.
Antibiotika, insbesondere Breitspektrumantibiotika mit inkompletter
Bioverfügbarkeit oder langer Halbwertszeit, haben einen
substanziellen Einfluss auf die Zusammensetzung und das Resistenzverhalten
der körpereigenen Flora. Diese resistenten Mikroorganismen
sind die Quelle von Reinfektionen.
Aussagekräftige
Befunde einer mikrobiologischen Untersuchung, d.h. Isolierung
und Identifizierung des pathogenen Erregers sowie eine Resistenzprüfung,
zu erhalten ist im Kindesalter erheblich schwieriger als bei
Erwachsenen. Proben, z.B. bei einer Otitis media oder Sinusitis,
sind nur nach Punktion des Infektionsherdes z.B. durch eine
Parazentese zu gewinnen, eine Indikation dafür ist jedoch
fast nie gegeben. Die Erregerdiagnostik bei Pneumonien ist unbefriedigend.
Patienten bis zum Alter von 6 Jahren verschlucken das Sputum,
bei Pneumonien durch Mycoplasma/Chlamydia pneumoniae
oder Legionella pneumophila zeigen die Kinder einen
trockenen Reizhusten meist ohne Sputum. Mikroorganismen können
aus dem Pleuraexsudat und der Blutkultur, bei atypischen Pneumonien
auch aus dem Epipharynxsekret isoliert werden. Die transtracheale
Bronchialaspiration ist abzulehnen, die Bronchiallavage beim
narkotisierten, intubierten Kind ist auf Problemfälle (nosokomiale
Pneumonie bei immunsupprimierten Patienten oder Therapieresistenz)
zu beschränken.
Eine Gelenkpunktion
bei Verdacht auf eine septische Arthritis ist hingegen unverzüglich
durchzuführen.
Besondere
Schwierigkeiten treten bei der Gewinnung von Harnproben beim
Säugling und Kleinkind auf. Die Gewinnung eines Mittelstrahlharns
ist meist erst nach dem 3. Lebensjahr möglich. Der Beutelurin
ist immer mit einer gewissen Keimmenge kontaminiert und muss
sofort bearbeitet werden, um ein repräsentatives Ergebnis
zu erbringen. Ein Versand ist nicht möglich. Die Gewinnung
eines Katheterharns ist mit dem Risiko der Keimverschleppung
behaftet, die suprapubische Blasenaspiration, obwohl in der
Literatur empfohlen, ist wegen der Belastung des Patienten nur
in Ausnahmefällen durchzuführen. Wenn in einer Harnprobe
mehrere Keime isoliert werden, deutet dies außer bei Patienten
mit einer neurogenen Blasenentleerungsstörung auf eine
Kontamination hin. Durch eine Quantifizierung des Leitkeims
ist evtl. trotzdem eine Aussage möglich. Ein Ausweg bietet
sich bei der Verwendung von Eintauchobjektträgerkulturen,
allerdings darf das Ergebnis nicht als alleiniges Kriterium
beurteilt werden, sondern nur in Kombination mit einer mikroskopischen
Untersuchung des Nativharns und einer Beurteilung der Keimmenge
im unzentrifugierten, ungefärbten Harn. > 1 Keim/Gesichtsfeld
bei einer 400fachen Vergrößerung ist diagnostisch
für eine Harnwegsinfektion [10].
Ein weiteres Problem der mikrobiologischen Diagnostik ist die
Zeitdauer bis zur Übermittlung der Kulturergebnisse und
der Resistenzprüfung. Bei einem Rachenabstrich mit Streptokokkennachweis
dauert dies im besten Fall 12h, das Ergebnis einer Harnkultur
oder einer Bronchialaspiration ist nach 24h, das Ergebnis einer
Liquor- bzw. Blutkultur (Keimisolierung und Resistenzprüfung)
ist frühestens nach 24-36h verfügbar. Kulturergebnisse
bei Mycoplasma/Chlamydia pneumoniae sowie auch Bordetella
pertussis bedürfen einer Bebrütungszeit von 7
Tagen und sind für eine Therapielenkung nicht geeignet,
wohl aber zur epidemiologischen Überwachung.
Auch ohne
labordiagnostische Untersuchungen ist in vielen Fällen
aufgrund unterschiedlicher Krankheitsbilder eine präsumptive
Diagnose möglich. Sie beruht auf:
- der
statistischen Wahrscheinlichkeit, mit der bestimmte Infektionserreger
in bestimmten Altersgruppen infrage kommen. Streptokokken
der Gruppe B sind für Neugeboreneninfektionen verantwortlich,
Streptokokken der Gruppe A treten nach dem 1. Lebensjahr auf,
da vorher kaum Haftrezeptoren an Wangenschleimhautepithelien
exprimiert werden. Pneumonien durch Mycoplasma/Chlamydia
pneumoniae treten ab dem 3. Lebensjahr auf;
- charakteristischen
klinischen Symptomen, z.B. einem typischen Exanthem bei Scharlach
und Streptokokken, Sugillationen der Haut bei Meningokokken,
einem feinfleckigen diskreten Exanthem am Stamm mit Tonsillitis,
Lymphknotenschwellung zervikal und Hepatosplenomegalie bei
Pfeiffer’schem Drüsenfieber, d.h. einer Infektion
mit Epstein-Barr-Viren;
- dem
Krankheitsverlauf, insbesondere dem Fieberverlauf. Infektionen
durch Streptokokken, Pneumokokken oder Meningokokken führen
meist zu einem abrupten Fieberbeginn mit Schüttelfrost,
Infektionen mit Mykoplasmen und Viren zu einem treppenförmigen
Fieberbeginn. Eine virale Rhinitis ist meist durch ein dünnflüssiges
seröses Sekret gekennzeichnet, eine primäre bakterielle
Rhinitis bzw. eine bakterielle Superinfektion durch ein eitriges,
bisweilen blutig tingiertesSekret. Ein erneuter Fieberanstieg
nach
bereits beginnender klinischer Besserung oder eine Persistenz
der Infektion über 4 Tage hinaus weist auf eine bakterielle
Superinfektion hin. Der Nachweis von Kälteagglutininen
wird bei Infektionen durch Mycoplasma pneumoniae
beobachtet;
- der
epidemiologischen Situation und einer evtl. bereits vorangegangenen,
ungezielten Antibiotikatherapie. Daraus lassen sich mit hoher
Treffsicherheit die selektionierte Keimspezies sowie auch
die Empfindlichkeit der Mikroorganismen ableiten.
Die
empirische kalkulierte Wahl eines Antibiotikums ist jedoch in
den letzten Jahren durch das Auftreten resistenter Mikroorganismen
auch im ambulanten Bereich erheblich schwieriger geworden. |
Therapie
Die erfolgreiche Behandlung einer Infektion setzt die Wahl eines
wirksamen Antibiotikums voraus. Ein Grundsatz einer antimikrobiellen
Behandlung besteht darin, möglichst gezielt, d.h. so schmal
wie möglich und so breit wie nötig, zu behandeln.
Dabei kommt es nicht nur auf die Wahl eines wirksamen Antibiotikums,
sondern auch auf eine Reihe weiterer Parameter an:
- Bioverfügbarkeit
und Beeinflussung der Bioverfügbarkeit durch verschiedene
Grundkrankheiten wie akute oder chronische Durchfallerkrankungen.
Die Bioverfügbarkeit hat auch einen Einfluss auf die
Selektion resistenter Mikroorganismen.
- Halbwertszeit
und Eliminationsroute eines Antibiotikums
- Eiweißbindung
- Gewebsverteilung
des Antibiotikums im Körper und Metabolismus
- Die
Penetration ins interstitielle Flüssigkeitskompartiment
und die Epithelial-Lining-Fluid (ELF) sowie entsprechend
der Art des Erregers und dem Ort der Infektion auch die Penetration
ins intrazelluläre Kompartiment sind entscheidende Parameter
für die Wirksamkeit eines Antibiotikums.
Pharmakokinetik
und Pharmakodynamik im Kindesalter
Eine wichtige Orientierungsgröße für die Wirksamkeit
eines Antibiotikums ist die Pharmakokinetik, d.h. die Bioverfügbarkeit
eines Medikaments, die durch die Messung der Serum- und Gewebskonzentrationen
und ihrer Beeinflussung durch Resorptions-, Diffusions- und
Exkretionsvorgänge bestimmt wird [11, 12, 13, 14].
Dabei
unterscheiden sich alle obengenannten Parameter bei Kindern
erheblich von denen bei Erwachsenen. Aber selbst im Kindesalter
sind wesentliche Unterschiede in den einzelnen Lebensabschnitten
– z.B. zwischen Früh- und Neugeborenen, Säuglingen,
Kleinkindern zwischen 2 und 6 Jahren, Schulkindern und Adoleszenten
– zu beobachten, wobei sich im Laufe der Zeit die pharmakologischen
und pharmakokinetischen Parameter dem Erwachsenenalter annähern.
Zudem sind besondere Grundkrankheiten zu berücksichtigen,
die die oben genannten Parameter zusätzlich überlagern.
Es bestehen in verschiedenen Lebensabschnitten erhebliche Unterschiede
in der Resorption, Verteilung und im Metabolismus von Antibiotika.
Durch eine beschleunigte Peristaltik im Säuglingsalter
sowie bei verschiedenen Grundkrankheiten kommt es zu Resorptionseinbußen
von 50% gemessen an der Fläche unter der Resorptionskurve
und der im Harn wieder entdeckten Wirkstoffmenge. Auch Resorptionseinbußen
durch gleichzeitige Verabreichung von Nahrung sind zu berücksichtigen.
Dadurch kann man nicht mit einer regulären Pharmakokinetik
rechnen, wie sie bei Erwachsenen zur Definition
von effektiven Tagesdosen und Dosierungsintervallen geführt
hat [15].
In
Abhängigkeit vom Lebensalter bestehen erhebliche Unterschiede
in der Bioverfügbarkeit. Bei Patienten im Alter zwischen
2 und 18 Monaten ist bei gleicher mg/kg-KG-Verabreichung von
Penicillin V K, aber auch Amoxicillin und Amoxicillin/Clavulansäure
die Fläche unter der Kurve um 75%, die im Harn wieder entdeckte
Substanzmenge um 50% reduziert. Dies hängt nicht zuletzt
von der beschleunigten
Passagezeit bei Säuglingen im Vergleich zu älteren
Kindern ab (Abbildung 1).
Die Resorption
hängt ab:
- vom
Füllungszustand und der Entleerungszeit des Magens
- vom
pH-Wert im Magen
- von
der intestinalen Oberfläche und Permeabilität
- von
der Peristaltik des Dünndarms und der mikrobiellen Besiedlung
- von
der Durchblutung im Splanchnikusgebiet, die z.B. bei hohem
Fieber vermindert ist
Bei
Säuglingen und Kleinkindern hat der Zeitpunkt der Nahrungsaufnahme
einen wesentlich größeren Einfluss auf die Verabreichung
von Medikamenten als bei Erwachsenen.
Für Penicillin V K wurde eine erhebliche Resorptionsminderung
(50% Verminderung der im Harn wieder entdeckten Menge) durch
Nahrung beobachtet [16].
Auch die Art der Nahrung hat einen entscheidenden Einfluss auf
die Resorption bzw. Resorptionsminderung. Milch, gefolgt von
Fett, Kohlenhydraten und Eiweiß haben in dieser Reihenfolge
eine Resorptionsminderung zur Folge, klare Flüssigkeiten
einen resorptionssteigernden Effekt (Abbildung
2).
Diese
Resorptionseinbußen werden außer bei Penicillin
auch bei zahlreichen anderen in diesem Alter häufig verwendeten
Antibiotika (Amoxicillin, Amoxicillin + Clavulansäure,
Sulbactam-Ampicillin, Azidocillin) beobachtet [17]. Es wird
auch diskutiert, dass die Resorption von Prodrugs wie Cefuroxim
Axetil und Cefpodoxim Proxetil im frühen Säuglingsalter
wegen der Unreife intestinaler Enzyme zur Spaltung des Esters
unzureichend ist [18]. Die Folgen dieser Resorptionseinbuße
sind:
- (zu)
geringe Wirkstoffkonzentrationen am Infektionsort mit eingeschränkter
klinischer Wirksamkeit, die zu eingeschränkter klinischer
Wirksamkeit und Rezidivneigung führen
- gesteigerte
Rate an Nebenwirkungen, insbesondere gastrointestinale Nebenwirkungen,
durch osmotische Wirkung nicht absorbierter Arzneimittel und
Störung der körpereigenen Flora
- subinhibitorische
Konzentrationen induzieren die Entwicklung resistenter Mikroorganismen.
Abbildung 1: Unterschiede
in der Bioverfügbarkeit zwischen den einzelnen Lebensabschnitten
bei einer Dosierung des Kaliumsalzes von Phenoxymethylpenicillin
von 12.500 IE pro Kilogramm Körpergewicht.
|
Abbildung 2: Resorptionseinbußen
von Penicillin V K bei Schulkindern nüchtern und
nach einer Milchmahlzeit.
|
|
|
Pharmakodynamik
Ein weiterer wichtiger Faktor bei der Infektionsbehandlung bei
Säuglingen und Kleinkindern ist die Beachtung der Pharmakodynamik
von Antibiotika [20]. Die Pharmakodynamik beschreibt die Wirkung
eines Antibiotikums auf den Mikroorganismus. Bei Erwachsenen
konnte festgestellt werden, dass eine Überschreitung der
Wirkstoffkonzentration über den MHK-Wert am Infektionsort
> 40% des Zeitraums bis zur nächsten Dosis für
eine effektive Keimeradikation ausreicht. Mikroorganismen zeigen
in Gegenwart eines Antibiotikums geänderte Oberflächeneigenschaften,
d.h. eine niedrigere Konzentration von Lipooligosacchariden
in der Zellwand, was einerseits zu einer geringeren Entzündungsreaktion,
andererseits durch eine geringere Elektronegativität zu
einer besseren Phagozytose führt. Für das Kindesalter
werden jedoch Wirkstoffkonzentrationen über dem MHK-Wert
über 75-90% des Zeitraums bis zur nächsten Dosis empfohlen.
Daraus resultiert eine rasche Keimelimination und klinische
Heilung sowie eine Verhinderung der Resistenzentwicklung. Im
Gegensatz dazu sind subinhibitorische Konzentrationen von Antibiotika
mit verzögerter klinischer Besserung, dem Übergang
in eine chronisch schwelende Infektion und der Induktion/Selektion
von resistenten Mikroorganismen verbunden. Die notwendige Zeit,
in der die Hemmkonzentration überschritten sein muss, hängt
von der körpereigenen Abwehr ab, die aber beim Säugling
und Kleinkind noch nicht verlässlich entwickelt ist [19,20].
Abbildung
3 zeigt, dass eine einzige zusätzliche Dosis nach 4
Stunden am ersten Behandlungstag zu einer Überschreitung
des MHK-Wertes am Infektionsort über nahezu 36 Stunden
führt, während die 3x tägliche Gabe nur eine
Überschreitung des MHK-Wertes
z.B. für H. influenzae von 40% der Zeit ergibt.
Diese
eine zusätzliche Dosis ist mit erheblich verbesserten klinischen
Ergebnissen, z.B. bei der Behandlung der Otitis media, und einer
niedrigeren Rezidivrate verbunden.
Abbildung 3: Konzentrationsverlauf
von Amoxicillin
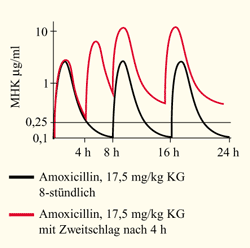
|
Behandlungsdauer
Die
Behandlungsdauer wird kontrovers diskutiert: Die Meinung, dass
sich die Therapiedauer nach der Eradikation des ätiologischen
Agens zu richten hat, ist für die Kinderheilkunde nur bedingt
korrekt. Wichtiger ist es, die Behandlungsdauer nicht nur nach
der Keimeradikation, sondern vielmehr nach der Normalisierung
des ursprünglichen Pathomechanismus, der zur Infektion
geführt hat, zu richten. Zum Beispiel ist die Funktion
der Eustachischen Tube nach einem Virusinfekt für 8 - 12
Tage gestört. Bei einer Behandlungsdauer von 5 Tagen besteht
für weitere 5 - 7 Tage nach Therapieende eine Tubenbelüftungsstörung,
wobei persistierendes Sekret in der Paukenhöhle zu einer
schwelenden Infektion bzw. einer bakteriellen Wiederbesiedlung
aus dem Nasenrachenraum und einem Rezidiv Anlass geben kann.
In klinischen Untersuchungen konnten die Unterschiede zwischen
den einzelnen Behandlungsschemata nicht unmittelbar
am Therapieende, sondern nach 4 - 6 Wochen an einer wesentlich
niedrigeren Rezidiv-/Reinfektionsrate gemessen werden.
|
Literatur:
| 1.
Horn M.E., Reed S.E., Taylor P.E.: „Role of viruses
and bacteria in acute wheezy bronchitis in childhood. A
study of sputum.“ Arch. Dis. Child. 54 (1979) 587-592. |
| 2.
Baquero F.: „Trends in antibiotic resistance of respiratory
pathogens: an analysis and commentary on a collaborative
surveillance study.“ J. Antimic. Chemoth. 38 Suppl.
A(1996) 117-132. |
| 3.
Felmingham D., Grüneberg R.N.: „The Alexander
Project 1996-1997 latest susceptibility data from this institutional
study of bacterial pathogens from community acquired lower
respiratory tract infections.“ J. Antimic.Chemoth.
46 (2000) 767-773. |
| 4.
Gillespie M.B.: „Recurrent otitis media in children.“
JAMA 289 (2003) 1383-1384. |
| 5.
Goss C.H.: „Airway clearance in cystic fibrosis.“
Resp. Care. 48 (2003) 20-21. |
| 6.
Lewis D.B., Wilson C.B.: „Developmental Immunology
and role of host defenses in neonatal susceptibility to
infection.“ In Remington & Klein Infectious Diseases
of the fetus and neonate. Saunders (1995) 20-98. |
| 7.
Rowley A., Shulman S.: „Kawasaki Sandom“ In
Jenson HB, Baltimore RS: Ped. Infectious Diseases. Saunders
(2002) 478-485. |
| 8.
Ogra: „Vaccination Strategies for Mucosal Immune Responses.“
Clin. Microbiol. Rev. 14 (2001) 430-445. |
| 9.
Kaster U., Guggenbichler J.P.: „Influence of macrolide
antibiotics on promotion of resistance in the oral flora
of children .“ Infection 29 (2001) 251-256. |
| 10.
Kunin C.M., Deutscher R., Paquin P.: „Urinary tract
infections in schoolchildren.“Medicine 43 (1964) 91-130. |
| 11.
Dagan R., Klugman K.P., Craig W.A., Baquero F.: „Evidence
to support the rationale that bacterial eradication in respiratory
tract infections is an important aim of antibacterial therapy.“
J. Antimic. Chemoth. 47 (2001) 129-140. |
| 12.
Ritschel W.A., Kearns G.L.: „Pediatric Pharmacokinetiks.“
In Ritschel und Kearns: Handbook of Basic Pharmacokinetics.
5th EDAmerican Pharmaceutical Association. (1999) 304-321. |
| 13.
Reed M.D., Blumer J.L.: „Therapeutic drug monitoring
in the pediatric intensive care unit.“ Ped. Clin.
North. Am. 42 (1994) 1127-1143. |
| 14.
Kearns G.L.: „Impact of developmental pharmacology
on pediatric study design: Overcoming
the challenges.“ J. Allergy Clin.Immunol. 106 Suppl.
(2000) 128-138. |
| 15.
Guggenbichler J.P., Kienel G.: „Pharmakokinetische
Untersuchung mit neuen galenischen Zubereitungen von Cephalexin.“
Päd. Pädol. 13 (1978) 315-320. |
| 16.
Guggenbichler J.P.: „Resorption oral verabreichter
Antibiotika und Chemotherapeutika bei Kindern und ihre Beeinflussung.“
Päd. Pädol. 17 (1982) 565-584. |
| 17.
Hughes G.S.: „The effect of gastric pH and food on
the pharmacokinetics of a new oral cephalosporin, cefpodoxim
proxetil.“ Clin. Pharm. Ther. 46 (1989) 647-685. |
| 18.
Guggenbichler J.P.: „Unpublizierte Beobachtungen bei
6 Säuglingen < 3 Monaten.“ (1996). |
| 19.
Abdel-Rahman S., Kearns G.L.: „The pharmacokinetic-pharmacodynamic
interface: Determinants of Antiinfective Drug Action and
Efficacy in Pediatrics.“ IN Feigin, Cherry, Demmler
Kaplan: Textbook of Pediatric Infectious Diseases II: (2004)
2965-2987. |
| 20.
Guggenbichler J.P.: „Dosierung von Antibiotika im
Kindesalter – Schnittstelle zwischen Pharmakokinetik
und Pharmakodynamik.“ Antibiotika Monitor tom XX/3
(2004). |
Anschrift
des Verfassers:
Univ.-Prof. Dr. J. Peter Guggenbichler
Kinder- und Jugendklinik der Universität Erlangen-Nürnberg
D-91054 Erlangen, Loschgestraße 15
E-Mail: prof.guggenbichler@gmx.de
|
|
|