| G. Weiss
Med. Universität, Klin. Abt. für Allgemeine Innere
Medizin, Klinische Infektiologie und Immunologie, Innsbruck
(Vorstand: A.o. Univ.-Prof. Dr. J. Patsch) |
|
Schlüsselwörter:
Eisen, Makrophagen,
Anämie, intrazelluläre Bakterien, Siderophore, Stickstoffmonoxid
(NO), Interferon |
|
Zusammenfassung
Eisen
ist aufgrund seiner Funktion für den Sauerstofftransport
im Blut und seiner Cofaktorrolle für viele zentrale Enzyme
essenziell für das Wachstum aller Zellen und somit auch
von Mikroorganismen. Darüber hinaus beeinflusst Eisen die
Effektivität der Immunantwort, einerseits aufgrund seiner
Effekte auf die Differenzierung und Proliferation v.a. von Lymphozyten,
andererseits beeinflusst Eisennegativ proinflammatorische und
T-Helfer-Zell-Typ-1 induzierte Immuneffektorwege. Des Weiteren
besitzt Eisen katalytische Funktion für die Bildung von
hochtoxischen Hydroxylradikalen, die sowohl in der Immunantwort
eine Rolle spielen, aber auch mit Gewebeschädigung im Rahmen
chronisch inflammatorischer Prozesse assoziiert sind. Andererseits
haben Mikro-Organismen ausgeklügelte Mechanismen entwickelt,
um Eisen auch bei limitiertem Angebot des Metalls an sich zu
binden und aufzunehmen und so Wachstum und Proliferation sicherzustellen.
Solche Siderophor- und Eisenaufnahmesysteme sind häufig
mit Pathogenität von Bakterien und Pilzen assoziiert.
Aus
den genannten Gründen ist eine stringente Kontrolle der
Eisenhomöostase auch von zentraler Bedeutung in der Bekämpfung
von Infektionskrankheiten, zumal eine erhöhte Eisenverfügbarkeit
bzw. eine Eisenüberladung des Immunsystems mit einer erhöhten
Infektanfälligkeit und einem
ungünstigen klinischen Verlauf von Infektionen assoziiert
ist. Die häufigste Erkrankung, die diese Interaktion von
Eisen und Immunität offenbart, ist die Anämie chronischer
Erkrankungen (ACD), die besonders bei Patienten, die an Autoimmunerkrankungen,
Tumoren oder Infektionen leiden, zu finden ist. Dabei kommt
es unter anderem zu einer Restriktion von Eisen in Makrophagen,
was möglicherweise aus dem Bestreben des Körpers erwächst,
Eisen von eindringenden Mikro-Organismen und Tumorzellen fern
zu halten und andererseits die Effektivität der Immunantwort
zu stärken.
Die Kontrolle über die Eisenverfügbarkeit ist eines
der entschiedensten Kriterien, die den Verlauf einer Infektion
determinieren, weshalb Untersuchungen zu diesem komplexen Netzwerk
zwischen Eisenhomöostase, Immunantwort und Mikroben nicht
nur für das Verständnis der Zusammenhänge der
Host-Pathogen-Interaktion optimieren, sondern auch für
die Entwicklung neuer therapeutischer Optionen von größtem
Interesse sind.
|
Key-words:
Iron,
macrophages, anemia, intracellular bacteria, siderophores, nitricoxide,
interferon |
|
Summary
Iron
is an essential component for all living organisms because of
its co-factor role for essential enzyme in mitochondrial respiration,
citric acid cycle and DNA synthesis. In addition, iron exerts
subtle effects on immune function by modifying the proliferation
and differentiation of lymphocyte subsets and by exerting direct
negative effects of cell mediated immune effector mechanisms
of macrophages which are directed against invading pathogens.
On the other hand, microorganisms have evoked sophisticated
strategies to acquire iron even under limited availability to
ensure a sufficient amount of the metal needed for their proliferation.
Thus, the control over cellular iron homeostasis is one of the
central battlefields deciding about the fate of an infection.
This becomes most obvious with the anemia of chronic disease
(ACD). ACD is the most frequent anemia observed in hospitalized
patients and subjects suffering from diseases causing an activated
immune system such as cancer, auto-immune disorders and infections.
An increasing amount of evidence supports the notion that ACD
may result from a defense strategy of the body (host) in order
to limit the availability of iron to pathogens and to strengthen
immune effectors pathways directed against them.
|
Einleitung
Eisen
ist vor allem aufgrund seines Vorkommens in der Erdkruste in
Form von oxidierten Eisenverbindungen insgesamt das vierthäufigste
Element. Das Vorhandensein von Eisen ist eng mit der Entstehung
von Leben assoziiert. Eisen ist ein für alle Lebewesen
essenzielles Molekül, einerseits wegen seiner Rolle als
Cofaktor für viele lebenswichtige Enzyme, wie z.B. der
Akonitase im Zitratzyklus, als Bestandteil von Schlüsselenzymen
in der mitochondrialen Atmung oder von Ribonukleotid-Reduktase
in der DNA-Synthese, andererseits wegen seiner zentralen Bedeutung
für den Sauerstofftransport im Hämoglobin oder Myoglobin
[1]. Insgesamt enthält der menschliche Körper circa
4 g Eisen, dessen Homöostase sehr genau geregelt werden
muss. Denn obwohl Eisen eine derart zentrale Aufgabe in der
Zelle hat, führen sowohl ein Überangebot als auch
ein Mangel an Eisen zu Störungen der Zellfunktion. Bei
einem Überangebot von Eisen in der Zelle, wie man es bei
einer der häufigsten genetischen Erkrankungen in Mittel-
und Nordeuropa, der genetischen Hämochromatose findet,
wirkt das Metall als Katalysator für die Bildung toxischer
Radikale über die Fenton-Reaktion [2]. Dadurch kommt es
intrazellulär zur Akkumulation von toxischen Hydroxylradikalen
und damit zur Schädigung von Zellen, was mit der Zeit zur
Gewebezerstörung vor allem in parenchymatösen Organen
und dadurch zur Fibrose führt. Als Ausdruck dessen entwickeln
Patienten mit unbehandelter Hämochromatose häufig
eine Leberzirrhose, eine Kardiomyopathie oder einen Diabetes
[1, 3]. Die häufigste Form der Hämochromatose, von
der ca. 80% der Patienten betroffen sind, ist mit einer Mutation
in einem sogenannten nicht-klassischen MHC-I-Molekül, dem
HFE, assoziiert. Darüber hinaus gibt es noch vier andere
Formen
der primären Eisenüberladung, die durch Mutationen
in regulatorischen Eisenmetabolismusgenen hervorgerufen werden
[3].
Auf der anderen Seite führt ein Eisenmangel zur Einschränkung
des zellulären Stoffwechsels und einer Wachstumshemmung
und von Zellen, die sich klinisch zuerst als so genannte Eisenmangelanämie,
der weltweit häufigsten Anämieform, manifestiert [1].
Da Eisen kaum ausgeschieden werden kann und nur durch die so
genannte Zellmauserung bzw. durch Blutungen verloren geht, ist
die gut koordinierte Kontrolle von Eisenaufnahme verbunden mit
der intrazellulären Regulation von Eisenspeicherung und
Eisenverbrauch von vitaler Bedeutung für jede Zelle.
|
| Regulation
der Immunantwort durch Eisen Eine
ausreichende Verfügbarkeit von Eisen ist von essenzieller
Bedeutung für die Proliferation und Differenzierung von
Immunzellen, während ein Überangebot insbesondere
im Rahmen einer mit einer chronischen Immunaktivierung einhergehenden
Erkrankung sich negativ auf die zellvermittelte Immunantwort
auswirkt [4, 5]. So ist ein schwerer Eisenmangel mit einer reduzierten
Proliferationskinetik vor allem von NK- und T-Lymphozyten assoziiert.
Darüber hinaus kann die zelluläre Eisenverfügbarkeit
die Differenzierung und Aktivierung von Lymphozytensubsets wievon
T-Helfer-Zellen Typ 1 (TH1) und Typ 2 (TH2) oder CD8+-T-Zellen
beeinflussen, was wiederum profunde Effekte auf die Regulation
der zellulären Immuneffektorfunktion ausübt [4, 5,
6]. Letztendlich ist Eisen auch direkt in Immuneffektormechanismen
eingebunden. So katalysiert Eisen die Bildung von hochtoxischen
Hydroxyl-Radikalen (OH•) in aktivierten Monozyten/Makrophagen,
was von großer Bedeutung
für die unspezifische Immunabwehr gegenüber eingewanderten
Pathogenen ist [2].
Darüber hinaus übt Eisen direkte Effekte auf die Immuneffektorfunktion
von Monozyten aus. Erhöhte Konzentration von Eisen in Monozyten/Makrophagen
führt zu einer Blockade der IFN-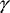 -vermittelten
Immuneffektorwege [7, 8]. Das zeigt sich unter anderem an einer
verminderten Produktion von TNF- -vermittelten
Immuneffektorwege [7, 8]. Das zeigt sich unter anderem an einer
verminderten Produktion von TNF-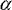 ,
einer eingeschränkten Antigenpräsentation durch verminderte
MHC-Klasse-II-Expression, einer reduzierten Expression von Adhäsionsmolekülen
wie ICAM-1 auf aktivierten Monozyten/Makrophagen oder einer
verminderten Bildung von Neopterin [9]. ,
einer eingeschränkten Antigenpräsentation durch verminderte
MHC-Klasse-II-Expression, einer reduzierten Expression von Adhäsionsmolekülen
wie ICAM-1 auf aktivierten Monozyten/Makrophagen oder einer
verminderten Bildung von Neopterin [9].
Das führt dazu, dass eisenbeladene Makrophagen nicht mehr
in der Lage sind, intrazelluläre Mikroorganismen wie Legionellen,
Listerien, Salmonellen oder Mykobakterien über diese IFN-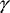 -vermittelten
Abwehrmechanismen zu eliminieren. Umgekehrt führt der Entzug
von Eisen, z.B. durch die therapeutische Gabe eines Eisenchelators,
zur Stimulation der Immuneffektorfunktion von Makrophagen und
zur Eliminierung der Mikroorganismen, was primär auf die
Beeinflussung der IFN- -vermittelten
Abwehrmechanismen zu eliminieren. Umgekehrt führt der Entzug
von Eisen, z.B. durch die therapeutische Gabe eines Eisenchelators,
zur Stimulation der Immuneffektorfunktion von Makrophagen und
zur Eliminierung der Mikroorganismen, was primär auf die
Beeinflussung der IFN-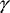 -mediierten
Immunabwehrmechanismen und nicht auf Limitierung des für
Mikroorganismen essenziellen Eisens zurückzuführen
ist [10, 11]. -mediierten
Immunabwehrmechanismen und nicht auf Limitierung des für
Mikroorganismen essenziellen Eisens zurückzuführen
ist [10, 11].
Ein
Teil dieser Effekte ist auf eine direkte Interaktion von Eisen
mit der Bildung des zentralen Immuneffektormoleküls NO
zurückzuführen. Sowie nämlich NO in die post-transkriptionelle
Kontrolle des Eisenmetabolismus über „iron regulatory
proteins“ eingreift [12], beeinflusst die zelluläre
Eisenverfügbarkeit auch die NO-Produktion. Erhöhte
intrazelluläre Konzentrationen von nicht-ferritingebundenem
Eisen reduzieren die Transkription Expression des Enzyms induzierbare
NO-Synthase (iNOS) inaktivierten Makrophagen, während Eisenentzug
durch Gabe von Desferrioxamin zu einer Erhöhung der iNOS-Expression
und damit der NO-Synthese führt [13]. Der zugrunde liegende
Mechanismus ist eine eisenbedingte Reduktion der Bindung der
zentralen Transkriptionsfaktoren NF-IL6 und HIF-1 an den iNOS-Promotor
mit konsekutiver Verminderung der Transkriptionsaktivität
[14, 15]. Diese Interaktion von Eisen und NO ist von wesentlicher
Bedeutung für die Abwehr gegenüber Infektionen. Die
vermehrte Produktion und Freisetzung von NO durch aktivierte
Makrophagen ist ein wesentlicher Immunabwehrmechanismus gegenüber
Tumorzellen und Mikroorganismen, sodass ein vermehrtes Eisenangebot
nicht nur die Proliferation von Mikroorganismen fördert,
sondern auch die gegen sie gerichteten Immunabwehrwege schwächt.
Vor
allem bei Infektionen mit intrazellulären Erregern scheint
der Eisenhomöostase eine entscheidende Bedeutung zuzukommen.
Vor nunmehr über 10 Jahren wurde in Makrophagen ein Resistenzgen
isoliert, das Schutz vor Infektionen mit Salmonellen, Leishmanien
und Tuberkelbakterien bietet [16, 17]. Dieses phagolysosomale
Transportprotein, NRAMP-1 (für natural resistance associated
macrophage protein), transportiert neben Protonen und Magnesium
auch Eisen aus dem Phagolysosom [18], womit es zu einer Eisenverarmung,
vermehrten Stimulation der Immunabwehr und besseren Abtötung
der eingedrungenen Erreger kommen kann. Darüber hinaus
führt die Expression von NRAMP-1 zu einer vermehrten Stimulation
der NO-Bildung [19], was wiederum einen wesentlichen Abwehrmechanismus
gegen diese intrazellulären Erreger darstellt. Da die zelluläre
Eisenverfügbarkeit einen wesentlichen Einfluss
auf die Bildung von NO ausübt, während NO umgekehrt
in die Eisenhomöostase eingreift, und die NRAMP-1-Expression
sowohl durch Eisen reguliert wird, als auch umgekehrt NRAMP-1
den zellulären Eisentransport und die Bildung von NO beeinflusst,
dürfte das regulatorische Triangulum NO, Eisen und NRAMP-1
von entscheidender Bedeutung für die Abwehr intrazellulärer
Erreger sein.
|
Eisen
und Infektion
Die Relevanz dieser Interaktionen von Eisen und Immunität
wurde durch zahlreiche klinische Beobachtungen untermauert.
Mehrere dieser Studienzeigen, dass eine erhöhte Eisenverfügbarkeit
mit einem erhöhten Tumor- und Infektionsrisiko bzw. mit
einem ungünstigen Verlauf einer dieser Erkrankungen vergesellschaftet
ist [20, 21].
In
einer doppelblinden, randomisierten, placebokontrollierten Studie
in Sambia konnte gezeigt werden, dass die Gabe des Eisenchelators
Desferrioxamin zusätzlich zu einer Standardmalariatherapie
mit Chinin zu einem günstigeren klinischen Verlauf bei
Kindern mit zerebraler Malaria führte, der schwersten Verlaufsform
einer Infektion mit PL. falciparum [22]. Die Applikation
von Desferrioxamin verkürzte die Fieber- und Komadauer
und führte zu einer rascheren Beseitigung vom Plasmodien
aus der Zirkulation. Damit verbunden kam es zu einem signifikanten
Anstieg der endogenen NO-Synthese nach Desferrioxaminebehandlung
[23]. Das legt den Schluss nahe, (i) dass der Mechanismus, über
den Desferrioxamine in vitro die iNOS Transkription
induziert, [12] auch in vivo Gültigkeit hat und
(ii) dass die vermehrte Bildung von NO für den günstigen
klinischen Verlauf verantwortlich sein könnte, da NO ein
zentrales Effektormolekül bei der
Abwehr von Parasiten ist [24, 25]. Das wird auch durch eine
Studie unterstützt, die zeigt, dass die Wirkung von Eisen/Desferrioxamine
auf die Plasmodien auf die Modulierung der Immunantwort und
nicht auf die Beeinflussung der Eisenverfügbarkeit für
die Parasiten zurückzuführen ist [25].
Eisen beeinflusst nicht nur die IFN-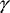 -Aktivität
und damit auch die Bildung von NO, sondern greift in das TH-1/TH-2
Netzwerk ein. So führt ein Überschuss von Eisen zu
einer verminderten Aktivität von pro-inflammatorisch wirkenden
TH-1-Zellen während die kreuzinhibitorische Aktivität
von TH-2 und damit eine antiinflammatorische und makrophagen-deaktivierende
Immunantwort gefördert wird [11, 27]. -Aktivität
und damit auch die Bildung von NO, sondern greift in das TH-1/TH-2
Netzwerk ein. So führt ein Überschuss von Eisen zu
einer verminderten Aktivität von pro-inflammatorisch wirkenden
TH-1-Zellen während die kreuzinhibitorische Aktivität
von TH-2 und damit eine antiinflammatorische und makrophagen-deaktivierende
Immunantwort gefördert wird [11, 27].
Auch bei Hepatitis C konnte gezeigt werden, dass der Eisenstatus
einen wesentlichen Einfluss auf den klinischen Verlauf der HCV-Infektion
hat. Ein erhöhter Eisengehalt in der Leber ist mit einem
schlechten Ansprechen auf eine Therapie mit IFN-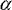 assoziiert. Darüber hinaus führen erhöhte Eisenspiegel
zu einem rascheren Übergang der Erkrankung in das Zirrhose-Stadium
[28]. Das kann (i) auf eine vermehrte Radikalbildung und Gewebsschädigung
durch Eisen, (ii) auf eine Schwächung der TH-1-vermittelten
Immunmechanismen durch das Metall, die eine zentrale Rolle für
die Abwehr von Viren spielen [29] und/oder (iii) auf die stimulierende
Wirkung von Eisen auf die HCV-Replikation bzw. HCV-Translation
zurückgeführt werden [30, 31]. Letzteres beruht auf
einer eisenvermittelten Induktion der Bildung des Translationsinitiationsfaktors
e-IF3, der v.a. bei HCV-Virustyp1b und 2 die Translation stimuliert.
Klinische Studien haben deshalb untersucht, inwieweit eine Reduktion
der Eisenspiegel durch regelmäßige Phlebotomien einen
günstigen Einfluss auf den klinischen
Verlauf einer HCV-Infektion ausübt. Zwar zeigen sich in
einigen Studien durchaus positive und vielversprechende klinische
Effekte, eine generelle Empfehlung einer derartigen additiven
Therapie erscheint aber zum jetzigen Zeitpunkt noch verfrüht
[32, 33].
assoziiert. Darüber hinaus führen erhöhte Eisenspiegel
zu einem rascheren Übergang der Erkrankung in das Zirrhose-Stadium
[28]. Das kann (i) auf eine vermehrte Radikalbildung und Gewebsschädigung
durch Eisen, (ii) auf eine Schwächung der TH-1-vermittelten
Immunmechanismen durch das Metall, die eine zentrale Rolle für
die Abwehr von Viren spielen [29] und/oder (iii) auf die stimulierende
Wirkung von Eisen auf die HCV-Replikation bzw. HCV-Translation
zurückgeführt werden [30, 31]. Letzteres beruht auf
einer eisenvermittelten Induktion der Bildung des Translationsinitiationsfaktors
e-IF3, der v.a. bei HCV-Virustyp1b und 2 die Translation stimuliert.
Klinische Studien haben deshalb untersucht, inwieweit eine Reduktion
der Eisenspiegel durch regelmäßige Phlebotomien einen
günstigen Einfluss auf den klinischen
Verlauf einer HCV-Infektion ausübt. Zwar zeigen sich in
einigen Studien durchaus positive und vielversprechende klinische
Effekte, eine generelle Empfehlung einer derartigen additiven
Therapie erscheint aber zum jetzigen Zeitpunkt noch verfrüht
[32, 33].
Auch
bei der Tuberkulose findet sich eine enger Zusammenhang zwischen
dem Krankheitsverlauf und dem Eisenangebot. So ist eine Bantusiderose,
ein sekundärer Eisenüberladungszustand im südlichen
Afrika, der mit der Herstellung des traditionellen Bieres in
Eisenkesseln assoziiert ist, mit einem ungünstigen klinischen
Verlauf und einer erhöhten Mortalität bei Tuberkulose
verbunden [34]. Diese Beobachtung wird durch In vitro-Daten
unterstützt, die zeigen, dass ein vermehrtes Eisenangebot
in Makrophagen die Proliferation von Mykobakterien fördert
und die Immunabwehrmechanismen schwächt [35].
Auch
bei der HIV-Infektion waren vor Verwendung von HAART (danach
wurden dazu keine Studien mehr publiziert) eine therapeutische
Eisengabe oder eine vermehrte Eisenspeicherung im Knochenmark
mit einem kürzeren Überleben assoziiert (for review
see 36). Es gibt noch viele weitere Beispiele, bei denen ein
Überangebot oder die Applikation von Eisen zu einem ungünstigen
Verlauf einer Infektion führt. Dazu gehören bakterielle
Infektionen mit Gram-positiven und Gram-negativen Erregern,
Pilzerkrankungen (z.B. Candidainfektionen) oder Infektionen
mit Parasiten (Leishmaniose, Pneumocystits carinii)[20]. Bei
Patienten unter Hämodialyse hat sich ein enger Zusammenhang
von hohen Eisenspiegeln oder Eisentherapie mit dem Auftreten
von infektiösen Komplikationen oder Septikämien offenbart,
wobei hier auch die negativen Effekte von Eisen auf die Funktion
von neutrophilen Granulozyten eine Rolle spielen [37].
Die
Gründe für die negative Beeinflussung des Krankheitsverlaufs
liegen in einer Schwächung der zellmedierten Immunabwehr
durch Eisen, in einer Beeinträchtigung der Funktionalität
von neutrophilen Granulozyten und in einer Wachstumsstimulation
der Mikroorganismen durch das essenzielle Element Eisen [20,
37, 38, 39, 40]. Zudem haben Mikroorganismen eine Unzahl von
Strategien entwickelt, um häm- und nichthämgebundenes
Eisen aufzunehmen, und verwenden z.T. auch Eisen dazu, um Abwehrmechanismen
zu stimulieren, die die Immuneffektorfunktion von Makrophagen
oder Granulozyten neutralisieren [40, 41]. |
| Die
Infektions-Anämie Als
pathophysiologischer Ausdruck der engen Interaktion von Eisenstoffwechsel
und Immunantwort entwickelt sich bei chronischen Infektionen
häufig eine normozytäre/normochrome Anämie, die
als Infektanämie oder Anämie chronischer Erkrankungen
(ACD) bezeichnet wird und sich auch in einem hohen Prozentsatz
bei Patienten findet, die an Autoimmunerkrankungen oder Tumoren
leiden [43, 44].
Die Pathophysiologie dieser Anämie basiert auf einer Umleitung
des Eisens aus der Zirkulation in die Speicher des Retikuloendothelialen
Systems (RES) mit Entstehung einer funktionellen Eisenverteilungsstörung
– gekennzeichnet durch eine Hypoferriämie und eine
Hyperferritinämie. Hierfür sind primär TH1/TH2-Zytokine
und das Akutphaseprotein Hepcidin verantwortlich, die zu einer
vermehrten Aufnahme und Retention von Eisen in Makrophagen führen.
Dazu kommen eine gesteigerte Erythrophagozytose [45] und eine
verminderte Eisenresorption aus dem Darm, wofür wiederum
Hepcidin verantwortlich sein dürfte. Das alles resultiert
in einer Limitierung
der Eisenverfügbarkeit für erythroide Vorläuferzellen
und führt dadurch zur Entwicklung einer Anämie [43,
44]. Weiters bewirken die Zytokine eine Hemmung der Proliferation
und Differenzierung von erythroiden Progenitorzellen und reduzieren
die Bildung und Wirksamkeit von Erythropoietin, allesamt Faktoren,
die die Anämie verstärken.
Die Diagnose einer ACD kann sehr einfach aufgrund typischer
Veränderungen im Eisenstoffwechsel gestellt werden. Bei
ACD-Patienten findet sich ein niedriger Serumeisenspiegel, eine
niedrige Transferrinsättigung und eine verminderte Transferrinkonzentration,
während der Serumferritinspiegel ebenso wie Zytokinkonzentrationen
im Serum erhöht sind.
Aus der Entstehung der Anämie ergeben sich nicht nur Nachteile
für den Patienten (Müdigkeit, verminderte Nierendurchblutung,
ineffiziente Herzleistung, kognitive Probleme), sondern auch
potenzielle Vorteile, die wohl aus dem Bestreben des Körpers
entspringen, das essenzielle Nahrungsmittel Eisen den Mikroorganismen
zu entziehen und gleichzeitig die gegen diese gerichteten Immuneffektorwege
zu verstärken (Abbildung 1). Somit
könnte die ACD als eine Abwehrstrategie des Körpers
bei der Kontrolle von Infektionen und Tumorerkrankungen gesehen
werden.
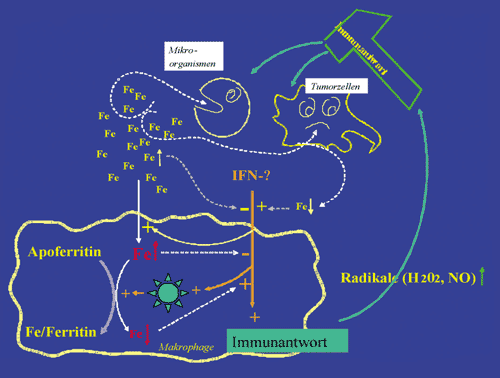
Abbildung
1: Der Kampf ums Eisen: Im Falle einer Infektion oder Tumorerkrankung
kommt es zur Aktivierung des Immunsystems. Durch die Wirkung
von Zytokinen wie Interferon-gamma (IFN-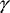 )
werden in Makrophagen Mechanismen in Gang gesetzt, die dazu
dienen sollen, diese Pathogene zu eliminieren. Dazu gehören
die Bildung anderer Zytokine, aber auch von Radikalen wie NO,
die Tumorzellen und Mikroorganismen schädigen. In der Gegenwart
von Eisen ist die Effektivität dieser Immunantwort herabgesetzt,
weshalb Makrophagen versuchen,
Eisen in das Speicherprotein Ferritin einzubauen und so dessen
negative Wirkung auf das Immunsystem herabzusetzen. Hierzu werden
komplexe molekulare Mechanismen in Gang gesetzt, wodurch die
Effizienz der Immunantwort steigt. Parallel dazu nehmen Makrophagen
aus der Zirkulation vermehrt Eisen auf und speichern dieses.
Dahinter steht die Strategie, den Mikroorganismen und Tumorzellen
das für diese essenzielle Nahrungsmittel Eisen zu entziehen
und dadurch deren Vermehrung zu blockieren. )
werden in Makrophagen Mechanismen in Gang gesetzt, die dazu
dienen sollen, diese Pathogene zu eliminieren. Dazu gehören
die Bildung anderer Zytokine, aber auch von Radikalen wie NO,
die Tumorzellen und Mikroorganismen schädigen. In der Gegenwart
von Eisen ist die Effektivität dieser Immunantwort herabgesetzt,
weshalb Makrophagen versuchen,
Eisen in das Speicherprotein Ferritin einzubauen und so dessen
negative Wirkung auf das Immunsystem herabzusetzen. Hierzu werden
komplexe molekulare Mechanismen in Gang gesetzt, wodurch die
Effizienz der Immunantwort steigt. Parallel dazu nehmen Makrophagen
aus der Zirkulation vermehrt Eisen auf und speichern dieses.
Dahinter steht die Strategie, den Mikroorganismen und Tumorzellen
das für diese essenzielle Nahrungsmittel Eisen zu entziehen
und dadurch deren Vermehrung zu blockieren.
Abbildung 1: Der Kampf ums
Eisen
|
Somit verfolgt der Entzug von Eisen aus dem Blut und dessen
Speicherung in Makrophagen zwei Ziele: Eine Blockade des Wachstums
von Tumorzellen und Mikroorganismen und eine Stärkung der
gegen diese gerichteten Immunfunktionen.
Aus
den genannten Gründen ist die Gabe von Eisen zur Therapie
der ACD bei Infektionen und Tumorerkrankungen strikt abzulehnen,
da diese Maßnahme diese Strategie unterlaufen würde
und zu einer Förderung des Wachstums von Mikroorganismen
und zu einer Schwächung der zellulären
Immunantwort führen würde.
Die Kontrolle über die Eisenhomöostase ist mithin
eines der entscheidenden Kriterien, das über den Verlauf
einer Infektion entscheiden kann. Da eine erhöhte Eisenverfügbarkeit
das Wachstum von Mikroorganismen fördert und die gegen
diese induzierten Immuneffektormechanismen schwächt, erscheint
es sinnvoll, Strategien zu entwickeln, die auf pharmakologischem
Weg die Eisenverfügbarkeit für Mikroorganismen eindämmen.
Einige Studien haben gezeigt, dass Eisenchelatoren durchaus
klinisches Potenzial bei der Behandlung von Infektionskrankheiten
aufweisen, allerdings sind die derzeit verfügbaren Substanzen
im Hinblick auf Membranpermeabilität und die Möglichkeiten
der intrazellulären Eisenchelierung noch ausbaufähig.
Andere therapeutische Ansätze zur Behandlung von Infektionen
könnten in der pharmakologischen Interaktion mit den Eisenaufnahmemechanismen
dieser Mikroorganismen liegen. Das Spannungsfeld zwischen Eisen,
Immunität und Infektionen kann deshalb sicherlich
als sehr zukunftsträchtige Branche in der Infektiologie
angesehen werden, vor allem in Anbetracht des zunehmenden Auftretens
multipler Resistenzen bei Bakterien, Pilzen und Parasiten.
|
Literatur:
| 1.
Brock J.H., Halliday J.W., Pippard M.J.,Powell L.W.: „Iron
Metabolism in Health and Disease.“ (eds.). Saunders
Company Ltd., Philadelphia (1993). |
| 2.
Rosen G.M., Pou S., Ramos C.L., Cohen M.S., Britigan B.E.:
„Free radicals and phagocytic cells.“ FASEB
J. 9 (1995) 200-205. |
| 3.
Pietrangelo A.: „Hereditary hemochromatosis –
a new look at an old disease.“ N. Engl. J. Med. 350
(2004) 2383-97. |
| 4.
Weiss G., Wachter H., Fuchs D.: „Linkage of cellular
immunity to iron metabolism.“ Immunol. Today 16 (1995)
495-500. |
| 5.
De Sousa M., Reimao R., Porto G., Grady R.W., Hilgartner
M.W., Giardina P.: „Iron and Lymphocytes: Reciprocal
regulatory interactions.“ Curr. Stud. Hematol. Blood
Transf. 58 (1992) 171-177. |
| 6.
Thorson J.A., Smith K.M., Gomez F., Naumann P.W., Kemp J.D.:
„Role of iron in T cell activation: Th-1 clones differ
from Th-2 clones in their sensitivity to inhibition for
DNA synthesis caused by IgG MAbs against transferrin receptor
and the iron chelatordes ferrioxamine.“ Cell Immunol
134 (1991) 126-137 |
| .7.
Weiss G., Fuchs D., Hausen A., Reibnegger G., Werner E.R.,
Werner-Felmayer G., et al.:„Iron modulates interferon-y
effects in the human myelomonocytic cell line THP-1.“
Exp. Hematol. 20 (1992) 605-10. |
| 8.
Recalcati S., Pometta R., Levi S., Conte D., Cairo G.: „Response
of monocyte iron regulatory protein activity to inflammation:
abnormal behavior in genetic hemochromatosis.“ Blood
91 (1998) 2565-72. |
| 9.
Oexle H., et al.: „Pathways for the regulation of
interferon-gamma-inducible genes by iron in human monocytic
cells.“ J. Leukoc. Biol. 74 (2003) 287-94. |
| 10.
Alford C.E., King T.E., Campell P.A.: „Role of transferrin,
transferrin receptors, and iron in macrophage listericidal
activity.“ J.Exp. Med. 174 (1991) 459-466. |
| 11.
Menacci A., Cenci E., Boelaert J.R., et al.: „Iron
overload alters T helper cell responses to Candida albicans
in mice.“ J. Infect. Dis. 175(1997) 1467-1476. |
| 12.
Weiss G., et al.: „Translational regulation via iron-responsive
elements by the nitricoxide/NO-synthase pathway.“
Embo. J. 12(1993) 3651-7. |
| 13.
Weiss G., Werner-Felmayer G., Werner E.R., Grünewald
K., Wachter H., Hentze M.W.: „Iron regulates nitric
oxide synthase activity by controlling nuclear transcription.“
J. Exp. Med. 180 (1994) 969-976. |
| 14.
Mellilo G., Taylor L.S., Brooks A., Musso T., Cox G.W.,
Varesio L.: „Functional requirement of the hypoxia
responsive element in the activation of the inducible nitric
oxide synthase promoter by the iron chelator desferrioxamine.“
J. Biol. Chem. 272 (1997) 12236-42. |
| 15.
Dlaska M., Weiss G.: „Central role of transcription
factor NF-IL6 for cytokine and iron-mediated regulation
of murine inducible nitricoxide synthase expression.“
J. Immunol. 162 (1999) 6171-7. |
| 16.
Blackwell J.M., Searle S., Goswami T., Miller E.N.: „Understanding
the multiple functions of NRAMP1.“ Microbes and Infection
2 (2000) 317-321, 2000. |
| 17.
Forbes J.R., Gros P.: „Divalent metal transport by
NRAMP proteins at the interface to host-pathogen interaction.“
Trends in Microbiology 9 (2001) 397-403. |
| 18.
Baker S.T., Barton C.H., Biggs T.E.: „A negative autoregulatory
link between Nramp1 function and expression.“ J. Leukoc.
Biol. 67 (2000) 501-7. |
19.
Fritsche G., Dlaska M., Barton H., TheurlI., Garimorth
K., Weiss G.: „Nramp1 functionality increases inducible
nitric oxide synthase transcription via stimulation of
IFN regulatory factor 1 expression.“ J. Immunol.
171(2003) 1994-8. |
| 20.
Weinberg E.D.: „Iron loading and disease surveillance.“
Emerg. Infect. Dis 5 (1999) 346-352. |
| 21.
Stevens R.G., Jones D.Y., Micozzi M.S., Taylor P.R.: „Body
iron stores and the risk of cancer.“ N. Engl. J. Med.
319 (1988) 1047-52. |
| 22.
Gordeuk V., Thuma P., Brittenham G., McLaren C., Parry D.,
Backenstose A., et al.: „Effect of iron chelation
therapy on recovery from deep coma in children with cerebral
malaria.“ N. Engl. J. Med. 327 (1992) 1473-7. |
| 23.
Weiss G., Thuma P.E., Mabeza F., Werner E.R., Herold M.,
Gordeuk V.R.: „Modulatory potential of iron chelation
therapy on nitricoxide formation in cerebral malaria.“
J. Infect.Dis. 175 (1997) 226-31. |
| 24.
MacMicking J., Xie Q.W., Nathan C.:„Nitric oxide and
macrophage function.“ Annu. Rev. Immunol. 15 (1997)
323-50. |
| 25.
Bogdan C.: „Nitric oxide and the regulation of gene
expression.“ Trends Cell Biol. 11 (2001) 66-75. |
| 26.
Fritsche G., Larcher C., Schennach H., Weiss G.: „Regulatory
Interactions between Iron and Nitric Oxide Metabolism for
Immune Defense against Plasmodium falciparum Infection.“
J. Infect. Dis. 183 (2001) 1388-94. |
27.
Thuma P., Weiss G., Herold M., Gordeuk V.R.: „Serum
neopterin, interleukin-4, and interleukin-6 concentrations
in cerebral malaria patients and the effect of iron chelation
therapy.“ Am. J. Trop. Med. Hyg. 54 (1996)164-8. |
| 28.
Shedlofsky S.I.: „Role of iron in the natural history
and clinical course of hepatitis C disease.“ Hepatogastroenterology
45 (1998) 349-55. |
| 29.
Weiss G., Umlauft F., Urbanek M., Herold M., Lovevsky M.,
Offner F., et al.: „Associations between cellular
immune effector function, iron metabolism, and disease activity
in patients with chronic hepatitis C virus infection.“
J. Infect. Dis. 180 (1999) 1542-8. |
| 30.
Kakizaki S., Takagi H., Horiguchi N., Toyoda M., Takayama
H., Nagamine T., et al.:„Iron enhances hepatitis C
virus replication in cultured human hepatocytes.“
Liver 20 (2000) 125-128. |
| 31.
Theurl I., Zoller H., Obrist P., Datz C., Bachmann F., Elliott
R.M., Weiss G.: „Iron regulates hepatitis C virus
translation via stimulation of eIF3 expression.“ J.
Infect. Dis.190 (2004) 819-825. |
| 32.
Sartori M., Andorno S., Rigamonti C., Boldorini R.: „Chronic
hepatitis C treated with phlebotomy alone: biochemical and
histological outcome.“ Dig. Liver Dis. 33 (2001) 157-62. |
| 33.
Di Bisceglie A.M., Bonkovsky H.L., Chopra S., Flamm S.,
Reddy R.K., Grace N., et al.:„Iron reduction as an
adjuvant to interferon therapy in patients with chronic
hepatitis C who have previously not responded to interferon:
a multicenter, prospective, randomized, controlled trial.“
Hepatology 32 (2000) 135-8. |
| 34.
Gordeuk V.R., McLaren C.E., MacPhail A.P., Deichsel G.,
Bothwell T.H.: „Associations of iron overload in Africa
with hepatocellular carcinoma and tuberculosis: Strachan's
1929 thesis revisited.“ Blood 87 (1996) 3470-6. |
| 35.
Gomes M.S., Boelaert J.R., Appelberg R.:„Role of iron
in experimental Mycobacterium avium infection.“ J.
Clin. Virol. 20 (2001) 117-22. |
| 36.
Gordeuk V.R., Delanghe J.R., Langlois M.R., Boelaert J.R.:„Iron
status and the outcome of HIV infection: an overview.“
J. Clin.Virol. 20 (2001) 111-5. |
| 37.
Sunder-Plassmann G., Patruta S.I., Horl W.H.: „Pathobiology
of the role of iron infection.“ Am. J. Kidney Dis.
34 (1999) 25-9. |
| 38.
Weiss G.: „Iron and immunity: a double-edged sword.“
Eur. J. Clin. Invest. 32 (2002) 70-8. |
| 39.
Schaible U.E., Kaufmann S.H.: „Iron and microbial
infection.“ Nat. Rev. Microbiol.2 (2004) 946-53. |
40.
Eide D.J.: „Metal iron transport in eukaryotic microorganisms:
insights from Saccharomyces
cerevisiae.“ Adv. Microb. Physiol. 43(2000) 1-38.
|
| 41.
Genco C.A., White Dixon D.: „Emerging strategies in
microbial haem capture.“ Mol.Microbiol. 39 (2001)
1-11. |
| 42.
Konijn A., Hershko C.: „The anaemia of inflammation
and chronic disease.“ In: DeSousa M., Brock J.H. (eds.):
Iron in Immunity, Cancer and Inflammation. Wiley and Sons,
Chicester (1989) 111-143. |
| 43.
Weiss G., Goodnough L.T.: „Anemia of chronic disease.“
N. Engl. J. Med. 352 (2005) 1011-23. |
| 44.
Means R.T., Krantz S.B.: „Progress in understanding
the pathogenesis of the anemia of chronic disease.“
Blood 80 (1992) 1639-1647. |
| 45.
Moura E., Noordermeer M.A., Verhoeven N., Verheul A.F.M.,
Marx J.J.: „Iron release from human monocytes after
erythropha-gocytosis in vitro: an investigation
in normal subjects and hereditary hemochromatosis patients.“
Blood 92 (1998) 2511-2519. |
Anschrift
des Verfassers:
A.o. Univ.-Prof. Dr. Günter Weiss
Medizinische Universität, Universitätsklinik für
Innere Medizin,
Klinische Infektiologie und Immunologie
A-6020 Innsbruck, Anichstraße 35
E-Mail: guenter.weiss@uibk.ac.at
|
|
|