| Zentralvenenkatheter-assoziierte
Bakteriämien |
| R. Krause
Medizinische Universitätsklinik Graz
(Vorstand: Univ.-Prof. Dr. E. Pilger) |
|
|
Zusammenfassung
Zentralvenenkatheter-assoziierte
Bakteriämien (catheter-related bloodstream infections =
CRBSIs) sind verbunden mit erhöhter Morbidität, Mortalität,
verlängerter Hospitalisation und erhöhten Kosten.
Die klinische Diagnostik einer CRBSI bereitet aufgrund unspezifischer
Symptome häufig Schwierigkeiten, weshalb oft allein schon
bei Verdacht auf eine CRBSI der Zentralvenenkatheter (ZVK) entfernt
wird. Nur rund 15-25% dieser explantierten ZVK sind tatsächlich
Ausgangspunkt einer Bakteriämie, wobei diese Diagnose immer
retrospektiv bleibt. Neben den in den letzten Jahren eingesetzten
Kulturmethoden
nach Katheterentfernung wurden Kulturmethoden und Direktmethoden
entwickelt, die bei in situ verbleibenden ZVK durchgeführt
werden. CRBSIs werden oft durch Gram-positive Kokken, selten
durch Gram-negative Bakterien und Sprosspilze verursacht. Für
die Therapie einer CRBSI eignen sich je nach ursächlichem
Keim u.a. Penicillinase-feste Penicilline, Glykopeptide, Cephalosporine,
bei Pilzen entsprechende Pilzmittel. ZVKs sollen bei Vorliegen
einer CRBSI entfernt werden.
|
Key-words:
catheter-related
blood stream infection |
|
Summary
Central
venous catheter-related bloodstream infections (=CRBSIs) are
associated with increased morbidity, mortality,
length of hospital stay and costs. Clinical findings are unreliable
for establishing a diagnosis of CRBSI, but catheters are often
removed based on clinical suspicion of CRBSI. Only 15 - 25%
of central venous catheters (CVCs) removed because of suspected
infection actually prove to be infected, and the diagnosis is
always retrospective. Beside culture methods performed after
catheter removal new culture methods and direct staining methods
without catheter removal were developed. CRBSIs are most often
caused by Gram-positive cocci, but rarely caused by Gram-negative
rods or fungi. Antimicrobial chemotherapy of CRBSI depends upon
the microbes involved and isoxazolylpenicillins, glycopeptides,
cephalosporines, or antifungals are recommended. In case of
CRBSI the CVC should be removed.
|
Einleitung
Die
medizinische Betreuung von Patienten auf der Intensivstation,
hämatoonkologischen Station, Dialyse und vielen anderen
medizinischen Einrichtungen erfordert die Implantation von zentralen
Venenkathetern (ZVKs), um Flüssigkeit, Medikation, Blut
und Blutprodukte und parenterale Ernährung verabreichen
und Hämodialysen/-filtrationen durchführen zu können.
Durch die Verwendung von ZVKs können eine Reihe von Komplikationen
auftreten, wovon die Infektion die wichtigste darstellt. Trotz
neuer und hocheffektiver antimikrobieller Substanzen beträgt
die Mortalität einer Zentralvenenkatheter-assoziierten
Bakteriämie (catheter-related blood stream infection =
CRBSI) 15 - 25% [1, 2]. |
| Definition
Laut
CDC liegt eine CRBSI bei einer Bakteriämie/Fungämie
bei einem Patienten mit mindestens einer positiven Blutkultur
von einer peripheren Venenpunktion, klinischen Zeichen einer
Infektion (z.B. Fieber, Schüttelfrost und/oder Hypotension)
und keiner anderen Quelle einer Bakteriämie/Fungämie
mit Ausnahme des ZVK vor, wobei Folgendes vorhanden sein sollte:
eine positive semiquantitative (>15 CFU/Kathetersegment)
oder quantitative (> 10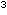 CFU/Kathetersegment) Kultur mit Isolation des gleichen Keims
(Species und Antibiogramm) vom Kathetersegment und peripheren
Blut; simultane quantitative Blutkulturen mit einem = 5:1 Verhältnis
zwischen zentraler und peripherer Blutkultur; > 2 h Differenz
zwischen
Zeit bis zur Positivität einer peripheren Blutkultur minus
Zeit bis zur Positivität einer zentralen Blutkultur [3].
CFU/Kathetersegment) Kultur mit Isolation des gleichen Keims
(Species und Antibiogramm) vom Kathetersegment und peripheren
Blut; simultane quantitative Blutkulturen mit einem = 5:1 Verhältnis
zwischen zentraler und peripherer Blutkultur; > 2 h Differenz
zwischen
Zeit bis zur Positivität einer peripheren Blutkultur minus
Zeit bis zur Positivität einer zentralen Blutkultur [3].
|
Epidemiologie
In den USA werden über 5 Millionen ZVKs pro Jahr implantiert
und viele der rund 200.000 nosokomialen Bakteriämien werden
durch ZVKs verursacht [4]. Die Inzidenz von CRBSIs ist abhängig
von den Stationen und beträgt in den USA zwischen 2 (respiratory
ICU) und 30 (burn ICU) CRBSIs pro 1.000 ZVK-Tagen [5]. In Europa
liegt die Inzidenz von CRBSIs im Schnitt bei 1,55 pro 1.000
ZVK Tagen [6].
|
| Pathogenese
Die
Pathogenese von CRBSIs ist komplex. Insbesondere der Ausgangspunkt
der Kolonisation und der spätere Ausgangspunkt der Bakteriämie
(innere Oberfläche versus äußere Oberfläche
des ZVKs) werden in der Literatur unterschiedlich beschrieben
und diskutiert. Als Ausgangspunkt einer Kolonisation und damit
verbundener Besiedelung der äußeren Oberfläche
des ZVK kommen die Haut des Patienten und Translokation der
Bakterien durch den Stichkanal oder eine Absiedelung von Bakterien
von einem anderen Infektionsfokus (z.B. Haut-Weichteilinfekt
am Fuß) in Betracht. Die Besiedelung der inneren Oberfläche
des ZVK kann durch Manipulation und konsekutiver Kontamination
der ZVK-Anschlüsse oder durch kontaminierte Infusionen
und Infusionsbestecke entstehen [4, 7]. In einer rezenten Untersuchung
war die innere Oberfläche bei allen Patienten mit CRBSI
Ausgangspunkt der Bakteriämie, wohingegen die äußere
Oberfläche nur in 50% Ausgangspunkt einer Bakteriämie
war. Zusätzlich waren die an der Katheterinsertionsstelle
gefundenen Bakterien selten ident mit den am oder im Katheter
gefundenen Bakterien, was die Translokationshypothese von Hautkeimen
entlang des Stichkanals als hauptsächlichen Pathogenitätsmechanismus
in Frage stellt [8]. Hautkeime scheinen jedoch auch schon bei
der Implantation eines ZVK auf luminale oder extraluminale Oberflächen
des ZVK zu gelangen, da in einer rezenten Untersuchung Hautkeime
am Implantationsbesteck und von ZVKs, die zur einer CRBSI führten,
ident waren [9]. |
| Mikrobiologie
CRBSI
werden meist durch Koagulase-negative Staphylokokken und Staphylococcus
aureus verursacht, selten finden
sich Gram-negative Stäbchen (z.B. Pseudomonas aeruginosa)
oder Sprosspilze [10]. In einer europäischen CRBSI-Prävalenzstudie
waren in 71% Gram-positive Kokken, in 22% Gram-negative Stäbchen
und in 7% Sprosspilze nachweisbar. Die fünf häufigsten
Mikroorganismen waren Koagulase-negative Staphylokokken, Staphylococcus
aureus, Candida spp., Enterococcus spp.
und Pseudomonas spp. [11].
|
| Diagnostik
Neben
den in den letzten Jahren eingesetzten Kulturmethoden nach Katheterentfernung
(z.B. Druskin-Technik, Maki-Technik, Cleri-flush-Technik, Brun-Buisson-Technik)
wurden Kulturmethoden (Differential Time To Positivity = DTP)
und Direktmethoden (Gram-Färbung, Acridin Orange Leukozyten
Cytospin = AOLC) entwickelt, die bei in situ verbleibenden
ZVKs durchgeführt werden.
Kulturmethoden
nach Katheterentfernung
Druskin-Technik [12]:
Bei dieser aus dem Jahr 1963 stammenden Methode wird ein distales
Stück des ZVK in Bouillon und einem aufgeschraubten Slide
mit Agar kultiviert. Diese Methode bietet keine Möglichkeit
der Unterscheidung zwischen Kontamination des ZVK und tatsächlicher
CRBSI und sollte daher nicht mehr verwendet werden.
Maki-Technik
[13]:
Diese semiquantitative Kulturtechnik soll eine CRBSI dann anzeigen,
wenn nach Ausrollen des distalen Katheterstücks auf Blutagar
und Bebrütung bei 37°C > 15 Kolonien auf dem Agar
nachweisbar sind. Da bei der Maki-Methode nur die äußere
Oberfläche des ZVK untersucht wird und rezente Studien
gezeigt haben, dass eine CRBSI meist von der inneren Oberfläche
eines ZVK ausgeht, sollte auch diese Methode
nicht als einzige Methode von einem Mikrobiologischen Labor
angeboten werden.
Cleri
flush-Technik [14]:
Bei dieser quantitativen Kulturmethode werden nach Spülung
des distalen ZVK-Segmentes endoluminale Keime kultiviert, wobei
eine CRBSI ab einer Keimzahl von > 10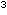 CFU angezeigt werden soll. Diese Methode ist aufgrund der notwendigen
Arbeitsschritte umständlich und zeitaufwändig.
CFU angezeigt werden soll. Diese Methode ist aufgrund der notwendigen
Arbeitsschritte umständlich und zeitaufwändig.
Brun-Buisson-Technik
[15]:
Bei dieser quantitativen Kulturmethode wird über das auf
rund 6 cm gekürzte distale ZVK-Segment 1 ml steriles Wasser
gegeben und daraufhin zentrifugiert. Diese Suspension wird dann
auf einem Blutagar mit einer Pipette ausgeimpft und bei 37°C
inkubiert, die kultivierten Keime abgezählt und auf die
Keimzahl pro ml Suspension rückgerechnet. Eine CRBSI liegt
ab einer Keimzahl von 10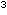 CFU/ml vor. Bei dieser Methode wird die innere Oberfläche
des ZVK´s nicht direkt untersucht, es wird jedoch angenommen,
dass durch die Zentrifugation Keime der inneren Oberfläche
gelöst werden und in die Suspension gelangen können.
Somit wird bei dieser Methode die innere und äußere
Oberfläche des ZVK untersucht.
CFU/ml vor. Bei dieser Methode wird die innere Oberfläche
des ZVK´s nicht direkt untersucht, es wird jedoch angenommen,
dass durch die Zentrifugation Keime der inneren Oberfläche
gelöst werden und in die Suspension gelangen können.
Somit wird bei dieser Methode die innere und äußere
Oberfläche des ZVK untersucht.
Kulturmethoden bei in situ liegendem ZVK
Quantitative Blutkultur (zentral und peripher)
[16]:
Dies ist eine quantitative Vergleichsmethode zwischen der Keimzahl
der simultan entnommenen zentralen und peripheren Blutkultur.
Ein Keimzahlverhältnis von 5 -10:1 zwischen zentraler und
peripherer Blutkultur deutet auf eine CRBSI hin. Diese Methode
ist aufgrund der komplexen Probengewinnung, -verarbeitung und
der hohen Kosten nicht zu empfehlen.
Differential
Time to Positivity (DTP) [17]:
Da die Keimlast in einer Blutkulturflasche mit der Zeit bis
zur Positivität,
d.h. bis zum Nachweis von Keimwachstum, korreliert, stellt diese
Methode eine Weiterentwicklung der quantitativen Blutkultur
(s.o.) dar. Nach Entnahme einer peripheren und zentralen Blutkultur
zum gleichen Zeitpunkt wird in einem automatischen Blutkultur-Gerät
die Zeit bis zur Positivität gemessen. Die DTP wird als
Differenz zwischen der Positivitätszeit der peripheren
Kulturminus Positivitätszeit der zentralen Kultur berechnet.
Eine DTP = 120 min zeigt eine CRBSI an, ebenso der zweimalige
Nachweis von Keimwachstum in der zentralen Blutkultur bei negativer
peripherer Blutkultur. In einer rezenten Studie wurde diese
Methode als neue Goldstandardmethode bei ZVK mit kurzer und
langer Liegedauer und Verdacht auf CRBSI empfohlen [18].
Direktmethode
bei in situ liegendem ZVK
Acridin-Orange-Leukocyten-Cytospin (AOLC)-Test und Gram-Färbung
[19].
Bei dieser Direktmethode wird aus 1 ml ZVK-Blut nach Lyse der
Erythrozyten und Fixation anschließend mittels Leukozyten-Cytospin-Zentrifuge
eine Probenschicht auf einen Objektträger aufgebracht und
mit Acridin-Orange und Gram-Färbelösung gefärbt.
Die Objektträger werden im UV- und Lichtmikroskop untersucht,
wobei jeglicher Nachweis von Bakterien und/oder Pilzen (z.B.
Sprosspilzen) eine CRBSI anzeigt. Zusätzlich wird neben
dem mikroskopischen Präparat eine quantitative Kontrollkultur
auf Blutagar angefertigt. Diese Methode stellt eine sehr schnelle
(Dauer von Probenentnahme bis zum Ergebnis rund 30 - 60 min)
und kostengünstige Technik dar. Die Sensitivität liegt
bei 96% und die Spezifität bei 92%. Kürzlich veröffentlichte
Studien zeigten, dass diese Methode auch bei neutropenischen
Patienten eingesetzt werden kann [20].
ELISA
zum Nachweis von Anti-Staphylokokken-Antikörpern
[21]
Ein zum Nachweis von Antikörpern gegen von Koagulase-negativen
Staphylokokken produziertem Lipid S-Antigen entwickelter ELISA
wurde bei Patienten mit CRBSI eingesetzt, wobei eine CRBSI mit
einer Sensitivität von 70% und Spezifität von 100%
detektiert werden konnte. Die Sensitivität dieses Tests
liegt damit weit unter der Sensitivität anderer Diagnosemethoden
(vgl. Sensitivität bei AOLC/Gram 96%) [22]. |
| Therapie
Für
die antimikrobielle Therapie bei CRBSI eignen sich je nach ursächlichem
Keim und Resistenzlage u.a. Penicilline, penicillinasefeste
Penicilline, Erst-, Dritt- und Viertgenerations-Cephalosporine,
Glykopeptide, und Azole. So kann zum Beispiel für einen
Methicillin-sensiblen Staphyloccocus aureus Flucloxacillin,
für Enterokokken Ampicillin, für Koagulase-negative
Staphylokokken Vancomycin, für Pseudomonaden Ceftazidim
und für Candida albicans Fluconazol eingesetzt
werden. Die Therapiedauer richtet sich nach dem klinischen Bild
und sollte zumindest 10 - 14 Tage betragen, bei Komplikationen
wie Endocarditis oder septischer Thrombose 4 - 6 Wochen.
Nichtgetunnelte
ZVKs
Bei Patienten mit Fieber, jedoch normalem Blutdruck und normalen
Organfunktionen sollten ZVKs wegen suspekter CRBSI nicht routinemäßig
entfernt werden, da die entfernten ZVKs sehr häufig nicht
Ursache des Fiebers sind. In einer Untersuchung waren bei oben
beschriebenen Patienten 71% der entfernten ZVKs steril [23].
Bisher wurde die Entfernung von ZVKs bei Patienten mit Fieber,
Hypotension und Organdysfunktion empfohlen, wobei aufgrund neuer
und schneller Diagnosemöglichkeiten die empirische
Entfernung ohne entsprechende Diagnostik zu hinterfragen ist.
Bei gesichertem Nachweis einer CRBSI (z.B. mittels DTP oder
AOLC/Gram) sollte der ZVK entfernt werden [23]. Bei CRBSI durch
Sprosspilze sollten ZVKs entfernt werden, da die Studienlage
derzeit keine eindeutige Empfehlung für den Verbleib des
ZVK zulässt [24, 25, 26].
Getunnelte ZVKs oder total implantierte ZVKs
Aufgrund der aufwändigen Entfernung eines getunnelten oder
totalimplantierten ZVKs ist eine zuverlässige Diagnostik
bei Verdacht auf CRBSI unbedingt notwendig, wobei AOLC/Gram
und DTP eingesetzt werden können [27, 20]. Bei Nachweis
einer CRBSI sollte der ZVK entfernt werden. Die Dauer einer
antimikrobiellen Therapie enspricht der bei nicht getunnelten
ZVKs, bei Nachweis von Koagulase-negativen Staphylokokken kann
ein Therapieversuch ohne ZVK-Entfernung durchgeführt werden
[23]. Eine Antibiotika-„lock“-Therapie führt
zu einer Reduktion von Rezidiv-CRBSIs, die Rate an Rezidiven
bleibt dennoch bei nichtakzeptablen 33 % [28].
|
Literatur:
| 1.
Heiselman D.: „Nosocomial bloodstream infections in
the critically ill.“ JAMA 272 (1994) 1819-20. |
| 2.
Pittet D., Tarara D., Wenzel R.P.: „Nosocomial bloodstream
infection in critically ill patients. Excess length of stay,
extra costs, and attributable mortality.“ JAMA 271
(1994) 1598-601. |
| 3.
„Guidelines for the Prevention of Intravascular Catheter-Related
Infections.“ (2002) MMWR Recommendations and Reports,Volume
51, Number RR-10. |
| 4.
Maki D.G., Mermel L.A.: „Infections due to infusion
therapy.“ In: Bennett J.V., Brachman P.S., eds. Hospital
infections. Philadelphia: Lippincott-Raven (1998) 689-724. |
5.
Jarvis W.R., Edwards J.R., Culver D.H., Hughes J.M., Horan
T., Emori T.G., Banerjee S., Tolson J., Henderson T.,
Gaynes R.P., et al.:„Nosocomial infection rates
in adult and pediatric intensive care units in the United
States.
National Nosocomial Infections Surveillance System.“
Am. J. Med. 91 (3B) (1991)185-191.
|
| 6.
Munoz P., Bouza E., San Juan R., Voss A., Pascau J., Desco
M., Co-Operative Group of the European Study Group on Nosocomial
Infections (ESGNI): „Clinical-epidemiological characteristics
and outcome of patients with catheter-related bloodstream
infections in Europe (ESGNI-006 Study).“ Clin. Microbiol.
Infect. 10 (2004) 843-5. |
| 7.
Sherertz R.J., Heard S.O., Raad I.I.: „Diagnosis of
triple-lumen catheter infection: comparison of roll plate,
sonication, and flushing methodologies.“ J. Clin.
Microbiol. 35 (1997) 641-6. |
| 8.
Dobbins B.M., Kite P., Kindon A., McMahon M.J., Wilcox M.H.:
„DNA fingerprinting analysis of coagulase negative
staphylococci implicated in catheter related bloodstream
infections.“ J. Clin. Pathol. 55 (2002) 824-8. |
| 9.
Jeske C., Raedler C., von Goedecke A., Mayr A., Hinterberger
G., Aspoeck Ch., Lass-Floerl C., Benzer A.: „Early
identification of bacteria leading to central venous catheter
contamination.“ Anesth. Analg. 97 (2003) 940-3. |
| 10.
Crump J.A., Collignon P.J.: „Intravascular Catheter-associated
infections.“ Eur. J. Clin. Microbiol. Infect. Dis.
19 (2000) 1-8. |
| 11.
Bouza E., San Juan R., Munoz P., Pascau J., Voss A., Desco
M., Cooperative Group of the European Study Group on Nosocomial
Infections (ESGNI): „A European perspective on intravascular
catheter-related infections: report on the microbiology
workload, aetiology and antimicrobial susceptibility (ESGNI-005
Study).“ Clin. Microbiol. Infect. 10 (2004) 838-42. |
| 12.
Druskin M.S., Siegel P.D.: „Bacterial Contamination
of indwelling intravenous polyethylene catheters.“
JAMA 185 (1963) 966-8. |
| 13.
Maki D.G., Weise C.E., Sarafin H.W.: „A semiquantitative
culture method for identifying intravenous-catheter-related
infection.“ N. Engl. J. Med. 296 (1977) 1305-9. |
| 14.
Cleri D.J., Corrado M.L., Seligman S.J.:„Quantitative
culture of intravenous catheters and other intravascular
inserts.“ J. Infect. Dis.141 (1980) 781-6. |
| 15.
Brun-Buisson C., Abrouk F., Legrand P., Huet Y., Larabi
S., Rapin M.: „Diagnosis of central venous catheter-related
sepsis. Critical level of quantitative tip cultures.“
Arch. Intern. Med. 147 (1987) 873-7. |
| 16.
Rushforth J.A., Hoy C.M., Kite P., Puntis J.W.: „Rapid
diagnosis of central venous catheter sepsis.“ Lancet
342 (1993) 402-3. |
| 17.
Blot F., Nitenberg G., Chachaty E., Raynard B., Germann
N., Antoun S., Laplanche A., Brun-Buisson C., Tancrede C.:
„Diagnosis of catheter-related bacteraemia: a prospective
comparison of the time to positivity of hub-blood versus
peripheral-blood cultures.“ Lancet 354 (1999) 1071-7. |
| 18.
Raad I., Hanna H.A., Alakech B., Chatzinikolaou I., Johnson
M.M., Tarrand J.: „Differential time to positivity:
a useful method for diagnosing catheter-related bloodstream
infections.“ Ann. Intern. Med. 140 (2004) 18-25. |
| 19.
Kite P., Dobbins B.M., Wilcox M.H., McMahon M.J.: „Rapid
diagnosis of central-venous-catheter-related bloodstream
infection without catheter removal.“ Lancet 354 (1999)
1504-7. |
| 20.
Krause R., Auner H.W., Gorkiewicz G., Wolfler A., Daxboeck
F., Linkesch W., Krejs G.J., Wenisch C., Reisinger E.C.:
„Detection of catheter-related bloodstream infections
by the differential-time-to-positivity method and gram stain-acridine
orange leukocyte cytospin test in neutropenic patients after
hematopoietic stem cell transplantation.“ J. Clin.
Microbiol. 42 (2004) 4835-7. |
| 21.
Worthington T., Lambert P.A., Traube A., Elliott T.S.J.:
„A rapid ELISA for the diagnosis of intravascular
catheter related sepsis caused by coagulase negative staphylococci.“
J. Clin. Pathol. 55 (2002) 41-43. |
| 22.
Kite P., Dobbins B.M., Wilcox M.H., McMahon M.J.: „Rapid
diagnosis of central-venous-catheter-related bloodstream
infection without catheter removal.“ Lancet 354 (1999)
1504-7. |
| 23.
Mermel L.A., Farr B.M., Sherertz R.J., Raad I.I., O'Grady
N., Harris J.S., Craven D.E.,Infectious Diseases Society
of America, American College of Critical Care Medicine,
Society for Healthcare Epidemiology of America: „Guidelines
for the management of intravascular catheter-related infections.“
Clin. Infect. Dis. 32 (2001) 1249-72. |
| 24.
Nucci M., Anaissie E.: „Should vascular catheters
be removed from all patients with candidemia? An evidence-based
review.“ Clin. Infect. Dis. 34 (2002) 5919. |
| 25.
Lazzarini L., Luzzati R.: „Removal of central venous
catheters from patients with candidemia.“ Clin. Infect.
Dis. 35 (2002) 1021. |
| 26.
Luzzati R., Amalfitano G., Lazzarini L., et al.: „Nosocomial
candidemia in non-neutropenic patients at an Italian tertiary
care hospital.“ Eur. J. Clin. Microbiol. Infect. Dis.
19 (2000) 6027. |
| 27.
Abdelkefi A., Achour W., Ben Othman T., Torjman L., Ladeb
S., Lakhal A., Hsairi M.,Kammoun L., Ben Hassen A., Ben
Abdeladhim A.: „Difference in time to positivity is
useful for the diagnosis of catheter-related blood-stream
infection in hematopoietic stem cell transplant recipients.“
Bone Marrow Transplant 35 (2005) 397-401. |
| 28.
Rijnders B.J., Van Wijngaerden E., Vandecasteele S.J., Stas
M., Peetermans W.E.:„Treatment of long-term intravascular
catheter-related bacteraemia with antibiotic lock: randomized,
placebo-controlled trial.“ J. Antimicrob. Chemother.
55 (2005) 90-4. |
Anschrift
des Verfassers:
A.o. Univ.-Prof. Dr. Robert Krause
Medizinische Universitätsklinik Graz
A-8036 Graz, Auenbruggerplatz 15
E-Mail: robert.krause@meduni-graz.at
|
|
|