| Was von der
Antibiotika-Therapie übrig bleibt …. – opportunistische
Pilzinfektionen durch Candida |
| E. Presterl
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
(Leiter: Univ.-Prof. DDr. W. Graninger) |
|
|
Zusammenfassung
Längst
betreffen opportunistische Pilzinfektionen durch Candida species
nicht nur Patienten mit Leukämie und Knochenmarkstransplantation,
sondern auch Patienten mit langem Intensivstationsaufenthalt,
nach großen Operationen und anderen das Immunsystem beeinträchtigenden
Systemerkrankungen. Ein Nachweis von Candida ist nicht aussagekräftig,
weil Candida Haut und Schleimhäute kolonisieren. Beweisend
sind der kulturelle Nachweis aus sonst sterilem Material (Blutkulturen,
Punktate) und der Nachweis von invasivem Wachstum in bioptisch
gewonnenem Material. Da das nicht bei allen Patienten möglich
ist,
müssen auch andere Kriterien für die Diagnose und
Behandlung herangezogen werden.
|
|
Summary
Invasive
fungal infections in immun-ocompromised patients are associated
with high morbidity and mortality. The pathogens most frequently
isolated are Candida. Invasive candidiases are not only confined
to haematological patients with leukaemia and bone marrow transplantation.
Patients requiring multiple invasive treatment and long-term
intensive care, undergoing large surgery and other systemic
diseases compromising the
immunsystem are equally prone to invasive fungal infections.
As Candida is frequently colonizing skin and mucous membranes,
isolation from superficial areas is not diagnostic. For definite
diagnosis of invasive fungal infection, the fungus must be isolated
from “relevant” specimens, i.e. normally sterile
sites (blood, abscesses etc.), or demonstration of invasive
growth of the fungus in a biopsy. Unluckily, this procedures
are not always feasible in the severely ill patients, thus other
criteria can be included for forming the diagnosis of a probable
or possible fungal infection caused by the opportunistic pathogens
Candida, Aspergillus and other fungi. This article is on the
diagnosis and the clinical management, including antifungal
therapy.
|
Einleitung
Invasive
Candida-Infektionen treten bei schwer kranken und immunsupprimierten
Personen auf [1]. Infolge Fortschritten in der Transplantationsmedizin,
der Intensivmedizin und der verbesserten Therapiemöglichkeiten
in der Hämatoonkologie haben diese Patienten zahlenmäßig
zugenommen, und somit auch die invasiven Pilzinfektionen. Im
Gegensatz zu den bakteriellen Infektionen gibt es bei Pilzinfektionen
in der Diagnostik und in der Therapie einige Besonderheiten
zu beachten. Generell sind klinische Zeichen und Symptome unspezifisch,
weswegen die Diagnose sowohl viel Erfahrung wie auch pragmatisches
Vorgehen erfordert. |
| Diagnostik
Bei
klinischem Verdacht, der sich aus den klinischen Symptomen,
Befunden in bildgebenden Verfahren zusammen mit der Grundkrankheit
des Patienten und Risikofaktoren ergibt, sollten diagnostische
Schritte zur Sicherung der Pilzinfektion unternommen werden.
Bei einer klinischen Verdachtsdiagnose wird Material aus verdächtigen
Läsionen zur mikroskopischen Untersuchung und zur Kultur
entnommen. Da die häufigsten invasiven Mykosen durch opportunistische
Pilze (Candida, Aspergillus), die überall in der Umwelt
oder als Teil der Normalflora vorkommen, verursacht werden,
ist ein kultureller Nachweis aus oberflächlichem, nicht
steril entnommenem Material (Abstriche, Sputum,
Bronchialsekret) nicht aussagekräftig. Damit kann lediglich
eine Kolonisation bewiesen werden. Daher spricht man von „relevantem
Material“, das primär steril sein sollte und eine
Aussage für eine invasive Pilzinfektion zulässt. Relevantes
Material ist Blut, Liquor, Punktat eines Abszesses oder Gewebe.
Eine invasive Mykose kann aber im histologischen Schnitt durch
invasiv ins Gewebe wachsende Pilzelemente nachweisbar sein.
In der Kultur werden Sprosspilze auf Spezialnährböden
(z.B. Sabouraud-Glukose-Agar) angelegt. Aufgrund des langsamen
Wachstums erfolgt die definitive Bewertung erst nach 2-3 Tagen.
Eine
routinemäßige Resistenzbestimmung aller Candida-Isolate
wird derzeit
aufgrund der aufwändigen Methodik nicht durchgeführt
und ist aufgrund der geringen Resistenzraten nicht angezeigt,
die, wie in einer rezenten Untersuchung festgestellt, bei circa
7% der untersuchten Candida-Stämme liegt (persönliche
Mitteilung, B. Willinger, Wien).
Eine
andere Möglichkeit der Diagnose ist die serologische Bestimmung
von Oberflächen-Bestandteilen im Blut, z.B. mittels des
Galactomannan-Tests (ELISA) für Aspergillus oder mittels
des 1,4-Beta-D-Glucan-Tests [2]. Diese Tests sind vor allem
bei wiederholten Untersuchungen aussagekräftig und eignen
sich auch zur Verlaufskontrolle. Eine neue Methode ist der Nachweis
von Pilz-DNA aus dem Blut oder anderen Materialien. Es gibt
in der Literatur eine Vielzahl von beschriebenen Methoden, die
sich bezüglich der Wahl der Ziel-DNA unterscheiden. Derzeit
gibt es aber noch keine kommerziellen PCR-Tests zum Nachweis
von Pilz-DNA. Ergebnisse von unterschiedlichen Methoden sind
noch kontroversiell und schlecht vergleichbar [3]. Wenn aber
ein Labor eine solche Methode etabliert und evaluiert, so können
bei entsprechender Expertise in klassischer Mykologie diese
Ergebnisse sicherlich in die Entscheidung bezüglich Diagnostik
und Therapie einbezogen werden.
|
Prinzipien
der antimykotischen Therapie
Aus den in der Einleitung angesprochenen Gründen hat es
auch in der Entwicklung von neuen Antimykotika Fortschritte
gegeben: Man kann nun zwischen Azol (Triazol)-Antimykotika (Fluconazol,
Itraconazol, Voriconazol), Polyenen (Amphotericin B und seinen
Lipid-assoziierten Darreichungsformen) und Echinocandinen (Caspofungin,
Micafungin) wählen [4]. In der Tabelle
3 wird ein kurzer Überblick über Dosis und Einsatz
gegeben.
Die Wahl eines Antimykotikums ist von der Art der Mykose, dem
Erreger und den pharmakologischen Besonderheiten der Substanz
abhängig. Die Antimykotika haben auch ein bestimmtes Wirkungsspektrum,
aber auch – was noch wichtiger ist – bestimmte pharmakologische
Eigenschaften oder verursachen bestimmte Interaktionen mit anderen
Medikamenten, worauf auch bei der Wahl zu achten ist. Zusätzlich
kann es zu unerwünschten Arzneimittelreaktionen kommen,
die bei Amphotericin B – Fieber, Schüttelfrost, Nephrotoxizität
– bekannt sind. Aufgrund der vor allem bei invasiven Schimmelpilz-Erkankungen
doch eher mäßigen Ansprechrate um die 50% wird immer
wieder eine Kombinationstherapie überlegt. Kontrollierte
Vergleichstudien, ob eine Kombinationstherapie, die neben dem
doppelten Risiko auf Unverträglichkeit auch doppelte Kosten
verursacht, auch zu einem deutlich besseren Ansprechen führt,
liegen derzeit nicht vor. Gerade diese Studien sollten im Hinblick
auf die Morbidität, Letalität und eingeschränkten
Diagnose-Möglichkeiten in nächster Zeit durchgeführt
werden.
|
| Candida-Infektionen
(Candidiasis) Candida
albicans ist einer der häufigsten Erreger systemischer
Mykosen, der beim Menschen isoliert wird. Candida sp.
ist ein Sprosspilz, der sich
durch Sprossung und nicht über Sporen vermehrt (Abbildung
1a und 1b). Candida albicans
gehört zu einem geringen Prozentsatz zur normalen endogenen
Flora des Menschen. Durch lokale und systemische Faktoren kann
es zu einer Vermehrung von Candida bei gleichzeitiger Reduktion
der normalen bakteriellen Flora kommen und zu entsprechender
Symptomatik führen [5]. „Nicht-albicans“-Candida-Arten
wurden in den letzten 10 Jahren häufiger isoliert als zuvor,
was unter anderem auf der besseren Methodik zur Bestimmung und
möglicherweise auf der vermehrten Verwendung von Azol-Antimykotika
beruht. Vor allem bei Candida glabrata und bei Candida
lusitaniae kann eine geringere Empfindlichkeit gegenüber
Fluconazol vorliegen. Candida krusei ist immer resistent
gegenüber Fluconazol.
|
Abbildung 1a: Candida albicans–
Kultur
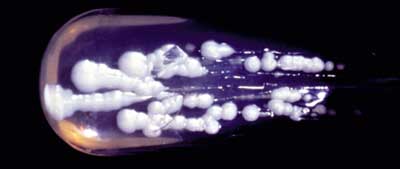
|
Abbildung 1b: Candida albicans
– Mikroskopisches Präparat
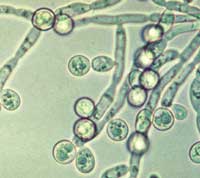
|
Neben
der systemischen Candidiasis sieht man die Candida-Dermatitis
häufig bei schwer kranken und bettlägrigen Patienten.
Daher muss gerade bei chronisch kranken Patienten die Genital-
und die Analregion wie auch die gesamte Haut auf ein hellrotes,
pustulöses, eventuell nässendes Exanthem mit Mazeration
untersucht werden (Abbildung 2). Der Mundsoor
kommt bei über einem Drittel der Zahnprothesenträger
vor. Bei Patienten mit HIV-Infektion ist massiver Mundsoor ein
Zeichen von stark reduzierter zellulärer Immunität
und AIDS. Häufig ist Mundsoor auch bei Patienten mit zytostatischer
Chemotherapie oder bei Patienten mit einer länger dauernden
Antibiotika-Therapie. Neben den typischen weißlichen Belägen
auf geröteter Schleimhaut gibt es eine atrophe Form ohne
weißliche Beläge, aber mit Rötung und Mazeration
der Schleimhaut. Der Patient klagt über Mundbrennen, pelzigen
Geschmack und Schmerzen beim Schlucken. Gelegentlich sieht man
in den Mundwinkeln Rhagaden, die so genannte Candida-Perlèche.
Üblicherweise ist eine orale Therapie mit einem Azol-Antimykotikum
mit einer Suspension insofern sinnvoll, weil
diese Suspension auch einen topischen Effekt hat. Zur Diagnose
reicht der Aspekt, eine Kultur ist bei Nicht-Ansprechen auf
die Therapie bzw. bei Rezidiv sinnvoll. Durch die antimykotische
Therapie kann ein weniger empfindlicher Candida-Stamm selektiert
worden sein, der mit einem anderen Antimykotikum behandelt werden
muss.
Abbildung 2: Candida dermatitis
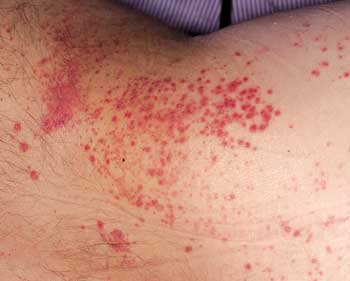
|
Candida-Oesophagitis
Die Candida-Oesophagitis ist eine Zwischenform von superfizieller
Mykose und invasiver Mykose, da es bei schwerem Befall zur Invasion
der Schleimhaut kommen kann. Die Symptome sind retrosternale
Schmerzen, Übelkeit, Appetitlosigkeit und Erbrechen. Die
Patienten verweigern die Nahrungsaufnahme, fiebern und sind
exsikkiert. Die Diagnose kann eigentlich nur endoskopisch gestellt
werden, bei Vorliegen von Mundsoor und entsprechender Prädisposition
(Tabelle 1) kann klinisch darauf geschlossen
werden. Üblicherweise wird mit einer antimykotischen parenteralen
Therapie begonnen. Bei Nichtansprechen bzw. bei Rezidiv der
Beschwerden ist eine Oesophago-Gastroskopie mit mykologischer
Kultur zur Erregeridentifizierung angezeigt.
Invasive
Candidiasis (Invasive Candidose)
Invasive Candida-Infektionen sind entweder Organmykosen oder
– weitaus häufiger – mit einer Candidämie
einhergehende Katheterinfektionen. Der Patient
hat Fieber (septische Fieberzacken oder subfebrile Temperaturen)
trotz breiter antibakterieller Therapie, allgemeine Verschlechterung,
Leukozytose,
Erhöhung der Akut-Phasen-Proteine, eventuell oberflächliche
Candida-Infektionen. Aufgrund des Vorliegens von Risiko- und
prädisponierenden Faktoren (Tabelle 1
und 2) kann bei entsprechender Symptomatik
und Nichtansprechen auf eine Breitband-Antibiotikatherapie auf
eine mögliche invasive Pilzinfektion geschlossen werden.
Vor Beginn der antimykotischen Therapie müssen zur Sicherung
der Diagnose eine mykologische Untersuchung (Mikroskopie, Kultur)
von relevantem Material (Blut, Abszess-Punkate, Liquor, Pleuraflüssigkeit),
eventuell eine Gewebebiopsie mit histologischer Aufarbeitung
und/oder bildgebende Verfahren (Computertomographie) durchgeführt
werden.
Eine
Candidämie (Nachweis von Candida spp.
im Blut) ist nur in ca. einem Drittel aller Fälle mit invasiver
Candidiasis nachweisbar. Häufig findet man wiederholt positive
Blutkulturen bei Patienten mit Infektion des zentralvenösen
Katheters oder bei Endocarditis. Der zentralvenöse Katheter
muss immer entfernt werden. Nach Entfernung des Katheters muss
eine antimykotische Therapie für 10 Tage durchgeführt
werden, da es infolge von Candidämie zur Absiedelung von
Candida ins Gewebe, auch ins Auge (Candida-Endophthalmitis)
kommen kann. Klinisch werden diese metastatischen Infektionen
oft Wochen bis Monate nach der ursprünglichen Candidämie
manifest. Bei neutropenischen Patienten kommt die hepatosplenale
Candidiasis vor, die schleichend mit Fieber und erhöhten
Leberwerten einhergeht. Eine Abszessbildung sieht man initial
nicht, weil die Größen der Abszesse unter der Auflösungsgrenze
der Sonographie oder sogar der Computertomographie sind (Abbildung
3). Bei Verdacht auf eine hepatosplenale Candidiasis
sollte daher die bildgebende Untersuchung von Leber und Milz
regelmäßig wiederholt werden. Metastatische Infektionen
können sich im ganzen Körper absiedeln, so kann man
neben der Candida-Endophthalmitis, Candida-Spondylodiscitis,
Candida-Arthritis auch Hautläsionen finden. Obwohl Candida
spp. sehr häufig – und auch in hohen Keimzahlen
– in Material aus dem Respirationstrakt (Tracheal-, Bronchialsekret)
nachweisbar ist, ist das kein Beweis für eine Candida-Pneumonie.
Eine Candida-Pneumonie ist sehr selten und üblicherweise
durch hämatogene Streuung bedingt (Abbildung
4). Eine definitive Diagnose kann nur durch Biopsie der
Läsion mit histologischer und kultureller Aufarbeitung
mit Identifikation der Candida-Art gestellt werden, da auch
Abszesse vom Aspekt her bakteriellen Abszessen ähneln.
Tabelle 1: Prädisponierende
Faktoren
|
• Immunosuppression |
|
–
Leukämie / Neoplasma |
| –
Neutropenie |
| –
Steroide / Immunsupp. |
| –
Radiatio |
| –
Cytotox. Chemotherapie |
| –
AIDS |
| –
Transplantation |
| |
| |
|
|
• Sonstige |
| –
Operation |
| –
Venenkatheter |
| –
Parenterale Ernährung |
| –
Hospitalisierungsdauer |
| –
Polymikrob. Infektionen |
| –
Antibiotika |
| –
Hyperkolonisation |
| –
Lokale Faktoren |
| –
Diabetes mellitus |
|
Tabelle
2: Risikofaktoren für Candida-Infektionen
bei Intensivpatienten
|
• Hohes Risiko |
| –
Bakt. Infekt., Antibiotika |
| –
Candida-Kolonisation |
| –
Isolation von > 2 Stellen |
| –
Immunosuppression |
| –
Hämodialyse |
| –
Operationen |
| –
Verbrennungen > 50% |
| –
Schweres Trauma |
| –
Severity-Score hoch |
|
|
• Weitere Risikofaktoren |
| –
Alter |
| –
Tunnelierter Katheter |
| –
Harnkatheter |
| –
Mehrere IV-Katheter |
| –
Diarrhoe |
| –
Parenterale Ernährung |
| –
Beatmung |
| –
Aufenthalt > 7 Tage |
| –
Neoplast. Grundkrankheit |
|
|
Abbildung 3: Hepatale Abszesse
nach Candidämie |
Abbildung 4: Lungenabszesse
durch Candida nach Candidämie durch einen zentralvenösen
Katheter |
|
|
|
| Therapie
Therapie
der Wahl bei Infektion mit Candida albicans und auch
mit Candida tropicalis ist Fluconazol. Die Dosierung
beträgt 10 (bis 15) mg/kg/Tag. Bei so genannten „Nicht-albicans“-Candida-Arten
kann eine geringere Empfindlichkeit gegenüber Fluconazol
vorliegen, sodass bei einem schwer kranken Patienten eine antimykotische
Therapie mit sicherer Wirksamkeit gegen „Nicht-albicans“
Candida, wie z.B. Caspofungin oder Voriconazol zum Einsatz kommen
sollte. Bei Vorliegen einer Resistenz gegen
Fluconazol oder Auftreten einer Candida-Infektion unter Fluconazol-Therapie
ist eine Resistenztestung gegen Voriconazol aber angezeigt.
Bei schwer immunsupprimierten Patienten, bei denen eine Infektion
durch Schimmelpilze, d.h. Aspergillus oder –
selten – auch Mucoraceae möglich ist, ist
nach wie vor – nach Ausschöpfen aller diagnostischer
Möglichkeiten – eine Therapie mit Amphotericin B,
bei beeinträchtigter Nierenfunktion als Lipid-assoziierte
Darreichungsform, indiziert.
Tabelle 3: Antimykotika, Dosierung
für die Therapie invasiver Mykosen
| Antimykotikum |
Dosis |
Indikation |
Bemerkungen |
| Fluconazol |
10
- 15 mg/kg |
Infektionen
durch
C. albicans, C. parapsilosis,
C. tropicalis |
iv
= po |
| Itraconazol |
3
x 100 - 200 mg/Tag |
Soor-Oesophagitis |
Nur
perorale Darreichungsform |
| Voriconazol |
Ladungsdosis
6 mg/kg/12 h am Tag 1,
dann 3 - 4 mg/kg/Tag |
Invasive
Aspergillose,
Scedosporium,
Fusarium |
Interaktionen
mit anderen
Arzneimitteln beachten |
| Amphotericin
B |
1
mg/kg iv |
Mucoraceae
(Zygomyzeten),
alle invasiven Mykosen,
ausser Scedosporium,
C. guillermondii |
Als
kontinuierliche Infusion [6] |
Lipid-assoziiertes
Amphotericin |
5
- 7 (max. 10) mg/kg |
Siehe
Amphotericin B |
Bei
Nierenbeeinträchtigung,
ambulante Therapie |
| 5-Flucytosin |
100
- 150 mg/kg in
4 Einzeldosen |
Harnwegsinfekt
durch
C. glabrata
Kombinationstherapie bei
Cryptococcus |
Dosisanpassung
bei
Nierenversagen!
Resistenzentwicklung
bei Monotherapie möglich |
| Caspofungin |
70
mg/Tag 1
50 mg ab Tag 2 |
Candida
spp. nicht-
albicans, Vortherapie
mit Fluconazol, Aspergillose |
|
| Micafungin |
200
mg/Tag |
Candida
spp. nicht-albicans |
|
|
|
Literatur:
| 1.
Clark T.A., Hajjeh R.A.: „Recent trends in the epidemiology
of invasive mycoses.“ Curr. Opin. Infect. Dis. 15
(6) (2002) 569-74. |
| 2.
Obayashi T., Yoshida M., Mori T., Goto H.,Yasuoka A., Iwasaki
H., et al.: „Plasma (1-->3)-beta-D-glucan measurement
in diagnosis of invasive deep mycosis and fungal febrile
episodes.“ Lancet Jan 7;345 (8941) (1995) 17-20. |
| 3.
Lass-Florl C., Gunsilius E., Gastl G., Bonatti H., Freund
M.C., Gschwendtner A., et al.:„Diagnosing invasive
aspergillosis during antifungal therapy by PCR analysis
of blood samples.“ J. Clin. Microbiol. 42 (9) (2004)
4154-7. |
| 4.
Graninger W., Presterl E.: „Schwere Pilzinfektionen.“
Österreichische Ärztezeitung (11) (2004)52-5. |
5.
McCullough M.J., Ross B.C., Reade P.C.:„Candida
albicans: a review of its history, taxonomy,
epidemiology, virulence attributes, and methods of strain
differentiation.“ Int. J. Oral Maxillofac. Surg.
25 (2) (1996) 136-44.
|
| 6.
Imhof A., Walter R.B., Schaffner A.: „Continuous infusion
of escalated doses of amphotericin B deoxycholate: an open-label
observational study.“ Clin. Infect. Dis. 15;36(8)
(2003) 943-51. |
Anschrift
der Verfasserin:
Univ.-Prof. Dr. Elisabeth Presterl
Univ.-Klinik für Innere Medizin I,
Klin. Abt. für Infektionen und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: elisabeth.presterl@meduniwien.ac.at
|
|
|