| Klinische Virologie
– eine Herausforderung |
| C. Wenisch, K. Kandel, E.
Bischof, H. Laferl, M. Szell
SMZ-Süd, KFJ Spital, 4. Medizinische Abteilung mit Infektions-
und Tropenmedizin, Wien
(Vorstand: Prim. Univ.-Prof. Dr. Christoph Wenisch) |
|
|
Zusammenfassung
Bis
vor einigen Jahren standen bei Virusinfektionen wenige diagnostische
Tests und nur supportive therapeutische Maßnahmen zu Verfügung.
Parallel zu einer deutlich verbesserten Diagnostik gibt es heute
für viele Virusinfektionen eine spezifische Therapie. Zudem
werden jedes Jahr neue Viren entdeckt und Zusammenhänge
klinischer Zustandsbilder mit spezifischen Viren assoziiert
(SARS-assoziierte Coronaviren, Parvoviren, Hantaan, HHV 6, HHV
8, Westnilvirus etc.). Die Kenntnis der Epidemiologie dieser
Infektionen ist für diagnostische
Überlegungen insbesondere bei importierten Infektionen
wichtig. All das hat das Management dieser Erkrankungen und
insbesondere den Verlauf und die Prognose dieser Erkrankungen
wesentlich verändert. Im folgenden Artikel wird die aktuelle
Herausforderung bei in Österreich vorkommenden klinisch
bedeutsamen Virusinfektionen (Influenza, HIV, FSME, CMV, Hepatitis
und Dengue) diskutiert.
|
Key-words:
Clinical
virology, HIV, CMV, Hepatitis, Influenza |
|
Summary
Until
recently, only limited diagnostic tests and supportive care
was available
for viral infections. Today, diagnostic systems improved considerably
and for a variety of viral infections specific antiviral therapy
is available. In addition to the growing knowledge of the viral
etiology of “new” diseases (parvovirus, SARS-associated
coronavirus, hantavirus, HHV 6, HHV 8, etc.) epidemiological
considerations are pivotal in respect to diagnosis, in particular
in the context of imported infections. These facts have considerably
modified management, course and prognosis of these infections.
Herein we review several aspects of the current challenge of
clinical virology (Influenza, HIV, FSME, CMV, Hepatitis, and
Dengue) in Austria.
|
HIV
Seit
dem erstmals 1981 beobachteten gehäuften Auftreten von
Pneumocystis-Pneumonien und Kaposi-Sarkomen unter US-amerikanischen
Homosexuellen und IVDUs [1] und der Isolation des HI-Virus durch
Gallo und Montagnier 1983 haben sich die Herausforderungen,
die diese Erkrankung an den behandelnden Arzt stellt, deutlich
gewandelt.
Derzeit
leben etwa 39,4 Millionen Menschen weltweit mit dem Virus, 25,4
Millionen davon auf dem afrikanischen Kontinent. Die Zahl der
Neuinfektionen wird für 2004 auf 4,9 Millionen geschätzt
[2]. Weniger als 4 % aller weltweit Infizierten haben Zugang
zu einer wirksamen medikamentösen Therapie. Während
staatliche und private Programme in Ländern wie Thailand,
Brasilien und Uganda
durch ihren Erfolg Hoffnung geben, müssen die zum Teil
explosionsartig steigenden Infektionsraten insbesondere unter
Jugendlichen in einigen osteuropäischen und zentralasiatischen
Ländern mit Besorgnis zur Kenntnis genommen werden. Bedeutend
ist weiters die Verteilung der Risikogruppen. In vielen afrikanischen
Ländern beträgt der Anteil der Frauen unter den HIV-Infizierten
bereits um die 80 %, in den USA und Europa sind die beiden größten
Risikogruppen noch Homosexuelle und Konsumenten intravenöser
Drogen. Dem auch hier steigenden Anteil infizierter Frauen muss
mit entsprechender Aufklärung Rechnung getragen werden.
Nur so kann in Zukunft verhindert werden, dass die Erstdiagnose
bei dieser Population häufig zu einem bereits fortgeschrittenen
Krankheitsstadium gestellt wird. Die Diagnose
der akuten HIV-Infektion stellt ein Problem dar, das nicht nur
auf eine Risikogruppe beschränkt ist. Gerade zu diesem
frühen Stadium ist die Viruslast oft sehr hoch und das
Transmissionsrisiko damit ebenso. Die Bedeutung der Therapieeinleitung
in dieser frühen Krankheitsphase wird diskutiert und der
Kliniker ist somit aufgerufen seine differentialdiagnostischen
Sinne zu schärfen [3]. HIV-assoziierte Morbidität
und Mortalität haben sich erst mit Einführung der
HAART 1996 deutlich geändert. Die mittlere Überlebensdauer
unter HAART wird heute auf 15 bis 20 Jahre geschätzt. Standen
früher opportunistische Infektionen und andere direkt HIV-assoziierte
Erkrankungen im Vordergrund des klinischen Verlaufs, so stellt
heute das Management Therapie-assoziierter Erkrankungen die
größte Herausforderung für den Arzt
dar. Der Anteil von Malignomen, Lebererkrankungen und Herz-Kreislauf-Erkrankungen
an den Todesursachen HIV-Positiver steigt stetig [4]. Dem behandelnden
Arzt steht heute einerseits ein umfassendes diagnostisches und
therapeutisches Armentarium zur Kontrolle opportunistischer
Infektion zur Verfügung. Andererseits kann er für
die HAART derzeit auf Präparate aus 4 Substanzgruppen mit
unterschiedlichem Angriffspunkt innerhalb des viralen Lebenszyklus
zurückgreifen [5]. Es handelt sich um NRTIs, NNRTIs , PIs
und die Fusionsinhibitoren. Integraseinhibitoren, Glucosidaseinhibitoren
und Chemokinrezeptorblocker befinden sich in einem bereits fortgeschrittenen
Entwicklungsstadium, während die Rolle, die Zytokinmodulatoren
für die Behandlung der HIV-Infektion spielen könnten,
noch nicht ganz geklärt scheint. Auf dem Gebiet der Vakzinentwicklung
konnte bis dato leider kein durchschlagender Erfolg erzielt
werden. Die Herausforderung für den behandelnden Arzt besteht
in der Auswahl der „richtigen“ Therapie für
jeden einzelnen Patienten. Zu berücksichtigen sind Lebensumstände,
Komorbidität und Komedikation, Komplexität der Einnahmevorschriften,
Resistenzsituationen und zu erwartende Nebenwirkungen. Neben
virologischen, immunologischen, infektiologischen und umfassenden
allgemeinmedizinischen Kenntnissen sind hohe psychosoziale Kompetenz
und gute kommunikative Fähigkeiten gefordert, um eine möglichst
optimale Arzt-Patienten-Beziehung zu schaffen. Nur auf dieser
Basis kann mit hoher Compliance und Adhärenz gerechnet
werden. Letztere sind die Vorraussetzung für einen lang
anhaltenden Therapieerfolg [6]. Dieser kann aber oft nur durch
Therapiemodifikationen erzielt werden. Erforderlich werden diese
bei Auftreten nicht traktabler oder nicht akzeptabler Nebenwirkungen
oder aber bei Entwicklung
von Resistenzen, die sich in bis zu 50% unter Therapie entwickeln.Trotz
aller deutlicher Fortschritte, die in den letzten 20 Jahren
in allen Teilbereichen der HIV-Infektion erzielt werden konnten,
bleiben also noch genügend Probleme zu lösen. Herausforderungen
für den klinischen Virologen wird es also auch in den nächsten
Jahrzehnten geben, noch größere Herausforderungen
wahrscheinlich aber für Regierungen, Pharmakonzerne sowie
Gesundheitsinstitutionen, die mit Prävention befasst sind.
|
| CMV
Eine
Infektion mit Cytomegalieviren im immunsupprimierten Patient
ist eine oft gefürchtete Komplikation immunsuppressiver
Therapien und geht mit einer hohen Letalität einher. So
kommt es durch das Virus bei transplantierten Patienten, bei
Neugeborenen oder bei HIV-Patienten zu schweren Organmanifestationen
der Lunge, der Retina, des Darmes oder des ZNS. Bei diesem speziellen
Krankengut sind diese Krankheiten daher wohl bekannt und gefürchtet.
Weniger
bekannt ist jedoch, dass das Cytomegalievirus bei immunkompetenten
Erwachsenen ebenfalls zu einer beträchtlichen Morbidität
und auch in seltenen Fällen zu schweren Komplikationen
führen kann [7, 8]. Leider wird dieses Krankheitsbild oft
viel zu spät diagnostiziert, und bis dahin werden unnötige
diagnostische und therapeutische Maßnahmen getroffen.
Obwohl die Erkrankung seit den 60er Jahren bekannt ist, wird
sie nach wie vor oft übersehen, obwohl sich viele Patienten
typisch präsentieren: Der „klassische“ CMV-Patient
heute ist etwa 30 Jahre alt, hat seit vielen Tagen teils hohes
Fieber und zeigt im Labor eine „Transaminitis“ (GPT
> GOT) [7, 8, 9, 10, 11].
Seit
1997 erfassen wir an unserer Abteilung alle Patienten mit einer
akuten
CMV-Infektion. Immunsupprimierte Patienten wurden von der Erfassung
ausgeschlossen. Insgesamt konnten wir 57 Patienten identifizieren.
Im Folgenden möchten wir die wichtigsten Charakteristika
dieser Erkrankung anhand unserer eigenen Daten präsentieren.
Männer
und Frauen sind gleich häufig betroffen. Bezüglich
der Altersverteilung zeigt sich ein Median von 34 Jahren. Etwa
80% der Patienten sind zwischen 21 und 40 Jahre alt. Es gibt
keine jahreszeitliche Häufung.
Etwa ein Drittel unserer CMV-Patienten hatte eine rezente Auslandsreise
in der Anamnese. Einerseits ist diese Beobachtung dadurch verzerrt,
dass unsere Infektionsambulanz auch von Tropenrückkehrern
frequentiert wird, andererseits sind die CMV-Seroprävalenzen
in subtropischen und tropischen Ländern deutlich erhöht.
Eventuell dürfte auch das erhöhte Risikoverhalten
im Urlaub (orale Kontakte, Geschlechtsverkehr) eine Rolle spielen.
Das klinische Leitsymptom dieser Erkrankung ist das Fieber;
fast alle Patienten haben Fieber. Die durchschnittliche Fieberdauer
betrug bei unseren Patienten 17,8 Tage, das durchschnittliche
Fiebermaximum betrug 38,8°C (Maximalwert: 40°C).
Fast
die Hälfte der Patienten klagt über Kopfschmerzen,
etwa ein Drittel über Myalgien. Ebenfalls ein Drittel berichtet
über eine teilweise extreme Müdigkeit. Weitere nicht
so oft beobachteten Symptome sind: Husten, Lymphknotenschwellung,
Nachtschweiß, Exanthem.
Im Labor zeigt sich in fast allen Fällen eine Erhöhung
der Transaminasen, wobei typischerweise – ähnlich
wie durch „klassische“ Hepatitisviren – die
GPT höher als die GOT ist. Auffallend bei diesen Patienten
ist eine oft deutliche Erhöhung der LDH.
Ebenfalls
richtungweisend im Labor ist der Nachweis einer Lymphozytose
mit reaktivierten bzw. atypischen Lymphozyten.
Dass
die Diagnose dieser Erkrankung Schwierigkeiten bereitet, zeigt
schon alleine die Tatsache, dass 40% unseres Kollektives auswärts
bereits mit Antibiotika anbehandelt wurden.
Der
Nachweis von CMV-IgM im Serum in Kombination mit Fieber und
erhöhten Leberwerten ist als Diagnose ausreichend. Nur
in speziellen Fällen ist die Durchführung einer CMV-PCR
oder der Nachweis des Antigen spp65 indiziert [12].
Eine
antivirale Therapie (Ganciclovir, Foscarnet) ist bei einem unkomplizierten
Verlauf nicht indiziert. Die akute CMV-Infektion ist eine wichtige
Differentialdiagnose des fiebernden Tropenrückkehrers,
des FUO-Patienten und gehört auch zu der Differentialdiagnose
der viralen Hepatitis. Eine frühzeitige Bestimmung der
CMV-Antikörper kann die Diagnose sichern und erspart dem
Patienten unnötige weitere diagnostische Schritte und sinnlose
Antibiotikagaben. |
Influenza
Die Influenza ist eine akute Viruserkrankung, die durch Tröpfcheninfektion
übertragen wird. Ihre Ausbreitung erfolgt vor allem in
dichten Menschenansammlungen, in Verkehrsmitteln, Arbeitsstätten,
Schulen, Kaufhäusern etc., besonders durch Anhusten und
Niesen sowie auch durch Husten und Niesen in die rechte Handfläche,
die man dann seinen Mitmenschen zur Begrüßung reicht.
Nach einer Inkubationszeit von 1 - 4 Tagen beginnt die Krankheit
plötzlich mit Schnupfen, Fröstelgefühl, Kopf-
und Gliederschmerzen. Danach erfolgt ein rascher Anstieg der
Körpertemperatur auf 39 - 40 Grad Celsius, zugleich
tritt der für die Erkrankung der Atemwege charakteristische
Husten bereits in den Vordergrund. Die Patienten klagen außerdem
über Brennen im Rachen und Schmerzen hinter dem Sternum.
Die Entfieberung erfolgt meistens nach 4 - 6 tägigem Krankheitsverlauf.
Die Erkrankung verläuft in den meisten Fällen relativ
leicht. Es kann aber auch zu gefährlichen Komplikationen
kommen, dazu gehören die Pneumonie, für die besonders
Hochrisikopatienten (die mit pulmonalen oder cardiovasculären
Grunderkrankungen, Patienten mit Diabetes mellitus, Nierenerkrankungen,
Hämoglobinpathien oder Immunsupression, Patienten in Pflegeheimen
und älteren Patienten) ein Risiko aufweisen. Auf der einen
Seite kann es sich dabei um eine primäre Influenzapneumonie
handeln, die insbesondere dann auftreten kann, wenn sich die
primäre Influenzainfektion nicht verbessert und hohes Fieber,
Dyspnoe und Zyanose auftritt; auf der anderen Seite auch die
sekundäre bakterielle Superinfektion, deren Pathogenese
auf den Flimmerzellverlust durch die Virusinfektion zurückgeführt
wird.
Der häufigste bakterielle Erreger ist Streptococcus
pneumoniae (48% in einer Untersuchung), auch Staphylococcus
aureus (19%) und Hämophilus influenzae-Pneumonie
können Influenza komplizieren. Klassischerweise tritt dies
nach einer initialen klinischen Besserung und Afebrilität
für 2 - 3 Tage im Sinne einer akuten Erkrankungsexacerbation
mit hohem Fieber, Husten, purulentem Sputum unter radiographischen
Zeichen von pulmonalen Infiltraten auf.
Andere wichtige Komplikationen sind Myositis und Rhabdomyolyse,
wobei auch hier Myoglobinurie und assoziiertes Nierenversagen
beschrieben wurden.
Weitere Komplikation ist das Reyesyndrom im Sinne einer extrapulmonalen
Komplikation, welches vor allem mit Influenza-B-Virusinfektion
assoziiert wurde. Insbesondere Kinder (Altersgruppen 2 - 16)
sind davon betroffen. Man sah bei dieser Erkrankung eine epidemiologische
Assoziation mit der Verwendung von Aspirin, welche durch die
Empfehlung Aspirin bei Influenza nicht zu verwenden und des
damit verbundenen Rückgangs der Inzidenz des Reyesyndroms
unterstützt wurde. Das Reyesyndrom führt klinisch
zu Übelkeit und Erbrechen, gefolgt von einer Vielzahl zentralnervöser
Zeichen wie Veränderung der Bewusstseinslage bis zur Lethargie,
Koma, Delirium und Krämpfe. Eine Hepatomegalie mit erhöhten
Leberfermenten und LDH und minimal erhöhtem Serum-Bilirubin
ist typisch. Die Kontrolle des cerebralen Ödems und der
Hypoglykämie sind wichtig bei diesen Patienten. Die Letalitätsrate
ist bis 10%.
Eine
weitere Komplikation ist eine hämorrhagische Encephalitis,
eine Myelitis transversa und eine aseptische Meningitis. Eine
Assoziation mit einem Guillain-Barre-Syndrom hinsichtlich der
Ätiologie wurde nicht bewiesen.
Eine Myocarditis und Pericarditis wurde häufig in der Pandemie
1918 berichtet, aber selten in späteren Berichten. Auf
der anderen Seite sieht man EKG-Veränderungen häufig
bei Patienten mit Influenza, insbesondere bei denen, die eine
zugrunde liegende chronische Herzkrankheit aufweisen.
Erst
1933 wurde das Influenza-Virus nachgewiesen. Man stellte dabei
3 Virustypen fest, Typ A, B und C. Seither wurde bei Pandemien
und größeren Epidemien nur das Influenza-Virus vom
Typ A festgestellt, Typ B kommt bei kleineren Epidemien und
Endemien vor, während sich der Typ C nur bei Einzelerkrankungen
im Kindesalter feststellen ließ. Erkältungskrankheiten,
die gewöhnlich als grippaler Infekt bezeichnet werden,
und
für die klassische Theorie aus Schnupfen und Heiserkeit
gekennzeichnet ist, werden in Wirklichkeit von anderen respiratorischen
Viren wie Rhinoviren, Coronaviren, Adenoviren oder Echoviren
verursacht.
Im Gegensatz zu anderen Virusinfektionen wie Pocken, Gelbfieber,
Polymylitis, Masern und Röteln ist aufgrund der Varibilität
der Oberflächenantigene des Influenza-Virus vom Typ A ein
umfassender Impfschutz nicht zu erzielen. Die starke Variabilität
der beiden Oberflächensubtypantigene (H und N) des Influenza-Virus
vom Typ A führt zu zahlreichen Subtypen. Die Pathogenität
von Influenza-Viren hängt vom Hämaglutinin ab. Bislang
sind 16 Hämaglutinin (H)- und 9 verschiedene Neurominidase
(N)-Subtypen bei Influenza-A-Viren bekannt. Der Grippeimpfstoff,
der Jahr für Jahr neu angeboten wurde, wirkte nur gegen
die Grippe des Vorjahres. Denn das Virus ändert seinen
durch den Impfstoff beherrschbaren Charakter fast jährlich.
Diese kontinuierlichen Veränderungen werden als Antigendrift
bezeichnet. Dieser Antigendrift ist die Ursache dafür,
dass Influenza-Virusinfektionen keine langanhaltende Immunität
hinterlassen und immer wieder Reinfektionen und jährliche
Epidemien auftreten können. Plötzliche und drastische
Veränderungen, die als Antigenshift bezeichnet werden,
sind hingegen ein Markenzeichen des Influenza-A-Virus und treten
in unvorhersehbaren Intervallen auf. Wenn solche drastisch veränderten
Virusvarianten die Fähigkeit besitzen, effizient von Mensch
zu Mensch übertragen zu werden, kann es zu ausgedehnten
Epidemien und in weiterer Folge zu einer Pandemie kommen.
Dabei kommt einem Genaustausch bei Haustieren (Geflügel
und Schweine) eine wichtige Rolle als Virusreservoir im Sinne
der genetischen Rekombination zu. Bei der so genannten
Hongkong-Grippe des Jahres 1968 dürfte das Hämoglutiningen
aus einem Influenza-Virus übernommen worden sein, das in
Geflügel vorkommt. Ganz ähnliche Bedingungen fanden
sich schon früher in den USA, wo Schweine-Influenza-Viren
offensichtlich eine Rolle spielten. Von besonderem Interesse
dürfte die Situation in China sein, wo – ähnlich
wie früher auch in europäischen Städten –
Geflügel, Schweine und Menschen in engem Kontakt miteinander
leben und wo daher das menschliche Influenza-Virus vom Typ A
die Möglichkeit findet und fand, sein Erbgut mit dem tierischen
Influenzavirus auszutauschen und neu zu rekombinieren. Solche
Zustände führen zu neuen Virussubtypen („Reassortanten“),
die neue biologische Eigenschaften aufweisen und sich daher
epidemisch ausbreiten können.
Es gilt als sicher, dass von solchen Reassortanten zwischen
Mensch und Tier von Zeit zu Zeit neue Influenzapandemien ausgehen,
wobei der Eindruck von sekulären Wellenbewegungen mit einem
Rhythmus von etwa 20 - 40 Jahren entstand [13].
In Österreich erkranken pro Jahr ca. 380.000 Personen an
der Influenza, 2.000 - 3.000 Personen sterben daran. Obwohl
Influenza somit zu den häufigsten und folgenschwersten
Infektionskrankheiten gehört, besteht in der Bevölkerung
kein adäquates Risikobewusstsein. Dies schlägt sich
in dramatisch niedrigen Durchimpfungsraten von durchschnittlich
17% nieder, welche trotz intensiver Aufklärungsarbeit verschiedener
Stellen nur sehr langsam gesteigert werden können [14].
Bei
vorhandener Epidemie wird auf klinischer Basis Influenza am
besten anhand der Nicolson’schen Kriterien diagnostiziert:
Dabei sind die epidemiologische Assoziation, eine plötzliche
Erkrankung mit Fieber höher als 38 Grad Celsius
Hauptkriterien plus zwei der folgenden Symptome – Muskel-
und Gliederschmerzen, Müdigkeit und Abgeschlagenheit bei
Kopfschmerzen, Husten, Heiserkeit, Bettlägrigkeit –
zur Diagnose notwendig (Tabelle 1).
Ist
die Grippewelle voll angelaufen, korrelieren klinische Diagnose
und Labordiagnose in etwa 90%. In dieser Zeit ist daher eine
Individualdiagnostik nicht erforderlich und würde nur den
Behandlungsbeginn verzögern. Die derzeit kommerziell erhältlichen
Schnelltestsysteme sind relativ unempfindlich und liefern insbesondere
bei älteren Personen falsch negative Ergebnisse. Zur Überwachung
von Veränderungen der zirkulierenden Virusstämme während
einer Epidemie sollten ausgewählte Untersuchungsmaterialien
an Fachlaboratorien weitergeleitet werden. Für den direkten
Virusnachweis sind ein Nasenrachenabstrich, abgesaugtes Nasenrachensekret
bei Säuglingen und Kleinkindern, Bronchialsekret, bronchoalveoläre
Lavage, Biopsie und Sektionsmaterial, welches innerhalb von
72 Stunden nach Symptombeginn im Labor einlangen sollte, adäquat.
Diagnostische Möglichkeiten für den direkten Virenvirusnachweis
gibt es im Sinne des Nachweises von virusspezifischen Proteinen
und Nukleinsäuresequenz mittels Immunfluoreszenztechnik,
ELISA und PCR direkt im Untersuchungsmaterial bzw.Virusanzucht.
Für den Nachweis virusspezifischer Antikörper ist
die Komplementbindungsreaktion geeignet [15].
Zur
Therapie steht heute Oseltamivir zur Verfügung. Die Dosierung
beträgt 2 x 75 mg p.o. für 5 Tage. Oseltamivir ist
ein Neuraminidasehemmer, welcher das Freisetzen von neu gebildeten
Viruspartikeln aus einer infizierten Zelle verhindert. Insoferne
ist ein frühzeitiger Behandlungsbeginn notwendig. Bei einem
Therapiebeginn innerhalb von 48 Stunden nach Symptombeginn
ist mit einer Verkürzung der Erkrankung von 1,5 - 2 Tagen
zu rechnen, bei einem Therapiebeginn 12 Stunden nach Symptombeginn
ist der Patient 3,1 Tage kürzer krank. Oseltamivir führt
zu 55% weniger Antibiotika für untere Atemwegsinfektionen
und zu einer Reduktion der Hospitalisierungsrate um 59 % [16,
17, 18]. Beides ist insbesondere für pandemische Situationen
und Planungen von höchster Relevanz. Auf Basis der Überlegungen
betreffend Schweregradbestimmung von pulmonalen Infektionen
wurden im Rahmen einer Arbeitsgruppe der Wiener Landessanitätsdirektion
Triagekriterien für die Aufnahmebedürftigkeit von
Influenzakranken evaluiert. Dabei wurde der VAB-65 Score (Verwirrung,
Atemfrequenz, Blutdruck, 65 Lebensjahre) vorgeschlagen. Nach
klinischer Diagnose (Tabelle 1) sieht dieses
Testscoreergebnis auf (Tabelle 2) Folgendes
vor:
Bei 0 und 1 Punkten ist eine ambulante Behandlung der Influenza
angezeigt.
Bei
2, 3 oder 4 Punkten ist eine stationäre Aufnahme notwendig.
Die Klassifikation richtet sich in Ermangelung eines influenzatypischen
Scores auf validierte Schweregradbestimmungen im medizinischen
Schrifttum betreffend untere Atemwegsinfektionen [19].
Auf
Basis krankenhaushygienischer Überlegungen ist eine Dauer
der Übertragbarkeit bei ausgebrochener Influenza von bis
zu 3 - 5 Tagen nach Ausbruch der Erkrankung bei Erwachsenen
und bis zu 7 Tagen bei Kindern zu erwarten. Patienten mit akuter
respiratorischer Symptomatik sind bereits im Aufnahmebereich
von medizinischen Einrichtungen von Patienten mit anderen Krankheitsbildern
zu trennen. Diese Patienten sollten kohortiert werden. Solange
beim Personal kein sicherer Impfschutz besteht, sind bei jedem
Kontakt mit PatientInnen mit nachgewiesener Influenzainfektion
Mundschutz, Augenschutz, Schutzkleidung, Handschuhe und hygienische
Händedesinfektion notwendig. Patienten sollten bei Verlassen
des Raumes mittels FFP3-Masken ohne Ventil versorgt werden [20].
Besucher
sollten bei Eintreten des Raumes eine Maske tragen. Ein Arbeitsverbot
für medizinisches Personal mit „Schnupfen“
sollte für Hochrisikobereiche wie Intensivstation, Knochenmarkstransplantation,
etc. vorgesehen werden. Eine Prophylaxe mit Oseltamivir bei
Patienten und Personal ist für die Dauer des unzureichenden
Impfschutzes möglich und wird auch von einigen Fachgesellschaften
(Paul-Ehrlich-Gesellschaft) empfohlen. Krankenbesuche sind auf
das Notwendige zu beschränken, nur wirklich indizierte
Aufnahmen sind vorzunehmen und elektive cardiopulmonale Eingriffe
sind zu verschieben. Zur Abschätzung der Epidemie- und
Pandemieauswirkungen steht heute ein
mathematisches Modell von Meltzer, welches vom CDC Atlanta kostenlos
zur Verfügung gestellt wird, zur Verwendung (Fluaid, Centers
for Disease Control, Atlanta, USA; www.2a.cdc.gof/od/fluaid/).
Dabei würde es bei keiner Durchführung von Prophylaxe
und Therapie bei einer Hospitalisierung von 1,5 % der Erkrankten
und einer 0,4 %igen Todesrate bei einer 30 %igen Erkrankungsrate
zu 36.209 Hospitalisationen und 9.672 Todesfällen in Österreich
kommen. Bei Verwendung von medikamentöser Prophylaxe für
Gesundheitspersonal und Therapie aller Erkrankten könnte
nach dieser Modellrechnung ca. ein Zehntel der Arztkonsultationen,
mehr als die Hälfte der Hospitalisationen sowie mehr als
die Hälfte der Todesfälle verhindert werden [21].
Tabelle 1: Influenzadiagnose
| Kriterien |
Influenza
~
90% Sensitivität/Spezifität |
|
| Influenza
in der Region |
 |
| Plötzliche
Erkrankung |
 |
| Fieber
> 38°C |
 |
| +
zwei der folgenden Symptome: |
|
| Muskel-
und Gliederschmerzen |
Husten |
| Müdigkeit
und Abgeschlagenheit |
Heiserkeit |
| Kopfschmerzen |
Bettlägerigkeit |
|
| *nach
Nicolson, Managing Influenza in primary care, 2002
|
Tabelle
2: Schweregradbestimmung (Triagekriterien nach
dem VAB-65-Score, Verwirrung, Atemfrequenz, Blutdruck,
65 Lebensjahre*)
| Schweregradbestimmung |
Punkte |
|
| Verwirrung
(zeitliche, örtliche und zur Person Desorientierung
oder Mentaltestscore < 8) |
1
Punkt |
| Atemfrequenz
>30 pro Minute |
1
Punkt |
Blutdruck
systolisch <90 mm/Hg oder
diastolisch < 60 mm/Hg |
1
Punkt |
| Lebensalter
> 65 Jahre |
1
Punkt |
|
|
*modifiziert nach [19] |
| Ergebnis
und Bedeutung: |
| Bei
Testscoreergebnissen von 0 und 1 Punkten ist
eine ambulante Behandlung der Influenza angezeigt. |
| Bei
Testscoreergebnissen von 2, 3 oder 4 Punkten
ist eine stationäre Aufnahme notwendig. |
|
|
|
| Früh-Sommer-Meningo-Enzephalitis
(FSME) Die
FSME ist eine der wichtigsten Ursachen von viralen Entzündungen
des Zentralnervensystems und kommt zumindest in 25 europäischen
und sieben asiatischen Ländern vor. In diesen Regionen
treten insgesamt mehr als 10.000 schwere Fälle pro Jahr
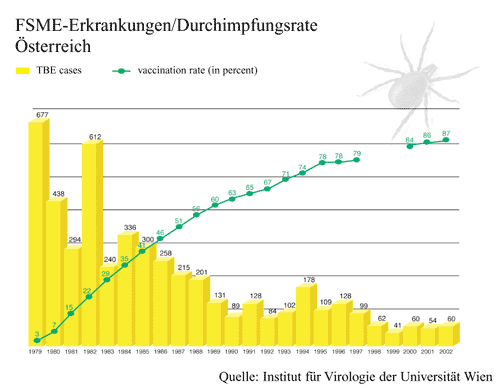
auf. In Österreich selbst wurden 2004 54 Fälle von
FSME diagnostiziert (Abbildung 1).
Abbildung
1: FSME-Erkrankungen/Durchimpfungsrate Österreich
|
Während
Schneider bereits 1931 die FSME als eigene Erkrankung erkannte
[22], wurde das FSME-Virus aus der Familie der Flaviviridae
erst 1937 von Zilber in Russland entdeckt [23]. Dabei werden
je nach geografischem Vorkommen ein europäischer, sibirischer
und fernöstlicher Subtyp unterschieden. Das Vorkommen des
Virus ist an so genannte Naturherde gebunden, in denen das Virus
zwischen Wirtstieren (Kleinsäugern) und Vektoren (Ixodes
ricinus und Ixodes persulcatus) zirkuliert. Die
Prävalenz infizierter Zecken variiert in Europa zwischen
0,5% und 5% [24].
Die
Infektion des Menschen erfolgt hauptsächlich in den Frühlings-
und Herbstmonaten durch den Biss einer Zecke beim Aufenthalt
im Freien. Als weiterer Infektionsweg wird der Genuss von Ziegenrohmilchprodukten
diskutiert [25].
Typischerweise verläuft die FSME biphasisch, wobei es nach
einer 1- bis 2-wöchigen Inkubationszeit zur virämischen
Phase mit uncharakteristischen grippalen Symptomen wie Fieber,
Muskel- und Gliederschmerzen kommt. Nach einem symptomfreien
Intervall von 8 Tagen präsentieren sich die Patienten mit
hohem Fieber und Kopfschmerzen. In 20 - 30 % der Fälle
werden meningoenzephalitische Symptome beobachtet. Anhaltende
neurologische und neuropsychiatrische Symptome für mehrere
Monate sind häufig. Als asiatisch-russisches Phänomen
existieren chronische Krankheitsverläufe ohne vorangegangene
Akutphase. Die Routinediagnostik der FSME besteht im Nachweis
von IgM- und IgG-Antikörpern mittels ELISA aus dem Serum.
Beweisend ist der 4-fache Titeranstieg nach 2 Wochen. Der direkte
Virusnachweis mit
RT-PCR ist in der Frühdiagnostik und nach einer kurz zuvor
erfolgten Impfung hilfreich.
Die Letalität liegt in Europa bei 1%, meistens jedoch bilden
sich alle Symptome wieder vollständig zurück. Eine
kausale Therapie der FSME gibtes nicht, das spezifische Immunglobulin
wurde aufgrund von besonders schwer verlaufenden Fällen
nach passiver Immunisierung vom Markt genommen.
Der einzige wirksame Schutz vor einer FSME-Infektion ist die
Impfung. Die erste aus Gewebskulturen entwickelte Vakzine wurde
in den frühen 1970er Jahren entwickelt und in Zusammenarbeit
des Virologischen Institutes der Universität Wien mit der
Immuno AG Wien (heute Baxter Healthcare) kommerzialisiert. Der
Impfstoff enthält inaktiviertes, hochgereinigtes Virus
des Europäischen Subtyps [26].
In der Vorimpfära hatte Österreich die höchste
Morbidität an FSME in Europa. Aus diesem Grund wurde 1981
eine Massenimpfkampagne in österreichischen Schulen gestartet,
was zu einer
Durchimpfungsrate von über 80% führte [27]. Die Schutzrate
der Impfung ist mit 98% sehr hoch. Dadurch konnte die Inzidenz
der FSME in den letzten 30 Jahren von 677 im Jahr 1979 auf 54
FSME-Erkrankungen 2004 reduziert werden. Im Vergleich dazu wurden
in der Tschechischen Republik bei etwa gleichem Erkrankungsrisiko,
aber sehr niedriger Durchimpfungsrate 2004 über 500 FSME-Fälle
registriert [28]. Dieser Vergleich belegt eindrucksvoll die
Effektivität der Impfung in Österreich.
Die
FSME ist eine Erkrankung aller Altersschichten, wobei das höchste
Risiko bei den 10 - 14-Jährigen liegt. Dennoch ist in vielen
europäischen Ländern heute mehr als die Hälfte
der Betroffenen älter als 50 Jahre. Diese älteren
Patienten neigen zu schwereren Verläufen mit längerer
Hospitalisierung und langwieriger Rehabilitation sowie höheren
Raten an Spätfolgen und Todesfällen. Ursache dafür
scheint eine altersabhängige Thymusdegeneration zu sein,
was über eine Verringerung an naiven T-Zellen zur verminderten
Effektivität des Immunsystems und zu schlechtem Ansprechen
auf Impfungen führt. Aus diesem Grund ist bei über
50-Jährigen ein kürzeres Impfintervall von 3 Jahren
erforderlich.
|
| Chronische
Hepatitis B (CHB) Trotz
einer seit Jahrzehnten verfügbaren, äusserst effektiven
aktiven Vakzine sind weltweit mehr als 400 Millionen Menschen
chronisch mit dem Hepatitis B-Virus (HBV) infiziert. Die Prävalenzraten
variieren stark. Wie Nordwesteuropa, Nordamerika und Australien
gehört Österreich mit < 1% zu den Niedrigendemiegebietender
Erde. Die Hochendemiegebiete (Prävalenzrate >8%) liegen
in Subsahara-Afrika und (Süd-)Ostasien. Bei drei
Viertel aller chronisch Infizierten handelt es sich folglich
um Asiaten. Die Mittelmeerländer und Osteuropastellen Gebiete
mit mittlerer Durchseuchung dar. Die CHB ist für ca. 60%
der jährlichen 530.000 Fälle von hepatozellulären
Karzinomen (HCC) verantwortlich. Wenn gleich die Richtlinien
hinsichtlich Indikation, Dauer und Endpunkten einer antiviralen
Therapie nicht so klar definiert sind wie bei der chronischen
Hepatitis C, wurden in den letzten Jahren durch die Verfügbarkeit
neuer Virustatika doch große Fortschritte auf diesem Gebiet
erzielt.
Unter dem Gesichtspunkt der Indikationsstellung zur antiviralen
Therapie ist eine Einteilung der chronischen HBV-Infektion,
definiert als > 6 Monate bestehender HbsAg-Positivität,
unter Berücksichtigung sowohl virologischer als auch klinischer
Gesichtspunkte sinnvoll. Virologisch kann die „wild type“-Variante
(HbeAg-positiv) von der „Precore-Mutanten“ (HbeAg-negativ)
unterschieden werden. Beide Varianten können sowohl als
hoch- wie auch als niedrigreplikative Form auftreten. Als Grenze
zwischen hoch- und niedrigreplikativer Form wird bei „wild
type“ ein Serumvirustiter von 105 copies/ml definiert.
Ob bei den „Precore-Mutanten“ ein Grenzwert von
104 copies/ml einen besseren Grenzwert darstellt, wird derzeit
noch diskutiert. Hinsichtlich klinischer Aspekte werden drei
Phasen unterschieden:
1. Eine
immuntolerante Phase (hohe Virustiter, keine Leberentzündung,
normale Transaminasen).
2. Eine
immunaktive, hochreplikative Phase (hohe Virustiter, histologisches
Bild der chronischen Hepatitis, deutlich erhöhte Transaminasen),
bei der je nach vorliegender Virusvariante eine HbeAg-positive
CHB von einer HbeAg-negativen CHB unterschieden wird sowie
3. Eine
niedrigreplikative Phase (niedrige Virustiter, kaum histologische
Entzündung, normale bzw. geringgradig erhöhte Transaminasen),
auch als inaktiver Hepatitis B-Carrier bezeichnet.
Aufgrund
von Fluktuationen des Viruslltiters und der Transaminasen kann
die Differenzierung der einzelnen Phasen manchmal schwierig
sein und ist oft nur im Verlauf durch serielle Bestimmungen
dieser Parameter möglich. Dies gilt insbesondere für
die HbeAg-negative CHB. Sowohl bei Patienten in der immuntoleranten
als auch bei jenen in der niedrigreplikativen Phase wird in
der Regel keine antivirale Therapie empfohlen. Ausnahmen stellen
allerdings Patienten dar, bei denen eine immunsuppressive Therapie
geplant ist. Selbst bei Patienten in der immunaktiven, hochreplikativen
Phase wird die Indikation zur Therapie nur bei Vorliegen histologisch
mäßiggradiger oder schwerer Hepatitis mit deutlich
erhöhten Transaminasen gestellt. Bei Patienten mit lediglich
milder CHB, seien sie nun HbeAg-positiv oder HbeAg-negativ,
wird in der Regel zugewartet. Aus all dem Erwähnten geht
hervor, dass eine Leberbiopsie zur Therapieindikation bei der
CHB in der Regel erforderlich ist. Als primäres Therapieziel
ist die möglichst vollständige Suppression der Virusreplikation,
jedenfalls auf < 105 copies/ml anzusehen. Im Falle der HbeAg-positiven
CHB („wild type“) sollte eine Serokonversion mit
Verlust von HbeAg und Auftreten von HbeAk erfolgen. Das Erreichen
der niedrigreplikativen Phase ist mit einer Senkung des Risikos
des Fortschreitens zur Leberzirrhose bzw. HCC verbunden.
Prinzipiell
stehen derzeit zwei Therapiekonzepte zur Verfügung:
1. Interferon-alfa,
wobei die einmal pro Woche subcutan zu verabreichenden pegylierten
Interferone (Peginterferon-alfa-2a bzw. Peginterferon-alfa-2b)
heute die Therapie der Wahl darstellen. Die Therapiedauer beträgt
48 bis 52 Wochen.
2. Nukleosid-
bzw. Nukleotidanaloga: Lamivudine und Adefovir, beides peros.
Therapiedauer mindestens 1 Jahr bzw. 6 Monate über die
HbeAg-Serokonversion hinaus.
Zusammengefasst
zeigt die Therapie mit Interferon-alfa-Präparaten bessere
Ansprechraten, weniger Rückfälle (stabile Überführung
in die niedrig-replikative Phase), ist aber mit signifikant
mehr und mitunter auch schweren Nebenwirkungen verbunden. Das
Problem der sehr gut verträglichen Therapie mit Lamivudine
stellt die häufig auftretende Resistenzentwicklung (17%
nach einem, 40% nach zwei und 57% nach drei Jahren) dar, die
dann oftmals eine Umstellung auf das ebenfalls gut verträgliche,
aber teurere Adefovir erforderlich macht. Im Allgemeinen wird
daher heute bei Fehlen von Kontraindikationen die Gabe eines
pegylierten Interferons als Primärtherapie empfohlen. Bei
Nichtansprechen, Unverträglichkeit oder Vorliegen von Kontraindikationen
sollten Lamivudine oder Adefovir eingesetzt werden. Beide Substanzen
können auch bei Patienten mit CHB mit dekompensierter Leberzirrhose,
bei denen Interferon kontraindiziert sind, eingesetzt werden
[29, 30].
|
| Chronische
Hepatitis C Während
weltweit ca. 170 Millionen Menschen mit dem Hepatitis C-Virus
(HCV) infiziert sein dürften, wird die Zahl der Betroffenen
in Österreich auf ca. 60.000 - 80.000 geschätzt. Laut
WHO ist die chronische HCV-Infektion für 20% der weltweit
1,4 Millionen Todesfälle infolge chronischer Lebererkrankungen
pro Jahr verantwortlich zu machen. Die Übertragung von
HCV erfolgt hauptsächlich durch Blut
und Blutprodukte (Bluttransfusionen, kontaminierte Nadeln und
Spritzen, iatrogen, nosokomial, iv-Drogenabusus), die vertikale
Übertragung von Mutter auf Kind oder auch die sexuelle
Übertragung ist – im Gegensatz zum HBV – (sehr)
selten. Wenngleich die chronische Hepatitis C jahre- bis jahrzehntelang
symptomarm verläuft, geht man heute davon aus, dass ca.
5 - 20% nach 20 bis 25 Jahren eine Leberzirrhose entwickeln
und die chronische Hepatitis C somit eine der Hauptursachen
gastrointestinaler Blutungen, Leberversagen und HCC und den
Hauptgrund für eine Lebertransplantation in Europa und
USA darstellt. Diese Tatsache bedeutet nicht nur Leid für
die Betroffenen, sondern sie stellt auch eine enorme gesundheitsökonomische
Herausforderung dar. Erfreulicherweise konnten in den letzten
Jahren entscheidende Fortschritte in der Therapie der HCV-Infektion
erzielt werden, und es ist nun mittels aktueller antiviraler
Kombinationstherapie möglich, das HCV in hohem Maße
dauerhaft zu eliminieren und damit zu erwartende Komplikationen
der Lebererkrankung zu verhindern bzw. hintanzuhalten. Im Zuge
der deutlich verbesserten Ansprechraten (von < 10% bei Genotyp
1 mit Standardinterferon noch vor 10 Jahren auf knapp 60% mit
moderner Kombinationstherapie derzeit) wird die Indikation zu
Therapie heute leichter und bei einem breiteren Spektrum an
Patienten gestellt.
Der
initiale Schritt in der Diagnostik der chronischen HCV-Infektion
liegt im Nachweis von Antikörpern gegen HCV (anti-HCV)
mittels ELISA-Tests, gefolgt vom direkten Virusnachweis (HCV-RNA)
mittels PCR. Bei positivem anti-HCV und negativer HCV-RNA handelt
es sich entweder um einen Patienten mit spontan ausgeheilter
HCV-Infektion (tritt in ca. 20% aller HCV-Infektionen auf) oder
um eine chronische HCV-Infektion mit
intermittierend sehr geringer Viruslast unter der Nachweisgrenze
der verfügbaren qualitativen Tests. Aus diesem Grund sollte
der HCV-RNA-Test wiederholt werden. Wird die chronische HCV-Infektion
durch die HCV-RNA bestätigt, folgt als nächster Schritt
die Bestimmung des HCV-Genotyps, die einerseits die Entscheidungsgrundlage
für die Dosierung und Dauer der Therapie ist, andrerseits
eine Abschätzung des Therapieansprechens, d.h. der dauerhaften
Viruseliminierung erlaubt. Hepatitis C besteht aus zumindest
6 Genotypen. In Österreich treten hauptsächlich Genotyp
1 (60 - 70%), Genotyp 2 und GT 3 (v.a. bei i.v.-Drogenanamnese)
sowie GT 4 (v.a. Immigranten aus Ägypten) auf. Die Ansprechraten
sind bei GT 2 + 3 deutlich höher (> 80%) als bei GT
1 + 4 (50 - 60%). Der Stellenwert der Leberbiopsie im Management
der chronischen Hepatitis C ist in letzter Zeit zunehmend in
Diskussion geraten. Patienten, die mit den Genotypen 2 oder
3 infiziert sind, werden heute in der Regel, soferne keine Kontraindikationen
vorliegen, ohne Durchführung einer Leberbiopsie behandelt.
Die Liste der Kontraindikationen ist lange, in praxi sind bei
unseren Patienten aber aktuelle iv-Drogenabhängigkeit,
chronischer Alkoholismus, schwere psychiatrische Grunderkrankungen
sowie zu hohes Alter (> 65 - 70 Jahre aufgrund starker Nebenwirkungen)
die Hauptgründe. Patienten, die stabil in einem Substitutionsprogramm
sind, sollten allerdings keineswegs von der Therapie ausgeschlossen
werden. Erfahrungsgemäß zeigen diese Patienten sogar
eine sehr gute Compliance. Selbst bei Patienten mit Genotyp-1-Infektion
wird die Leberbiopsie heutzutage keineswegs immer durchgeführt.
Einen gewissen Stellenwert hat die Biopsie noch bei Patienten
mit konstant normalen Transaminasen, die zwar tendenziell mildere
histologische Veränderungen zeigen, bei denen durchaus
aber
auch bereits fortgeschrittene fibrotische Veränderungen
bis hin zur Zirrhose möglich sind. Generell ist festzuhalten,
dass eine Leberbiopsie ungeachtet der Höhe der Transaminasen
durchgeführt werden soll, wenn davon eine Therapieempfehlung
abhängig gemacht wird. Die Durchführung einer Leberbiopsie
ist jedoch keine Voraussetzung, um eine Therapie beginnen zu
können. Die Therapie der Wahl stellen seit einigen Jahren
pegylierte Interferone (Peginterferon-alfa-2a bzw. Peginterferon-alfa-2b)
plus Ribavirin dar [31].
|
Literatur:
| 1.
Masur H., Michelis M.A., Greene J.B., Onorato I., Stouwe
R.A., Holzman R.S., Wormser G., Brettman L., Lange M., Murray
H.W.,Cunningham-Rundles S.: „An outbreak of community-acquired
Pneumocystis crinii pneumonia: initial manifestation of
cellular dysfunction.“ N. Engl. J. Med. 305 (24) (1981)1431-8. |
| 2.
Report on the global AIDS epidemic, Executive Summary, published
by UNAIDS (2004). |
| 3.
Smith D.E., Walker B.D., Cooper D.A, Rosenberg E.S., Kaldor
J.M.: Is antiretroviral treatment of primary HIVinfection
clinically justified on the basis of current evidence?”
AIDS. 18 (2004) 709-718. |
| 4.
Epidemiologisches Bulletin des RKI, Nr. 47 (2004). |
| 5.
Barbar G., Scozzafava A., Mastrolorenzo A., Supuran C.T.:
„Highly active antiretroviral therapy; current state
of the art, new agents and their pharmacological interactions
useful for improving therapeutic outcome.“ Curr. Pharm.11(14)
(2005) 1805-43. |
| 6.
Knobel H., Escobar I., Polo R., Ortega L.,Martin-Conde M.T.,
Casado J.L., Codina C.,Fernadez J., Galindo M.J., Ibarra
O., Llinnas M., Miralles C., Riera M., Fumaz C.R.,Segador
A., Segua F., Chamorro L.: „Recomendaciones GESIDA/SEFH/PNS
para mejorara la adherencia al tratamiwento antiretroviral
en el ano 2004.“ Enferm. Infecc. Microbi-ol. Clin.
23(4) (2005) 221-31. |
| 7.
Klemola E., Kaarianinen L.: „Cytomegalovirus as a
possible cause of a disease resembling infectious mononucleosis.“
Br. Med. J. 2 (1965) 1099. |
| 8.
Klemola E., von Essen R., Wager O., et al.:„Cytomegalo
virus mononucleosis in previously healthy individuals: Five
new cases and follow-up of 13 previously published cases.“
Ann. Intern. Med. 71 (1969) 11. |
| 9.
Krech U.: „Complement-fixation antibodies against
cytomegalovirus in different parts of the world.“
Bull World Health Organ. 49(1973) 103. |
| 10.
Wright J.G.: „Severe thrombocytopenia secondary to
asymptomatic cytomegalovirus infection in an immunocompetent
host.“ J.Clin. Pathol. 45 (1992) 1037. |
| 11.
Klemola E.: „Hypersensitivity reactions to ampicillin
in cytomegalovirus mononucleosis.“ Scand. J. Infect.
Dis. 2 (1970) 29. |
| 12.
Szell M., Laferl H., Wenisch C., et al.: „CMV in the
immunocompetent host.“ Infection 33 Suppl. 1 (2005). |
| 13.
Hansen L.: „Influenza.“ Clin. Evid. 10 (2003)
867-74. |
| 14.
Jacobson V.J., Szilagyi P.: „Patient reminder and
patient recall systems to improve immunization rates.“
Cochrane Database Syst.Rev. 3 (2005) CD003941. |
| 15.
Horimoto T., Kawaoka Y.: „Influenza: lessons from
past pandemics, warnings from current incidents.“
Nat. Rev. Microbiol. 8 (2005)591-600. |
| 16.
Freedman D.O., Leder K.: „Influenza: changing approaches
to prevention and treatment intravelers.“ J. Travel
Med. 1 (2005) 36-44. |
| 17.
Kaiser L., Wat C., Mills T., Mahoney P.,Ward P., Hayden
F.: „Impact of oseltamivir treatment on influenza-related
lower respiratory tract complications and hospitalizations.“
Arch. Intern. Med. 163(14) (2003) 1667-72. |
18.
Risebrough N.A., Bowles S.K., SimorA.E., McGeer A., Oh
P.I.: „Economic evaluation of oseltamivir phosphate
for postexposure prophylaxis of influenza in long-term
care facilities.“ J. Am. Geriatr. Soc. 53 (2005)444-51. |
| 19.
Lim W.S., van der Eerden M.M., Laing R.,Boersma W.G., Karalus
N., Town G.I., Lewis S.A., Macfarlane J.T.: „Defining
community acquired pneumonia severity on presentation to
hospital: an international derivation and validation study.“
Thorax 58 (2003) 377-382. |
| 20.
Matthews L., Woolhouse M.: „New approaches to quantifying
the spread of infection.“ Nat. Rev. Microbiol. 3(7)
(2005) 529-36. |
| 21.
Laver G.: „Influenza drug could abort a pandemic.“
Nature. 434(7035) (2005) 821. |
| 22.
Schneider H.: „Über epidemische acute „meningitis
serosa.“ Wien. Klin. Wochenschr. 44 (1931) 350-352. |
| 23.
Dumpis U., Crook D., Oksi J.: „Tick-borne encephalitis.“
Clin. Infect. Dis. 28 (1999) 882-890. |
| 24.
Randolph S.E., Green R.M., Peacey M.F.,Rogers D.J.: „Seasonal
synchrony: the key to tick-borne encephalitis foci identified
by satellite data.“ Parasitology 121 (2000) 15-23. |
25.
Greskova M., Sekeyova M., Stulpalova S.,Necas S.: „Sheep
milk-borne epidemic of tick-borne
encephalitis in Slovakia.“ Intervirology 5 (1975)
57-61.
|
| 26.
Barrett P.N., Schober-Bendixen S., Ehrlich H.J.: „History
of TBE vaccines.“ Vaccine 21Supp1 (2003) 41-9. |
| 27.
Kunz C.: „TBE vaccination and the Austrian experience.“
Vaccine 21 Suppl 1 (2003)50-5. |
| 28.
Vir. Ep. Inf. Nr. 02/05-3. |
| 29.
Lai C.L., Ratziu V., Yuen M.F., Poynard T.:„Viral
hepatitis B.“ Lancet. 362 (9401) (2003) 2089-94. |
| 30.
Janssen H.L., van Zonneveld M., Senturk H., Zeuzem S., Akarca
U.S., Cakaloglu Y.,Simon C., So T.M., Gerken G., de Man
R.A., Niesters H.G., Zondervan P., Hansen B.,Schalm S.W.,
HBV 99-01 Study Group, Rotterdam Foundation for Liver Research:
„Pegylated interferon alfa-2b alone or in combination
with lamivudine for HBeAg-positive chronic hepatitis B:
a randomised trial.“ Lancet. 365(9454) (2005) 123-9. |
| 31.
Poynard T., Yuen M.F., Ratziu V., Lai C.L.:„Viral
hepatitis C.“ Lancet 362(9401) (2005)2095-100. |
Korrespondierender
Autor:
Prim. Univ.-Prof. Dr. Christoph Wenisch
4. Med. Abteilung mit Infektions- und Tropenmedizin,
SMZ-Süd, KFJ Spital
A-1100 Wien, Kundratstraße 3
E-Mail: christoph.wenisch@wienkav.at
|
|
|