Antimikrobielles
Wirkprofil der beiden neuen
polymerischen Guanidine Akacid und Akacid plus |
| C. Kratzer, A. Buxbaum,
S. Tobudic, W. Graninger, A. Georgopoulos*
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
* Korrespondierender Autor: Univ.-Prof. DDr. A. Georgopoulos |
|
Schlüsselwörter
Biozid, Akacid, Akacid
plus, MHK, Bakterizidie, Resistenzinduktion, Toxizität
|
|
Zusammenfassung
In
der vorliegenden Studie wurde die In vitro-Wirksamkeit
der beiden neuartigen polymerischen Guanidine, Akacid und sein
Nachfolger Akacid plus, im Vergleich zu Chlorhexidindiglukonat
gegenüber 369 klinischen Isolaten von Patienten mit dokumentierten
Infektionen in österreichischen Spitälern, deren akute
Toxizität und die Fähigkeit der Resistenzinduktion
von Akacid evaluiert. Die untersuchten Bakterien- und Pilzstämme
waren: Staphylococcus aureus (98), Staphylococcus
epidermidis (9), Enterococcus faecalis (32), Klebsiella
spp. (45), Enterobacter spp. (20), Escherichia
coli (65), Salmonella spp. (6), Shigella
spp. (2), Yersinia enterocolitica (1), Acinetobacter
spp. (4), Proteus spp.(7), Pseudomonas aeruginosa
(59), Stenotrophomonas maltophilia (4), Candida
spp. (10) und Aspergillus spp. (7). Die Empfindlichkeit
der Testsubstanzen wurde auch gegenüber Sporen von Bacillus
subtilis und Bacillus anthracis untersucht. Für
die Bestimmung der minimalen Hemmkonzentration (MHK) wurde die
Mikrodilutionsmethode nach CLSI (Clinical and Laboratory Standards
Institute) verwendet. Zusätzlich wurde die bakterizide
Wirksamkeit von Akacid plus nach einer Expositionszeit von 5
Minuten im Quantitativen Suspensionstest
Europäischer Standard EN 1040 gegenüber den Qualitätskontrollstämmen
von S. aureus, Enterococcus hirae, E.
coli und P. aeruginosa untersucht. In vitro-Resistenzselektion
gegenüber Akacid wurde an 24 verschiedenen Bakterienstämmen
durchgeführt. Alle drei Testsubstanzen zeigten höchste
antimikrobielle Wirksamkeit gegenüber Staphylococcus
und Bacillus spp. Höhere MHK-Werte wurden gegenüber
Enterokokken, Gram-negativen Bakterien und Pilzen gefunden.
MHK50 und MHK90
von Chlorhexidin zeigten einen 4-8-fachen Anstieg für die
Methicillin-resistenten S. aureus im Vergleich zu den
Methicillin-empfindlichen Stämmen, wohingegen kein Unterschied
in den MHK-Werten für Akacid und Akacid plus gegenüber
Antibiotikaempfindlichen und multiresistenten Stämmen gefunden
wurde. Bakterizide Wirkung von Akacid plus wurde gegenüber
allen getesteten Bakterienspezies bei einer Konzentration 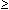 0,1% beobachtet. Im In vitro--Resistenzselektionstest
konnte kein Anstieg der MHK-Werte für Akacid in den getesteten
Isolaten nach 30 Passagen nachgewiesen werden. Darüber
hinaus zeigten Akacid und Akacid plus niedrige akute orale und
dermale Toxizität. Aufgrund ihrer breiten antimikrobiellen
Eigenschaften und ihres niedrigen Toxizitätsprofils könnten
die polymerischen Guanidine Akacid und Akacid plus zukünftig
wertvolle Substanzen für die Prophylaxe und Therapie von
bakteriellen Infektionen und Pilzinfektionen darstellen.
0,1% beobachtet. Im In vitro--Resistenzselektionstest
konnte kein Anstieg der MHK-Werte für Akacid in den getesteten
Isolaten nach 30 Passagen nachgewiesen werden. Darüber
hinaus zeigten Akacid und Akacid plus niedrige akute orale und
dermale Toxizität. Aufgrund ihrer breiten antimikrobiellen
Eigenschaften und ihres niedrigen Toxizitätsprofils könnten
die polymerischen Guanidine Akacid und Akacid plus zukünftig
wertvolle Substanzen für die Prophylaxe und Therapie von
bakteriellen Infektionen und Pilzinfektionen darstellen.
|
Key-words
Biocide,
Akacid, Akacid plus, MIC, bactericidal activity, induction of
resistance, toxicity |
|
Summary
This
paper evaluates the in vitro activity of the novel
polymeric guanidines, Akacid and its successor Akacid plus,
compared to the bisbiguanidechlorhexidine digluconate against
a total of 369 clinical isolates from patients with documented
infections in hospitals located in Austria, their acute toxicity
and the potential for induction of resistance of Akacid. The
tested bacterial and fungal strains were: Staphylococcus
aureus (98), Staphylococcus epidermidis (9), Enterococcus
faecalis (32), Klebsiella spp. (45), Enterobacter
spp. (20), Escherichia coli (65), Salmonella
spp. (6), Shigella spp. (2), Yersinia enterocolitica
(1), Acinetobacter spp. (4), Proteus spp.
(7), Pseudomonas aeruginosa (59), Stenotrophomonas
maltophilia (4), Candida spp. (10) and Aspergillus
spp. (7). The susceptibility of the active substances was also
investigated against spores of Bacillus subtilis and
Bacillus anthracis. Determination of minimal inhibitory
concentrations (MICs) was performed using the microdilution
method according to the CLSI criteria (Clinical and Laboratory
Standards Institute). Additionally, the bactericidal activity
of Akacid plus was investigated after exposure for 5 minutes
against quality control strains of S. aureus, Enterococcus
hirae, E. coli and P. aeruginosa using
the quantitative suspension test European Standard EN 1040.
In vitro selection of resistance to Akacid was carried
out on 24 different bacterial strains. All three active substances
were most effective against Staphylococcus spp. and
Bacillus spp. Higher MIC values were detected against
E. faecalis, gram-negative bacteria and fungi. MIC50
and MIC90 of chlorhexidine showed a 4-
to 8-fold increase for methicillin-resistant S.aureus
in comparison to methicillin-sensitive strains, while MIC values
for Akacid and Akacid plus were similar for both antibiotic-sensitive
and multi-resistant strains. Bactericidal action of Akacid plus
was observed against all tested bacterial species at concentrations
of 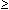 0.1%.
In the in vitro selection of resistance test no increase
in MIC values of Akacid in any isolate after 30 passages was
detected. Also, Akacid and Akacid plus showed low acute oral
and dermal toxicity. Due to their broad antimicrobial properties
and low toxicity profile, the polymeric guanidines Akacid and
Akacid plus could represent valuable substances for the prophylaxis
and treatment of bacterial and fungal infections in the future. 0.1%.
In the in vitro selection of resistance test no increase
in MIC values of Akacid in any isolate after 30 passages was
detected. Also, Akacid and Akacid plus showed low acute oral
and dermal toxicity. Due to their broad antimicrobial properties
and low toxicity profile, the polymeric guanidines Akacid and
Akacid plus could represent valuable substances for the prophylaxis
and treatment of bacterial and fungal infections in the future.
|
Einleitung
Die
polymerischen Guanidine Akacid und sein Nachfolger Akacid plus
sind neue Mitglieder der kationischen Familie antimikrobiell
wirksamer Substanzen. Sie wurden von der österreichischen
Firma POC mit Hauptsitz in Wien entwickelt und sind in der Europäischen
Union registriert.
Die Gruppe der kationischen Antiseptika umfasst chemisch sehr
unterschiedliche Substanzen, die aber als gemeinsames Charakteristikum
stark basische Gruppen, gebunden an ein ziemlich massives lipophiles
Molekül, besitzen. Die wichtigsten Vertreter sind unter
den Quarternären Ammoniumverbindungen Benzalkoniumchlorid
und Cetrimid, unter den Bisbiguaniden Chlorhexidin und Alexidin
und unter den polymerischen Biguaniden Polyhexamethylen-Biguanid
(PHMB). Die kationisch antimikrobiell wirksamen Substanzen werden
seit einem Jahrhundert zur Antisepsis und Desinfektion innerhalb
und außerhalb von klinischen Einrichtungen eingesetzt
[1-4]. Crawford et al. berechneten jährliche Nettogewinne
von durchschnittlich 275 Millionen bis 1,97 Billonen US Dollar
durch die Verwendung von Chlorhexidindigluconat im Verbandsmaterial
zur Prävention von Katheter-assoziierten Infektionen [5].
Aufgrund ihrer eigenen positiv geladenen Moleküle haben
die kationisch antimikrobiell wirksamen Substanzen eine hohe
Bindungsaffinität an die negativ geladenen Zellwände
und Membranen von Bakterien. Durch Störung dieser Angriffspunkte
kommt es zunächst zur Herabsetzung der Membranfluidität
und zu einer Störung der osmoregulatorischen und physiologischen
Zellfunktionen. In weiterer Folge entstehen hydrophile Poren
in der Phospholipidmembran, und die Proteinfunktion wird gestört.
Das Endresultat ist eine Lyse der Zielzelle [6]. Dieser Membran-schädigende
Wirkmechanismus konnte auch für die polymerischen Guanidine
gegenüber Escherichia coli demonstriert werden
[7].
Akacid, Poly-[2-(2-ethoxy)-ethoxyethyl-guanidinium-chloride],
und sein Nachfolger Akacid plus, eine 3:1-Mischung aus Poly-(hexamethylen-guanidinium-chloride)
und Poly-[2-(2-ethoxy)-ethoxyethyl)-guanidinium-chloride], zeigen
hohe Wasserlöslichkeit. Die beiden Substanzen wurden speziell
entwickelt, um die antimikrobielle Wirksamkeit dieser Klasse
zu verbessern und mit signifikant geringer Toxizität zu
kombinieren.
Ziel
dieser Studie war es, die In vitro-Aktivität von
Akacid und Akacid plus im Vergleich zu dem weit verbreiteten
Chlorhexidin gegenüber 369 verschiedenen klinischen Isolaten
von Patienten mit dokumentierten Infektionen in österreichischen
Spitälern, deren Toxizität und die Fähigkeit
der Resistenzinduktion von Akacid zu evaluieren. Zusätzlich
wurde die bakterizide Wirksamkeit von Akacid plus nach einer
Expositionszeit von fünf Minuten im Quantitativen Suspensionstest
gegenüber den Qualitätskontrollstämmen von S.
aureus, Enterococcus hirae, E. coli und
P. aeruginosa untersucht.
|
| Material
und Methoden Stocklösungen
von Akacid und Akacid plus (POC, Austria) als 25%ige wässrige
Lösungen und Chlorhexidindiglukonat (Sigma, Germany) als
20%ige Lösung wurden in destilliertem Wasser, Müller-Hinton-Bouillon
bzw. RPMI 1640-Medium zu den gewünschten Konzentrationen
verdünnt. Es wurden 369 klinische Isolate von Patienten
mit dokumentierten Infektionen in österreichischen Spitälern
getestet. Die Verteilung der Spezies und die Anzahl der Stämme
war wie folgt: Methicillin-empfindliche S. aureus (MSSA)
(36 Stämme), Methicillin-resistente S. aureus
(MRSA) (62 Stämme), Methicillin-resistente S. epidermidis
(MRSE) (9 Stämme); Vancomycin-empfindliche Enterococcus
faecalis (27 Stämme); Vancomycin-resistente E.
faecalis (VRE) (5 Stämme); Klebsiella spp.
(45 Stämme); Escherichia coli (65 Stämme),
Salmonella spp. (6 Stämme), Shigella
spp. (2 Stämme); Yersinia enterocolitica (1 Stamm);
Acinetobacter spp. (4 Stämme); Proteus
spp. (7 Stämme); Pseudomonas aeruginosa (59 Stämme);
Stenotrophomonas maltophilia (4 Stämme); Candida
spp. (10 Stämme); Aspergillus spp. (7 Stämme).
Zusätzlich wurden auch Bacillus subtilis (Sporensuspension
für den Hemmstofftest, Merck) und Bacillus anthracis
CH10 (Anthrax Sporen Merck reg.no. G112/WET/ACT 36/47) getestet.
Für die Bestimmung der minimalen Hemmkonzentration (MHK)
gegenüber Bakterien, Spross- und Schimmelpilzen wurden
die Mikrodilutionsmethoden nach CLSI (Clinicaland Laboratory
Standards Institute, früher NCCLS) verwendet [8, 9, 10].
Die Testmedien waren Kationen-angereicherte Müller-Hinton-Bouillon
für Bakterien und 3-(N-Morpholino) Propansulfonsäure-gepuffertes
2-fachkonzentriertes RPMI 1640-Medium mit Glutamin und 2% Glukose
für Pilze. Es wurde ein Testinokulum von 5x10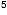 Kolonie-bildenden Einheiten (KBE)/ml für Bakterien, ein
Inokulum von 0,5 - 2,5 x 10
Kolonie-bildenden Einheiten (KBE)/ml für Bakterien, ein
Inokulum von 0,5 - 2,5 x 10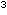 Blastosporen/ml für Sprosspilze und ein Inokulum von 1
- 5 x 10
Blastosporen/ml für Sprosspilze und ein Inokulum von 1
- 5 x 10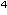 Konidien/ml
für Schimmelpilze verwendet. Mikrodilutionsplatten wurden
bei 35°C für 24 Stunden (für Bakterien) bzw. für
48 Stunden (für Pilze) inkubiert. Die niedrigste Biozidkonzentration,
bei der kein mikrobielles Wachstum sichtbar war, wurde als MHK
definiert. Konidien/ml
für Schimmelpilze verwendet. Mikrodilutionsplatten wurden
bei 35°C für 24 Stunden (für Bakterien) bzw. für
48 Stunden (für Pilze) inkubiert. Die niedrigste Biozidkonzentration,
bei der kein mikrobielles Wachstum sichtbar war, wurde als MHK
definiert.
Killing-Kurven von Akacid für S.aureus ATCC 29213
und E. coli ATCC 35218 (Inokulum 10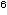 KBE/ml) wurden erstellt. Konzentrationen von 0,5x, 1x, 2x und
4x MHK wurden im Vergleich einer Biozid-freien Kontrolle getestet
und die Lebendkeimzahl wurde zum Zeitpunkt 0, nach 5 min, 30
min, 2 h, 6 h und 24 h ermittelt. Drei unabhängige Experimente
wurden pro Stamm durchgeführt.
KBE/ml) wurden erstellt. Konzentrationen von 0,5x, 1x, 2x und
4x MHK wurden im Vergleich einer Biozid-freien Kontrolle getestet
und die Lebendkeimzahl wurde zum Zeitpunkt 0, nach 5 min, 30
min, 2 h, 6 h und 24 h ermittelt. Drei unabhängige Experimente
wurden pro Stamm durchgeführt.
Die
bakterizide Wirksamkeit von 0,01, 0,1, 0,25 und 0,5% Akacid
plus wurde im Quantitativen Suspensionstest Europäischer
Standard EN 1040 [11] gegenüber S. aureus ATCC
6538, E. hirae ATCC 10541, E. coli ATCC 10536
und P. aeruginosa ATCC 15442 bestimmt. Zu 1 ml destilliertem
Wasser und 1 ml Keimsuspension (1,5 - 5 x 10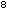 KBE/ml) wurden 8 ml Testsubstanz hinzugefügt. Nach einer
Einwirkzeit von 5 Minuten bei 20°C wurde 1 ml Testlösung
zu 8 ml Neutralisierungslösung (Natriumtryptonlösung
ergänzt mit 3% Saponin, 3% Polysorbat 80, 0,1% Histidin
und 0,1% Cystein) und 1 ml destilliertem Wasser übertragen.
Nach weiteren 5 Minuten wurde 1 ml der neutralisierten Mischung
in leere Petrischalen pipettiert und von 15 ml geschmolzenen
Tryptone-Soja-Agar (TSA), ergänzt mit Neutralizern, wie
beschrieben bei Kampf et al. [12], bedeckt. Die TSA-Platten
wurden für 48 Stunden bei 37°C inkubiert. Eine Reduktion
der Lebendkeimzahl >10
KBE/ml) wurden 8 ml Testsubstanz hinzugefügt. Nach einer
Einwirkzeit von 5 Minuten bei 20°C wurde 1 ml Testlösung
zu 8 ml Neutralisierungslösung (Natriumtryptonlösung
ergänzt mit 3% Saponin, 3% Polysorbat 80, 0,1% Histidin
und 0,1% Cystein) und 1 ml destilliertem Wasser übertragen.
Nach weiteren 5 Minuten wurde 1 ml der neutralisierten Mischung
in leere Petrischalen pipettiert und von 15 ml geschmolzenen
Tryptone-Soja-Agar (TSA), ergänzt mit Neutralizern, wie
beschrieben bei Kampf et al. [12], bedeckt. Die TSA-Platten
wurden für 48 Stunden bei 37°C inkubiert. Eine Reduktion
der Lebendkeimzahl >10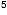 KBE/ml wurde als bakterizide Wirksamkeit bezeichnet.
KBE/ml wurde als bakterizide Wirksamkeit bezeichnet.
In
vitro-Resistenzselektion von Akacid wurde für 24 Stämme
durchgeführt: MSSA (1 Stamm), MRSA (2 Stämme), MRSE
(4 Stämme), VRE (5 Stämme), Klebsiella spp.
(2 Stämme), E. coli (3 empfindliche und 2 ESBL-positive
Stämme), P. aeruginosa (2 empfindliche und 2 ESBL-positive
Stämme) und Acinetobacter (2 Stämme). Die
In vitro-Resistenzselektionsmethode nach Markopoulos
et al. [13] wurde für die Experimente verwendet. 30 Passagen
von jedem Testisolat wurden 2-mal durchgeführt. Falls unterschiedliche
Ergebnisse gefunden wurden, wurde nur der höhere MHK-Wert
als Resultat akzeptiert.
Die
Toxizitätsstudien wurden an der Toxikologie der ARC Seibersdorf
research GmbH (Seibersdorf, Österreich) durchgeführt.
Die akute Toxizität nach einer einzigen peroralen Verabreichung
an Ratten wurde nach der EU-Methode B.1 tris Akute orale Toxizitätsstudie
an Ratten – Acutetoxic class method [14] ermittelt. Die
Experimente wurden mit einer Dosierung von 200 mg/kg Körpergewicht
an 3 Tieren eines Geschlechts gestartet. Aufgrund der Beobachtungen
dieser Untersuchungen wurde die 2. Dosis auf 2000 mg Wirkstoff/kg
Körpergewicht angehoben. Alle Tiere wurden 2 Wochen lang
beobachtet.
Die akuten toxischen Effekte von Akacid und Akacid plus nach
einer einmaligen dermalen Applikation wurden anhand der EU-Methode
B.3 Akute dermale Toxizität [15] untersucht. Akacid und
Akacid plus in einer Dosierung von 2000 mg/kg Körpergewicht
wurden 1x für eine Dauer von 24 Stunden auf ein 5 x 6 cm
großes Areal in der dorsalen Thorakalregion von 5 männlichen
und 5 weiblichen Ratten verabreicht. Die Tiere wurden abermals
für 14 Tage beobachtet.
Um eine mögliche Irritation oder Korrosion von Akacid und
Akacid plus nach einer einmaligen Applikation auf die intakte
Haut von Kaninchen nachzuweisen, wurde die EU-Methode B.4 Akute
Toxizität: Dermale Irritation/Korrosion [16] durchgeführt.
1,5 g der unverdünnten Testsubstanz (25% wässrige
Lösung) wurden für 4 Stunden mit der intakten Haut
von 3 weiblichen Neuseeland-White-Kaninchen in Kontakt gebracht.
Die Haut der Tiere wurde nach 1, 24, 48 und 72 Stunden auf Erythem/Schorf
und Ödem sowie auf andere lokale Veränderungen untersucht.
|
| Ergebnisse
Die
Resultate der MHK-Testung von Akacid, Akacid plus und Chlorhexidin
gegenüber klinisch relevanten Bakterien- und Pilzstämmen
sind in den Tabellen 1 - 3 dargestellt. Akacid und Akacid plus
zeigten hohe antimikrobielle Wirksamkeit gegenüber Staphylokokken
(Tabelle 1) mit MHK-Werten von 0,5 - 8 und
0,06 - 0,5 mg/l, unabhängig von der Empfindlichkeit der
Stämme gegenüber Methicillin. MHK50
und MHK90 von Chlorhexidin wiesen einen
4-8-fachen Anstieg für MRSA im Vergleich zu Methicillin-empfindlichen
Stämmen auf. Alle drei kationisch antimikrobiell wirksamen
Substanzen erreichten höhere MHK-Werte gegenüber E.
faecalis (2-64 mg/l), kein Unterschied wurde jedoch für
Vancomycin-empfindliche Enterokokken und VRE gefunden. Niedrige
MHK-Werte waren ebenso ausreichend, um das Auskeimen der Sporen
von B. subtilis und B. anthracis zu hemmen.
Akacid, Akacid plus und Chlorhexidin zeigten geringere Empfindlichkeit
für Gram-negative Bakterien und Pilze. MHK-Werte gegenüber
Enterobakterien (Tabelle 2) einschließlich
Salmonella spp., Shigella spp. und Y.
enterocolitica lagen im Bereich von 8-32 mg/l für
Akacid, 1-8 mg/l für Akacid plus und 2-32 mg/l für
Chlorhexidin. Die Testsubstanzen zeigten ähnliche Empfindlichkeit
gegenüber Acinetobacter spp., während höhere
MHK-Werte gegenüber P. aeruginosa, S. maltophilia
und Proteus spp. gefunden wurden. Akacid plus erzielte
die höchste antifungale Wirksamkeit gegenüber Pilzstämmen
von Candida und Aspergillus spp., gefolgt
von Chlorhexidin und Akacid (Tabelle 3).
Alle Testsubstanzen erreichten die niedrigsten MHK-Werte gegenüber
Candida tropicalis, gefolgt von Aspergillus niger.
Tabelle
1: In vitro-Aktivität von kationisch
antimikrobiell wirksamen Substanzen gegenüber Gram-positiven
Bakterien (139 Stämme) und Sporen von Bacillus
spp. (2 Stämme)
| Pathogen
(n) |
Biozid
|
MHK
(mg/l)
|
Bereich
|
MHK50 |
MHK90 |
| MSSA
(36) |
Akacid |
Akacid
plus |
Chlorhexidin
|
|
|
|
|
| MRSA
(62) |
Akacid |
Akacid
plus |
Chlorhexidin
|
|
|
|
|
| MRSE
(9) |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| E.
faecalis (27) |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| VRE
(5) |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| Bacillus
spp. (2) |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
Tabelle
2: In vitro-Aktivität von kationisch
antimikrobiell wirksamen Substanzen gegenüber Enterobacteriaceae
(146 Stämme)
| Pathogen
(n) |
Biozid
|
MHK
(mg/l)
|
Bereich
|
MHK50 |
MHK90 |
| E.
coli (65) |
Akacid |
Akacid
plus |
Chlorhexidin
|
|
|
|
|
| Klebsiella
spp. (45) a |
Akacid |
Akacid
plus |
Chlorhexidin
|
|
|
|
|
| Enterobacter
spp. (20) b |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| Salmonella
spp. (6) c |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| Shigella
spp. (2) d |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| Y.
enterocolitica (1) |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| Proteus
spp. (7) e |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| a
K.
pneumoniae, K. oxytoca |
c
S.
enteritidis, S. typhimurium |
e
P. mirabilis, P. vulgaris |
| b
E.
aerogenes, E. cloacae |
d
S.
sonnei, S. flexneri |
|
|
Tabelle
3: In vitro-Aktivität von kationisch
antimikrobiell wirksamen Substanzen gegenüber Non-Fermentern
(67 Stämme) und Pilzen (17 Stämme)
| Pathogen
(n) |
Biozid
|
MHK
(mg/l)
|
Bereich
|
MHK50 |
MHK90 |
| P.
aeruginosa (59) |
Akacid |
Akacid
plus |
Chlorhexidin
|
|
|
|
|
| Acinetobacter
spp. (4) a |
Akacid |
Akacid
plus |
Chlorhexidin
|
|
|
|
|
| S.
maltophilia (4) |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| Candida
spp. (10) b |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
| Aspergillus
spp. (7) c |
Akacid |
Akacid
plus |
Chlorhexidin |
|
|
|
|
a
A.
baumannii, A. iwoffi
b
C.
albicans, C. glabrata, C. krusei, C. tropicalis
c
A.
niger, A. flavus, A. fumigatus |
|
|
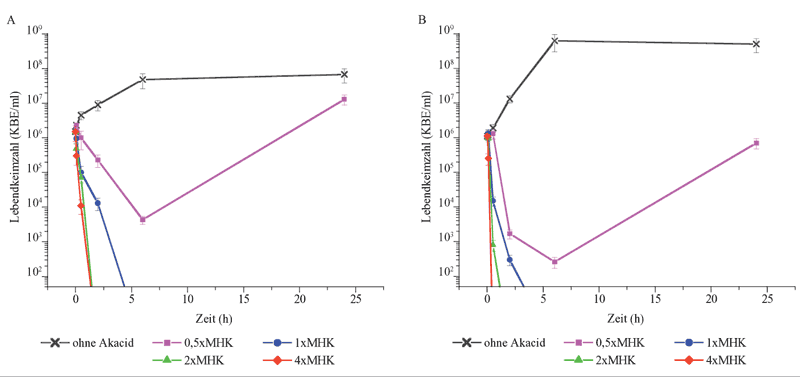
Killing-Kurven für S. aureus ATCC29213 und E.
coli ATCC 35218 sind in Abbildung 1
dargestellt (unteres Detektionslimit 5 x 10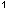 KBE/ml). Akacid in einer Konzentration
KBE/ml). Akacid in einer Konzentration 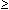 2 x MHK und 1 x MHK eradizierte S. aureus und E.
coli innerhalb von 2 bzw. 6 Stunden.
2 x MHK und 1 x MHK eradizierte S. aureus und E.
coli innerhalb von 2 bzw. 6 Stunden.
Abbildung
1: Killing-Kurve für Akacid gegenüber
S. aureus ATCC 29213 (MHK, 4 mg/l) und E.
coli ATCC 35218 (MHK, 16 mg/l). Die durchschnittliche
Lebendkeimzahl (KBE/ml) von S. aureus (A) und
E. coli (B) wurde in Gegenwart von Akacid bei
0,5x, 1x, 2x und 4x MHK nach 5 min, 30 min, 2 h, 6 h und
24 h im Vergleich zu einer Biozid-freien Wachstumskontrolle
evaluiert. Dargestellte Werte repräsentieren das
arithmetische Mittel ±1 Standardabweichung von
3 unabhängigen Experimenten.
|
Wie
in Tabelle 4 gezeigt wird, erreichte 0,1%
Akacid plus im Quantitativen Suspensionstest bakterizide Wirksamkeit
(Reduktionsfaktor > 10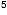 KBE/ml) gegenüber Qualitätskontrollstämmen von
S. aureus, E. hirae, E. coli und
P. aeruginosa nach fünf Minuten Expositionszeit.
KBE/ml) gegenüber Qualitätskontrollstämmen von
S. aureus, E. hirae, E. coli und
P. aeruginosa nach fünf Minuten Expositionszeit.
Der In vitro-Resistenzselektionstest von Akacid wurde
nicht nur für empfindliche ATCC-Stämme, sondern auch
für multi-resistente klinische Gram-positive und Gram-negative
Stämme durchgeführt. Es wurde kein Anstieg der MHK-Werte
in den getesteten Isolaten nach 30 Passagen gefunden (Tabelle
5).
Die
mediane lethale Dosis (LD50) von Akacid
und Akacid plus im Anschluss an eine einmalige perorale oder
dermale Applikation in Ratten war > 2000 mg Wirksubstanz/kg
Körpergewicht (siehe Tabelle 6). Nach
einer einzigen Verabreichung der beiden polymerischen Guanidine
auf die intakte Haut von Kaninchen wurden keine allgemeinen
sowie lokalen toxischen Effekte an den exponierten Hautstellen
beobachtet.
Tabelle
4: Ergebnisse des Quantitativen Suspensionstests
EN 1040 von Akacid plus gegenüber S. aureus,
E. hirae, E. coli und P. aeruginosa nach
5 Minuten Expositionszeit
| Pathogen |
Inokulum
N |
|
Konzentration
von Akacid plus in %
|
0,5 |
0,25 |
0,1 |
0,01 |
| S.
aureus |
4,1x10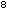 |
R |
>2,7x10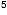 |
>2,7x10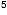 |
>2,7x10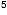 |
<1,4x10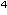 |
| E.
hirae |
3,5x10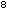 |
R |
>2,3
x 10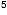 |
>2,3x10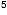 |
>2,3x10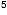 |
2,3x10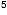 |
| E.
coli |
2,5x10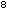 |
R |
>1,7x10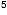 |
>1,7x10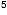 |
>1,7x10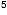 |
3,5x10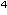 |
| P.
aeruginosa |
2,1x10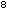 |
R |
>1,4x10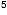 |
>1,4x10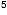 |
>1,4x10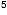 |
>1,4x10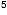 |
N:
Lebendkeimzahl in der Inokulumsuspension (KBE/ml)
R:
Reduktion der Lebendkeimzahl (KBE/ml)igatus |
|
Tabelle
5: In vitro-Resistenzselektion von unterschiedlichen
Bakterienstämmen gegenüber Akacid (MHK-Werte
sind in mg/l angegeben)
| Pathogen
(n) |
0.
Passage |
10.
Passage |
20.
Passage |
30.
Passage |
MSSA
(1) |
MRSA
(2) |
MRSE
(2) |
| MRSE
(2) |
|
|
|
|
|
|
|
|
|
|
K.
pneumoniae (1) |
K.
oxytoca (1) |
|
|
|
|
|
E.
coli (1) |
E.
coli (1) |
E.
coli, ESBL-positiv (2) |
|
|
|
|
|
P.
aeruginosa, ESBL-positiv (2) |
P.
aeruginosa (1) |
P.
aeruginosa (1) |
|
|
|
|
|
|
|
|
|
|
Tabelle
6: Ergebnisse der akuten oralen und dermalen
Toxizitätsstudie von Akacid und Akacid plus an Ratten
| Wirkstoff |
Applikations-
form |
Dosis
(mg/kg) |
Geschlecht
|
Anzahl
der Tiere
|
LD50
a
(mg/kg) |
exponiert |
verstorben |
| Akacid |
|
|
|
|
|
|
|
|
|
|
|
|
| Akacid
plus |
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
| Diskussion
In
Spitals- und Gesundheitseinrichtungen stellen Antiseptika und
Desinfektionsmittel ein wesentliches Werkzeug zur Infektionskontrolle
und eine bedeutende Hilfe in der Prävention von nosokomialen
Infektionen dar [17]. Aufgrund ihres raschen Wirkungseintritts
können Desinfektionsmittel die Ausbreitung von pathogenen
Keimen verhindern [18].
Die vorliegende Studie demonstriert das breite antimikrobielle
Wirkprofil der neuartigen Biozide Akacid und Akacid plus im
Vergleich zu Chlorhexidindiglukonat. Die kationisch antimikrobiell
wirksamen Substanzen zeigten höhere Empfindlichkeit gegenüber
Staphylokokken und Bacillus spp. als gegenüber
E. faecalis, Gram-negativen Bakterien und Pilzen. Im
Allgemeinen sind Enterokokken weniger empfindlich gegenüber
Bioziden als die Staphylokokken, obwohl Unterschiede in den
inhibitorischen und bakteriziden Konzentrationen unter den einzelnen
Enterokokkenspezies gefunden werden [19]. Frühere Studien
von Cookson et al. [20], Irizarry et al. [21] und Suller et
al. [22] enthüllten, dass MRSA-Stämme eine geringere
Empfindlichkeit gegenüber Chlorhexidin, Triclosan und quaternären
Ammoniumverbindungen aufweisen. Kürzlich entdeckten Schmidt
et al. [23] die herabgesetzte Empfindlichkeit von Triclosan
speziell gegenüber MRSE. In unserer Studie wurde ein 4-8-facher
Anstieg der MHK50 und MHK90
von Chlorhexidin für MRSA im Vergleich zu Methicillin-empfindlichen
Stämmen gefunden, während die MHK-Werte für Akacid
und Akacid plus unverändert blieben. Im Gegensatz dazu,
erreichten alle drei Testsubstanzen äquivalente MHK-Werte
für Vancomycin-empfindliche E. faecalis und VRE.
Zusätzlich wurde die antifungale Aktivität gegenüber
17 Pilzstämmen untersucht. Akacid plus erreichte eindeutig
die niedrigsten MHK-Werte gegenüber den getesteten Spross-
und Schimmelpilz-Spezies. Alle Testsubstanzen zeigten höchste
Wirksamkeit gegenüber C. tropicalis gefolgt von
A. niger. Im Quantitativen Suspensionstest ohne organische
Belastung erzielte 0,1% Akacid plus innerhalb von fünf
Minuten bakterizide Wirksamkeit gegenüber allen getesteten
Bakterienspezies.
Der
zunehmende Einsatz von Bioziden hat zur Besorgnis über
eine mögliche Resistenzentwicklung auch bei Bioziden geführt.
Zahlreiche Studien haben bereits über einen Zusammenhang
zwischen Biozid- und Antibiotikaresistenz berichtet. Block et
al. [24] konnten eine Assoziation zwischen der Intensität
des Chlorhexidinverbrauchs und einer herabgesetzten Empfindlichkeit
gegenüber Mikroorganismen im Spital herstellen. Ebenso
haben Lambert et al. [25] eine Korrelation zwischen der Resistenz
zu Antibiotika und zu den Bioziden Benzalkoniumchlorid und Chlorhexidin
in klinischen Stämmen von P. aeruginosa gefunden.
Im Gegensatz dazu konnten wir keine bakterielle Resistenz zu
Akacid induzieren. Der Kontakt subinhibitorischer Konzentrationen
von Akacid resultierte auch nach 30 Passagen in keiner reduzierten
Empfindlichkeit gegenüber Staphylococcus spp.,
E. faecalis, Klebsiella spp., E. coli,
P. aeruginosa und Acinetobacter spp.
Bis
jetzt gilt es als akzeptierte Tatsache, dass hohe antimikrobielle
Aktivität von Bioziden auch mit hoher Toxizität einhergeht.
Die toxikologischen Studien von Akacid und Akacid plus an Ratten
und Kaninchen haben eine niedrige akute orale und dermale Toxizität
gezeigt (LD50 > 2000 mg/kg Körpergewicht).
Aufgrund
ihrer breiten antimikrobiellen Eigenschaften und ihres niedrigen
Toxizitätsprofils könnten die polymerischen Guanidine
Akacid und Akacid plus zukünftig wertvolle Substanzen für
die Prophylaxe und Therapie von bakteriellen Infektionen und
Pilzinfektionen darstellen.
|
Literatur:
| 1.
Holah J.T., Taylor J.H., Dawson D.J., Hall K.E.: “Biocide
use in the food industry and the disinfectant resistance
of persistant strains of Listeria monocytogenes
and Escherichia coli.” Symp. Ser. Soc. Appl.
Microbiol. 31 (2002) 111-120. |
| 2.
Kusnetsov J.M., Tulkki A.I., Ahonen H.E., Martikainen P.J.:
“Efficacy of three prevention strategies against legionella
in cooling water systems.” J. Appl. Microbiol. 82
(1997) 763-768. |
| 3.
Hibbard J.S.: “Administration of 2% chlorhexidine
gluconate in 70% isopropyl alcohol is effective in 30 seconds.”
Infect.Control Hosp. Epidemiol. 23 (2002) 233-234. |
| 4.
Gerli S., Rossetti D., Di Renzo G.C.: “A new approach
for the treatment of bacterial vaginosis: use of polyhexamethylene
biguanide. A prospective, randomized study.” Eur.Rev.
Med. Pharmacol. Sci. 7 (2003) 127-130. |
| 5.
Crawford A.G., Fuhr J.P., Bhaskar R.:“Cost-benefit
analysis of chlorhexidine gluconate dressing in the prevention
of catheter-related bloodstream infections.” Infect.Control
Hosp. Epidemiol. 25 (2004) 668-674. |
| 6.
Gilbert P., Moore L.E.: “Cationic antiseptics: diversity
of action under a common epithet.” J. Appl. Microbiol.
99 (2005) 703-715. |
| 7.
Kerschner H.: „Wirkmechanismus von Akacid Forte gegenüber
E. coli.“ Dissertation, Medizinische Universität
Wien (2004). |
| 8.
National Committee for Clinical Laboratory Standards: “Methods
for Dilution Antimicrobial Susceptibility Tests for Bacteria
that Grow Aerobically – 6th Edition: Approved Standard
M7-A6.” NCCLS, Wayne,Pa, USA (2003). |
9.
National Committee for Clinical Laboratory Standards:
“Reference Method for Broth Dilution Antifungal
Susceptibility Testing of Yeasts: Approved Standard Second
Edition: NCCLS document M27-A2.” NCCLS, Wayne, Pa,
USA (2002). |
| 10.
National Committee for Clinical Laboratory Standards: “Reference
Method for Broth Dilution Antifungal Susceptibility Testing
of Conidium-forming Filamentous Fungi. Proposed Standard
M38-A.”NCCLS, Wayne, Pa, USA (2002). |
| 11.
European Committee for Standardization: “European
Standard EN 1040: Chemical disinfectants and antiseptics
– Basic bactericidal activity – Test method
and requirements (phase 1).” CEN, Brussels(1997). |
| 12.
Kampf G., Höfer M., Henning R.: “Neutralization
of chlorhexidine for in vitro testing of disinfectants.”
Zent. Bl. Hyg.Umweltmed. 200 (1998) 457-464. |
| 13.
Markopoulos E., Graninger W., Georgopoulos A.: “In
vitro selection of resistance to vancomycin and teicoplanin
in Enterococcus faecium and Enterococcus faecalis
compared with Staphylococcus epidermidis.”
J. Antimicrob. Chemother. 41 (1998)43-47. |
| 14.
European Commission: “EU Method B.1 tris Acute Oral
Toxicity - Acute toxic class method.” Dir. 2004/73/EC;
O.J. L 152(2004). |
| 15.
European Commission: “EU Method B.3 Acute Dermal Toxicity.”
Dir.92/69/EEC; O.J. L383 A (1992). |
| 16.
European Commission: “EU Method B.4 Acute Toxicity:
dermal irritation/corrosion.” Dir. 2004/73/EC; O.J.
L 152 (2004). |
| 17.
Dettenkofer M., Block C.: “Hospital disinfection:
efficacy and safety issues.”Curr. Opin. Infect. Dis.
18 (2005) 320-325. |
| 18.
Cozard A., Jones R.D.: “Disinfection and the prevention
of infectious disease.”Am. J. Infect. Control 31 (2003)
243-254. |
| 19.
McDonnell G., Russell A.D.: “Antiseptics and disinfectants:
activity, action, and resistance.” Clin. Microbiol.
Reviews 12(1999) 147-179. |
| 20.
Cookson B.D., Bolton M.C., Platt J.H.:“Chlorhexidine
resistance in methicillin-resistant Staphylococcus aureus
or just and elevated MIC? An in vitro and in vivo
assessment.” Antimicrob. Agents Chemother. 35 (1991)
1997-2002. |
| 21.
Irizarry L., Merlin T., Rupp J., Griffith J.: “Reduced
susceptibility of methicillin-resistant Staphylococcus
aureus to cetylpyridinium chloride and chlorhexidine.”
Chemother. 42 (1996) 248-52. |
| 22.
Suller M.T., Russell A.D.: “Antibiotic and biocide
resistance in methicillin-resistant Staphylococcus aureus
and vancomycin-resistant Enterococcus.” J.
Hosp. Infect. 43 (1999) 281-91. |
| 23.
Schmid M.B., Kaplan N.: “Reduced triclosan susceptibility
in methicillin-resistant Staphylococcus epidermidis.”
Antimicrob. Agents Chemother. 48 (2004) 1397-1399. |
| 24.
Block C., Furman M.: “Association between intensity
of chlorhexidine use and microorganisms of reduced susceptibility
in a hospital environment.” J. Hosp. Infect.51 (2002)
201-206. |
| 25.
Lambert R.J., Joyson J., Forbes B.: “The relationships
and susceptibilities of some industrial, laboratory and
clinical isolates of Pseudomonas aeruginosa to
some antibiotics and biocides.” J. Appl. Microbiol.
91(2001) 972-984. |
Korrespondierender
Autor:
Univ.-Prof. DDr. Apostolos Georgopoulos
Univ.-Klinik für Innere Medizin I, Klin. Abt.für Infektionen
und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: apostolos.georgopoulos@meduniwien.ac.at
|
|
|