In
vitro-Wirksamkeit von Akacid plus gegenüber
Spross- und filamentösen Pilzen im Vergleich zu
konventionellen Antimykotika und Chlorhexidin |
| S. Tobudic, C. Kratzer,
W. Graninger, A. Georgopoulos*
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
* Korrespondierender Autor: Univ.-Prof. DDr. A. Georgopoulos |
|
Schlüsselwörter
Pilze, Candida,
Dermatophyten, Schimmelpilze, MHK, Killing-Kurve, Akacid plus
|
|
Zusammenfassung
Ziel
der vorliegenden Arbeit war es, die In vitro-Wirksamkeit
des neuartigen polymerischen Guanidins Akacid plus mit konventionellen
Antimykotika und Chlorhexidin gegenüber 132 verschiedenen
klinischen Pilzisolaten zu vergleichen. Die untersuchten Pilzstämme
waren: C. albicans (n=46), C. glabrata (n=13),
C. parapsilosis (n=11), C. krusei (n=8), C.
tropicalis (n=5), C. guillermondi (n=3), C.
pelliculosa (n=1), C. pseudotropicalis (n=1),
C. lusitaniae (n=1), C. lipolytica (n=1),
Trichophyton rubrum (n=17), Trichophyton mentagrophytes
(n=5), Microsporum canis (n=4), Trichophyton viollaceum
(n=1), Trichophyton souadense (n=1), Aspergillus
fumigatus (n=5), Aspergillus flavus (n=1), Aspergillus
terreus (n=1), Acremonium speci (n=1), Dermatiaceae
(n=1), Pencillium purpurescens (n=2), Scopulariopsis
brevicularis (n=2) und Emericella nidulans (n=1).
Für die Bestimmung der minimalen Hemmkonzentration (MHK)
wurde die Mikrodilutionsmethode in RPMI1640 nach CLSI (Clinical
and Laboratory Standards Institute) verwendet. Zusätzlich
wurden Killing-Kurven von Akacid plus gegenüber C.
krusei ATCC 6258, C. tropicalis ATCC 750 und C.
albicans 4D (Fluconazol-resistentes klinisches Isolat)
getestet. Gegenüber allen Stämmen von Candida
spp. erreichte Akacid plus MHK-Werte im Bereich von 0,03-8 mg/l.
MHK50 und MHK90
gegenüber C. albicans und Non-albicans
Spezies waren äquivalent und betrugen 1 bzw. 4 mg/l. Vergleichbare
MHK-Werte wurden für Nystatin, Clotrimazol und Caspofungin
gefunden, während Fluconazol und Chlorhexidin mit 32 mg/l
eine deutlich höhere MHK90 erzielten.
Akacid plus, Chlorhexidin und Fluconazol erreichten ähnliche
MHK-Werte (4-64 mg/l) gegenüber Dermatophyten. Der MHK-Bereich
von Akacid plus, Amphotericin B und Voriconazol gegenüber
den getesteten Schimmelpilzen betrug 0,25-32 mg/l. Die Ergebnisse
der zeitabhängigen Abtötung von Candida spp.
durch Akacid plus haben eine fungizide Wirksamkeit der untersuchten
Substanz bei 1x MHK nach einer Exposition für 5-6 Stunden
demonstriert. Aufgrund der vergleichbaren In vitro-Wirksamkeit
zu konventionellen Antimykotika und Chlorhexidin und der raschen
Aktivität gegenüber Candida spp. könnte
das neue Biozid Akacid plus zukünftig eine wichtige Rolle
in der Prophylaxe und Therapie von Pilzinfektionen spielen.
|
Key-words
Fungi, Candida, Dermatophytes, Moulds, MIC,
time-killing-curve, Akacid plus |
|
Summary
The
purpose of this study was to evaluate the in vitro
activity of Akacid plus, a novel polymeric guanidine, compared
to conventional antifungal drugs and chlorhexidine against 132
different fungal isolates. The included clinical strains were:
C. albicans (n=46), C. glabrata (n=13), C.
parapsilosis (n=11), C. krusei (n=8), C. tropicalis
(n=5), C. guillermondi (n=3), C. pelliculosa
(n=1), C. pseudotropicalis (n=1), C. lusitaniae
(n=1), C. lipolytica (n=1), Trichophyton rubrum
(n=17), Trichophyton mentagrophytes (n=5), Microsporum
canis (n=4), Trichophyton viollaceum (n=1), Trichophyton
souadense (n=1), Aspergillus fumigatus (n=5),
Aspergillus flavus (n=1), Aspergillus terreus
(n=1), Acremonium speci (n=1), Dermatiaceae
(n=1), Pencillium purpurescens (n=2), Scopulariopsis
brevicularis (n=2) and Emericella nidulans (n=1).
In vitro susceptibility was evaluated by determination
of the minimal inhibitory concentration (MIC) in RPMI 1640 according
to CLSI (Clinical and Laboratory Standards Institute) guidelines.
Additionally, time killing-curves of Akacid plus were carried
out on C. krusei ATCC 6258, C. tropicalis
ATCC 750 and fluconazol-resistant C. albicans 4D. MICs
of Akacid plus against all strains of Candida spp.
were in the range of 0,03-8 mg/l. MIC50
and MIC90 were equivalent against C.
albicans and non-albicans species and reached
values of 1 and 4 mg/l. MIC values of Akacid plus were comparable
to that of nystatin, clotrimazole and caspofungin, whereas MIC90
(32 mg/l) of fluconazole and chlorhexidine was significantly
higher than for Akacid plus. Akacid plus, chlorhexidine and
fluconazole achieved corresponding MIC values (4-64mg/l) against
dermatophytes. The MIC range of Akacid plus, amphotericin B
and voriconazole against tested moulds was 0.25-32 mg/l. Time-killing
curves of Akacid plus against Candida spp. demonstrating
fungicidal activity were at 1x MIC after exposure for 5-6 hours.
Due to its fast fungicidal activity against Candida
spp. and comparable in vitro effectiveness to conventional
antifungal drugs and chlorhexidine, the new biocide Akacid plus
might play an important role in the prophylaxis and treatment
of fungal infections in the future.
|
Einleitung
Pilze
stellen nach Enterobacteriaceae, Staphylococcus
aureus, Pseudomonas aeruginosa und Koagulase-negativen
Staphylokokken die fünfthäufigsten pathogenen Krankheitserreger
insbesondere bei klinisch kranken Patienten dar [1]. Der Sprosspilz
Candida spp. ist der häufigste Erreger unter den
Pilzen und verursacht ein breites Spektrum an Infektionen, oberflächliche
bzw. muko-kutane Candidosen bis hin zu invasiven Candidosen,
die verschiedene Organe betreffen können. Obwohl C.
albicans die am häufigsten isolierte Spezies darstellt,
kommen auch Non-albicans Spezies immer mehr als Erreger
in Frage [2, 3, 4]. Muko-kutane Candidosen werden in erster
Linie mit lokalen oder oralen Azolen (Clotrimazol, Fluconazol,
Itraconazol) behandelt [4]. Zur Therapie der invasiven Candidosen
werden Fluconazol, Voriconazol, Caspofungin oder Amphotericin
B eingesetzt [5].
2-5%
aller invasiven Pilzinfektionen werden durch Aspergillus-Spezies,
zumeist A. fumigatus, seltener durch A. flavus,
A. niger oder A. terreus, verursacht [6].
Die wichtigsten durch Aspergillen verursachten Infektionen sind
die invasive pulmonale Aspergillose, die allergische bronchopulmonale
Aspergillose, das Aspergillom, die Mykotoxikose und die Aspergillus-Tracheobronchitis.
Die häufigste Form, die invasive pulmonale Aspergillose,
wird typischerweise bei sehr schwer immunsupprimierten Patienten
beobachtet. Zur Behandlung können Voriconazol, liposomales
oder konventionelles Amphotericin B, Itraconazol oder Caspofungin
eingesetzt werden [7].
Dermatophyten
sind eine spezielle Gruppe von filamentösen Pilzen, die
durch Invasion der Keratinozyten bei Menschen und Tieren eine
oberflächliche Infektion verursachen können. Zur Therapie
von Dermatophyteninfektionen werden unter anderem Terbinafin,
Clotrimazol, Itraconazol und Fluconazol eingesetzt [8].
Abgesehen
von den konventionellen Antimykotika zeigen auch einige andere
Substanzklassen, wie z.B. die kationisch antimikrobiell wirksamen
Substanzen, eine gute Wirksamkeit gegenüber Pilzen. Diese
Substanzen können sowohl in der Prävention (als Antiseptikum)
als auch in der Therapie (in lokaler Applikationsform) von Pilzinfektionen
eingesetzt werden [9, 10].
Das Ziel der vorliegenden Arbeit war es, die In vitro-Wirksamkeit
des polymerischen Guanidins Akacid plus, einem neuartigen Mitglied
der kationisch antimikrobiell wirksamen Substanzen, mit dem
Bisbiguanid Chlorhexidin, und mit konventionellen Antimykotika
gegenüber verschiedenen Spezies von Spross- und filamentösen
Pilzen zu vergleichen. Zusätzlich wurden die zeitabhängige
fungizide Wirksamkeit von Akacid plus gegenüber verschiedenen
Candida-Spezies mittels Killing-Kurve und die Resistenzrate
von Fluconazol gegenüber Candida spp. evaluiert.
|
| Material
und Methode
Insgesamt
wurden 90 klinische Isolate von Candida spp., 28 klinische
Isolate von Dermatophyten und 14 Schimmelpilzisolate getestet.
Von 2004 bis 2005 wurden Sprosspilz- und Dermatophytenisolate
von Patienten mit Hautinfektionen an der Dermatologie im AKH
Wien gesammelt und unserer Abteilung zur Verfügung gestellt.
Die getesteten Hautisolate waren: C. albicans (46 Stämme),
C. glabrata (13 Stämme), C. parapsilosis
(11 Stämme), C. krusei (8 Stämme), C.
tropicalis (5 Stämme), C. guillermondi (3
Stämme), C. pelliculosa (1 Stamm), C. pseudotropicalis
(1 Stamm), C. lusitaniae (1 Stamm), C. lipolytica
(1 Stamm), Trichophyton rubrum (17 Stämme), Trichophyton
mentagrophytes (5 Stämme), Microsporum canis
(4 Stämme), Trichophyton viollaceum (1 Stamm)
und Trichophyton souadense (1 Stamm). Die Isolate von
Schimmelpilzen wurden aus verschiedenen klinischen Materialien
isoliert und gehörten zu folgenden Spezies: Aspergillus
fumigatus (5 Stämme), Aspergillus flavus
(1 Stamm), Aspergillus terreus (1 Stamm), Acremonium
speci (1Stamm), Dermatiaceae (1 Stamm), Pencillium
purpurescens (2 Stämme), Scopulariopsis brevicularis
(2 Stämme), Emericella nidulans (1 Stamm).
Die
Stocklösungen von Akacid plus (POC, Austria) und von Chlorhexidindiglukonat
(Sigma, Germany), als 25- und 20%ige wässrige Lösungen,
wurden mit destilliertem Wasser und RPMI 1640 zu den gewünschten
Konzentrationen verdünnt. Amphotericin B, Fluconazol, Clotrimazol,
Nystatin, Caspofungin und Voriconazol wurden als Referenzsubstanzen
ausgewählt und wurden nach den jeweiligen Vorschriften
des Herstellers in Dimethylsulfoxid bzw. in destilliertem Wasser
gelöst.
Für
die Bestimmung der minimalen Hemmkonzentration (MHK) wurde die
Mikrodilutionsmethode in 2-fach konzentriertem RPMI 1640--Medium
mit Glutamin und mit 2% Glukose nach CLSI (Clinical and Laboratory
Standard Institute, früher NCCLS) M27-A2 [11] für
Candida spp. und M38-A für Schimmelpilze [12]
verwendet. Für Dermatophyten wurde eine modifizierte Methode
des Standards M38-A durchgeführt [8]. Die Inokulumgröße
war 0,5x10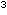 -2,5x10 -2,5x10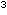 Kolonie-bildende Einheiten (KBE)/ml für Candida
und 0,5x10
Kolonie-bildende Einheiten (KBE)/ml für Candida
und 0,5x10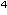 -5x10 -5x10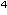 Konidien/ml für Fadenpilze. Die Endkonzentration aller
getesteten Substanzen reichte von 0,007 bis 256 mg/l. Antimykotikum-
und Inokulum-freie Kontrollen wurden inkludiert. Die Mikrotiterplatten
wurden bei 35°C für 48 Stunden für Candida
spp. und Schimmelpilze und bei 28°C für 7 Tage für
Dermatophyten inkubiert. Die MHK der Azole wurde definiert als
die niedrigste Konzentration, die eine auffallende Reduktion
der Trübung im Vergleich zur Wachstumskontrolle erzielte
(50% Wachstumshemmung). Für alle anderen Testsubstanzen
wurde die MHK als die niedrigste Konzentration definiert, die
in einer totalen Wachstumshemmung resultierte (100% Wachstumshemmung).
Bei jedem Testansatz wurden zur Qualitätskontrolle C.
krusei ATCC 6258 und C. tropicalis ATCC750 mitgeführt.
Konidien/ml für Fadenpilze. Die Endkonzentration aller
getesteten Substanzen reichte von 0,007 bis 256 mg/l. Antimykotikum-
und Inokulum-freie Kontrollen wurden inkludiert. Die Mikrotiterplatten
wurden bei 35°C für 48 Stunden für Candida
spp. und Schimmelpilze und bei 28°C für 7 Tage für
Dermatophyten inkubiert. Die MHK der Azole wurde definiert als
die niedrigste Konzentration, die eine auffallende Reduktion
der Trübung im Vergleich zur Wachstumskontrolle erzielte
(50% Wachstumshemmung). Für alle anderen Testsubstanzen
wurde die MHK als die niedrigste Konzentration definiert, die
in einer totalen Wachstumshemmung resultierte (100% Wachstumshemmung).
Bei jedem Testansatz wurden zur Qualitätskontrolle C.
krusei ATCC 6258 und C. tropicalis ATCC750 mitgeführt.
Killing-Kurven
von Akacid plus wurden gegenüber C. krusei ATCC
6258, C. tropicalis ATCC 750 und C. albicans
4D, ein Fluconazol-resistentes klinisches Isolat, in RPMI 1640
nach der Methode von Karlowsky et al. erstellt [13]. Die Sprosspilze
wurden auf Sabouraud-Dextrose-Agar-Platten subkultiviert. Von
der Platte wurden 2-3 Kolonien in 20 ml RPMI 1640-Medium inokuliert.
Die Pilzsuspension wurde unter Schütteln bei 37°C für
16 Stunden inkubiert. Zu 1 ml Pilzsuspension (10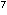 KBE/ml) wurden entweder 9 ml Biozid-freies RPMI 1640-Medium
(Wachstumskontrolle) oder 9 ml Akacid plus in RPMI in den Endkonzentrationen
von 0,5x, 1x, 2x, 4x, 8x MHK hinzugefügt und bei 37°C
für 0, 1, 2, 3, 4, 5, 6, 7, 8, 24 und 48 Stunden inkubiert.
Danach wurden jeweils 20 µl Suspension entnommen und in
10er Schritten in Sabouraud-Glucose-Bouillon verdünnt und
auf Sabouraud-Dextrose-Agar-Platten getropft. Die Platten wurden
bei 37°C für 48 Stunden inkubiert und die Anzahl der
lebensfähigen Pilzkolonien wurde bestimmt. Drei unabhängige
Testungen wurden für jeden Stamm durchgeführt und
Killing-Kurven wurden mit der Darstellung von Mittelwerten log10
KBE/ml in Abhängigkeit von der Zeit konstruiert.
KBE/ml) wurden entweder 9 ml Biozid-freies RPMI 1640-Medium
(Wachstumskontrolle) oder 9 ml Akacid plus in RPMI in den Endkonzentrationen
von 0,5x, 1x, 2x, 4x, 8x MHK hinzugefügt und bei 37°C
für 0, 1, 2, 3, 4, 5, 6, 7, 8, 24 und 48 Stunden inkubiert.
Danach wurden jeweils 20 µl Suspension entnommen und in
10er Schritten in Sabouraud-Glucose-Bouillon verdünnt und
auf Sabouraud-Dextrose-Agar-Platten getropft. Die Platten wurden
bei 37°C für 48 Stunden inkubiert und die Anzahl der
lebensfähigen Pilzkolonien wurde bestimmt. Drei unabhängige
Testungen wurden für jeden Stamm durchgeführt und
Killing-Kurven wurden mit der Darstellung von Mittelwerten log10
KBE/ml in Abhängigkeit von der Zeit konstruiert. |
| Ergebnisse
Die
Ergebnisse der MHK-Bestimmung sind in den Tabellen
1-3 und in den Abbildungen 1-4 dargestellt.
Gegenüber allen getesteten Stämmen von Candida
spp. erreichte Akacid plus MHK-Werte im Bereich von 0,03 und
8 mg/l. Vergleichbare MHK-Werte wurden für Nystatin, Clotrimazol
und Caspofungin gefunden, während Fluconazol und Chlorhexidin
mit 32 mg/l eine deutlich höhere MHK90
erzielten (Tabelle 1, Abbildung
1-4). Die MHK50- und MHK90-Werte
von Akacid plus gegenüber C. albicans- und Non-albicans-Spezies
waren äquivalent und betrugen 1 bzw. 4 mg/l. 15,3% der
C. albicans-Stämme und 4,5% aller Non-albicans-Stämme
waren resistent gegenüber Fluconazol (MHK >64 mg/l).
43,1% der Non-albicans-Stämme zeigten ebenso nur
eine dosisabhängige Empfindlichkeit gegenüber Fluconazol
(MHK 16-32 mg/l). Akacid plus, Chlorhexidin und Fluconazol erreichten
ähnliche In vitro-Wirksamkeit (MHK 4-64 mg/l)
gegenüber Dermatophyten. Clotrimazol zeigte die höchste
Empfindlichkeit gegenüber Dermatophyten mit MHK-Werten
von 0,06-0,5 mg/l (Tabelle 2, Abbildung
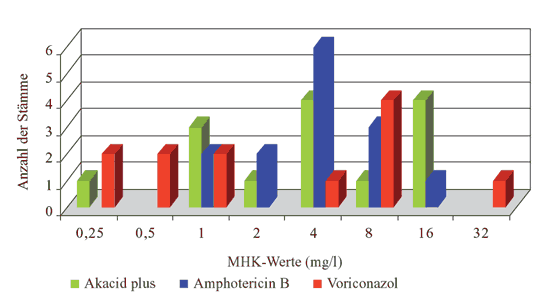
5). Der MHK-Bereich von Akacid plus, Amphotericin B und
Voriconazol gegenüber den getesteten Schimmelpilzen betrug
0,25-32 mg/l, höhere MHK-Werte 16->256 mg/l wurden für
Caspofungin bestimmt. Die MHK90 von Akacid
plus gegenüber Aspergillus spp. war 16 mg/l und
die von Amphotericin B und Voriconazol 8 mg/l (Tabelle
3, Abbildung 6).
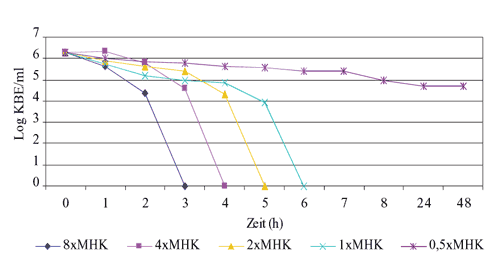
Killing-Kurven für C. krusei ATCC6258, C.
tropicalis ATCC 750 und C. albicans 4D wurden
erstellt. Die Ergebnisse der zeitabhängigen Abtötung
des Fluconazol-resistenten Stamms C. albicans 4D durch
Akacid plus sind in Abbildung 7 dargestellt.
Akacid plus in einer Konzentration 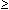 1x
MHK führte zu einer Abtötung von Candida
spp. nach einer Exposition von 5-6 Stunden bei 37°C. 1x
MHK führte zu einer Abtötung von Candida
spp. nach einer Exposition von 5-6 Stunden bei 37°C.
Tabelle
1: In vitro-Aktivität von Akacid
plus, Chlorhexidin und konventionellen Antimykotika gegenüber
Candida spp. insgesamt (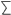 )
bzw. getrennt für C. albicans und Non-albicans-Spezies
(n). )
bzw. getrennt für C. albicans und Non-albicans-Spezies
(n).
Pathogen
(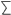 /n) /n) |
Wirksubstanz
|
MHK
(mg/l)
|
MHK-Bereich
|
MHK50 |
MHK90 |
|
Candida
spp. (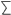 =90) =90)
|
Akacid
plus |
Nystatin |
Clotrimazol
|
Fluconazol |
Caspofungin |
Chlorhexidin |
|
0,03-8 |
1-4 |
0,03-8 |
0,125-256 |
0,06-4 |
8-64 |
|
|
|
| C.
albicans (n=46) |
Akacid
plus |
Nystatin |
Clotrimazol
|
Fluconazol |
Caspofungin |
Chlorhexidin |
|
0,5-8 |
1-4 |
0,03-8 |
0,25-256 |
0,06-2 |
8-32 |
|
|
|
| Non-albicans-Spezies
(n=44) |
Akacid
plus |
Nystatin |
Clotrimazol
|
Fluconazol |
Caspofungin |
Chlorhexidin |
|
0,03-4 |
1-4 |
0,03-1 |
0,125-256 |
0,5-4 |
4-64 |
|
|
|
Tabelle
2: In vitro-Aktivität von Akacid
plus, Chlorhexidin, Fluconazol und Clotrimazol gegenüber
Dermatophyten insgesamt (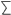 )
bzw. getrennt für T. rubrum und Non-rubrum-Spezies
(n). )
bzw. getrennt für T. rubrum und Non-rubrum-Spezies
(n).
Pathogen
(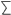 /n) /n) |
Wirksubstanz
|
MHK
(mg/l)
|
MHK-Bereich
|
MHK50 |
MHK90 |
| Dermatophyten
(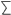 =28) =28) |
Akacid
plus |
Chlorhexidin |
Fluconazol |
Clotrimazol |
|
16-32 |
16-32 |
4-64 |
0,06-0,5 |
|
|
|
| T.
rubrum (n=17) |
Akacid
plus |
Chlorhexidin |
Fluconazol |
Clotrimazol |
|
8-32 |
16-32 |
4-64 |
0,125-0,5 |
|
|
|
| Non-rubrum
(n=11) |
Akacid
plus |
Chlorhexidin |
Fluconazol |
Clotrimazol |
|
16-32 |
16-32 |
16-64 |
0,06-0,125 |
|
|
|
Tabelle
3: In vitro-Aktivität von Akacid
plus, Amphotericin B, Voriconazol und Caspofungin gegenüber
Schimmelpilzen insgesamt (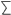 )
bzw. getrennt für Aspergillus und Non-Aspergillus-Spezies
(n) )
bzw. getrennt für Aspergillus und Non-Aspergillus-Spezies
(n)
Pathogen
(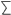 /n) /n) |
Wirksubstanz
|
MHK
(mg/l)
|
MHK-Bereich
|
MHK50 |
MHK90 |
| Schimmelpilze
(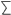 =14) =14) |
Akacid
plus |
Amphotericin
B |
Voriconazol |
Caspofungin |
|
0,25-16 |
1-16 |
0,25-32 |
16->256 |
|
|
|
| Aspergillus
spp. (n=7) |
Akacid
plus |
Amphotericin
B |
Voriconazol |
Caspofungin |
|
|
|
|
| Andere
Schimmelpilze (n=7) |
Akacid
plus |
Amphotericin
B |
Voriconazol |
Caspofungin |
|
0,25-16 |
1-16 |
0,25-32 |
16->256 |
|
|
|
|
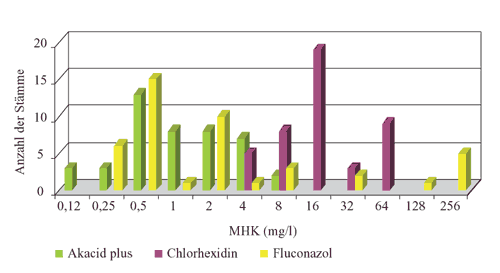
Abbildung
1: Verteilung der MHK-Werte von Akacid plus,
Chlorhexidin und Fluconazol gegenüber C. albicans
(n=46)
Abbildung
2: Verteilung der MHK-Werte von Akacid plus,
Chlorhexidin und Fluconazol gegenüber C. glabrata
(n=13)
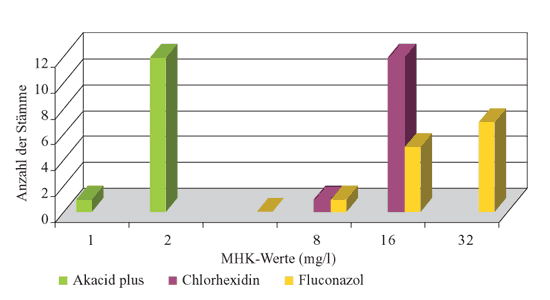
Abbildung
3: Verteilung der MHK-Werte von Akacid plus,
Chlorhexidin und Fluconazol gegenüber C. parapsilosis
(n=11)
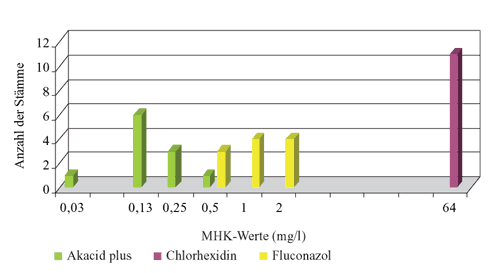
Abbildung
4: Verteilung der MHK-Werte von Akacid plus,
Chlorhexidin und Fluconazol gegenüber C. tropicalis
(n=5)
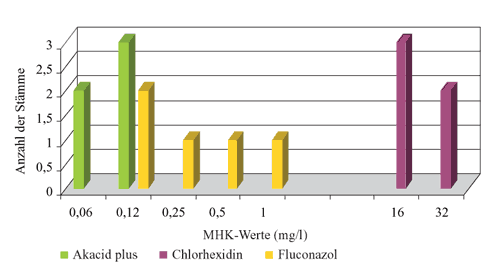
Abbildung
5: Verteilung der MHK-Werte von Akacid plus,
Chlorhexidin und Fluconazol gegenüber Dermatophyten
(n=28)
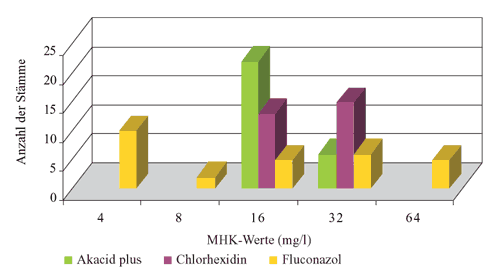
Abbildung
6: Verteilung der MHK-Werte von Akacid plus,
Chlorhexidin und Fluconazol gegenüber Schimmelpilzen
(n=14)
Abbildung
7: Killing-Kurve von Akacid plus gegenüber
C. albicans 4D
|
|
| Diskussion
Der
weltweite Gebrauch von Fluconazol hatte eine Resistenzentwicklung
gegenüber C. krusei und C. glabrata zur
Folge [14]. Obwohl C. albicans gegenüber den konventionellen
Antimykotika meistens empfindlich ist, wurde auch bei dieser
Spezies eine Resistenzentwicklung gegenüber Azolen bei
HIV-Patienten mit oropharyngealen Candidosen und bei klinisch
schwer kranken Patienten mit invasiven Candidosen sowie bei
Gesunden beschrieben [15, 16]. Außerdem wurde bereits
eine Resistenzentwicklung bei C. tropicalis gegenüber
Fluconazol [17] sowie eine deutlich verminderte Empfindlichkeit
von Amphotericin B gegenüber C. glabrata, C.
krusei und C. lusitaniae berichtet [4]. Gleichzeitig
steigt die Anzahl von Pilzinfektionen stetig an, sodass eine
Entwicklung neuer antifungaler Substanzen mit unterschiedlichen
Wirkmechanismen erforderlich wird. In der vorliegenden Arbeit
wurde ein Vergleich von Akacid plus zu konventionellen Antimykotika
und Chlorhexidin gezogen. Akacid plus zeigte sowohl ähnliche
In vitro-Wirksamkeit gegenüber Candida
spp. als auch gegenüber den Fadenpilzen (Dermatophyten
und Schimmelpilzen). 10% der getesteten Candida spp.
waren resistent und 21,1% waren dosisabhängig empfindlich
gegenüber Fluconazol. Hohe MHK-Werte von Caspofungin wurden
gegenüber Schimmelpilzen gefunden, jedoch haben In
vivo-Ergebnisse gegenüber Aspergillus spp.
in der Vergangenheit gezeigt, dass zur Evaluierung der In
vitro-Ergebnisse besser die minimale effektive Konzentration
(MEK) statt der MHK bestimmt werden sollte. Die MEK wird als
die niedrigste Konzentration definiert, die einen morphologischen
Effekt an den Zellmembranen von Pilzen produziert [18]. Für
die anderen konventionellen Antimykotika konnte eine Übereinstimmung
zwischen den In vitro-Ergebnissen und der In vivo-Wirksamkeit
bestätigt werden [4, 7]. Frühere In vitro-Studien
an Akacid plus haben die fungizide Wirksamkeit der neuen Substanz
im quantitativen Suspensionstest mit und ohne organische Belastung
gegenüber den Qualitätskontrollstämmen von C.
albicans ATCC 10231 und A. niger ATCC 16404 demonstriert
[19]. In dieser Studie konnte eine Abtötung von Candida
spp. bei 1x MHK nach einer Exposition von nur 5-6 Stunden gezeigt
werden. Aufgrund der vergleichbaren In vitro-Wirksamkeit
zu konventionellen Antimykotika und Chlorhexidin und der raschen
Aktivität gegenüber Candida spp. könnte
das neue Biozid Akacid plus zukünftig eine wichtige Rolle
in der Prophylaxe und Therapie von Pilzinfektionen spielen. |
Literatur:
| 1.
Vincent J.L., Bihari D.J., Suter P.M., et al.:“The
prevalence of nosocomial infection in intensive care units
in Europe. Results of the European prevalence of infection
in intensive care (EPIC) study. EPIC international advisory
committee.” JAMA 274 (1995) 639-644. |
| 2.
Pfaller M.A., Jones R.N., Edmond M.B.,Wenzel R.P.: “National
surveillance of nosocomial blood stream infection due to
species of Candida albicans: frequency of occurrence
and antifungal susceptibility in the SCOPE programme.”
Diagn. Microbiol.Infect. Dis. 30 (1998) 121-129. |
| 3.
Goswami D., Goswami R., Banerjee U., Dadhwal V., Miglani
S., Latiff A., Kochupillai N.: “Pattern of Candida
species isolated from patients with diabetes mellitus and
vulvovaginal candidiasis and their response to single dose
oral fluconazole.” J. Infect. 52(2006) 111-117. |
| 4.
Pappas P.G., Rex J.H., Sobel D., et al.:“Guidelines
for treatment of candidiasis.” J.Infect. Dis. 38 (2004)
161-189. |
| 5.
Sims C.R., Ostrosky-Zeichner L., Rex J.H.: “Invasive
candidiasis in immuno-compromized hospitalized patients.”
Arch. Med.Res. 36 (2005) 660-671. |
| 6.
Kontoliannis D.B., Bodey G.B.: “Invasive aspergillosis
in 2002: an update.“ Eur. J.Clin. Microbiol. Infect.
Dis. 21 (2002) 161-172. |
| 7.
Stevens D.A., Kan V.L., Judson M.A., et al.: “Practice
guidelines for diseases caused by Aspergillus.” Clin.
Infect. Dis. 30 (2000)696-709. |
| 8.
Fernandez-Torres B., Carrillo A.J., Martin E., et al.: “In
vitro activities of 10 antifungal drugs against 508
dermatophytestrains.” Antimicrob. Agents Chemother.
45(2001) 2524-2528. |
| 9.
Imbert C., Lassy E., Daniault G., Jacquemin J.L., Rodier
M.H.: “Treatment of plastic and extracellular matrix
components with chlorhexidine or benzalkonium chloride:
effect on Candida albicans adherence capacity in
vitro.” J. Antimicrob. Chemother.51 (2003) 281-287. |
| 10.
Molteni B., D’Antuono A., Bandini P.,et al.: “Efficacy
and tolerability of a new chlorhexidine-based vaginal gel
in vaginal infections.” Curr. Med. Res. Opin. 20 (2004)849-853. |
| 11.
National Committee for Clinical Laboratory Standards. Reference
method for broth dilution antifungal susceptibility testing
of yeasts. Approved Standard M27-A2. NCCLS, Wayne, PA (2002). |
| 12.
National Committee for Clinical Laboratory Standards. Reference
method for broth dilution antifungal susceptibility testing
of filamentous fungi. Approved Standard M38-A. NCCLS, Wayne,
PA(2002). |
| 13.
Karlowsky J.N., Harding G.A.J., Zelenitsky S.A., et al.:
“In vitro kill curves of a new semisynthetic
echinocandin, LY-303366, against fluconazole-sensitive and
-resistant Candida species.” Antimicrob.Agents
Chemother. 41 (1997) 2576-2578. |
| 14.
Rex J.H., Rinaldi M.G., Pfaller M.A.:“Resistance of
Candida Species to fluconazole.” Antimicrob.
Agents Chemother. 39(1995) 1-8. |
| 15.
Marr K.A., White T.C., Burik J.A.H., Bowden R.A.: “Development
of fluconazole resistance in Candida albicans causing
disseminated infection in a patient undergoing marrow transplantation.”
Clin. Infect. Dis.25 (1997) 908-910. |
| 16.
Xu J.G., Ramos A.R., Vilgalys R., Mitchell T.G.: “Clonal
and spontaneous origins of fluconazole resistance in Candida
albicans.” J. Clin. Microbiol. 38 (2000) 1214-1220. |
| 17.
Barchiesi F., Calabrese D., Sanglard D.,et al.: “Experimental
induction of fluconazole resistance in Candida tropicalis
ATCC750.” Antimicrob. Agents Chemother. 44(2000) 1578-1584. |
| 18.
Kurtz M.B., Heath I.B., Marrinan J.,Dreikorn S., Onishi
J., Douglas C.: “Morphological effects of lipopeptides
against Aspergillus fumigatus correlate with activities
against (1,3,)-Beta D-glucan synthesis.”Antimicrob.
Agents Chemother. 38 (1994)1480-1489. |
| 19.
Kratzer C., Tobudic S., Graninger W., Buxbaum A., Georgopoulos
A.: “In vitro antimicrobial activity of the
novel polymeric guanidine Akacid plus.” J. Hosp. Infect.(2006),
in press. |
Korrespondierender
Autor:
Univ.-Prof. DDr. Apostolos Georgopoulos
Univ.-Klinik für Innere Medizin I, Klin. Abt.für Infektionen
und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: apostolos.georgopoulos@meduniwien.ac.at
|
|
|