Resistenzsituation
und Serotypenverteilung von
Streptococcus pneumoniae in Österreich |
| S. Forsthuber, H. Lagler,
R. Gattringer, K. Stich, A. Hirschl, W. Graninger, A. Georgopoulos*,
The Austrian Bacterial Surveillance Network
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
*(Korrespondierender Autor: Univ.-Prof. DDr. A. Georgopoulos) |
|
|
Zusammenfassung
In
der vorliegenden Studie wurde die aktuelle Resistenzsituation
von Pneumokokken sowie die Abdeckungsrate bezüglich der
derzeit in Österreich erhältlichen Vakzine untersucht.
Die Stämme wurden zwischen Jänner 2003 und Februar
2005 von Patienten aus ganz Österreich isoliert. Die Ergebnisse
der Serotypisierung zeigten, dass 75% bzw. 60% der Stämme
im 23-valenten bzw. 7-valenten Impfstoff enthalten waren. Insgesamt
konnten die Kapseltypen 14, 3, 19F,6B und 23F am häufigsten
bestimmt werden. 12% der untersuchten Isolate zeigten eine verminderte
Empfindlichkeit gegenüber Penicillin, wobei jedoch nur
1 Stamm (0,02%) hochresistent (MHK 2 µg/ml) war. Ein deutlich
höheres Resistenzniveau wiesen die getesteten 14-, 15-gliedrigen
Makrolide (Clarithromycin, Azithromycin, Erythromycin) (18%),
Tetracyclin (15%) sowie Ciprofloxacin (15%) auf. Die molekularbiologische
Untersuchung von Makrolid-resistenten Pneumokokken hinsichtlich
zugrunde liegender Resistenzmechanismen ergab, dass sowohl der
mefA-Genotyp (M-Phänotyp) als auch der erm-Genotyp
(MLSB-Phänotyp) annähernd gleich
häufig präsent waren. 58 (10%) der untersuchten Stämme
wiesen eine Multi-Resistenz auf, wobei mehr als 60% den Serotypen
14, 6B, 19F sowie 23F zuzuordnen waren. Insgesamt zeichneten
sich jedoch nach wie vor Penicillin, Telithromycin, die neueren
Fluoroquinolone sowie Amox./Clav. durch eine hohe Wirksamkeit
gegenüber den getesteten Pneumokokken aus.
|
Key-words
S. pneumoniae, resistance, resistance genes,
serotypes |
|
Summary
Between
January 2003 and February 2005, a total of 554 S. pneumoniae
isolates were recovered from both invasive and non-invasive
sites, and analysed by serotyping, antibiotic susceptibility
testing and molecular typing. The most common capsular serotypes
were in order of frequency 14, 3, 19F, 6B, 23F, whereas 75%
were covered by serotypes included in the 23-valent vaccine.
Referring to the 7-valent conjugate vaccine licensed for use
in young children, 60% of strains isolated from children were
covered. Antibiotic susceptibility testing revealed that 0.02%
of S. pneumoniae isolates were highly resistant to
penicillin. Higher resistance rates demonstrated macrolides
(18%), tetracycline (15%) and ciprofloxacin (15%). Genetical
analysis showed a similar distribution of mefA-genotype
(M-phenotype) and erm-genotype (MLSB-phenotype)
in macrolide resistant strains. Furthermore, 58 isolates expressed
multidrug-resistance, whereas > 60% belonged to serotypes
14, 6B, 19F and 23F. In summary, newer fluoroquinolones, telithromycin
and amoxicillin/clavulanic acid were the most active antibiotics
against all tested S. pneumoniae isolates.
|
Einleitung
Seit
der Entdeckung des ersten Penicillin-resistenten S. pneumoniae-Stammes
in den 60er Jahren kam es in den letzten Jahrzehnten sowohl
in Entwicklungsländern als auch in Industrienationen zu
einem kontinuierlichen Anstieg der Penicillin-Resistenz [1],
wobei derzeit die höchsten Resistenzen in Asien zu verzeichnen
sind (z.B. Südkorea mit 80%). Obwohl global gesehen dieser
Trend anhält, gibt es deutliche regionale Unterschiede
zwischen den einzelnen Ländern. Ein wesentlicher Grund
hierfür ist der unterschiedlich hohe Antibiotika-Verbrauch
bzw. der Einsatz von Breitspektrum-Antibiotika in den entsprechenden
Ländern. Europäische Studien belegen, dass in Ländern
mit hohen Prävalenzen z.B. an Penicillin-resistenten Pneumokokken
ein hoher Gesamt-Antibiotika-Verbrauch zu verzeichnen ist, während
in Ländern mit niedrigeren Resistenzraten sowohl weniger
Antibiotika konsumiert als auch Substanzen mit engerem Spektrum
bevorzugt werden [2, 3]. Obwohl der Zusammenhang zwischen In
vitro-Resistenz, vor allem bezüglich Penicillin-Resistenz,
und Therapieerfolg kontrovers diskutiert wird [4, 5], ergibt
sich eine klinische Relevanz dadurch, dass Penicillin-resistente
Stämme häufig Multi-Resistenzen (z.B. Co-Resistenz
gegenüber Makroliden, Tetracyclinen und Fluoroquinolonen)
aufweisen, wodurch wiederum die Therapie erschwert wird. Auch
in epidemiologischer Hinsicht sind multi-resistente Stämme,
welche hauptsächlich mit den Serogruppen 6, 9, 14, 19 und
23 assoziiert sind [6], von besonderer Bedeutung. Ein bekanntes
Beispiel hierfür ist der spanische 23F-Klon, welcher zuerst
in Spanien isoliert wurde und sich in weiterer Folge weltweit
(z.B. Europa, Argentinien, Brasilien, USA, Südafrika, Mexiko
sowie Südkorea) ausgebreitet hat [7]. Das PMEN (Pneumococcal
Molecular Epidemiology Network) hat bis jetzt 26 internationale
Klone nach den Kriterien von McGee et al. identifiziert [11].
Diese Stämme breiten sich infolge der zunehmenden Globalisierung
durch Handels- und Reiseverkehr sowie Migration weltweit aus
und werden neben dem Antibiotikaverbrauch für die zunehmende
Resistenz verantwortlich gemacht.
Ziele
der vorliegenden Studie waren die Erfassung der aktuellen Resistenzsituation
von Pneumokokken in Österreich gegenüber wichtigen,
häufig in Klinik und Praxis eingesetzten Antibiotika, sowie
die Serotypenverteilung bzw. Abdeckungsrate bezüglich derzeit
erhältlicher Vakzine. |
| Material
und Methode Zwischen
Jänner 2003 und Februar 2005 wurden 554 Pneumokokken aus
ganz Österreich gesammelt, wobei die Mehrzahl der Stämme
aus dem Respirationstrakt isoliert wurden (Tabelle
1). 256 Keime stammten von Kindern 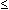 10 Jahre und 298 Isolate von Kindern > 10 Jahre sowie von
Erwachsenen (Erw.), wobei in den folgenden Ausführungen
die Einteilung in Kinder
10 Jahre und 298 Isolate von Kindern > 10 Jahre sowie von
Erwachsenen (Erw.), wobei in den folgenden Ausführungen
die Einteilung in Kinder 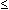 10 Jahre und Erwachsene (inkl. Kinder > 10 J.) erfolgte.
10 Jahre und Erwachsene (inkl. Kinder > 10 J.) erfolgte.
Tabelle
1: Verteilung der untersuchten S. pneumoniae-Stämme
bezüglich Entnahmematerial
| |
|
Kinder
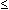 10 J.
10 J. |
n |
% |
|
| Auge |
| BAL |
| Blut |
| Bronchialsekret |
| Liquor |
| Nase |
| Pleurapunktion |
| Rachen |
| Sputum |
| Trachealsekret |
|
19 |
6,4 |
36 |
12,1 |
38 |
12,7 |
1 |
0,3 |
8 |
2,7 |
36 |
12,1 |
3 |
1 |
56 |
18,8 |
81 |
27,2 |
20 |
6,7 |
|
42 |
16,4 |
2 |
0,8 |
25 |
9,8 |
7 |
2,7 |
15 |
5,8 |
64 |
25 |
4 |
1,6 |
71 |
27,7 |
23 |
9 |
3 |
1,2 |
|
|
|
|
|
|
Alle
Pneumokokken wurden sowohl mittels mikrobiologischer Methoden
(Optochin-Sensibilität, Galle-Löslichkeits-Test) als
auch molekular-biologisch aufgrund von Pneumokokken-spezifischen
Virulenzfaktoren (ply, lytA, psaA) identifiziert. Die
Kapseltypen wurden mit typenspezifischen Antiseren (Statens-Serum-Institut,
Kopenhagen) mittels Kapselquellungstest nach Neufeld bestimmt.
Die Bestimmung der minimalen Hemmkonzentration (MHK) wurde mittels
Mikrodilutionsmethode entsprechend den Richtlinien nach CLSI
(Clinical and Laboratory Standards Institute) [8] durchgeführt
und interpretiert, wobei die In vitro-Empfindlichkeit
von insgesamt 12 verschiedenen Antibiotika getestet wurde: Penicillin
(PEN), Augmentin (AUG), Erythromycin (ERY), Clarithromycin (CLA),
Azithromycin (AZI), Josamycin (JOS), Clindamycin (CLI), Telithromycin
(TEL), Tetracyclin (TET), Ciprofloxacin (CIP), Levofloxacin
(LVX) und Moxifloxacin (MXF).
Zusätzlich zur Empfindlichkeitsprüfung mittels Mikrodilution
wurden alle S. pneumoniae-Stämme mit einer ERY-MHK
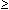 1 µg/ml
auf ihre zugrunde liegenden Resistenzmechanismen untersucht.
Der Nachweis des M-Resistenz-Phänotyps (Resistenz gegenüber
14- und 15-gliedrigen Makroliden mittels Effluxsystem) sowie
des MLSB-Resistenz-Phänotyps (Resistenz
gegenüber Makroliden, Lincosamiden und Streptogramin-B
durch Methylierung des Targets an der 23S rRNA) erfolgte mittels
Doppel-Plättchen-Diffusions-Test [9]. Die Makrolid-Resistenzgene
ermB, ermC, ermTR sowie mefA,
sowie die Tetracyclin-Resistenzgene tetM und tetO
wurden mit Hilfe einer PCR bestimmt [10]. 1 µg/ml
auf ihre zugrunde liegenden Resistenzmechanismen untersucht.
Der Nachweis des M-Resistenz-Phänotyps (Resistenz gegenüber
14- und 15-gliedrigen Makroliden mittels Effluxsystem) sowie
des MLSB-Resistenz-Phänotyps (Resistenz
gegenüber Makroliden, Lincosamiden und Streptogramin-B
durch Methylierung des Targets an der 23S rRNA) erfolgte mittels
Doppel-Plättchen-Diffusions-Test [9]. Die Makrolid-Resistenzgene
ermB, ermC, ermTR sowie mefA,
sowie die Tetracyclin-Resistenzgene tetM und tetO
wurden mit Hilfe einer PCR bestimmt [10].
Die
Identifizierung internationaler multi-resistenter Klone erfolgte
mittels PFGE (Pulsfeld-Gelelektrophorese), PBP-RFLP (PBP-Restriktions-Fragment-Längen-Polymorphismus)
sowie Sequenzierung von „House-keeping Genen“ [11,
12].
|
Ergebnisse
Serotypen-Prävalenz
Die
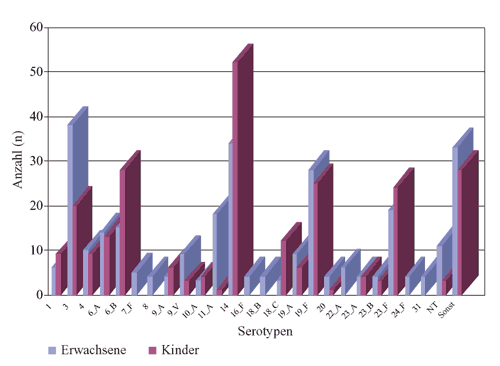
Verteilung der häufigsten Serotypen sind in Abbildung
1 dargestellt. Insgesamt konnte bei 540 Pneumokokken eine
Kapsel nachgewiesen werden, wobei 50 verschiedene Serotypen
identifiziert wurden. Die Ergebnisse der Serotypisierung zeigten
allerdings, dass 75% (n 192) der Kinder-Pneumokokken auf nur
9 verschiedene Serotypen entfielen: 14, 6B,19F, 23F, 3, 6A,
18C, 4 und 1. Die Abdeckungsrate bezüglich des 7-valenten
Konjugat-Impfstoffes (Prevenar®) betrug 60% (n
153). In der Altersgruppe > 10 Jahre waren die dominierenden
Serotypen (65%), angeführt nach Häufigkeit, 3, 14,
19F, 23F, 11A, 6B, 6A, 4, 19A sowie 9V. Insgesamt betrugen die
Abdeckungsraten ohne Berücksichtigung des Alters 75% (Pneumovax23®)
und 49% (Prevenar®).
Abbildung
1: Serotypenverteilung von 554 S. pneumoniae
(298 Erwachsene inkl. Kinder > 10 J., 256 Kinder  10 J.)
10 J.)
|
Prävalenz
der Antibiotika-Resistenz von S. pneumoniae
Die
Ergebnisse der MHK-Prüfung sind in Tabelle
2 dargestellt. Wie aus der Tabelle ersichtlich, lag die
intermediäre Penicillinresistenz bei 11% (Erw.) bzw. 13%
(Kinder), wobei nur ein Isolat eine MHK von  2 µg/ml aufwies und als hochresistent einzustufen war.
Annähernd 70% der Penicillin-resistenten Stämme wiesen
die Kapseltypen 14, 23F, 6B, 6A sowie 9A auf. Ein deutlich höheres
Resistenzniveau war bei den häufig als Alternative bei
ß-Laktam-Allergie eingesetzten Makroliden sowie bei Tetracyclin
(14%) zu verzeichnen. Dabei war die CLA-Resistenzrate der getesteten
Kinderstämme (22%) gegenüber den Erwachsenen-Isolaten
(15%) signifikant höher (p= 0,030). Bei beiden Altersgruppen
lag die Ciprofloxacinresistenz bei >15% (Erwachsene: 15,1%
/ Kinder: 16%), allerdings zeigten sich neuere Fluoroquinolone
(Levofloxacin und Moxifloxacin) zu 99% bzw. 100% wirksam.
2 µg/ml aufwies und als hochresistent einzustufen war.
Annähernd 70% der Penicillin-resistenten Stämme wiesen
die Kapseltypen 14, 23F, 6B, 6A sowie 9A auf. Ein deutlich höheres
Resistenzniveau war bei den häufig als Alternative bei
ß-Laktam-Allergie eingesetzten Makroliden sowie bei Tetracyclin
(14%) zu verzeichnen. Dabei war die CLA-Resistenzrate der getesteten
Kinderstämme (22%) gegenüber den Erwachsenen-Isolaten
(15%) signifikant höher (p= 0,030). Bei beiden Altersgruppen
lag die Ciprofloxacinresistenz bei >15% (Erwachsene: 15,1%
/ Kinder: 16%), allerdings zeigten sich neuere Fluoroquinolone
(Levofloxacin und Moxifloxacin) zu 99% bzw. 100% wirksam.
In
der vorliegenden Studie wurden nicht nur die Resistenzen gegenüber
einzelnen Substanzen, sondern auch die Mehrfachresistenzen (=
Resistenz gegenüber  3 Substanzklassen) der Isolate ausgewertet. Von den getesteten
554 Pneumokokken zeigten sich 58 Isolate multi-resistent (MDR),
wobei 12 verschiedene Muster eruiert werden konnten (Tabelle
3). Alle MDR-Stämme waren gegenüber 14- und 15-gliedrigen
Makroliden resistent und > 50% wiesen eine gleichzeitige
Resistenz gegenüber Penicillin auf. 32 MDR-Pneumokokken
wurden von Kindern
3 Substanzklassen) der Isolate ausgewertet. Von den getesteten
554 Pneumokokken zeigten sich 58 Isolate multi-resistent (MDR),
wobei 12 verschiedene Muster eruiert werden konnten (Tabelle
3). Alle MDR-Stämme waren gegenüber 14- und 15-gliedrigen
Makroliden resistent und > 50% wiesen eine gleichzeitige
Resistenz gegenüber Penicillin auf. 32 MDR-Pneumokokken
wurden von Kindern 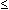 10
J. isoliert, wobei 11 verschiedene Serotypen identifiziert werden
konnten. Die Abdeckungsrate von Prevenar® betrug
bei diesen Isolaten 78% (n 25). In der zweiten Altersgruppe
waren nur 9% (n 26) der Stämme multi-resistent, allerdings
konnten hier 13 verschiedene Serotypen gefunden werden. 10
J. isoliert, wobei 11 verschiedene Serotypen identifiziert werden
konnten. Die Abdeckungsrate von Prevenar® betrug
bei diesen Isolaten 78% (n 25). In der zweiten Altersgruppe
waren nur 9% (n 26) der Stämme multi-resistent, allerdings
konnten hier 13 verschiedene Serotypen gefunden werden.
Tabelle
2: In vitro-Aktivität von S.
pneumoniae
|
|
Erwachsenea
(n = 298) |
| Empfindlichkeit
nach CLSIb
|
|
Kinder
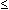 10 Jahre (n = 256)
10 Jahre (n = 256) |
| Empfindlichkeit
nach CLSIb
|
|
Gesamt
(n = 554) |
| Empfindlichkeit
nach CLSIb
|
|
| |
|
|
|
| PEN |
| AUG |
| ERY |
| CLA |
| AZI |
| JOS |
| CLI |
| TEL |
| TET |
| CIP |
| LVX |
| MXF |
|
266
(89,3) |
32
(10,7) |
- |
298
(100) |
- |
- |
251
(84,2) |
2
(0,7) |
45
(15,1) |
253
(84,9) |
2
(0,7) |
43
(14,4) |
253
(84,9) |
- |
45
(15,1) |
277
(93) |
- |
21
(7) |
279
(93,6) |
- |
19
(6,4) |
298
(100) |
- |
- |
253
(84,9) |
3
(1) |
42
(14,1) |
253
(84,9) |
- |
45
(15,1) |
294
(98,7) |
3
(1) |
1
(0,3) |
298
(100) |
- |
- |
|
222
(86,7) |
33
(12,9) |
1
(0,4) |
256
(100) |
- |
- |
198
(77,3) |
1
(0,4) |
57
(22,3) |
199
(77,7) |
2
(0,8) |
55
(21,5) |
199
(77,7) |
1
(0,4) |
56
(21,9) |
228
(89,1) |
- |
28
(10,9) |
228
(89,1) |
- |
28
(10,9) |
255
(99,6) |
1
(0,4) |
- |
219
(85,5) |
4
(1,6) |
33
(12,9) |
215
(84) |
- |
41
(16) |
253
(98,8) |
3
(1,2) |
- |
256
(100) |
- |
- |
|
488
(88,1) |
65
(11,7) |
1
(0,2) |
554
(100) |
- |
- |
449
(81) |
3
(0,5) |
102
(18,4) |
452
(81,6) |
4
(0,7) |
98
(17,7) |
452
(81,6) |
1
(0,2) |
101
(18,2) |
505
(91,2) |
- |
49
(8,8) |
507
(91,5) |
- |
47
(8,5) |
553
(99,8) |
1
(0,2) |
- |
472
(85,2) |
7
(1,3) |
75
(13,5) |
468
(84,5) |
- |
86
(15,5) |
547
(98,7) |
6
(1,1) |
1
(0,2) |
554
(100) |
- |
- |
|
a inkl. Kinder > 10 J.
b Für die Interpretation der
MHK-Ergebnisse wurden die CLSI-Grenzwerte angewandt
|
|
Tabelle
3: Multiresistente S. pneumoniae-Stämme
bezogen auf Serotypen (n = 58)
| |
Serotypen
(n) |
| Erwachsene
b
|
Kinder |
|
|
| PEN,
ERY, CIP |
| PEN,
ERY, CLI |
| PEN,
ERY, CLI, CIP |
| PEN,
ERY, CLI, TET |
| PEN,
ERY, CLI, TET, CIP |
| PEN,
ERY, TEL, CIP |
| PEN,
ERY, TET |
| PEN,
ERY, TET, CIP |
| ERY,
CLI, CIP |
| ERY,
CLI, TET |
| ERY,
CLI, TET, CIP |
| ERY,
TET, CIP |
|
| 6A(1) |
| - |
| - |
| 14(2) |
| 4(1),
15A(1), 23A(1), 23F(1) |
| - |
| 14(1),
17F(1) |
| 14(2) |
| 3(1) |
| 3(1),
6B(1), 19A(2), 19F(3), 23F(1) |
| 6B(1),
19F(1) |
| 18B(2),
23F(1), 31(1) |
|
| 3(1),
6B(3) |
| 9A(1),
23F(1) |
| 14(1) |
| 1(1),
14(2), 6B(3), 9V(1), 23F(1) |
| 6B(1),
14(2), 19F(1) |
| 19F(1) |
| 14(1) |
| - |
| 5(1) |
| 3(1),
6A(1), 6B(2), 14(1), 19C(1), 19F(4) |
| - |
| - |
|
5
(8,6) |
2
(3,4) |
1
(1,7) |
10
(17,2) |
8
(13,8) |
1
(1,7) |
3
(5,2) |
2
(3,4) |
2
(3,4) |
18
(31) |
2
(3,4) |
4
(6,9) |
|
a multi-drug resitance
b inkl. Kinder > 10 J. |
|
|
Makrolid-Phänotypen und molekularbiologische Analysen
Die
Ergebnisse der Phäno- und Genotypisierung Makrolid-resistenter
Isolate sind in Tabelle 4 dargestellt. Von
den insgesamt 102 Pneumokokken mit einer Erythromycin-MHK 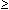 1µg/ml zeigten 54 einen MLSB-Phänotyp
und 48 einen M-Phänotyp. Bei 39 Isolaten konnten Erm-Methylasen(ermB,
ermC, ermTR; MLSB-Phänotyp)
nachgewiesen werden, während 38 Stämme mefA
(M-Phänotyp) enthielten. 5 Pneumokokken waren sowohl ermB-
als auch mefA-positiv. Bei beiden Altersgruppen zeigten
MLSB-Stämme signifikant höhere
MDR-Raten als Stämme mit dem M-Phänotyp (p
< 0,001).
1µg/ml zeigten 54 einen MLSB-Phänotyp
und 48 einen M-Phänotyp. Bei 39 Isolaten konnten Erm-Methylasen(ermB,
ermC, ermTR; MLSB-Phänotyp)
nachgewiesen werden, während 38 Stämme mefA
(M-Phänotyp) enthielten. 5 Pneumokokken waren sowohl ermB-
als auch mefA-positiv. Bei beiden Altersgruppen zeigten
MLSB-Stämme signifikant höhere
MDR-Raten als Stämme mit dem M-Phänotyp (p
< 0,001).
Ausgewählte
multi-resistente Stämme wurden mittels PFGE, PBP-RFLP sowie
Sequenzierung bestimmter „Housekeeping-Gene“ weiter
analysiert, um das mögliche Vorhandensein pandemischer
multi-resistenter Klone in Österreich zu eruieren. Die
Ergebnisse zeigten, dass von insgesamt 26 internationalen Klonen
7 in Österreich nachzuweisen waren: Spanien23F-1-Klon,
Spanien6B-2-Klon, Spanien9V-3-Klon, England14-9-Klon,
Poland6B-20-Klon, Portugal19F-21-Klon,
Taiwan23F-15-Klon.
Tabelle
4: Makrolid-resistente S. pneumoniae:
Phänotypen und Resistenzgene
| |
Resistenzgene |
MDRa |
ermB |
ermC |
ermTR |
mefA |
tetM |
tetO |
|
|
| |
|
|
| 13 |
2 |
- |
2 |
9 |
- |
17 |
4 |
- |
1 |
- |
3 |
- |
2 |
- |
- |
- |
15 |
3 |
- |
5 |
|
| Kinder |
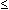 10 Jahre
10 Jahre |
|
|
|
| 23 |
- |
- |
2 |
13 |
- |
26 |
2 |
- |
- |
2 |
2 |
- |
- |
- |
- |
- |
23 |
1 |
- |
6 |
|
|
|
|
| Diskussion
Pneumokokken
gelten als einer der häufigsten Erreger von ambulant erworbenen
Atemwegsinfektionen, wie z.B. Otitis media, Sinusitis und Pneumonie,
sowie als Auslöser schwerer invasiver Infektionen, wie
Meningitis und Sepsis, und sind nach Angaben der WHO weltweit
für ca. 1,6 Mio. Todesfälle pro Jahr verantwortlich
[13]. Eine effektive Therapie dieser Infektionen wird allerdings
durch die zunehmenden Resistenzraten, vor allem gegenüber
Penicillin und Makroliden, erschwert. Vergleicht man den Anstieg
der Penicillin-Resistenz europäischer Länder, so kam
es vor allem in Italien (8%->15%), Irland (25%->41%),
Portugal (20%->28%), Spanien (41%->53%), Frankreich (43%->62%),
(14%->26%) sowie Ungarn (36%->65%) zu einem deutlichen
Anstieg, während sich das Resistenzniveau in Großbritannien
(~ 14%), Belgien (~ 18%), Schweiz (~ 13%), den Niederlanden
(~ 4%) und Deutschland (~ 8%) nicht wesentlich verändert
hat. In Ländern außerhalb Europas kam es hauptsächlich
in den USA (30%->43%), Mexiko (47%->57%) und Brasilien
(14%->43%) zu einem Ansteigen der Penicillin-Resistenz [14,
15]. Die Ergebnisse der vorliegenden Studien zeigten, dass es
in Österreich ebenfalls zu einem Anstieg der Penicillin-Prävalenz
kam. So betrug die Resistenz 1996 noch annähernd 5%, 2002
schon 10% [16] und in der jetzt durchgeführten Studie 12%.
Neben ß-Lactamen sind vor allem Makrolide ein wesentlicher
Bestandteil in der Therapie von Pneumokokken-Infektionen. Seit
Einführung der ersten Substanz (Erythromycin) dieser Antibiotikaklasse
sind die Resistenzraten vor allem in den letzten Jahren sprunghaft
angestiegen. In einigen Ländern hat die Makrolid-Resistenz
bei S. pneumoniae die Penicillin-Resistenz sogar übertroffen,
wobei dieser Trend vor allem im europäischen (Italien,
Niederlande, Deutschland, Belgien und Österreich) und im
asiatischen Raum (Hongkong, Japan, Südkorea) zu erkennen
ist [15]. Vergleicht man, analog der Penicillin-Resistenz, Ergebnisse
der Erythromycin-Resistenz bei Pneumokokken von 1996/97 mit
Daten von 1999/2000 so hat die Resistenz in den meisten westeuropäischen
Staaten (Irland 14%->26%; Niederlande 2%->8%; Deutschland
7%->16%; Österreich 5%->14%; Frankreich 46%->58%;
Italien 30%->43% und Portugal 4%->16%) und in bestimmten
osteuropäischen Ländern (Ungarn 14%->56%; Polen
13%->23%) zugenommen, während sie z.B. in Spanien (29%)
und Belgien (32%) nahezu unverändert hoch geblieben ist
[14,15]. Weltweit betrachtet sind die höchsten Resistenzen
in Asien (z.B. Südkorea 88%) zu finden. In Österreich
lag die Resistenz 1996 noch bei 3%, 2002 schon bei 10% und in
der vorliegenden Studie bei 18% [16].
Obwohl
Erythromycin in der Therapie keine Rolle spielt, ergibt sich
die klinische Relevanz der Resistenzdaten dadurch, dass die
meisten ERY-resistenten Stämme auch gegenüber den
therapeutisch eingesetzten Makroliden (Clarithromycin, Azithromycin)
resistent sind. In der jetzt durchgeführten Studie waren
alle ERY-resistenten Pneumokokken (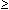 1 µg/ml) zusätzlich gegenüber Clarithromycin
und Azithromycin resistent. Prinzipiell unterscheidet man bei
einer Resistenz gegenüber Erythromycin zwischen zwei Phänotypen
(MLSB mit den Untergruppen konstitutive
MLSB und induzierbare MLSB
sowie M), welche sich aus den zugrunde liegenden Resistenzmechanismen
ergeben. c-MLSB-resistente Stämme
(erm-Genotyp) zeigen eine vollständige Kreuzresistenz
zwischen allen Makroliden, Lincosamiden und StreptograminB-Antibiotika.
Bei Keimen mit induzierbarer MLSB-Resistenz
(erm-Genotyp) sollten ebenfalls weder Makrolide (inkl.
16-gliedrige Makrolide) noch Clindamycin zur Therapie eingesetzt
werden, da diese Antibiotika bei Streptokokken als Induktoren
fungieren. Im Gegensatz dazu besteht beim M-Phänotyp (mef-Genotyp)
nur eine Resistenz gegenüber 14- und 15-gliedrigen Makroliden,
während Josamycin und Clindamycin vollständig wirksam
sind. Die Ergebnisse, welche im Rahmen einer internationalen
Studie bei ERY-resistenten S. pneumoniae durchgeführt
wurden, haben gezeigt, dass weltweit ermB (56%, hpsl.
Europa) gegenüber mefA (35%, hpsl. Nordamerika)
dominierte [17]. Die Höhe der ermB-Rate variiert
allerdings in den einzelnen europäischen Ländern.
Während in Spanien, Frankreich, Polen, Ungarn und Belgien
> 90% ermB-positive S. pneumoniae nachzuweisen
waren, zeigten sich in anderen europäischen Ländern
(Großbritannien, Schweden, Österreich, Deutschland)
wesentlich niedrigere ermB-Raten (< 60%). Die vorliegende
Studie zeigte allerdings, dass in Österreich beide Geno-
bzw. Phänotypen annähernd gleich verteilt waren.
1 µg/ml) zusätzlich gegenüber Clarithromycin
und Azithromycin resistent. Prinzipiell unterscheidet man bei
einer Resistenz gegenüber Erythromycin zwischen zwei Phänotypen
(MLSB mit den Untergruppen konstitutive
MLSB und induzierbare MLSB
sowie M), welche sich aus den zugrunde liegenden Resistenzmechanismen
ergeben. c-MLSB-resistente Stämme
(erm-Genotyp) zeigen eine vollständige Kreuzresistenz
zwischen allen Makroliden, Lincosamiden und StreptograminB-Antibiotika.
Bei Keimen mit induzierbarer MLSB-Resistenz
(erm-Genotyp) sollten ebenfalls weder Makrolide (inkl.
16-gliedrige Makrolide) noch Clindamycin zur Therapie eingesetzt
werden, da diese Antibiotika bei Streptokokken als Induktoren
fungieren. Im Gegensatz dazu besteht beim M-Phänotyp (mef-Genotyp)
nur eine Resistenz gegenüber 14- und 15-gliedrigen Makroliden,
während Josamycin und Clindamycin vollständig wirksam
sind. Die Ergebnisse, welche im Rahmen einer internationalen
Studie bei ERY-resistenten S. pneumoniae durchgeführt
wurden, haben gezeigt, dass weltweit ermB (56%, hpsl.
Europa) gegenüber mefA (35%, hpsl. Nordamerika)
dominierte [17]. Die Höhe der ermB-Rate variiert
allerdings in den einzelnen europäischen Ländern.
Während in Spanien, Frankreich, Polen, Ungarn und Belgien
> 90% ermB-positive S. pneumoniae nachzuweisen
waren, zeigten sich in anderen europäischen Ländern
(Großbritannien, Schweden, Österreich, Deutschland)
wesentlich niedrigere ermB-Raten (< 60%). Die vorliegende
Studie zeigte allerdings, dass in Österreich beide Geno-
bzw. Phänotypen annähernd gleich verteilt waren.
Aufgrund
der steigenden Resistenzraten von Penicillin und Makroliden
werden Substanzen wie neuere Fluoroquinolone (Levofloxacin,
Moxifloxacin) als mögliche Alternative bei Pneumokokken-Infektionen
vorgeschlagen. Bei Kindern sollten Amox./Clav., bzw. bei Penicillin-Allergie
16-gliedrige Makrolide wie Josamycin, als Alternative gesehen
werden. Im Gegensatz zu Penicillin, Makroliden und Tetracyclin
sind Resistenzen gegenüber Fluoroquinolonen bei Pneumokokken
weltweit gesehen noch selten. Allerdings haben Studien gezeigt,
dass in Asien bereits 5% bzw. 3% der Stämme gegenüber
LVX bzw. MXF resistent sind, wobei vor allem in Hongkong mit
14,3% hohe LVX-Resistenzraten zu verzeichnen waren [15, 18].
In der vorliegenden Studie waren 99,8% der Stämme gegenüber
LVX vollempfindlich, während Moxifloxacin zu 100% wirksam
war.
Da
die Erkankungshäufigkeit und Letalität von Pneumokokken-Infektionen
nach wie vor relativ hoch ist und die Therapie durch ansteigende
Resistenzen zunehmend erschwert wird, bestand die Notwendigkeit,
effiziente Vakzine zu entwickeln, wobei in Österreich derzeit
zwei Pneumokokken-Impfstoffe im Handel sind: der 23-valente
Impfstoff Pneumovax23® sowie der speziell für
Kleinkinder entwickelte 7-valente Konjugat-Impfstoff Prevenar®.
Um die aktuelle Serotypen-Prävalenz von S. pneumoniae
und ihre Abdeckung bezüglich vorhandener Vakzine zu evaluieren,
wurde bei allen S. pneumoniae-Stämmen der Neufeld-Kapselquellungstest
durchgeführt. Wie bei der von Buxbaum et al. [16] veröffentlichten
Studie, bei welcher die Serotypenverteilung in Österreich
von 1996 bis 2002 untersucht wurde, waren die häufigsten
Typen 3, 6B, 14, 19F sowie 23F. Die Vakzin-Abdeckung zeigte
ebenfalls ähnliche Ergebnisse: Pneumovax23®–
75% (72% Buxbaum et al.) und Prevenar®–
49% (44% Buxbaum et al.). Bei Kindern 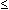 10 Jahre betrug die Abdeckung bezüglich Prevenar®
jedoch 60%.
10 Jahre betrug die Abdeckung bezüglich Prevenar®
jedoch 60%. |
Literatur:
| 1.
Appelbaum, P. C. (1992). Antimicrobial resistance in Streptococcus
pneumoniae: an overview. Clin Infect Dis 15: 77-83. |
| 2.
Cars, O., Molstad, S. & Melander, A.(2001). Variation
in antibiotic use in the European Union. Lancet 357: 1851-1853. |
| 3.
Granizo, J. J., Aguilar, L., Casal, J., Garcia-Rey, C.,
Dal-Re, R. & Baquero, F.(2000). Streptococcus pneumoniae
resistance to erythromycin and penicillin in relation to
macrolide and beta-lactam consumption in Spain (1979-1997).
J Anti-microb Chemother 46: 767-773. |
| 4.
Choi, E. H. & Lee, H. J. (1998). Clinical outcome of
invasive infections by penicillin-resistant Streptococcus
pneumoniae in Korean children. Clin Infect Dis 26, 1346-1354. |
| 5.
Feikin, D. R., Schuchat, A., Kolczak, M., Barrett, N. L.,
Harrison, L. H., Lefkowitz, L., McGeer, A., Farley, M. M.,
Vugia, D. J., Lexau, C., Stefonek, K. R., Patterson, J.
E.& Jorgensen, J. H. (2000). Mortality from invasive
pneumococcal pneumonia in the era of antibiotic resistance,
1995-1997. AmJ Public Health 90, 223-229. |
| 6.
Klugman, K. P. (1996). Epidemiology, control and treatment
of multiresistant pneumococci. Drugs 52 Suppl 2: 42-46. |
| 7.
Smith, R. D. & Coast, J. (2002). Antimicrobial resistance:
a global response. Bulletin of the World Health Organisation
80: 126-133. |
| 8.
Clinical and Laboratory Standards Institute. (2003). Methods
for dilution and antimicrobial susceptibility tests for
bacteria that grow aerobically. Approved standard (M7-A5,
M100-S13), 6th ed. Wayne, PA. |
| 9.
Seppala, H., A. Nissinen, Q. Yu, and P.Huovinen. (1993).
Three different phenotypes of erythromycin-resistant Streptococcus
pyogenes in Finland. J Antimicrob Chemother 32:885-91. |
| 10.
Reinert, R. R., S. Muckel, A. Al-Lahham, B. G. Spratt, A.
B. Brueggemann, R.Hakenbeck, and R. Lutticken. (2003). Characterization
of German penicillin non-susceptible serotype 23F pneumococci
using multilocus sequence typing. J Med Micro-biol 52:981-7. |
| 11.
McGee, L., L. McDougal, J. Zhou, B. G. Spratt, F. C. Tenover,
R. George, R. Hakenbeck, W. Hryniewicz, J. C. Lefevre, A.
Tomasz, and K. P. Klugman. (2001). Nomenclature of major
antimicrobial-resistant clones of Streptococcus pneumoniae
defined by the pneumococcal molecular epidemiology network.
J Clin Microbiol 39:2565-71. |
| 12.
Enright, M. C., and B. G. Spratt. (1998). A multilocus sequence
typing scheme for Streptococcus pneumoniae: identification
of clones associated with serious invasive disease. Microbiology
144 ( Pt 11):3049-60. |
| 13.
World Health Organization. (2003). Pneumococcal vaccines.
The Weekly Epidemiological Record 2003 14: 2004 |
| 14.
Felmingham, D. & Gruneberg, R. N.(2000). The Alexander
Project 1996-1997: latest susceptibility data from this
international study of bacterial pathogens from community-acquired
lower respiratory tract infections. J Antimicrob Chemother
45,191-203. |
| 15.
Felmingham, D., Reinert, R. R., Hirakata, Y. & Rodloff,
A. (2002). Increasing prevalence of antimicrobial resistance
among isolates of Streptococcus pneumoniae from the PROTEKT
surveillance study, and compatative in vitro activity of
the ketolide, telithromycin. J Antimicrob Chemother50 Suppl
S1, 25-37. |
| 16.
Buxbaum, A., S. Forsthuber, R. Sauermann, R. Gattringer,
W. Graninger, and A. Georgopoulos. (2004). Development of
macrolide-resistance and comparative activity of telithromycin
in streptococci in Austria, 1996-2002. Int J Antimicrob
Agents24:397-400. |
| 17.
Farrell, D. J., Morrissey, I., Bakker, S. & Felmingham,
D. (2002). Molecular characterization of macrolide resistance
mechanisms among Streptococcus pneumoniae and Streptococcus
pyogenes isolated from the PROTEKT 1999-2000 study. J Antimicrob
Chemother 50 Suppl S1, 39-47. |
| 18.
Canton, R., Morosini, M., Enright, M. C.& Morrissey,
I. (2003). Worldwide incidence, molecular epidemiology and
mutations implicated in fluoroquinolone-resistant Streptococcus
pneumoniae: data from the global PROTEKT surveillance programme.
J Antimicrob Chemother 52, 944-952. |
| 19.
Buxbaum, A., Forsthuber, S., Graninger W. & Georgopoulos,
A. (2004). Serotype distribution and antimicrobial resistance
of Streptococcus pneumoniae in Austria. JAntimicrob Chemother
54: 247-250. |
* The Austrian
Bacterial Surveillance Network: A. Hirschl, G. Tucek, W. Ulrich,
U. Setinek-Liszka (Wien); F. Allerberger(Innsbruck); W. Sixl,
A. Bojatzis (Graz); M. Müller (Salzburg); E. Grund (Klagenfurt);
G. Alpi (Villach); G. Leitner (Leoben); W. Pflanzl (Oberwart);
W. Aichinger (Wels); J. Feichtinger (Steyr); H. Gogl (Vöcklabruck);
G. Brinninger (Ried); W. Öhlinger (Krems); L. Gerstner
(Mistelbach); W. Stiglbauer (Wr. Neustadt); M. Drlicek (Linz)
Korrespondierender
Autor:
Univ.-Prof. DDr. Apostolos Georgopoulos
Univ.-Klinik für Innere Medizin I, Klin. Abt.für Infektionen
und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: apostolos.georgopoulos@meduniwien.ac.at
|
|
|