Wirksamkeit
der 23-valenten Pneumokokken-Polysaccharid-Impfung bei splenektomierten
Patienten mit soliden Tumoren |
| R. Gattringer 1,
M. Greitbauer 2, H. Burgmann 1,
* 1 Impfberatungsambulanz für immunsupprimierte
Patienten, Innere Medizin I, Klin. Abt.für Infektionen
und Chemotherapie, MUW
2 Univ.-Klinik für Unfallchirurgie, MUW
* (Korrespondierender Autor: a. Univ.-Prof. Dr. Heinz Burgmann) |
|
Schlüsselwörter
Splenektomie, Tumor, Trauma, 23-valenter Pneumokokken-Polysaccharid-Vakzine,
Effektivität, Antikörper-Serumkonzentration |
|
Zusammenfassung
Patienten
nach Milzexstirpation oder funktioneller Asplenie haben ein
erhöhtes Risiko für das so genannte Overwhelming-Postsplenectomie-Infectionssyndrom
(OPSI). Der häufigste Erreger ist mit 50-60% Streptococcus
pneumoniae. Es wird daher empfohlen, diese Risikopatienten
unter anderem gegen Pneumokokken zu impfen. Die Effektivität
der Impfung bei Patienten mit Splenektomie und maligner Grunderkrankung
ist allerdings nicht bekannt.
Ziel
der Studie war es, die Ansprechrate des 23-valenten Pneumokokken-Polysaccharid-Impfstoffes
bei splenektomierten Patienten mit maligner Grunderkrankung
zu evaluieren. Zwischen 1993 und 1999 wurden 37 splenektomierte
Patienten in die Studie inkludiert (16 Patienten hatten zusätzlich
einen Tumor; bei 21 Patienten erfolgte die Splenektomie nach
einem Trauma). Jeder Patient erhielt 0,5ml eines Pneumokokken-Polysaccharid-Impfstoffes
in den M. deltoideus.
Die
Studie zeigte, dass die Impfung mit dem 23-valenten Pneumokokken-Polysaccharid-Impfstoff
eine adäquate Immunantwort hervorrufen kann. Da der Impferfolg
nicht vorher gesagt werden kann, ist die Messung der Antikörper-Konzentration
bei Risikopatienten unerlässlich.
|
Key-words
Splenektomy, malignancy, trauma, pneumococcal-polysaccharide
vaccination, efficacy, serum antibody concentration |
|
Summary
In
the present study we addressed the question whether an underlying
malignancy affects the response to vaccination against bacterial
polysaccharide antigens (e.g. Streptococcus pneumoniae)
in splenectomized patients. We included 37 splenectomized adult
patients from our outpatient clinic for infectious diseases,
who attended for vaccination between 1993 and 1999. 16 patients
suffered from malignancies and splenectomy; 21 patients had
traumatic splenectomy (and served as control group). Each subject
received an intradeltoid injection with 0.5ml of a single lot
of Pneumo 23 vaccine. Blood samples for determination of pneumococcal
antibodies were taken prior to vaccination and 6-8 weeks afterwards.
Patients with malignancies and splenectomy may respond adequately
to the vaccination. In these risk patients antibody determination
after the vaccination is mandatory.
|
Einleitung
Patienten
nach Milzexstirpation oder funktioneller Asplenie haben ein
erhöhtes Risiko für das so genannte Overwhelming-Postsplenectomy-Infectionssyndrom
(OPSI). In einer Studie aus Westaustralien fand sich bei 1.490
Splenektomien ohne folgende Prophylaxe eine Infektionsrate von
0,42 auf 100 Personenjahre, das bedeutet 1 splenektomierter
Patient erleidet eine schwere Sepsis in 200 Jahren. Das entspricht
einer ungefähr 12,6fach höheren Inzidenz verglichen
mit dem Normalkollektiv. Das Risiko für die Infektion ist
aber korreliert mit dem Grund der Splenektomie und dem Alter.
Milzentfernungen nach Trauma haben das geringste Risiko (1,4%),
während bei Thallasämie mit einem beträchtlich
erhöhten Risiko zu rechnen ist (24,8%). Junge Patienten
scheinen am gefährdetsten zu sein, die Mortaliät bei
Kindern unter 16 Jahren war 2,2% im Vergleich zu 0,8% bei Erwachsenen.
Die Mehrzahl der Infektionen findet in den Jahren nach der Splenektomie
statt. Pimpl et al. beschreiben 202 Post-Splenektomie-Patienten,
die an Sepsis verstorben sind: 50% starben innerhalb der ersten
drei Monate, weitere 28,2% in den ersten drei Jahren nach dem
Eingriff. Der häufigste Erreger ist Streptococcus pneumoniae
(50-60%), es finden sich aber auch zu einem geringeren Prozentsatz
Haemophilus influenzae, Escherichia coli,
Pseudomonas aeruginosa und Neisseria meningitidis.
S.
pneumoniae Serotyp 23 ist wahrscheinlich der häufigste
verantwortliche Keim, aber Infektionen mit 14 anderen Serotypen
wurden beobachtet. Der derzeit verwendete Pneumokokken-Impfstoff
hat eine Effektivität von wahrscheinlich 80%. Es konnte
in einer Studie gezeigt werden, dass durch Impfung gegen die
Pneumokokken die Inzidenz an OPSI in splenektomierten dänischen
Kindern vermindert werden konnte, allerdings wurden Septikämien
auch in geimpften Kindern beobachtet. Da die Inzidenz der OPSI
nicht sehr hoch ist, ist es schwer, signifikante Reduktionen
der Inzidenz und Mortalität zu bestimmen. Groß angelegte
Studien sind dafür notwendig. Somit wird heute die Empfehlung
gegeben, bei geplanter Splenektomie zumindest 2 Wochen vor dem
geplanten Eingriff die Impfung durchzuführen. Bei posttraumatischen
Milzentfernungen sollte kurz nach der Operation, am besten gleich
im Krankenhaus, die Impfung durchgeführt werden. Es ist
allerdings bis heute nicht bekannt, bei welchen Antikörperkonzentrationen
Impfschutz besteht. Weiters wird empfohlen, zumindest nach 6
Jahren eine Auffrischungsimpfung durchzuführen. Allerdings
sind diese Empfehlungen kontroversiell diskutiert.
Weiters ist nicht bekannt, wie gut splenektomierte Patienten
mit einer malignen Grunderkrankung auf die Vakzination mit dem
23-valenten Pneumokokken-Polysaccharid-Impfstoff ansprechen.
Ziel der vorliegenden Studie war es, die Ansprechrate des 23-valentenPneumokokken-Polysaccharid-Impfstoffes
bei splenektomierten Patienten mit maligner Grunderkrankung
zu evaluieren.
|
| Material
und Methode Zwischen
1993 und 1999 wurden 37 splenektomierte Patienten in die Studie
inkludiert. Sechzehn Patienten hatten zusätzlich einen
Tumor als Grunderkrankung, bei 21 Patienten erfolgte die Splenektomie
wegen eines Traumas. Die demographischen Daten sind in Tabelle
1 und 2 angeführt.
Tabelle
1: Impfantwort auf die 23-valente Pneumokokken-Polysaccharid-Impfung
bei 21 splenektomierten Traumapatienten
| Pat.Nr. |
Alter |
Zugrunde
liegende
Erkrankung |
Pneumo-
IgG vV |
Pneumo-
IgG nV |
Anstieg |
Pneumo-
IgM vV |
Pneumo-
IgM nV |
Anstieg |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
25 |
41 |
55 |
59 |
52 |
39 |
55 |
33 |
40 |
76 |
58 |
75 |
36 |
41 |
33 |
33 |
61 |
49 |
27 |
63 |
74 |
|
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
T |
|
67 |
417 |
62 |
202 |
623 |
276 |
41 |
370 |
669 |
735 |
39 |
541 |
123 |
711 |
251 |
192 |
38 |
351 |
193 |
871 |
71 |
|
52 |
813 |
264 |
5391 |
1320 |
1441 |
811 |
304 |
2336 |
1928 |
792 |
4241 |
2511 |
1353 |
561 |
3008 |
10292 |
1354 |
401 |
13411 |
123 |
|
0,8 |
1,9 |
4,25 |
26,6 |
2,1 |
5,2 |
19,7 |
0,82 |
3,49 |
2,6 |
20,3 |
7,8 |
20,4 |
1,9 |
2,23 |
15,6 |
271 |
3,9 |
2,1 |
15,4 |
1,7 |
|
123 |
1361 |
270 |
48 |
137 |
474 |
257 |
246 |
165 |
148 |
152 |
426 |
159 |
170 |
377 |
172 |
20 |
96 |
307 |
381 |
95 |
|
301 |
811 |
1118 |
357 |
258 |
1349 |
373 |
495 |
1157 |
435 |
836 |
7389 |
1423 |
1693 |
- |
2279 |
1029 |
487 |
1720 |
2085 |
156 |
|
2,44 |
0,59 |
4,1 |
7,4 |
1,88 |
2,8 |
1,45 |
2,01 |
7,01 |
2,9 |
5,5 |
17,3 |
8,9 |
9,96 |
- |
13,2 |
51,45 |
5 |
5,6 |
5,5 |
1,6 |
|
vV
– vor Vakzination
nV – nach Vakzination |
|
Tabelle
2: Impfantwort auf die 23-valente Pneumokokken-Polysaccharid-Impfung
bei 16 splenektomierten Tumorpatienten
| Pat.Nr. |
Alter |
Zugrunde
liegende
Erkrankung |
Pneumo-
IgG vV |
Pneumo-
IgG nV |
Anstieg |
Pneumo-
IgM vV |
Pneumo-
IgM nV |
Anstieg |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
44 |
46 |
84 |
48 |
50 |
70 |
46 |
63 |
57 |
39 |
56 |
63 |
44 |
35 |
54 |
57 |
|
N.
ventriculi |
N.
ventriculi |
N.
ventriculi |
N.
mammae |
N.
ventriculi |
N.
coli |
N.
ventriculi |
N.
pancreas |
Hemangio-karzinom |
N.
ventriculi |
N.
coli |
N.
ventriculi |
N.
pancreaticus |
N.
ventriculi |
N.
ventriculi |
Hypernephrom |
|
444 |
102 |
46 |
193 |
208 |
2199 |
652 |
177 |
1836 |
253 |
20 |
1557 |
20 |
384 |
5375 |
464 |
|
1977 |
289 |
211 |
12880 |
210 |
8350 |
670 |
1397 |
2304 |
1724 |
69 |
5311 |
561 |
634 |
4758 |
7563 |
|
4,45 |
2,8 |
4,6 |
66,7 |
1 |
3,8 |
1,02 |
7,9 |
1,25 |
6,8 |
3,45 |
3,4 |
28 |
1,65 |
0,89 |
16,3 |
|
85 |
175 |
165 |
756 |
231 |
117 |
152 |
341 |
119 |
119 |
155 |
96 |
20 |
161 |
1739 |
73 |
|
237 |
590 |
- |
24882 |
240 |
2734 |
342 |
1998 |
88 |
826 |
967 |
357 |
2214 |
1393 |
979 |
408 |
|
2,9 |
3,37 |
- |
32,9 |
1,01 |
23,4 |
2,25 |
5,9 |
0,74 |
6,9 |
6,24 |
3,7 |
110,7 |
8,65 |
0,56 |
5,6 |
|
vV
– vor Vakzination
nV – nach Vakzination |
|
|
Jeder
der Patienten erhielt eine Impfung mit 0,5 ml eines Pneumokokken-Polysaccharid-Impfstoffes
(Pneumo-23, Sanofi-Pasteur-MSD) intramuskulär in den M.
deltoideus. Blutproben zur Bestimmung der Serumantikörper
gegen den verwendeten Impfstoff wurden vor und 6 Wochen nach
der Impfung abgenommen.
Die Serum-Antikörper gegen den 23-valenten Pneumokokken-Polysaccharid-Impfstoff
wurden mittels eines Inhouse-ELISA bestimmt (Daten werden als
Serum-Titer angegeben). |
| Resultate
und Diskussion Die
Impfantworten der Trauma- und Karzinompatienten finden Sie in
Tabelle 1 und 2 bzw.
in Abbildung 1 und 2.
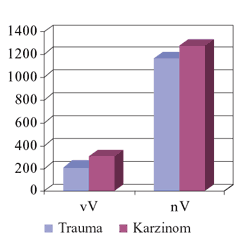
Abbildung
1: Geometrischer Mittelwert der
IgG-Pneumokokken-Antikörper-Titer
vor und nach der Impfung
|
Abbildung
2: Geometrischer Mittelwert der
IgM-Pneumokokken-Antikörper-Titer vor und nach
der Impfung
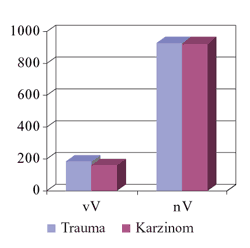
|
Betreffend
Impfantwort auf den 23-valenten Pneumokokken-Polysaccharid-Impfstoff
fand sich kein signifikanter Unterschied zwischen den beiden
Gruppen.
Eine
mögliche Erklärung dafür könnte sein, dass
keiner der Tumorpatienten 3 Monate vor der Impfung eine Chemotherapie
erhielt. Somit scheinen solide Tumore kein zusätzlicher
Faktor für Immunsuppression betreffend Impfantwort nach
Splenektomie zu sein.
Wichtig
ist es allerdings, dass auch nur die Hälfte der splenektomierten
Traumapatienten einen zumindest 4-fachen Titeranstieg zeigten.
Das unterstreicht die Wichtigkeit, den Impferfolg bei diesen
Patienten zu messen. Allerdings war es bisher nicht möglich,
die Impfantwort zu boostern, denn Nachteil des 23-valenten Polysaccharid-Impfstoffes
ist, dass Polysaccharide hauptsächlich von T-Zell-unabhängigen
Mechanismen erkannt werden, und der Proband entwickelt somit
kein T-Zell-Gedächtnis.
Seit einigen Jahren gibt es nun einen konjugierten Pneumokokken-Impfstoff,
der auch geboostert werden kann. Dieser Impfstoff ist derzeit
aber nur für Kinder zugelassen. Nachteil dieses Impfstoffes
ist, dass nur 7 Antigene erhalten sind. Es werden aber Anstrengungen
unternommen, in näherer Zukunft zusätzliche wichtige
Antigene zu inkludieren.
Es
laufen derzeit Untersuchungen, die die Effektivität dieses
konjugierten Impfstoffes bei Erwachsenen mit Splenektomie demonstrieren
sollen.
Zusammenfassend kann gesagt werden, dass die Impfung mit dem
23-valenten Pneumokokken-Polysaccharid-Impfstoff eine adäquate
Immunantwort hervorrufen kann. Da der Impferfolg nicht vorhergesagt
werden kann, ist die Messung der Antikörper-Konzentrationen
bei Risikopatienten unerlässlich. Weitere Studien werden
den Stellenwert des konjugierten Pneumokokken-Impfstoffes zeigen.
|
Literatur:
| 1.
Butler JC, Breiman RF, Campbell JF, Lipman HB, Broome CV,
Facklam RR: Pneumococcal polysaccharide vaccine efficacy.
An evaluation of current recommendations. JAMA. 1993 Oct
20;270(15):1826-31. |
| 2.
Konradsen HB: Humoral immune response to pneumococcal vaccination.
Prevention of infections with Streptococcus pneumoniae by
immunization. APMISSuppl. 1996;60:1-28. |
| 3.
Shapiro ED, Berg AT, Austrian R, Schroeder D, Parcells V,
Margolis A, Adair RK,Clemens JD: The protective efficacy
of polyvalent pneumococcal polysaccharide vaccine. N Engl
J Med. 1991 Nov21;325(21):1453-60. |
| 4.
Bruyn GA, van Furth R: Pneumococcal polysaccharide vaccines:
indications, efficacy and recommendations. Eur J Clin Microbiol
Infect Dis. 1991 Nov;10(11):897-910. |
| 5.
Waghorn DJ: Overwhelming infection in asplenic patients:
current best practice preventive measures are not being
followed. JClin Pathol 2000; 54(3):214-8. |
| 6.
Caplan ES, Boltansky H, Snyder MJ,Rooney J, Hoyt NJ, Schiffman
G, Cowley RA: Response of traumatized splenectomized patients
to immediate vaccination with polyvalent pneumococcal vaccine.
J Trau-ma. 1983 Sep;23(9):801-5. |
| 7.
Sullivan J, Ochs HD, Schiffmann G, Hammerschlag MR, Miser
J, Vichinsky E, Wedgewood RJ: Immune Response after Splenectomy.
Lancet. |
| 8.
Spoulou V, Victoratos P, Ioannidis JPA,Grafakos S: Kinetics
of Antibody Concentration and Avidity for the Assessment
of Immune Response to Pneumococcal Vaccine among Children
with Bone MarrowTransplants. JID 2000; 182: 965-9. |
| 9.
Addiego JE, Amman AJ, Schiffmann G, Baehner R, Higgins G,
Hammond D: Response to pneumococcal polysaccaride vaccine
in patients with untreated Hodgkin´s disease. Lancet.
1980 Aug 30;2(8192):450-2. |
| 10.
Hartkamp A, Mulder AHL, Rijkers GT,van Velzen-Blad H, Biesma
DH: Antibody response to pneumococcal and haemophilus vaccination
in patients with B-cell chronic lymphocytic leukaemia. Vaccine
2001;19:1671-77. |
| 11.
Schwartz PE, Sterioff S, Mucha P, Mel-ton LJ, Offord KP:
Postsplenectomy sepsis and mortality in adults. JAMA 1982;248(18):
2279-83. |
| 12.
Molrine DC, George S, Tarbell N, Mauch P, Diller L, Neuberg
K, Schamberger RC, Anderson EL, Phillips NR, Kinsella K,
Ambrosino DM: Antibody response to Polysaccaride and Polysaccharide-conjugate
Vaccine after Treatment of Hodgkin Disease. Ann Intern Med
1995; 123:828-34. |
| 13.
Petrasch S, Kuhnemund O, Reinacher A, Uppenkamp M, Reinert
R, Schmiegel W, Lutticken R, Brittinger G.: Antibody responses
of splenectomized patients with non-Hodgkin's lymphoma to
immunization with polyvalent pneumococcal vaccines. Clin
Diagn Lab Immunol. 1997 Nov;4(6):635-8. |
| 14.
Rao SP, Rajkumar K, Schiffman G, Desai N, Unger C, Miller
ST: Anti-pneumococcal antibody levels three to seven years
after first booster immunization in children with sickle
cell disease, and after a second booster. J Pediatr. 1995
Oct;127(4):590-2. |
| 15.
Weintrub PS, Schiffman G, Addiego JEJr, Matthay KK, Vichinsky
E, Johnson R, Lubin B, Mentzer WC, Ammann AJ: Long-term
follow-up and booster immunization with polyvalent pneumococcal
polysaccharide in patients with sickle cell anemia. JPediatr.
1984 Aug;105(2):261-3. |
| 16.
Chan CY, Molrine DC, George S, Tarbell NJ, Mauch P, Diller
L, Shamberger RC,Phillips NR, Goorin A, Ambrosino DM.:Pneumococcal
conjugate vaccine primes for antibody responses to polysaccharide
pneumococcal vaccine after treatment of Hodgkin's disease.
J Infect Dis. 1996 Jan;173(1):256-8. |
Korrespondierender
Autor:
a.Univ.-Prof.
Dr. Heinz Burgmann
Univ.-Klinik für Innere Medizin I, Klin. Abt.für Infektionen
und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: heinz.burgmann@meduniwien.ac.at
|
|
|