Infektion
beim diabetischen Fuß – Mikrobiologie |
| H. Mittermayer
Institut für Hygiene, Mikrobiologie und Tropenmedizin,
Nationales Referenzzentrum für nosokomiale Infektionen
und
Antibiotikaresistenz, Nationales Referenzzentrum für Hepatitis,
Krankenhaus der Elisabethinen Linz
(Leiter: Prim. Univ.-Prof. Dr. Helmut Mittermayer) |
|
| Die
Häufigkeit des diabetischen Fußsyndroms und der damit
verbundenen Probleme wird oft unterschätzt. Etwa 15-25%
der Diabetiker leiden in ihrem Leben zumindest einmal an einer
ulzerösen Läsion am Fuß, die durchschnittliche
Heilungsdauer beträgt 4 Monate. 10% der Ulzera persistieren
über ein Jahr, 15% heilen bis zum Tod nicht aus. Schätzungsweise
3%-7% Läsionen treten jährlich neu auf, das Risiko
für ein Rezidiv ist mit 30%-100% ausgesprochen hoch. Das
diabetische Fußsyndrom gilt als eine schwerwiegende Komplikation,
da es mit einem hohen Amputationsrisiko vergesellschaftet ist.
40%-60% aller nicht traumatischen Amputationen der unteren Extremität
betreffen Diabetiker, ungefähr 85% der Amputationen geht
eine ulzeröse Läsion voraus. Infektionen sind für
die Entstehung von untergeordneter Bedeutung, spielen aber eine
wichtige Rolle bei der Progression, sind mitverantwortlich für
Wundheilungsstörungen und ein wichtiger Risikofaktor für
Amputationen. Das diabetische Fußsyndrom ist auch ein
ökonomisches Problem, jeder fünfte Krankenhausaufenthalt
und die Hälfte aller Belagstage von Diabetikern sind auf
Fußprobleme zurückzuführen. Die Belastungen
sind beträchtlich: Die Kosten eines oberflächlichen
Ulkus belaufen sich schätzungsweise auf 4.500 Euro und
die einer tiefen Infektion auf 23.500 Euro. Ein Gangrän
belastet das Gesundheitsbudget sogar mit 50.000 Euro. Weniger
als 1% der Gesamtkosten entfallen dabei auf die antibiotische
Therapie. |
Erregerspektrum
Die Besiedelung
der Läsionen geschieht durch die Keime der Haut- und
Schleimhautflora sowie durch exogene Mikroorganismen. Beim
Entstehen einer Wundinfektion und auch bei der Therapie muss
man zwischen Kontamination, Kolonisation und der eigentlichen
Infektion unterscheiden. Unter Kontamination versteht man
das Vorhandensein von Mikroorganismen, die sich nicht vermehren.
Praktisch alle Wunden sind kontaminiert, die Wundheilung wird
davon aber meist nicht beeinflusst. Der nächste Schritt
ist die Kolonisation, bei der es zur Vermehrung der adhärenten
Keime kommt, allerdings noch immer ohne erkennbare Schädigung
oder Wundheilungsstörung. Von einer Wundinfektion spricht
man, wenn sich potenziell pathogene Mikroorganismen (z.B.
Staphylococcus aureus, ß-hämolysierende
Streptokokken, E. coli, Proteus, Klebsiellen,
obligate Anaerobier, Pseudomonas u.a.) vermehren
und lokale oder systemische Krankheitszeichen auftreten. Antibiotika
sind bei Kontamination oder Kolonisation im Allgemeinen nicht
indiziert, der Einsatz von Antiseptika hingegen oft sinnvoll.
Die Mehrzahl der Infektionen ist polymikrobiell bedingt (Abbildung
1). Bei frühen akuten Wunden dominieren Gram-positive
Keime (S. aureus, ß-hämolysierende Streptokokken),
nach etwa 4 Wochen nimmt die Besiedelung durch Gram-negative
Keime (Proteus, E. coli, Klebsiella) zu. Lange bestehende
chronische Wunden enthalten zunehmend mehr Anaerobier und
Gram-negative Nonfermenter (Pseudomonas, Acinetobacter,
Stenotrophomonas) aus exogenen Quellen. Enterokokken
und Sprosspilze (Candida) werden auch häufig gefunden,
die klinische Relevanz erscheint aber fraglich. Mykobakterien
sind schlecht erfassbar, könnten aber an der verzögerten
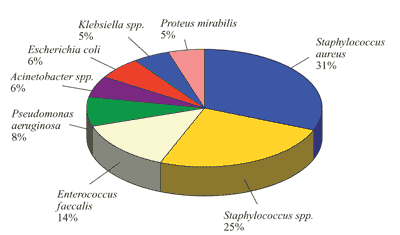
Wundheilung mitverantwortlich sein. Staphylokokken sind bei
über der Hälfte der infizierten diabetischen Läsionen
nachweisbar. 22-28% davon sind Staphylococcus aureus.
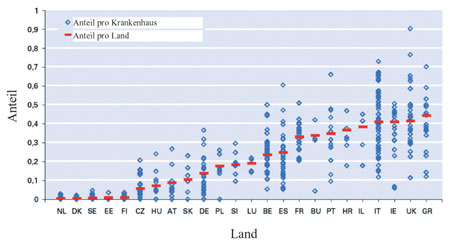
Die Häufigkeit des Auftretens von MRSA ist in den einzelnen
Ländern sehr unterschiedlich (Abbildung
2). Bis vor einiger Zeit wurden MRSA fast ausschließlich
als nosokomial auftretende Keime beobachtet, seit kurzem findet
man aber immer häufiger auch so genannte „community“-MRSA
(c-MRSA) außerhalb des Krankenhausbereiches. Diese resistenten
Bakterien sind genetisch etwas anders aufgebaut, die Resistenzkassette
ist kleiner, beinhaltet meist nur eine Resistenzdeterminante,
gilt aber als einfacher übertragbar. C-MRSA bilden auch
häufig den Virulenzfaktor PVL (Pantone-Valentine-Leukozidin),
der zu Schädigung von Leukozyten und Porenbildung in
biologischen Membranen führt.
Abbildung
1: Isolate bei stationären Patienten mit diabetischem
Fußsyndrom
Abbildung
2: Unterschiede in der Häufigkeit von MRSA in
Krankenhäusern, Daten von EARSS (European Antimicrobial
Resistance Surveillance System)
|
Behandlungsmöglichkeiten
Die
Behandlung der infizierten diabetischen Fußläsion
sollte möglichst aufgrund einer mikrobiologischen Untersuchung
erfolgen, da das Erregerspektrum zwar kalkulierbar, die Antibiotikaresistenz
lokal und regional unterschiedlich und letztendlich kaum voraussagbar
ist. Bei der Identifikation der Erreger spielt die richtige
Materialgewinnung eine entscheidende Rolle. Der Goldstandard
ist die Wundbiopsie oder Nadelaspiration vom Wundrand, alternativ
kann nach Reinigung mit steriler Kochsalzlösung auch ein
Abstrich vom Grund der Wunde erfolgen. Bei Verdacht auf Osteomyelitis
ist eine Knochenbiopsie empfehlenswert, da vom Wundabstrich
nicht zuverlässig auf die Verhältnisse im Knochen
geschlossen werden kann. In einer rezenten Untersuchungsserie
betrug die Konkordanz zwischen den mikrobiologischen Ergebnissen
aus den tiefen und den oberflächlich gewonnenen Proben
nur 22,5% (Senneville E., et al., CID 2006; 39, 57-62).
Bei Kontamination und Kolonisation sollten nur antiseptische
Wirkstoffe, wie Iodophore, PVP-Jod oder Octenidinhydrochlorid,
und bei chronischen schlecht heilenden Wunden auch Polihexanid,
Taurolidin, nanokristallines Silber oder eventuell auch Fliegenlarven
(Lucilia sericata) zum Einsatz kommen. Die Diagnose einer Infektion
und damit die Indikationsstellung für Antibiotika muss
nach klinischen Kriterien (Rötung, Schwellung, Ödem,
systemische Zeichen) erfolgen. Die Therapie kann empirisch begonnen
werden und wird nach Vorliegen des Kulturergebnisses adaptiert.
Bei der Auswahl des Antibiotikums ist zu berücksichtigen,
dass üblicherweise Gram-positive Kokken dominieren (60-80%),
Gram-negative Keime vor allem bei chronischen Wunden und Vorbehandlung
vorkommen (20-30%) und bei Ischämie bzw. Gangrän Anaerobier
(4-15%) obligat sind. Eine empirische Therapie ausschließlich
gegen Gram-positive Kokken ist nur bei leichten bis mittelschweren
Infektionen ausreichend, bei schweren Infektionen ist auf ein
genügend breites Spektrum zu achten. Außerdem müssen
die aktuelle lokale Resistenzsituation, mögliche Vorbehandlungen
und die Prävalenz von MRSA berücksichtigt werden.
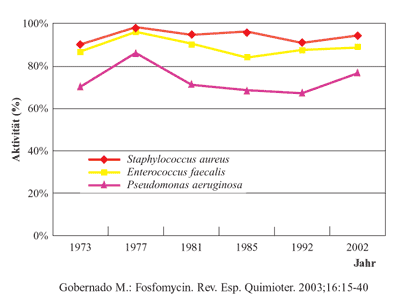
Da Fosfomycin nur sehr gezielt zum Einsatz kommt, ist die Empfindlichkeit
wichtiger Erreger unverändert günstig. Fosfomycin
ist daher ein sinnvoller Kombinationspartner in der parenteralen
Therapie von infizierten diabetischen Fußläsionen
(Abbildung 3 und 4).
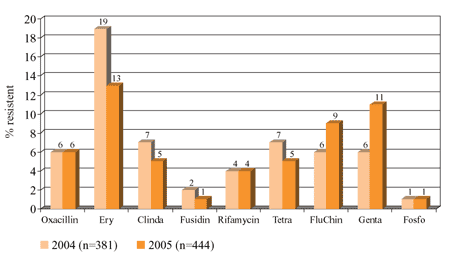
Abbildung
3: Antibiotikaresistenz bei S. aureus aus
Wundsekret (2004-2005), Institut für Hygiene, Mikrobiologie
und Tropenmedizin im Krankenhaus der Elisabethinen Linz
Abbildung
4: Empfindlichkeit gegen Fosfomycin
|
Anschrift
des Referenten:
Prim. Univ.-Prof. Dr. H. Mittermayer
Institut für Hygiene, Mikrobiologie und Tropenmedizin, A.ö.
Krankenhaus der Elisabethinen Linz
A-4010 Linz, Fadingerstraße 1
E-Mail: helmut.mittermayer@elisabethinen.or.at
|