| Schildzecken-Borreliose
und andere durch Zecken vermittelte Erkrankungen |
G. Stanek
Klinisches Institut für Hygiene und Medizinische Mikrobiologie,
Medizinische Universität Wien |
|
|
Schlüsselwörter:
Ixodes ricinus, Lyme-/Schildzecken-Borreliose, FSME,
Anaplasmose, Rickettsiose, Tularämie, Babesiose |
|
Zusammenfassung
Zecken
gehören weltweit zu den wichtigsten Überträgern
von Krankheitserregern des Menschen. Die meisten Zecken gehören
einer von zwei Familien an, den Schildzecken oder den Lederzecken.
Während Lederzecken hauptsächlich Rückfallfieber-Borrelien
in relativ trockenen Klimaten übertragen, übertragen
Schildzecken eine Fülle von Krankheitserregern im gemäßigten
Klima der nördlichen Hemisphäre. Unter den Schildzecken
Europas ist Ixodes ricinus am weitesten verbreitet
und bei weitem die häufigste Zeckenart auf unserem Kontinent.
Die dreiwirtige Zecke benötigt in jedem Entwicklungsstadium
nur eine Blutmahlzeit. Ixodes ricinus hat ein sehr
weites Wirtsspektrum; mehr als 300 verschiedene Wirbeltierarten
dienen als Blutwirte. Gewöhnlich befallen die Zeckenlarven
kleine Säugetiere, wie Mäuse, und nehmen dabei verschiedenste
Mikroorganismen und Viren auf, unter denen sich gefährliche
Krankheitserreger des Menschen befinden. Diese bleiben während
der Verwandlung ins nächste Stadium in der Zecke, werden
also transstadial in das nächste Entwicklungsstadium, das
Nymphenstadium, übertragen. Nymphen befallen den Menschen
sehr häufig. Sie können die Krankheitserreger von
Schildzecken-Borreliose, Früh-Sommer-Meningo-Enzephalitis,
Anaplasmose, Rickettsiosen, Hasenpest (Tularämie), Babesiose
und andere auf den Menschen übertragen, wobei die Borrelien
weitaus am häufigsten klinische Erkrankungen verursachen.
Selten rufen Babesien eine manifeste Erkrankung des Menschen
hervor. Ixodes ricinus ist zu einem beträchtlichen
Anteil mit Rickettsia helvetica infiziert, während
die Schildzecke Dermacentor marginatus als Überträger
von Rickettsia slovaca identifiziert worden ist, welche
Lymphadenopathien hervorrufen kann. Die Laboratoriums-Diagnose
dieser Erkrankungen erfolgt entweder durch den Nachweis spezifischer
Antikörper in gepaarten Serumproben oder durch den direkten
Nachweis der Krankheitserreger oder mit Hilfe beider Methoden.
Verschiedene Antibiotika dienen zur Behandlung der bakteriellen
und durch Babesien verursachten Infektionen. Vor der FSME kann
man sich nur durch Impfung schützen.
|
Key-words:
Ixodes ricinus, Lyme-/hard tick borreliosis,
TBE, anaplasmosis, rickettsioses, tularemia, babesiosis |
|
Summary
Among
the various species of hard ticks, Ixodes ricinus is
the most frequently found tick throughout Europe. As with other
ixodid ticks, the developmental cycle runs through three stages.
In each stage a blood meal is required in order to develop to
the next stage. Ixodes ricinus has been found to feed
on more than 300 different vertebrate species. Usually, larval
ticks feed on small mammals such as mice and become infected
with various microorganisms and viruses, of which some are substantial
pathogens to humans. The pathogens remain in the tick during
molting andare thus transstadially transmitted to the next developmental
stage. Pathogens transmitted to humans are the agents of hard
tick borreliosis, the tick-borne encephalitis virus, Rickettsia
spp., Anaplasma phagocytophilum, occasionally
Francisella tularensis, protozoal Babesia species and
other, which may also cause manifest infections in humans in
Central Europe. The hard tick Dermacentor marginatus
transmits Rickettsia slovaca, agent of tick-borne lymphadenopathia.
Laboratory confirmation of the diseases which are caused by
these agents is either made by detection of specific antibodies
in blood samples of the acute and of the reconvalescent phase
of the disease or by direct detection of the agent or by both.
Certain antimicrobial chemotherapeutics are effective in the
treatment of the bacterial and protozoal infections. TBE can
only be prevented by active immunisation.
|
Einleitung
Zecken
gehören weltweit zu den wichtigsten Überträgern
von Krankheitserregern des Menschen. Die meisten Zecken gehören
einer von zwei Familien an, den Schildzecken
oder den Lederzecken. Während Lederzecken
hauptsächlich Rückfallfieber-Borrelien in relativ
trockenen Klimaten übertragen, übertragen Schildzecken
eine Fülle verschiedener Krankheitserreger. Unter den Schildzecken
Europas ist Ixodes ricinus am weitesten verbreitet
und bei weitem die häufigste Zeckenart auf unserem Kontinent.
Von den zahlreichen Krankheitserregern, die sie übertragen
kann, spielen derzeit Borrelien und FSME-Viren klinisch die
wichtigste Rolle. Bezüglich FSME ist Österreich ein
Ausnahmeland, weil aufgrund der breiten Durchimpfung der Bevölkerung
die Erkrankungszahlen im Vergleich mit den Nachbarländern
sehr niedrig sind.
Mit
Schildzecken-Borrelien wird jährlich eine unbekannte Zahl
von Personen infiziert; zwischen 50.000 und 100.000 Personen
erkranken jährlich manifest an Borreliose. Es gibt allerdings
viele andere Erreger, die klinisch offensichtlich nicht diese
dominante Rolle spielen, aber in Ixodes ricinus-Zecken
häufig vorkommen. Dazu gehören Babesien, Rickettsien,
Anaplasmen und der Hasenpest-Erreger Francisella tularensis.
Der
Ausdruck „Schildzecken-Borreliose“ sollte anstelle
des Begriffs Lyme-Borreliose (oder Lyme-Krankheit) verwendet
werden. Auch der Ausdruck „Borreliose“ eignet sich,
wenn man nur in Erinnerung behält, dass es die „Lederzecken-Borreliose“(endemisches
Rückfallfieber) gibt. Zwar waren es insbesondere Gelenkserkrankungen
von Kindern aus den Ortschaften Lyme, Old-Lyme und East Haddam
in Connecticut, die Mitte der 1970er Jahre Anlass zur Beschreibung
der neuen Arthritis-Form „Lyme-Arthritis“ gaben
(Steere et al. 1977). Die nachfolgenden Forschungsarbeiten zeigten
aber, dass das initiale und führende Krankheitssymptom,
das Erythema (chronicum) migrans, in Europa schon seit Beginn
des 20. Jahrhunderts bekannt war (Afzelius 1909, Lipschütz
1913). Andere Manifestationen der später als Borrelieninfektion
erkannten Erkrankungen, wie zum Beispiel das Bannwarth-Syndrom,
waren ebenfalls längst in sehr detaillierten Beschreibungen
und Studien aus Europa erfasst (Bannwarth 1941, Schaltenbrand
1967). Selbst die bakterielle/Spirochäten-Ätiologie
wurde wiederholt geäußert (Hellerstrom 1951, Hollstrom
1951, Weber 1974). Dazu gab es schon früh die Gewissheit,
dass Zecken als Überträger fungieren müssen (Lipschütz
1923). Der spektakuläre Durchbruch kam mit der Entdeckung
und Anzüchtung von Spirochäten aus Schildzecken im
Jahr 1981/82 durch W. Burgdorfer (Burgdorfer et al. 1982) und
Alan Barbour (1984). Wesentlich für den ursächlichen
Zusammenhang war die Anzüchtung der Borrelien aus Haut,
Blut und Liquor von Patienten (Burgdorfer et al. 1983, Steere
et al. 1983, Benach et al. 1983), die uns am Hygiene-Institut
der Universität Wien ebenfalls im selben Zeitraum gelang
(Stanek et al. 1985a, b). |
| Schildzecken
Einzige
Nahrungsquelle Blut
Die
einzige Nahrungsquelle für Zecken ist Blut. Schildzecken
saugen nur einmal in jedem Entwicklungsstadium (Larve, Nymphe,
adulte weibliche und männliche Zecke) und nehmen dabei
im Lauf von Tagen eine relativ große Blutmenge von derselben
Körperstelle des Wirts auf. Der Entwicklungszyklus verschiedener
Schildzeckenarten ist sehr ähnlich. Die europäische
Zecke Ixodes ricinus, der so genannte Holzbock, sucht
in seinen verschiedenen Entwicklungsstufen (Larve, Nymphe und
adulte Tiere) in der bodennahen Vegetation vorbeikommende Blut-Wirte.
Auf dem Wirt sucht die Zecke eine geeignete Hautstelle für
die Blutmahlzeit, schlitzt die Haut mit den skalpellartigen
Mundwerkzeugen (Chelizeren) auf, führt den gezahnten Rüssel
(Hypostom) in die Wunde, welcher zusammen mit dem so genannten
Zement, der von den Speicheldrüsen sezerniert wird, die
Zecke fest an ihrem Platz verankert. Dort haftet die Zecke für
einige Tage fest: Larven 2-3 Tage, Nymphen 4-5 Tage
und adulte weibliche Zecken 7-9 Tage. In dieser Zeit
wächst sowohl der Darm als auch die Haut aktiv, um die
enormen Blutmengen zu bewältigen, welche in den letzten
24 Stunden der Blutmahlzeit aufgenommen werden (Gray 2002).
Die adulte männliche Zecke, deren Rücken zur Gänze
von einem Chitinschild bedeckt ist, nimmt selbst nur sehr selten
eine, und dann eine sehr kleine Blutmahlzeit, befruchtet das
Weibchen gewöhnlich bei ihrer Blutmahlzeit an einem großen
Wirtstier und stirbt dann ab. Zecken stechen Blutgefäße
nicht direkt an, sondern bilden durch Sekretion vasoaktiver
Mediatoren und Immunmodulatoren einen „Ernährungs-Teich“,
den so genannten „feeding pool“, in dem das Blut
flüssig bleibt und Gegenreaktionen des Wirts unterdrückt
werden. Die Blutmahlzeit wird durch Wasser-Extraktion konzentriert,
das Wasser durch die Speicheldrüsen der Zecke in den Wirt
zurück sezerniert. Mit dem Wasser werden auch die Krankheitserreger
in den Blutwirt transportiert.
Verwandlungen:
Larve, Nymphe, Adulte (weibliche und männliche Zecke)
Wenn
die Zecke vollgesogen ist, zieht sie das Hypostom zurück,
fällt vom Wirtstier ab, beginnt die Blutmahlzeit zu verdauen
und sich ins nächste Stadium zu entwickeln. Die Verdauung
erfolgt durch Pinozytose (Mikrophagozytose) und Endozytose der
Blutbestandteile durch die Darmwandzellen. Danach folgt eine
intrazelluläre Verdauung anstelle einer intraluminalen
Verdauung, wie sie bei den meisten anderen hämatophagen
Arthropoden üblich ist. Die Verdauung und die anschließende
Verwandlung in ein neues Entwicklungsstadium gehen langsam vor
sich. Die Entwicklung kann in den gemäßigten Klimazonen
einige Monate dauern. Nach der Metamorphose folgt eine Ruhephase,
bis die ungesogene Zecke schließlich auf die Vegetation
klettert und einem neuen Blutwirt auflauert. Bei Ixodes
ricinus kann zwischen den Blutmahlzeiten ein ganzes Jahr
vergehen.
Krankheitserreger
in Zecken
Krankheitserreger
sind entweder bereits durch transovarielle Übertragung
in den Larven vorhanden (wie Babesien und FSME-Viren), und/oder
sie werden von verschiedenen Wirtstieren bei der Blutmahlzeit
aufgenommen. Das Überleben von aufgenommenen Mikroorganismen
wird durch den von Verdauungs-Enzymen freien Darm von Schildzecken
begünstigt. Die meisten von Zecken übertragenen Krankheitserreger
durchdringen die Darmwand kurz nach ihrer Aufnahme mit der Blutmahlzeit
und befinden sich als Infektionserreger in den Speicheldrüsen
des nächsten Entwicklungsstadiums der Zecke. Ausnahmen
bilden die Borrelien. Diese Krankheitserreger bleiben im Darm
und wandern erst bei der Blutmahlzeit des nächsten Entwicklungsstadiums
der Zecke in die Speicheldrüsen. Sie benötigen eine
bestimmte Zeit zur Aktivierung, welche gewöhnlich durch
Temperaturerhöhung bei der Blutmahlzeit erreicht wird.
Da jedes Zecken-Entwicklungsstadium nur einmal eine Blutmahlzeit
benötigt, werden die Infektionserreger durch ein Entwicklungsstadium
aufgenommen (Larve oder Nymphe) und durch das nächste übertragen
(Nymphe oder adulte weibliche Zecke); man nennt dies die transstadiale
Übertragung.
Lebensbereich
und Mikroklima
Die
frei lebenden Stadien von Schildzecken sind gegenüber Austrocknung
sehr empfindlich. Sie können in einem Milieu mit weniger
als 80% relativer Luftfeuchte nicht überleben. Diese Lebensbedürfnisse
zwingen die Zecken in Bereiche (Habitate), in denen die relative
Luftfeuchte in der bodennahen Vegetation selbst im Hochsommer
nicht unter 85% abfällt. Ungesogene Zecken und solche,
die kürzlich eine Blutmahlzeit beendet haben, nehmen Wasser
aus der feuchten Umgebungsluft durch hygroskopische Substanzen
auf, die von den Speicheldrüsen sezerniert werden. So ausgestattet
können ungesogene Zecken ihre Wirtssuche auch in die obere
Vegetation ausdehnen und ihren Blutwirten über einige Tage
auflauern, bevor sie zur Rehydrierung wieder auf den Erdboden
zurück müssen. Zecken können in offenen Gebieten
mit häufigen Regenfällen und dichter Vegetation existieren.
Allerdings ist ein Habitat aus Laub- und Mischwäldern typischer,
weil es die Lebensbedingungen für alle Entwicklungsstufen
bietet und dazu noch eine Fülle von Wirtstieren für
Ixodes ricinus und für andere Schildzeckenarten
bereithält.
Wirtstiere
je nach Entwicklungsstadium
Die
drei Entwicklungsstadien der Schildzecken befallen verschiedene
Wirte. Larven befallen gewöhnlich Nager, Nymphen befallen
Vögel und mittelgroße Säugetiere, während
adulte weibliche Zecken große Wirtstiere wie Rehe und
Rotwild zur Blutmahlzeit aufsuchen. Larven
bewegen sich bis zu 20 cm, Nymphen bis zu 40 cm und
adulte Zecken bis zu 80 cm über dem Erdboden,
und das nur so lange, bis sie die Austrocknungsgefahr in Bereiche
mit idealer Luftfeuchte hinunter drängt. Doch selbst adulte
Zecken klettern gewöhnlich nie höher als einen halben
Meter über dem Boden. Die unterschiedliche Verteilung auf
der Vegetation erklärt wahrscheinlich auch die relative
Wirtsspezifität der Zecken. Alle Stadien von Ixodes
ricinus befallen auch den Menschen, aber es ist mehrfach
belegt, dass Nymphen den Menschen viel öfter befallen als
Larven oder Adulte.
Wirtssuche
je nach Saison
Schildzecken
vermeiden trockene und kalte Perioden des Jahres. In den meisten
Habitaten ist die Wirtssuche im Frühling und Frühsommer
am intensivsten und im Sommer am geringsten. Bei uns beobachtet
man einen zweiten, etwas niedrigeren Aktivitätsgipfel der
Zecken im Herbst. Dieses Grundmuster variiert selbstverständlich
wegen der unterschiedlichen Wirte und des Einflusses von Makro-
und Mikroklima. Die Perioden der Wirtssuche regulieren Zecken
durch eine Ruhepause nach einer Stadienwandlung, die sogenannte
Diapause. Sie gilt für Eier, voll gesogene Larven und Nymphen.
Die Diapause schützt Zecken davor, ihre Entwicklung im
Frühwinter zu beginnen, und verzögert die Aktivität
der ungesogenen, hungrigen Zecken bis nach dem Hochsommer.
Einflüsse
auf Zeckenpopulationen
In
jedem Habitat hängt die Dichte der Zeckenpopulationen von
der Art der Vegetation, von Klima und Wetter sowie von der Anwesenheit
von Blutwirten in den parasitischen Lebensphasen ab. Optimale
Habitate sind Laubwälder in gemäßigten Klimazonen,
welche gewöhnlich auch Lebensraum für zahlreiche Blutwirte
der Zecken sind. Große Tiere haben als Blutwirte den größten
Einfluss auf die Dichte der Zeckenpopulation. Falls das Habitat
speziell für die frei lebenden Entwicklungsphasen der Zecken
geeignet ist, genügt sogar eine relativ kleine Zahl von
Wild, um eine sehr große Zeckenpopulation zu erhalten.
Das Verständnis der Faktoren, die eine dichte Zeckenpopulation
bedingen, hat auch einen Voraussagewert für z.B. Klimaänderungen.
Dies belegt eine Studie aus Schweden, in der die Ausbreitung
von Ixodes ricinus in den Norden des Landes und die
damit verbundene Zunahme von FSME-Fällen in Schweden auf
die seit mehr als einem Jahrzehnt wärmeren Wintertemperaturen
zurückgeführt wird (Lindgren et al. 2000). Temperaturzunahme
kann die Zeckendichte und Zeckenverteilung auf verschiedene
Weise fördern. Es steht mehr Zeit für den Ablauf des
Entwicklungszyklus innerhalb einer Saison zur Verfügung,
die Zeckenhabitate können sich durch intensiver wachsende
Vegetation weiter ausdehnen, und geeignete Blutwirte stehen
wegen der besseren Winterbedingungen für Wildtiere auch
im Herbst und Winter zur Verfügung. Weiters finden sich
infektiöse Zecken noch in Höhen von 1350 m (Stünzner
et al. 2006).
|
| Schildzecken-Borreliose
(folgend Borreliose)
Borrelien
Borrelien
sind Bakterien aus der Familie der Spirochätazeen. Krankheitserreger
in Europa sind Borrelia afzelii, B. burgdorferi
sensu stricto und B. garinii; in Einzelfällen
wurden B. valaisiana, B. bissettii und B.
spielmanii von Patienten mit Borreliose isoliert. In Europa
ist der wichtigste Vektor die Zecke Ixodes ricinus.
Nager und Vögel sind wichtige Reservoire dieser Borrelien.
Durchschnittlich sind in Österreich 22% der Ixodes
ricinus-Zecken mit Borrelien infiziert (Radda et al. 1986,
Stanek et al.1986). In Nordamerika ist nur B.burgdorferi
sensu stricto als Krankheitserreger vorhanden.
Krankheitsbilder
und Diagnose
Die Borreliose
ist die häufigste von Schildzecken übertragene bakterielle
Infektionskrankheit in der nördlichen Hemisphäre.
Erkrankungsfälle sind aus ganz Europa bekannt. Die Krankheitserreger
werden ausschließlich durch Ixodes-Zecken übertagen.
Die Infektionskrankheit manifestiert sich in Erkrankungen von
Haut, Nervensystem, Muskel- und Skelettsystem, Herz und seltener
anderer Organe wie Augen, Nieren und Leber. Rund 3% erkranken
nach einem Zeckenstich an Borreliose. Der Zeckenstich wird nur
etwa von der Hälfte der Betroffenen bemerkt. Wir unterscheiden
frühe lokalisierte, frühe disseminierte, späte
und chronisch persistierende oder progrediente Infektionen.
Dissemination und Organmanifestation sind an Eigenschaften der
jeweiligen Borrelienstämme sowie an die Gast-Wirts-Beziehung
gebunden, die heute nur in Ansätzen verstanden werden.
Die
klinischen Manifestationen der Schildzecken-Borreliose sowie
die wesentlichen Elemente der Diagnostik entsprechen den klinischen
Falldefinitionen der European Union Concerted Action on Lyme-Borreliosis
(EUCALB) (Stanek et al. 1996) und dem Lancet Seminar (Stanek,
Strle 2003).
Erythema
(chronicum) migrans
Das
Erythema migrans ist die häufigste Manifestation der Borreliose
und bei über 85% der Patienten die einzige klinische Erscheinung,
die in Europa ganz überwiegend von Borrelia afzelii
hervorgerufen wird. Die Hautinfektion entwickelt sich nach einer
variablen Inkubationszeit von wenigen Tagen bis über einen
Monat nach dem infektiösen Zeckenstich. Sie ist durch einen
sich zentrifugal um die Stichstelle ausbreitenden roten Fleck
charakterisiert (Abbildung 1, 2). Eine zentrale Abblassung wird
bei zunehmender Ausdehnung des Erythems häufig beobachtet
(Abbildung 3), die Kokardenform ist ebenfalls nicht ungewöhnlich
(Abbildung 4). Multiple Erythemata (MEM) entstehen infolge hämatogener
Verbreitung der Borrelien vom ursprünglichen Erythem. Neben
dem ersten Erythem entstehen unabhängig von der Zeckenstichstelle
auf verschiedenen Hautstellen weitere Erytheme. MEMs werden
in Europa viel seltener als in den USA und dann häufiger
bei Kindern beobachtet. Bestätigt wird die Diagnose durch
die Anzüchtung von Borrelien und/oder den Nachweis von
Borrelien-DNA in Hautproben. Serologische Untersuchungen zum
Nachweis der aktuellen Infektion sind für die Diagnose
„Erythema migrans“ nicht zielführend (Stanek
et al. 1999). Wird dennoch die Serologie gewünscht, sollten
8 ml Nativ-Blut und 4 ml EDTA-Blut zum Zeitpunkt der klinischen
Diagnose und noch einmal 6-8 Wochen später abgenommen werden
und am besten an das Referenzzentrum für „Borrelia“
im Hygiene-Institut der Medizinischen Universität Wien
eingesendet werden. Die Ergebnisse stellen einen Ausgangswert
dar, beeinflussen aber weder die klinische Diagnose noch geben
sie einen Hinweis auf den Behandlungserfolg.
|
Abbildung 1:
Erythema migrans in der Kniekehle
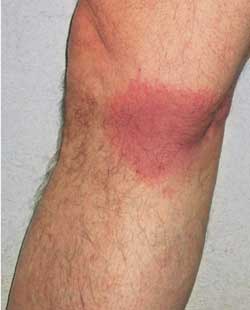
|
Abbildung 2:
Erythema migrans auf der rechten Brust
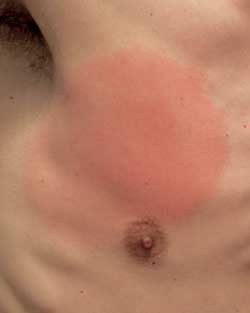
|
|
Abbildung 3:
Erythema migrans auf dem Unterschenkel, kurz nach Behandlungsbeginn
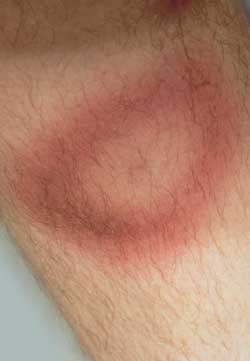
|
Abbildung 4:
Erythema migrans, kokardenförmig, auf dem Rücken
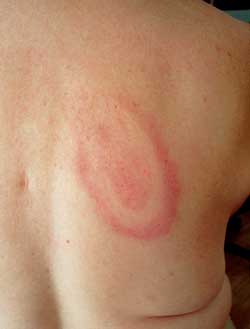
|
Borrelien-Lymphozytom
Das Borrelien-Lymphozytom ist eine seltene Manifestation schmerzloser,
blauroter Knoten oder Plaques, die sich bei Kindern gewöhnlich
am Ohrläppchen, am Ohrrand oder am Skrotum, bei Erwachsenen
an der Brustwarze befinden (Abbildung 5a, 5b, 5c). Ein vorausgegangenes
oder vorhandenes Erythema migrans und der histologische Nachweis
eines B-Zell-Pseudolymphoms unterstützen die Diagnose.
Selten gelingt der Beweis der Borrelien-Infektion durch Anzüchtung
von Borrelien (Strle et al. 1992) oder Borrelien-Nukleinsäure-Nachweis
aus Hautbiopsien.
|
Abbildung 5a:
Borrelien-Lymphozytom am Ohrläppchen
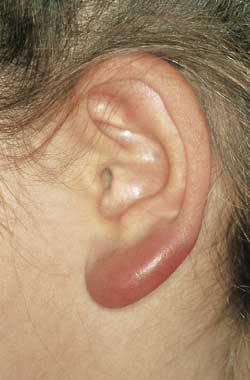
|
Abbildung
5b: Borrelien-Lymphozytom am Ohrläppchen
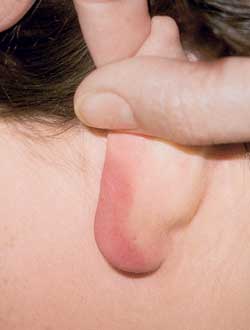
|
Abbildung
5c: Borrelien-Lymphozytom an der Brustwarze
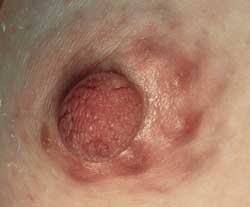
|
Acrodermatitis
chronica atrophicans (ACA)
Dabei handelt es sich um eine chronisch progressive, fibrosierende
Hauterkrankung, die in Europa die häufigste Form einer
chronischen Schildzecken-Borreliose darstellt. Der Erreger ist
ganz überwiegend Borrelia afzelii. ACA tritt gewöhnlich
auf den Streckseiten der Extremitäten auf (Abbildung 6),
zuerst als teigige Haut-Schwellung oder blaurote Verfärbung,
später gefolgt von Atrophie, welche die Haut sehr zart
und durchscheinend macht, gefältelt wie Zigarettenpapier
(Abbildung 7). Die Venen treten deutlich hervor, eine fleckige
Pigmentierung tritt auf. Über Knochenvorsprüngen sind
Verdickungen und Knotenbildungen möglich. Bei lange bestehender
ACA tritt bei einem Großteil der Fälle eine periphere
Neuropathie auf (Kristoferitsch et al. 1988). Die sind alles
Folgen einer kontinuierlich bestehenden Infektion. Borrelien
wurden aus mehr als 20 Jahre bestehenden ACA-Hautläsionen
isoliert. Gewöhnlich findet man bei ACA-Patienten hohe
Serumkonzentrationen von IgG-Antikörpern gegen Borrelien.
Die klinische Diagnose wird durch das histologische Bild einer
intensiven lymphozytären Infiltration, die Anzüchtung
von Borrelien und/oder durch den Nachweis von Borrelien-Nukleinsäure
in Hautproben bestätigt.
|
Abbildung 6:
Acrodermatitis chronica atrophicans, Unterschenkel
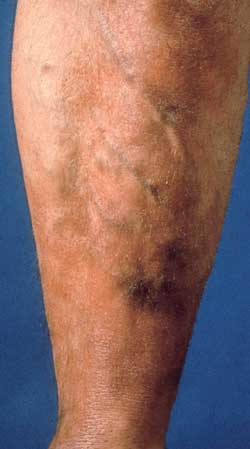
|
Abbildung 7:
Acrodermatitis chronica atrophicans; atrophe, zigarettenpapierdünne
Haut
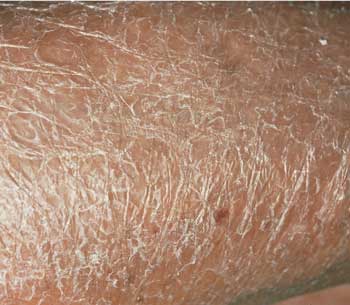
|
Neuroborreliose
Die frühe Neuroborreliose ist nach dem Erythema migrans
die häufigste Manifestation einer akuten Schildzecken-Borreliose
in Europa. Mit einer Inkubationszeit von durchschnittlich vier
(Kinder) bis sieben (Erwachsene) Wochen manifestiert sie sich
als milde aseptische Meningitis, isolierte einseitige oder manchmal
beidseitige Fazialisparese oder als Neuritis anderer Hirnnerven,
beziehungsweise bei Erwachsenen gewöhnlich als schmerzhafte
Meningo-Radikuloneuritis (Garin-Bujadoux-Bannwarth-Syndrom)
mit oder ohne Fazialis-Lähmung oder Lähmung anderer
Hirnnerven. Das diagnostische Spektrum umfasst Radikuloneuritis,
Meningoradikulitis, kraniale Hirnnervenneuritis, Meningitis,
Meningoenzephalitis, Radikulomyelitis, Enzephalitis und Enzephalomyelitis.
Die
Radikulitis-Symptome entwickeln sich durchschnittlich sieben
Wochen nach dem Zeckenstich oder nach einem Erythema migrans.
Dabei treten zuerst Schmerzen auf, die nachts stärker werden
mit wechselnder Lokalisation. Die Schmerzen werden als brennend,
bohrend, beißend oder reißend erlebt und sprechen
nur wenig auf Analgetika an. Bei drei von vier dieser Patienten
entwickeln sich nach einer bis vier Wochen neurologische Ausfälle,
Lähmungen häufiger als Sensibilitätsstörungen.
Die Lähmungen sind oft asymmetrisch verteilt, wobei die
Extremität, von der die Zecke entfernt oder an der das
Erythema migrans lokalisiert war, häufig deutlicher betroffen
ist als die Gegenseite. Da die Radikulitis im Gegensatz zu der
seltenen Polyneuritis prompt auf eine Behandlung mit Antibiotika
anspricht, wird eine primär durch die Erreger hervorgerufene
Entzündungsreaktion angenommen.
Bei
einem Großteil der Patienten mit Bannwarth-Syndrom kommt
es zu Hirnnervenausfällen. Es können alle Hirnnerven
beteiligt sein, mit Ausnahme des Riechnervs. Bei Hirnnervenbeteiligung
ist ganz überwiegend der Nervus facialis betroffen, wobei
ein beidseitiger Befall nicht selten ist. Unabhängig von
der Schwere der Fazialisparese ist die Prognose sehr gut. In
den meisten Fällen kommt es innerhalb von 1-2 Monaten zu
einer vollständigen Rückbildung. Defektheilungen werden
bei etwa 5% der Patienten beobachtet.
Eine
Beteiligung des zentralen Nervensystems wird im Rahmen einer
Neuroborreliose sehr selten festgestellt. Die häufigste
Manifestation ist eine Myelitis mit spastisch-ataktischem Gang
und Blasenstörung. Die Symptomatik kann sich über
Tage oder mehrere Monate entwickeln. Bei 2/3 der Patienten kommt
es zu einer schweren Tetra- oder Paraparese. Bei mehr als der
Hälfte der Patienten mit Myelitis finden sich zusätzliche
Zeichen einer Enzephalitis und bei etwa der Hälfte eine
Hirnnervenbeteiligung.
Eine
periphere Neuropathie wird bei europäischen Patienten meist
in Verbindung mit einer Acrodermatitis chronica atrophicans
gesehen. Die Beschwerden äußern sich in distalverteilten
Parästhesien. Die wenigen histologischen Untersuchungen
zeigten Perivaskulitis und thrombosierte epineurale Blutgefäße.
Im
Liquor cerebrospinalis findet sich eine lymphozytäre Pleozytose
(Abbildung 8). Intrathekal gebildete spezifische Antikörper
lassen sich bei Erwachsenen meist regelmäßig nachweisen.
Bei Kindern mit isolierter Fazialisparese sowie sehr früh
nach Krankheitsbeginn kann die Liquorpleozytose fehlen (Millner
et al. 1989, Stanek 1991). Früh nach Krankheitsbeginn und
bei geringer Liquor-Zellzahl gelingt auch die Anzüchtung
der Borrelien aus dem Liquor, der Erreger ist überwiegend
Borrelia garinii.
| Abbildung
8: Charakteristisches Liquorzellbild bei Meningoradikuloneuritis
Garin-Bujadoux-Bannwarth
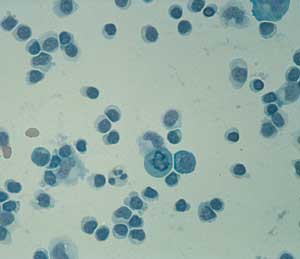
|
Abbildung
9: Borrelien-Arthritis des linken Knies. Infoge
einer Baker-Zyste Wadenschwellung median. (Diese Abbildung
wurde von Herrn Prof. Dr. Peter Herzer, München,
zur Verfügung gestellt.)
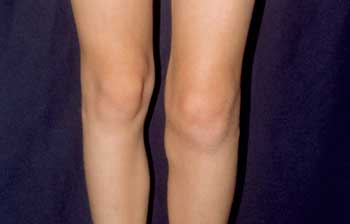
|
Lyme-Arthritis
Die typische Lyme-Arthritis manifestiert sich als intermittierende
oder chronische Mono- oder Oligoarthritis der großen Gelenke
(Abbildung 9), die selten mit Erosionen von Knorpel und Knochen
verbunden sein kann. Das Knie ist am
häufigsten betroffen. Der Nachweis von Borrelien-DNA
in Synovialflüssigkeit und Synoviabiopsien sowie der seltene
kulturelle Borrelien-Nachweis aus diesen Proben weisen auf eine
direkte Infektion des Gelenks hin (Marlovits et al. 2004). Die
Gelenksentzündung(en) schwinden nach einigen Jahren spontan.
Bei manchen Patienten mit einer so genannten Behandlungsresistenten
Arthritis scheint eine genetische Prädisposition zur Lyme-Arthritis
zu bestehen, denn sie findet sich viel häufiger bei Personen
mit einem HLA-DR2- oder DR4-Phänotyp, was auf einen Immunogenitäts-Faktor
in der Pathogenese hinweist. Bei amerikanischen Patienten ist
in etwa der Hälfte der Blutsenkungswert leicht erhöht,
bei Leukozytose und/oder einem erhöhten Serum-IgM. Das
CRP ist gewöhnlich im Normalbereich. Kryoglobuline und
zirkulierende Immunkomplexe können vorliegen. Die meisten
Patienten haben keine Rheumafaktoren, keine antinukleären
Antikörper. Polymorph-kernige Leukozyten überwiegen
in der Synovialflüssigkeit, die Zellzahl bewegt sich zwischen
0,5 und 110 x109 pro L.
Die
Diagnose Lyme-Arthritis basiert auf der Anamnese, dem klinischen
Erscheinungsbild, dem Ausschluss anderer Arthritis-Ursachen
und dem Nachweis von Serum-IgG-Antikörpern gegen Borrelien.
Die Anzüchtung von Borrelien aus der Synovialflüssigkeit
gelingt nur sehr selten. Hingegen ist der Nachweis von Borrelien-DNA
in der Synovialflüssigkeit oder in der Synovia mittels
PCR sehr sensitiv. Differentialdiagnostisch gleicht die Lyme-Arthritis
bei Kindern am ehesten einer oligoartikulären juvenilen
Arthritis und bei Erwachsenen einer reaktiven Arthritis.
Lyme-Karditis
Die Borrelien-Infektion des Reizleitungssystems des Herzens
äußert sich in transienten Rhythmusstörungen
und Atrioventrikulärem Block zweiten und dritten Grades.
Die Anzüchtung von Borrelien aus Herzmuskelproben eines
Patienten mit lange bestehender dilatativer Kardiomyopathie
(Stanek et al. 1990) lässt auch an chronische Herzerkrankungen
denken. Für die Begründung eines ursächlichen
Zusammenhangs stehen bisher Ergebnisse kontrollierter Studien
aus. Insgesamt ist die spezifische Diagnose der Lyme-Karditis
durch den Mangel an Möglichkeiten für den direkten
Erregernachweis erschwert.
Unspezifische
Symptome
Einige Patienten mit einer frühen oder späten Form
der Lyme-Borreliose berichten über unspezifische Beschwerden
wie Krankheitsgefühl, Müdigkeit, Unruhe, psychische
Veränderungen, Depression, Kopf-, Muskel- und Gelenksschmerzen.
Borrelien können gelegentlich muskulo-skeletale, neurokognitive
oder Müdigkeits-Symptome auslösen, aber diese Vorkommnisse
sind ungewöhnlich und die Symptome unterscheiden sich nicht
von denen, die durch andere Infektionen oder belastende physische
oder emotionale Ereignisse ausgelöst werden.
Laboratoriumsdiagnostik
der Borreliose
Direkter
Nachweis durch Kulturund/oder PCR
Die Anzüchtung von Borrelien gelingt am besten aus Hautbiopsien
vom Erythema migrans. Mit weitaus geringerem Erfolg lassen sich
Borrelien aus Liquor cerebro spinalis, Blut, Gelenkspunktat
und Synovia-Biopsien sowie Muskel- und Herzmuskelbiopsie anzüchten.
Das Untersuchungsmaterial muss vor Beginn der Antibiotikabehandlung
gewonnen werden. Anzüchtung und Identifizierung von Borrelien
werden im Zentrum für Infektionsdiagnostik mit „Borrelia“
Referenz-Laboratorium durchgeführt.
Wichtiger
Grundsatz für die Interpretation eines negativen Ergebnisses
nach dem Versuch des direkten Nachweises von Borrelien mittels
Kultur und/oder PCR: die Infektion mit dem vermuteten Erreger
ist dadurch nicht ausgeschlossen.
Serologie
Bei Erythema migrans ist der Wert eines serologischen
Befundes sehr gering. Wenn er gewünscht wird, dann werden
zumindest 2 Serumproben im Abstand von 6 bis 8 Wochen benötigt.
Die Ergebnisse haben jedoch keinen bestätigenden Wert für
die klinische Diagnose, das gilt sowohl für IgM- als auch
für IgG-Antikörper.
Bei
Vorliegen einer oder Verdacht auf alle weiteren Manifestationen
der Borreliose sollten nur noch IgG-Antikörper
berücksichtigt werden. Nachweis intrathekal gebildeter
IgG-Antikörper ist bei Verdacht auf Neuroborreliose
erforderlich; hierzu werden Liquor- und Serumproben
vom selben Tag benötigt.
Ergebnisse
mit verschiedenen Testsystemen dürfen nicht miteinander
verglichen werden. Das noch gültige Prinzip der Borrelien-Serologie
ist das „Zwei-Test-Prinzip“. Mit dem ersten sensitiven
Test, heute meist ein ELISA, wir nach spezifischen Antikörpern
gesucht, mit dem zweiten Test, einem Immunoblot/Westernblot,
wird ein grenzwertiges oder positives Ergebnis auf seine Spezifität
geprüft. Fällt der Immunoblot negativ aus, dann war
das erste Ergebnis falsch grenzwertig oder falsch positiv.
Positive
serologische Ergebnisse allein sind keine Indikation für
eine antibiotische Behandlung! Bei positiver Serologie ohne
Klinik ist ein Kontrolltest nach 3-4 Monaten zu empfehlen.
Therapie
der Borreliose
Prinzip
und Behandlungszeit
Alle klinischen Manifestationen der Lyme-Borreliose sollen mit
Antibiotika behandelt werden. Nur solche Antibiotika dürfen
verwendet werden, die sich in vitro und in klinischen
Studien als wirksam erwiesen haben. Die Ergebnisse einer Behandlung
hängen nicht nur von Lokalisation, Ausdehnung und Dauer
der klinischen Manifestationen ab, sondern auch vom ausgewählten
Antibiotikum, von Dosis, Behandlungsdauer, möglichen Nebenwirkungen
und Komplikationen. Patienten mit Neuroborreliose erhalten Antibiotika
primär intravenös, bei den meisten anderen Manifestationen
werden Antibiotika oral verabreicht. Zehn bis 14 Tage sind die
empfohlenen Behandlungszeiten für Erythema migrans, Borrelien-Lymphozytom
und Neuroborreliose.
Antibiotika
Geeignete Antibiotika für die Behandlung lokalisierter
Manifestationen sind Phenoxymethylpenicillin (Penicillin
V), Amoxicillin, Cefuroxim und Doxycyclin, die oral verabreicht
werden. Azithromycin hat sich ebenfalls als wirksam erwiesen
(Strleet al. 1996), ist aber in Österreich für diese
Indikation nicht zugelassen. Neuroborreliose
wird mit Ceftriaxon oder Penicillin G behandelt, welche intravenös
gegeben werden (Stanek & Strle 2003). Zur Behandlung chronischer
Manifestationen werden dieselben Substanzen verwendet, die Behandlungszeit
wird in der Regel aber verdoppelt (Tabelle 1).
Tabelle
1: Behandlung der Schildzecken-Borreliose
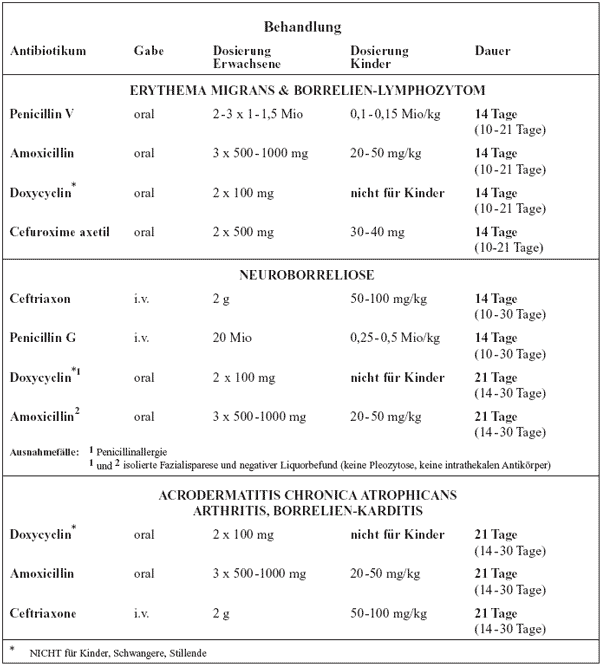
Bei
oralen Penicillinen wird allgemein empfohlen, die Tagesdosis
auf zwei bis drei Einzelgaben aufzuteilen. Eine Tagesdosis von
25.000 I.E. Penicillin V pro kg Körpergewicht sollte bei
Kindern und Erwachsenen nicht unterschritten werden. Dosierungen
bis 6.0 Mega I.E. Penicillin V pro Tag werden von Erwachsenen
komplikationslos vertragen. Penicillin V ist auch zur Behandlung
von Erythema migrans in der Schwangerschaft geeignet.
Patienten
mit Neuroborreliose und schwerer Lyme-Karditis werden mit Ceftriaxon
oder mit Penicillin G intravenös für 2-3 Wochen und
nur ausnahmsweise oral mit Doxycyclin behandelt. Für die
Behandlung von Acrodermatitis chronica atrophicans und Arthritis
werden Doxycyclin, Amoxicillin (beide oral) oder Ceftriaxon
(parenteral) empfohlen.
Seropositive
Gesunde nicht behandeln !
Bei Personen mit Antikörpern gegen Borrelien, aber ohne
klinische Zeichen einer Erkrankung wird empfohlen zu beobachten,
denn eine Antibiotika-Behandlung von gesunden, seropositiven
Personen ist nutzlos. Das gilt auch für Personen, die nach
den Empfehlungen behandelt worden und nur unvollständig
genesen sind. Sie können an lange anhaltenden Symptomen
wie hartnäckiger Müdigkeit, Myalgien, Arthralgien,
Parästhesien oder Dysästhesien oder Beeinträchtigung
der Gedächtnisleistung und Stimmungsschwankungen leiden.
Dieses Syndrom wird „post-treatment chronic Lyme borreliosis“
genannt. Ergebnisse von Studien aus den USA zeigten, dass die
Symptome solcher Patienten durch lange dauernde Antibiotika-Behandlung
(i.v. Ceftriaxon für 30 Tage, gefolgt von oralem Doxycyclin
für 60 Tage) nicht besser beeinflusst wurden als durch
Plazebo.
Therapieversager
Wenn Symptome nach einer den Empfehlungen entsprechenden Behandlung
anhalten, darf man diese nicht ohne Weiteres mit einer Persistenz
der Borrelien gleichsetzen. Nur extrem selten gelingt der mikrobiologische
Beweis eines Behandlungsfehlers nach einer entsprechenden Therapie.
Allerdings scheinen Borrelien postinfektiöse Syndrome bahnen
zu können, wie Fibromyalgie, wobei die Symptome in Abwesenheit
lebender Borrelien bestehen bleiben und daher auch nicht auf
Antibiotika reagieren. Manchmal ist ein Therapieversagen auf
eine irreversible Gewebsschädigung durch die Borrelien-Infektion
zurückzuführen. Aber wahrscheinlich viel häufiger
ist eine falsche Diagnose Ursache für Therapieversagen.
Daher ist die Behandlung von seropositiven Patienten mit –
zum Beispiel – Arthralgien und Myalgien viel eher eine
Behandlung von serologischen Ergebnissen und nicht von Borreliose.
|
| Prophylaxe
Antibiotikaprophylaxe
Die Gabe
von Antibiotika nach einem Zeckenstich wird in Europa
nicht empfohlen. Bei einer Manifestationsquote von
etwa 4% wäre die breitgestreute Gabe von Antibiotika nicht
nur unnötig sondern sogar gefährlich, da sie ein Großteil
gar nicht gebraucht hätte, aber durch die Behandlung an
anderen Infektionen erkranken könnte (wie z.B. Pilzinfektionen
von Schleimhäuten).
Immunprophylaxe
Eine aktive
Immunisierung mit einem rekombinanten OspA-Serotyp-1-Impfstoff
(OspA-Serotyp 1 ist ein dominantes immunogenes Oberflächenprotein
von Borrelia burgdorferi sensu stricto) war in den
USA über 3 Jahre im Handel, wurde aber am Beginn des Jahres
2002 vom Markt genommen. Die Impfung erzielte eine Schutzrate
von 80 –100%, die Frequenz der Auffrischungsimpfungen
war noch nicht definiert. Wegen der unterschiedlichen Genospezies
und der großen Zahl von Serotypen in Europa sind hier
bei der Entwicklung eines Lyme-Borreliose-Impfstoffes zahlreiche
Probleme zu bewältigen.
|
| Früh-Sommer-Meningo-Enzephalitis
(FSME) Infektionsmöglichkeit
Das FSME-Virus
ist das bedeutendste durch Zecken übertragene Flavivirus.
Das FSME-Virus-Genom ist sehr stabil, seine Oberflächenantigene
bleiben praktisch unverändert. Man unterscheidet den europäischen,
zentral-sibirischen und den fernöstlichen Subtyp des FSME-Virus.
Das Virus zirkuliert in Naturherden zwischen kleinen Säugetieren,
Weidetieren und Schildzecken. Menschen werden gewöhnlich
durch Zeckenstich in einem Naturherd infiziert. Es besteht aber
auch die seltene Möglichkeit, FSME-Viren durch Genuss nicht
pasteurisierter Milch von infizierten Milchtieren aufzunehmen.
Die Erkrankung wurde deshalb früher auch biphasisches Milchfieber
genannt. Die FSME ist in umschriebenen geografischen Gebieten
Europas endemisch (siehe Website des Bundesministeriums für
Gesundheit, Familie und Jugend http://www.bmgfj.gv.at).
Krankheitsverlauf
Typischerweise
verläuft die FSME in zwei Phasen. Die erste Erkrankungsphase
tritt 4 bis 14 Tage nach dem Zeckenstich auf und dauert nur
wenige Tage. Sie ist durch Fieber, Kopf- und Gliederschmerzen,
eventuell katarrhalische Symptome des Respirationstraktes und
gelegentlich durch Beschwerden seitens des Magen-Darm-Traktes
gekennzeichnet. Diese unspezifischen Symptome werden nicht unzutreffend
als Sommergrippe bezeichnet. Nach einem Intervall von wenigen
Tagen beginnt die zweite Erkrankungsphase, sofern das Virus
die Blut-Hirn-Schranke durchsetzt und das Gehirn und die Hirnhäute
infiziert hat. Das Fieber ist jetzt höher, begleitet von
heftigen Kopfschmerzen und Erbrechen. Die zweite Phase kann
als Meningitis, Meningoenzephalitis oder als Meningoenzephalomyelitis
verlaufen. Auch periphere Nerven können betroffen sein.
Selbst schwerste Formen der FSME heilen meist folgenlos aus;
nur selten bleiben Lähmungen zurück.
Spezifische
Diagnose
Wegen des
uncharakteristischen Krankheitsbildes erfolgt die spezifische
Diagnose gewöhnlich durch Nachweis spezifischer IgM- und
IgG-Serum-Antikörper (Holzmann et al.1996). Beim Ausbruch
der Erkrankung des Zentralnervensystems lassen sich nur in 50%
spezifische Liquor-Antikörper nachweisen, ab dem 10. Krankheitstag
finden sie sich bei allen Patienten (Hofmann et al. 1983).
Prophylaxe
Eine spezifische
Behandlung gibt es nicht, bei ausgebrochener Erkrankung kann
nur symptomatisch behandelt werden. Für die spezifische
Prophylaxe stehen Impfstoffe zur intramuskulären Verabreichung
zur Verfügung. Die österreichische Bevölkerung
hat die Empfehlungen zur Schutzimpfung gegen FSME eindrucks
vollbejaht. Mehr als 80% der Gesamtbevölkerung sind geimpft
(Kunz et al. 1991). Erst diese umfassende Immunisierung, nicht
aber die gezielte Immunsierung von exponierten Personen allein,
hat zu einer signifikanten Reduktion der FSME in Österreich
geführt. Die aktive Immunisierung erfolgt mit einer inaktivierten
FSME-Ganzvirus-Vakzine (Baxter, Novartis Behring), die für
Kinder (0,25 ml) und Erwachsene (0,5 ml) zur Verfügung
steht. Für die Vollimmunisierung sind drei Impfungen erforderlich
nach dem Zeitschema 0-1-12 Monate. Auffrischungs-Impfungen erfolgen
nach den Empfehlungen im jeweiligen Impfplan (siehe Website
des BMfGFJ http://www.bmgfj.gv.at).
Vor einer Auffrischungsimpfung kann der Grad der bestehenden
Immunität durch serologische Untersuchungen ermittelt werden.
Die Serokonversionsrate nach FSME-Impfung liegt zwischen 98
und 99%, die Schutzrate über 98%. Eine passive Immunisierung
wird wegen der geringen oder fraglichen Schutzwirkung und der
möglichen Komplikationen bei verspäteter Gabe heute
völlig abgelehnt.
|
| Humane
Granulozytäre Anaplasmose (HGA) Krankheitserreger
Anaplasma
phagocytophilum ist ein kleines (0,5-2,0 µm), pleomorphes,
obligat intrazelluläres, Gram-negatives Bakterium. Es bildet
in den neutrophilen Granulozyten, den Zielzellen des Bakteriums,
intrazytoplasmatische Mikrokolonien aus, so genannte Morulae,
aus denen sie durch Zytolyse freigesetzt werden und weitere
neutrophile Granulozyten befallen können. A. phagocytophilum
befällt die primären Effektorzellen der antibakteriellen
Abwehr und verfügt über Mechanismen gegen die intrazelluläre
Abtötung.
In
Europa wurde A. phagocytophilum erstmals aus dem Blut
eines Patienten in Slowenien kultiviert (Petrovec et al. 1997).
Die Zecke Ixodes ricinus fungiert als Vektor von A.
phagocytophilum in Europa. Welche Reservoirtiere eine Rolle
spielen, bleibt noch zu erforschen. Die Prävalenz von A.
phagocytophilum in Ixodes ricinus-Zecken aus Österreich
ist relativ hoch (ca. 14%; Publikation in Vorbereitung), jedoch
wurden Anaplasmosen bei uns bisher nur sehr selten beobachtet.
Krankheitsverlauf
Die Erkrankung
beginnt etwa 1 Woche (bis zu 30 Tagen) nach Zeckenstich akut
mit unspezifischen „Grippe-ähnlichen“ Symptomen
(Leitsymptomen) wie hohes Fieber (>39°C), Schüttelfrost,
Krankheitsgefühl, Kopf- und Muskelschmerzen und zusätzlichen
Beschwerden wie Schwindel, Erbrechen, Arthralgien und trockener
Reizhusten. Die Symptome halten gewöhnlich nur einige Tage
an, allerdings sind auch Verläufe von mehr als 2 Monaten
bekannt. Nach Beginn einer adäquaten antibiotischen Therapie
entfiebern die Patienten typischerweise prompt. Differentialdiagnostisch
ist die HGA vor allem gegenüber Virusinfektionen, in erster
Linie gegenüber der FSME abzugrenzen (Lotric-Furlan et
al. 2006)
Spezifische
Diagnose
Die Diagnose
erfolgt durch hämatologische und mikrobiologische Untersuchungen.
Veränderungen im Blutbild sind Thrombozytopenie, Leukozytopenie,
Erhöhung von Transaminasen und C-reaktivem Protein. Für
die mikrobiologische Diagnose werden EDTA-Blut (PCR und Nachweis
von Morulae in neutrophilen Granulozyten) und Serum für
den Nachweis spezifischer Antikörper benötigt.
Behandlung
Die
Behandlung erfolgt bei Kindern und Erwachsenen mit Doxycyclin
für 7 Tage.
|
| Rickettsiosen
Krankheitserreger
Rickettsien
sind Gram-negative, kokkobazilläre Bakterien, die sich
obligat intrazellulär vermehren. Sie befallen Gefäßendothelien.
In Österreich ist ein hoher Anteil, etwa 1/3 von Ixodes
ricinus-Zecken mit Rickettsia helvetica durchseucht
(Publikation in Vorbereitung). Die Präsenz von R. helvetica
in Europa in Ixodes ricinus bewegt sich zwischen 2,5%
und 38% (Fournier et al. 2000). R. slovaca wird in
Mitteleuropa von der Schildzecke Dermacentor marginatus
übertragen, wurde allerdings auch aus I. ricinus
und D. reticulatus isoliert (Rehacek et al. 1997).
Rickettsien gelangen in alle Organe der Zecke und vermehren
sich im Zytoplasma ihrer Zellen. Die Übertragung erfolgt
über den Zeckenspeichel.
Krankheitsverlauf
Rickettsia
helvetica
Der Krankheitsverlauf ist mit Fieber, Abgeschlagenheit, Muskel-
und Kopfschmerzen nicht charakteristisch. Derzeit sind diagnostische
Verfahren zum direkten und indirekten Nachweis noch im Aufbau.
Rickettsia
slovaca
Ein charakteristisches Krankheitsbild wurde erstmals 1996 in
Ungarn beobachtet und führte zur Beschreibung des Syndroms
„tick-borne lymphadenopathy, TIBOLA“ (Lakos 2002).
Krankheitserscheinungen bestehen in vergrößerten,
zum Teil schmerzhaften regionalen Lymphknoten und/oder vesikulären
ulzerativen Hautreaktionen (Eschar) an der Zeckenstichstelle.
Kinder sind davon ganz überwiegend betroffen. Der Zeckenstich
durch D. marginatus befindet sich bei 96% der Patienten
auf der behaarten Kopfhaut. Die Inkubationszeit erstreckt sich
von wenigen Tagen bis zu 2 Monaten. Geringgradiges Fieber, Müdigkeit,
Benommenheit, Kopfschmerzen, Myalgien, Gelenksschmerzen und
Appetitverlust bilden die Begleitsymptome. Die Diagnose erfolgt
idealerweise durch den molekularbiologischen Nachweis von Rickettsia
slovaca aus Lymphknoten-Biopsien.
Behandlung
Doxycyclin
ist das Antibiotikum der Wahl.
|
| Tularämie
(Hasenpest) Krankheitserreger
Francisella
tularensis ist ein Gram-negatives Bakterium, das in bestimmten
geografischen Gebieten Europas, wie zum Beispiel in den österreichisch-slowakischen
Grenzlandschaften entlang der March, endemisch ist. Verschiedene
Kleinsäuger wie Nager und Hasen fungieren als Reservoire.
In Mäusen aus diesen Gebieten lassen sich Mischinfektionen
mit verschiedenen Borrelienarten und F. tularensis
von August bis Dezember nachweisen, während Borrelien durchgehend
von Mai bis Jänner gefunden werden (Vyrosteková
et al. 2002). F. tularensis findet sich nicht nur in
Dermacentor-Zecken, sondern auch in Ixodes ricinus.
Der Übertragungsweg durch Zeckenstich ist ungewöhnlich,
da der direkte Kontakt mit verendeten Tieren oder mit dem Blut
beim „Abziehen“ von Hasen oder nach Genuss von unzureichend
erhitztem Fleisch sowie auch von nicht pasteurisierter Milch
von infizierten Tieren ausreicht, um die Krankheitserreger zu
übertragen.
Krankheitsverlauf
Bei der Übertragung
durch Zeckenstich entsteht um die Stichstelle ein ausgestanztes
Geschwür. Danach kommt es zur Schwellung der regionalen
Lymphknoten und gelegentlich zu Fieber (ulzeroglanduläre
Form). Von den in der West-Slowakei in den Jahren 1985 bis 1998
beobachteten 418 Tularämie-Fällen wurden 45 (11%)
durch Zeckenstich übertragen (Gurycova et al. 2001). Bei
der aerogenen Übertragung kann eine hoch fieberhafte Lungenentzündung
entstehen. Massenerkrankungen durch F. tularensis bei
Arbeitern einer Zuckerfabrik im Marchfeld wurden auf das Einatmen
von Wassertröpfchen bei der Reinigung von Zuckerrüben
zurückgeführt. Die Tröpfchen enthielten Partikel
von Mäusekadavern, in denen sich vitale Francisellen
befanden (Hayek & Flamm 1967).
Spezifische
Diagnose
Die Laboratoriums-Diagnose
ist insbesondere wegen der Abgrenzung gegenüber Rickettsiosen
und der Durchführung einer geeigneten Therapie notwendig.
Es besteht sowohl die Möglichkeit, F. tularensis
auf künstlichen Kulturmedien anzuzüchten, als auch
die Infektion indirekt durch den Nachweis spezifischer Antikörper
in gepaarten Serumproben mittels Agglutinationstest nachzuweisen.
Behandlung
Die Behandlung
erfolgt mit Antibiotika wie Doxycyclin oder Gyrasehemmer.
|
| Babesiose
Krankheitserreger,
Infektionszyklus
Babesien
sind kleine Sporozoen, die in den Erythrozyten verschiedenster
Säugetiere, und selten auch des Menschen parasitieren.
Babesien werden von verschiedenen Schildzecken-Arten übertragen,
in denen sie ihren sexuellen Vermehrungszyklus vollziehen. Zecken
fungieren durch trans-ovarielle Übertragung auch als Babesien-Reservoir.
Eigene jüngste Forschungsergebnisse zeigten, dass Ixodes
ricinus in Österreich regional unterschiedlich zu
einem beträchtlichen Teil mit Babesien infiziert ist (Publikation
in Vorbereitung). Nach Übertragung durch Zeckenstich befallen
die infektiösen Babesien Erythrozyten, in denen sie den
asexuellen Teil ihres Infektionszyklus vollziehen. In den Erythrozyten
sind sie als pleomorphe, ringförmige Strukturen nachzuweisen.
Sie ähneln dabei den frühen (trophozoiten) Ring-Formen
des Malariaerregers Plasmodium falciparum. Die Erythrozyten
werden durch den Babesien-Befall allerdings nicht verändert;
sie zeigen weder Tüpfelung noch Pigment. Reife Babesien
bilden in den Erythrozyten gelegentlich Tetraden-Formen. Über
100 Babesienarten werden beschrieben. Auch in Mitteleuropa existieren
zahlreiche Arten wie Babesia bovis, B. divergens,
B. canis, B. ovis und B. major. Die
Erreger der Rinderbabesiose, so genanntes Weiderot (Hämoglobinurie),
werden durch Ixodes ricinus übertragen, Erreger
der Hunde- und Schafe-Babesiose durch Rhipicephalus-
und Dermacentor-Zecken. Die Aufklärung der Übertragung
und Ursache des Rinder-Texas-Fiebers durch Theobald Smith und
Frederick Kilbourne in den Jahren 1889 bis 1893 brachte erstmals
die Erkenntnis, dass Zecken nicht nur Ektoparasiten, sondern
bedeutende Vektoren verschiedenster Krankheitserreger sind (Assadian
& Stanek 2002). Nur wenige Babesienarten können Infektionen
des Menschen verursachen; zu diesen gehören B. microti
und B. divergens.
Krankheitsverlauf
Von Infektionen
mit B. microti aus dem Nordosten der USA ist bekannt,
dass die Erkrankung bei nicht-splenektomierten Personen 10 bis
24 Tage nach dem Zeckenstich ausbricht und unbehandelt über
einige Wochen bestehen bleibt. Sie verläuft uncharakteristisch
und beginnt mit Krankheitsgefühl, Fieber, Schüttelfrost,
Schweißausbrüchen, Gelenks- und Muskelschmerzen,
Kopfschmerzen, Müdigkeit und Schwäche. Nicht selten
finden sich eine Lebervergrößerung und erhöhte
Bilirubin- und Transaminase-Werte infolge der hämolytischen
Anämie. Seit der ersten Fall-Beobachtung aus dem Nordosten
der USA gibt es nun Berichte über jährlich mehrere
hundert Fälle aus dieser Region (Kjemtrup & Conrad
2000).
Manifeste
Babesien-Infektionen des Menschen in Mitteleuropa sind anscheinend
auf Einzelfälle beschränkt (Skrabalo & Deanovic
1957) und erfolgen offensichtlich nur durch B. divergens.
Hier betrifft die Infektion in erster Linie splenektomierte
oder immunsupprimierte Personen. Die hämolytische Erkrankung
beginnt bei dieser Personengruppe schlagartig hochfieberhaft.
Dazu
zeigen Ergebnisse seroepidemiologischer Studien, dass eine relativ
hohe Seroprävalenz gegen Babesien bei Personen aus Endemiegebieten
der Lyme-Borreliose in Europa vorliegt. Das lässt den Schluss
zu, dass inapparente Babesien-Infektionen des Menschen offensichtlich
regelmäßig vorkommen (Hunfeld et al. 1998).
Spezifische
Diagnose
Die Diagnose
kann durch den Nachweis von Babesien in Giemsa-gefärbten
Blutausstrichen und Dickem Tropfen erfolgen. Allerdings kann
die morphologische Diagnose der Babesiose durch die gewöhnlich
niedrige Parasitämie falsch negativ ausfallen. Daher werden
auch serologische Methoden zur Diagnostik verwendet. Aber der
Wert der serologischen Diagnostik (Immun-Fluoreszenz) ist wiederum
gemindert durch mögliche Kreuzreaktionen mit Malaria-Erregern.
Aufgrund dieser Probleme gehört heute in jedem Fall der
hochsensitive Nachweis von spezifischen Nukleinsäuresequenzen
mittels geeigneten Amplifikations-Techniken zum diagnostischen
Vorgehen.
Behandlung
Zur Behandlung
werden Clindamycin, Quinin und Azithromycin kombiniert.
|
| Entfernung
von Zecken Eine
anhaftende Zecke sollte so bald wie möglich aus der Haut
entfernt werden, und zwar mit Hilfe einer geeigneten Pinzette,
mit der die Zecke so nah an der Haut wie möglich gefasst
und sorgfältig herausgezogen wird. Die Stichstelle sollte
dann desinfiziert werden. Ärztliche Hilfe zur Entfernung
der Zecke wird nur dann nötig, wenn die Zecke an einer
Hautstelle haftet, die nur schwer zugänglich oder sehr
empfindlich ist. Das Aufbringen von Öl, Cremen und so fort
auf die anhaftende Zecke, oder Drehen und Drücken der Zecke,
erhöhen das Infektionsrisiko nicht (Kahl et al. 1998).
|
Literatur
| Afzelius
A (1910) Verhandlungen der Dermatologischen Gesellschaft
zu Stockholm, 28 Oct 1909. Archives of Dermatology and Syphilis
101:404. |
| Assadian
O, G. Stanek (2002) Theobald Smith – The discoverer
of ticks as vectors of disease. Wien Klin Wochenschr 114:479-481. |
| Bannwarth
A (1941) Chronische lymphozytäre Meningitis, entzündliche
Polyneuritis und „Rheumatismus“. Arch Psychiatr
Nervenkrankh 113:284-376. |
| Barbour
AG (1984) Isolation and cultivation of Lyme disease spirochetes.
Yale J Biol Med 57:521-525. |
| Benach
JL, Bosler EM, Hanrahan JP, Coleman JL, Habicht GS, Bast
TF, Cameron DJ, Ziegler JL, Barbour AG, Burgdorfer W, Edelman
R, Kaslow RA (1983) Spirochetes isolated from the blood
of two patients with Lyme disease. N Engl J Med 308:740-742. |
| Burgdorfer
W, Barbour AG, Hayes SF, Benach JL, Grunwaldt E, Davis JP
(1982) Lyme disease – a tick-borne spirochetosis?
Science 216(4552):1317-9. |
| Burgdorfer
W, Barbour AG, Hayes SF, Peter O, Aeschlimann A (1983) Erythema
chronicum migrans – a tickborne spirochetosis. Acta
Trop 40:79-83. |
| Fournier
PE, F Grunnenberger, B Jaulhac, G Gastinger, D Raoult (2000)
Evidence of Infection in Humans with Rickettsia helvetica
in Eastern France. Emerg Infect Dis.2000;6:389-392. |
| Gray
J (2002) Biology of Ixodes species ticks in relation to
tick-borne zoonoses. Wien Klin Wochenschr 114: 473-478. |
| Gurycova
D, V Vyrostekova, G Khanakah, E Kocianova, G Stanek (2001)
Importance of surveillance of tularemia natural foci in
the known endemic area of Central Europe, 1991-1997. Wien
Klin Wochenschr113:433-438. |
| Hayek
H, H Flamm (1967) On the problem of tularemia vectors in
the disease reservoir Marchfeld. Wien Med Wochenschr 117:765-767. |
| Hellerstrom
S (1951) Erythema chronicum migrans Afzelius with meningitis.
Acta Derm Venereol 31:227-234. |
| Hofmann
H, FX Heinz, C Kunz (1983) ELISA for IgM and IgG antibodies
against tick-borne encephalitis virus: Quantification and
standardization results. Zentralblatt Bakt Hyg 255:448-455. |
| Hollstrom
E (1951) Successful treatment of erythema migrans Afzelius.
Acta Derm Venereol 31:235-243. |
| Holzmann
H, M Kundi, K Stiasny, J Clement, P McKenna, C Kunz, FX
Heinz(1996) Correlation between ELISA, hemag-glutination
inhibition, and neutralisation tests after vaccination against
tick-borne encephalitis. J Med Virology 48:102-107. |
| Hunfeld
KP, R Allwinn, S Peters, P Kraiczy, V Brade (1998) Serologic
evidence for tick-borne pathogens other than Borrelia burgdorferi
(TOBB) in Lyme borreliosis patients from midwestern Germany.
Wien Klin Wochenschr 110:901-908. |
| Kahl
O, Janetzki-Mittmann C, Gray JS, Jonas R, Stein J, de Boer
R (1998) Risk of infection with Borrelia burgdorferi sensu
lato for a host in relation to the duration of nymphal Ixodes
ricinus feeding and the method of tick removal. Zentralbl
Bakteriol 287:41-52. |
| Kjemtrup
AM, PA Conrad (2000) Human babesiosis: an emerging tick-borne
disease.Int J Parasitol 30:1323-1337. |
| Kristoferitsch
W, E Sluga, M Graf, H Partsch, R Neumann, G Stanek, H Budka(1988)
Neuropathy associated with acro-dermatitis chronica atrophicans:
clinical and morphological findings. Ann New York Acad Scie
539:35-45. |
| Kunz
C, H Hofmann, H Dippe (1991) Early summer meningoencephalitis
vaccination, apreventive medicine measure with high acceptance
in Austria. Wien Med Wochenschr 141:273-276. |
| Lakos
A (2002) Tick-borne lymphadenopathy (TIBOLA). Wien Klin
Wochenschr 114:647-653. |
| Lindgren
E, L Tälleklint, T Polfeldt (2000) Impact of climatic
change on the northern latitude limit and population density
of the disease-transmitting European tick Ixodes ricinus.
Environ Health Persp 108: 119-123. |
| Lipschütz
B (1913) Über eine seltene Erythemform (Erythema chronicum
migrans). Archives of Dermatology and Syphilis 118:349-356. |
| Lipschütz
B (1923) Weiterer Beitrag zur Kenntnis der „Erythema
chronicum migrans“. Archives of Dermatology and Syphilis
143:365-374. |
| Lotric-Furlan
S, Rojko T, Petrovec M, Avsic-Zupanc T, Strle F (2006) Epidemiological,
clinical and laboratory characteristics of patients with
human granulocytic anaplasmosis in Slovenia. Wien Klin Wochenschr118:708-713. |
| Marlovits
S, Khanakah G, Striessnig G, Vecsei V, Stanek G (2004) Emergence
of Lyme arthritis after autologous chondrocyte transplantat.
Arthritis Rheum 50:259-264. |
| Millner
M, Schimek MG, Spork D, Schnizer M, Stanek G (1989) Lyme
borreliosis in children. A controlled clinical study based
on ELISA values. Eur J Pediatr 148:527-530. |
| Petrovec
M, Lotric Furlan S, Zupanc TA, Strle F, Brouqui P, Roux
V, Dumler JS(1997) Human disease in Europe caused by a granulocytic
Ehrlichia species. J ClinMicrobiol 35:1556-1559. |
| Radda
A, Burger I, Stanek G, Wewalka G(1986) Austrian hard ticks
as vectors of Borrelia burgdorferi, an overview. Zentralbl
Bakteriol Mikrobiol Hyg [A] 263:79-82. |
| Rehacek
J, Kocianova E, Lukacova M, Stanek G, Khanakah G, Vyrostekova
V, Valkova D (1997) Detection of spotted fevergroup (SFG)
rickettsia in Ixodes ricinus ticks in Austria. Acta Virol
41:355-356. |
| Skrabalo
Z, Deanovic Z (1957) Piroplasmosis in man: report of a case.
Doc Med Geogr Trop 9:11-16. |
| Stanek
G et al. (a) (1985) Isolation of spirochetes from the skin
of patients with erythema chronicum migrans in Austria.
Zentralbl Bakteriol Mikrobiol Hyg [A]260:88-90 |
| Stanek
G et al. (b)(1985) Differences between Lyme disease and
European arthropod-borne Borrelia infections. Lancet8425:8401. |
| Stanek
G, Burger I, Hirschl A, Wewalka G,Radda A (1986) Borrelia
transfer by ticks during their life cycle. Studies on laboratory
animals. Zentralbl Bakteriol Mikrobiol Hyg[A] 263:29-33. |
| Stanek
G, Klein J, Bittner R, Glogar D(1990) Isolation of Borrelia
burgdorferi from the myocardium of a patient with long-standing
cardiomyopathy. N Engl J Med322:249-252. |
| Stanek
G (1991) Laboratory diagnosis and seroepidemiology of Lyme
borreliosis.Infection 19:263-267. |
| Stanek
G, O'Connell S, Cimmino M, Aberer E, Kristoferitsch W, Granstrom
M, GuyE, Gray J (1996) European Union Concerted Action on
Risk Assessment in Lyme Borreliosis: clinical case definitions
for Lyme borreliosis. Wien Klin Wochenschr108:741-747. |
| Stanek
G, Breier F, Menzinger G, Schaar B,Hafner M, Partsch H (1999)
Erythema migrans and serodiagnosis by enzyme immunoassay
and immunoblot with three borrelia species. Wien Klin Wochenschr111:951-956. |
| Stanek
G, Strle F (2003) Lyme borreliosis. Lancet 362(9396):1639-1647.
|
| Steere
AC, Malawista SE, Snydman DR, Shope RE, Andiman WA, Ross
MR, Steele FM (1977) Lyme arthritis: an epidemic of oligoarticular
arthritis in children and adults in three connecticut communities.
ArthritisRheum 1977;20:7-17. |
| Steere
AC, Grodzicki RL, Kornblatt AN, Craft JE, Barbour AG, Burgdorfer
W, Schmid GP, Johnson E, Malawista SE.(1983) The spirochetal
etiology of Lyme disease. N Engl J Med. 1983 308:733-740. |
| Strle
F, Pleterski-Rigler D, Stanek G, Pejovnik-Pustinek A, Ruzic
E, Cimperman J (1992) Solitary borrelial lymphocytoma:report
of 36 cases. Infection 20:201-206. |
| Strle
F, Maraspin V, Lotric-Furlan S, Ruzic-Sabljic E, Cimperman
J (1996) Azithromycin and doxycycline for treatment of Borrelia
culture-positive erythema migrans. Infection. 24:64-68.
|
| Stünzner
D, Hubalek Z, Halouzka J, Wendelin I, Sixl W, Marth E (2006)
Prevalence of Borrelia burgdorferi sensu lato in the tick
Ixodes ricinus in the Styrian mountains of Austria. Wien
Klin Wochenschr 118:682-685. |
| Vyrostekova
V, Khanakah G, Kocianova E, Gurycova D, Stanek G (2002)
Prevalence of coinfection with Francisella tularensis in
reservoir animals of Borrelia burgdorferi sensu lato. Wien
Klin Wochenschr 114:482-488. |
Anschrift
des Verfassers:
Univ.-Prof. Dr. med. Gerold Stanek
Klinisches Institut für Hygiene und Medizinische Mikrobiologie,
Abteilung Infektionsimmunologie
Medizinische Universität Wien
A-1095 Wien, Kinderspitalgasse 15
E-Mail: gerold.stanek@meduniwien.ac.at
|
|
|