J.P. Guggenbichler
Univ.-Klinik für Kinder und Jugendliche der Universität
Erlangen/Nürnberg |
|
|
Schlüsselwörter:
Makrolide, Ketolide,
empirische Behandlung von Pneumonien, gute Verträglichkeit,
hohe intrazelluläre Wirkstoffkonzentrationen, zunehmende
Resistenz bei Makroliden mit 14- und 15-gliedrigem Laktonring,
Empfindlichkeit vieler resistenter Keime auf Josamycin und Telithromycin |
|
Zusammenfassung
Das
breite Wirkspektrum der Makrolide, das die Leitkeime von Infektionen
der oberen Luftwege einschließlich intrazellulärer
Mykoplasmen, Chlamydien und Legionellen einschließt, machen
diese Substanzgruppe zu beliebten Präparaten in der Kinderheilkunde.
In den letzten Jahren ist es jedoch zu einem Einbruch in der
Wirksamkeit von Pneumokokken, Streptokokken und Staphylokokken
gekommen. Obwohl die Resistenzsituation in Österreich erheblich
günstiger ist als in Frankreich und Spanien, sind doch
bereits 15–20% der Streptokokken und Pneumokokken auf
Makrolide unempfindlich.
Nicht
alle Makrolide sind jedoch gleich. Josamycin, das einzige Präparat
mit einem 16-gliedrigen Laktonring, ist gegen Mikroorganismen
mit einer Efflux-Pumpen (mef)-Resistenz wirksam. Auch
75% der Makrolid-resistenten Staphylokokken sind auf Josamycin
empfindlich. Ketolide sind ebenso, ähnlich wie Josamycin,
gegen viele Makrolid-resistente Mikroorganismen wirksam.
Makrolide
erreichen besonders hohe Wirkstoffkonzentrationen intrazellulär
und in der Mucinschicht. Die gute Bioverfügbarkeit von
Clarithromycin mit Wirkstoffkonzentrationen, die deutlich über
denen von Erythromycin, vor allem aber Azithromycin, liegen,
ermöglicht es dadurch, niedrig – d.h. mef-resistente
Mikroorganismen mit einem MHK-Wert 0,5 – ≤8 µg/ml
– zu eradizieren.
Azithromycin
besitzt eine Halbwertszeit von bis zu 96 Stunden. Dadurch ist
einerseits eine 3-Tage-Verabreichung möglich. Subinhibitorische
Wirkstoffkonzentrationen über 4–6 Wochen führen
jedoch zur Induktion einer mef-Resistenz und Selektion
resistenter Mikroorganismen in der Rachenflora.
Makrolide
eignen sich als empirische Ersttherapie zur Behandlung von Infektionen
der oberen und unteren Luftwege, von gastrointestinalen Infektionen
durch Helicobacter und Campylobacter sowie von
Haut- und Weichteilinfektionen. Makrolide werden auch in der
Behandlung von Borrelieninfektionen im Stadium I und Infektionen
durch Mycobacterium avium eingesetzt.
|
Key-words:
Macrolides,
Ketolides, increasing resistance of macrolides with 14- and 15-membered
lacton ring structure, Josamycin and Ketolides are susceptible
to many macrolide resistant microorganisms, high intracellular
concentrations, empiric therapy of community acquired pneumonia |
|
Summary
The
broad spectrum of activity against the majority of microorganisms
responsible for upper and lower respiratory tract infections,
and the high intracellular concentrations in macrophages and
in the epithelial lining fluid make macrolides to a favoured
group of antibiotics in pediatrics. Also a number of difficult
to treat infections e.g. Mycobacterium avium intracellulare
are in the spectrum of macrolides.
Unfortunately
the rate of macrolide resistant microorganisms (Streptococcus
pneumoniae and Streptococcus pyogenes) is increasing
worldwide in Japan, the USA and southern European countries
to the extent, that macrolides should be used only after susceptibility
testing. Two resistance mechanisms are observed. The low level
resistance (mefA gene, MIC 0.5 – ≤8 µg/ml),
due to the development of an efflux pump is inducible ;the high
level resistance (ermB gene with an MIC of >32 µg/ml)
is mainly due to selection. Both genes are evenly distributed.
The combination mefA and ermB resistance is found
in at least half of the resistant microorganisms and is rising.
Josamycin and the new ketolides are still active against the
majority of resistant microorganisms in particular mefA
resistant bacteria.
There
is a substantial difference in the pharmacokinetic and pharmacodynamic
profile in particular the newer macrolides. Azithromycin shows
low serum and concentrations in the epithelial lining fluid
(ELF) and a halflife of up to four days. This results in subinhibitory
concentrations e.g. in saliva for up to 6 weeks with induction
and selection of mostly mefA resistant microorganisms.
Serum ELF and macrophage concentrations of Josamycin, Clarithromycin
and Roxithromycin are substantially higher.
Macrolides
are generally well tolerated, allergic hypersensitivity reactions
are rare. Erythromycin is responsible for gastrointestinal side
effects, abdominal cramps, vomiting and diarrhea due to its
prominent gastrokinetic properties.
Macrolide
antibiotics are especially valuable for the empiric therapy
of upper (e.g. sinusitis) and lower respiratory tract infections
e.g. community acquired pneumonia. Therapy of streptococcal
tonsillitis is indicated in penicillin allergic children after
susceptibility testing. Macrolides are indicated for treatment
of pertussis, skin and soft tissue infections including erythema
chronicum migrans.
|
Einleitung
Erythromycin,
das erste Antibiotikum aus der Gruppe der Makrolide, ist seit
der Einführung 1952 ein überaus geschätztes Präparat
in der Kinderheilkunde. Erythromycin besitzt ein breites antimikrobielles
Spektrum, das vor allem die Leitkeime von Infektionen der oberen
und unteren Atemwege umfasst, und eine gute Verträglichkeit.
Makrolid-Antibiotika haben ihren Namen vom makrozyklischen Laktonring
und dessen glykosidischen Verbindungen an Zucker und/oder Aminozucker.
Die Struktur von Erythromycin enthält einen 14-gliedrigen
Laktonring, der mit Hydroxyl- und Ketogruppen substituiert ist.
Die Struktur wird durch 6-Desoxy-Hexose (Cladinose) ergänzt.
Zahlreiche natürliche und halbsynthetische Wirksubstanzen
mit 14- bis 17-gliedrigen Laktonringen wurden seither entwickelt
und weisen eine zum Teil wesentliche Verbesserung der antimikrobiellen
Wirksamkeit, geringere Resistenzentwicklung, bessere Säurestabilität
und Bioverfügbarkeit auf.
Clarithromycin
und Roxithromycin als Weiterentwicklungen von Erythromycin besitzen
einen 14-gliedrigen Laktonring, Azithromycin besitzt als einziges
Makrolid-Antibiotikum einen 15-gliedrigen Laktonring, Josamycin
hat einen 16-gliedrigen und Spiramycin einen 17-gliedrigen Laktonring.
Der 16-gliedrige Laktonring bedingt einen wichtigen Unterschied
zu den übrigen Makroliden, denn dadurch sind Resistenzen,die
auf einem Makrolid-Efflux-Mechanismus beruhen, unwirksam. Spiramycin
mit einem 17-gliedrigen Laktonring zeigt eine um das 4- bis
32-fach geringere Wirksamkeit gegen Erythromycin-empfindliche
Mikroorganismen, besitzt aber zumindest im Tierversuch eine
gewisse Wirksamkeit gegen Toxoplasma gondii.
Eine
weitere Entwicklung sind die Ketolide, wobei die Hexose Cladinose
durch eine Ketobindung ersetzt wird. Bei Telithromycin ist eine
Pyridinium- und Imidazolgruppe durch eine Arylgruppe mit dem
C11-C12-Carbonat des Laktonrings verbunden. Telithromycin besitzt
eine Wirksamkeit gegen vormals Erythromycin-empfindliche Stämme
wobei insbesondere mef-resistente Mikroorganismen empfindlich
sind. |
| Wirkmechanismus
Makrolid-Antibiotika
weisen eine reversible Bindung an die 50S und 70S der Ribosomen
von Bakterien auf. Dieser Vorgang interferiert mit der Fixierung
des t-RNA-Aminosäurekomplexes und verhindert die korrekte
Ablesung der messenger-RNS und somit in Folge die Funktion der
Ribosomen, wodurch die Proteinsynthese gehemmt wird. Untersuchungen
von Mazzei zeigten, dass dadurch das Längenwachstum blockiert
wird. Diese Wirkweise bedingt grundsätzlich eine bakteriostatische
Wirksamkeit, die jedoch bei höheren Konzentrationen und
rasch proliferierenden Mikroorganismen als bakterizide Wirkung
imponiert. Bei Konzentrationen über dem 2- bis 4-fachen
MHK-Wert wirkt z.B. Josamycin bakterizid. Die Destabilisierung
des Ribosomen-Peptidyl-tRNA-Komplexes wird von der Molekülgröße
beeinflusst: Großmolekulare Makrolide mit dem 16-gliedrigen
Laktonring, aber auch Lincosamide und Streptogramin destabilisieren
den Ribosomen-Peptidyl-Komplex stärker als 14- und 15-gliedrige
Makrolide. Als Folge kommt es durch großmolekulare Makrolide
(z. B. Josamycin) deutlich seltener zur Resistenzinduktion.
Makrolide
zeigen eine zeitabhängige Wirkung, wobei zusätzlich
ein anhaltender postantibiotischer Effekt, d.h. eine fortbestehende
Suppression des Keimwachstums bei Abfall der Wirkstoffkonzentration
unter den MHK-Wert, beschrieben wird.
Von
besonderer Bedeutung ist die Fähigkeit der Makrolide, die
Zellmembran der Wirtszelle zu durchdringen und sich im Intrazellulärraum,
insbesondere im endoplasmatischen Retikulum, anzureichern. Dadurch
sind Makrolide besonders gegen intrazelluläre Mikroorganismen
wirksam. |
| Wirkspektrum
Das
breite Wirkspektrum der Makrolid-Antibiotika bedingt besonders
in der Kinderheilkunde ein vielfältiges Einsatzgebiet.
Das antimikrobielle Spektrum der Makrolide enthält die
Leitkeime von Infektionen oberer und unterer Atemwege wie Streptokokken
(ß-hämolysierende Streptokokken der Gruppe A und
Streptococcus viridans), Pneumokokken, Coagulase-positive
und -negative Staphylokokken einschließlich penicillinasebildender
Stämme, Moraxella catarrhalis, Haemophilus influenzae.
Die Wirksamkeit von Erythromycin, Clarithromycin, Roxithromycin
und Josamycin gegen Haemophilus influenzae ist schwach.
Bemerkenswert ist, dass Josamycin und Clarithromycin einen antimikrobiell
aktiven Metaboliten, z. B. das 14 Hydroxy-Clarithromycin, mit
guter Wirksamkeit gegen Haemophilus influenzae bildet.
Muttersubstanz und Metabolit wirken gegen Haemophilus influenzae
additiv bzw. teilweise auch synergistisch. Azithromycin ist
das wirksamste Makrolid gegen Haemophilus influenzae,
gegen die Majorität der übrigen Keime zeigt Azithromycin
jedoch einen um 1–2 Titerstufen höheren MHK-Wert.
Alle Makrolide zeigen eine gute Wirksamkeit gegen Bordetella
pertussis/parapertussis.
Eine
Domäne der Makrolide ist die sehr gute Wirksamkeit gegen
Mycoplasma und Chlamydia pneumoniae, nachdem das
Alternativpräparat Tetrazyklin bei Kindern bis zum 8.–10.Lebensjahr
nicht eingesetzt werden kann, da es sich in den Epiphysenfugen
(Wachstumsstörungen) und im Zahnschmelz (Zahnverfärbungen)
ablagert. Makrolide sind auch gegen Legionella pneumophila
sowie Corynebacterium diphtheriae wirksam. Im Wirkspektrum
ist auch Neisseria meningitidis enthalten, wenn auch
diese Präparate wegen fehlender Liquorpenetration nicht
zur Behandlung einer Meningokokken-Meningitis geeignet sind.
Makrolide
sind auch zur Behandlung einiger gastrointestinaler und urogenitaler
Infektionen geeignet: Im Spektrum sind Helicobacter und
Campylobacter jejuni, Neisseria gonorrhoae und
Chlamydia trachomatis sowie Ureaplasma urealyticum
enthalten. Empfindlich sind auch Borrelia burgdorferi,
Mycobacterium avium intrazellulare und Spirochäten.
Primär
unempfindlich sind Gram-negative Mikroorganismen wie Enterobacteriaceae,
Azinetobacter spp, Pseudomonas spp. Der Grund
dafür liegt in einer Undurchlässigkeit der Zellmembran
für hydrophile antibiotisch wirksame Substanzen, wenn auch
einige Publikationen eine gewisse Wirksamkeit von Azithromycin
gegen Pseudomonas beschreiben. Ob dieser Befund eine klinische
Relevanz hat, ist jedoch sehr unsicher. Erythromycin-unempfindlich
sind Bacteroides fragilis und andere Bacteroides spp,
Brucellen. Diese Keime wie auch Peptostreptokokken sind
jedoch auf Josamycin empfindlich.
|
| Resistenz
bakterieller Mikroorganismen auf Makrolide
Inzidenz
Ein
besonderes Problem bei der Verabreichung von Makroliden besteht
darin, dass Mikroorganismen bei steigendem Einsatz rasch eine
Resistenz gegen diese Wirkstoffgruppe entwickeln. Als Beispiel
in den 60er-Jahren gilt das Auftreten von mehr als 30% Erythromycin-resistenter
Streptokokken innerhalb von 3 Jahren in Finnland, nachdem Makrolide
als Mittel der ersten Wahl zur Behandlung einer Streptokokkentonsillitis
empfohlen wurden.
Nach
den internationalen Vereinbarungen spricht man bei einem MHK-Wert
von <0,5 µg/ml von einem empfindlichen, bei 0,5–1
µg/ml von einem intermediär-empfindlichen, bei einem
MHK-Wert von >1 µg/ml von einem resistenten Keim.
In
den letzten Jahren kam es vor allem in den USA und in Kanada
zu einem erheblichen Rückgang der Empfindlichkeit von Pneumokokken
aber auch Streptokokken auf Makrolide (Abbildung 1, Daten G.
Doorn, G. Zahnel).
Abbildung
1: Makrolid-Resistenz von Streptococcus pneumoniae
in den USA
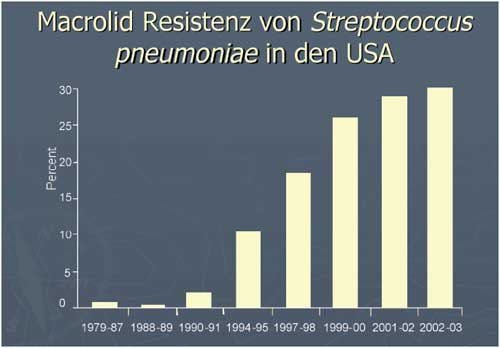
Besonders
betroffen sind davon Säuglinge und Kleinkinder bis zum
5. Lebensjahr sowie Jugendliche mit Infektionen der oberen und
unteren Luftwege (Abbildung 2a, 2b).
Abbildung
2a: Makrolid-resistente Pneumokokken, 2003–2005
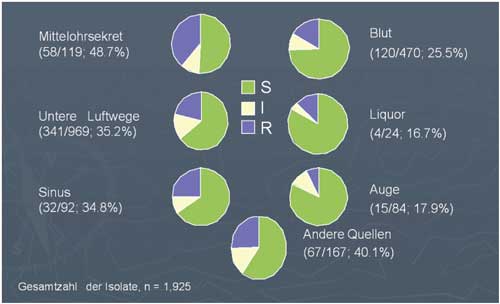
Abbildung
2b: Makrolid-resistente Pneumokokken, 2003–2005
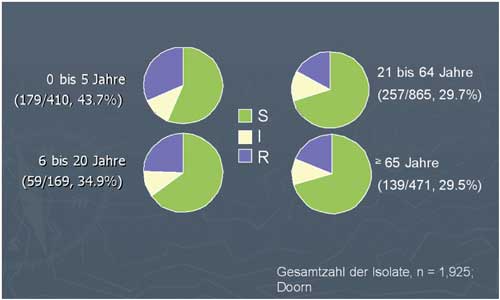
Dies
konnte in Europa in diesem Ausmaß bisher nicht beobachtet
werden. Reinert berichtet von insgesamt 28,0% Makrolid-resistenter
Stämmen in Europa, wobei die Rate in Spanien und Frankreich
über dem Durchschnitt, in Österreich und Deutschland
(19,9% der Pneumokokken und 14% der S. pyogenes-Isolate)
unter dem Durchschnitt lag. Georgopoulos untersuchte die antimikrobielle
Empfindlichkeit invasiver Pneumokokkenstämme in Österreich
und beobachtete, dass 19 von 56 Isolaten eine verminderte Empfindlichkeit
(MIC >/= 1 mg/L) aufwiesen. Jebelean berichtet 2003 von 16%
Makrolid-resistenten Pneumokokken und 13,3% der S. pyogenes-Isolate
mit großen lokalen Unterschieden. Resistenzraten von 20%
der ß-hämolysierenden Streptokokken wurden z.B. in
Graz, Linz und Wien beschrieben, in Westösterreich ist
die Resistenzsituation mit 3–5% wesentlich günstiger.
Es
bestehen jedoch entscheidende Unterschiede in der Resistenz
zwischen den einzelnen Präparaten mit einem 14-, 15- oder
16-gliedrigen Laktonring. Für Josamycin besteht eine Sonderstellung
insofern, als sowohl für Pneumokokken, S. pyogenes
und Staphylokokken Resistenzraten zwischen 2–5% beobachtet
werden. So sind z. B. >70% der Erythromycin-resistenten Staphylokokken
auf Josamycin empfindlich.
Resistenzmechanismen
Für
die Resistenzentwicklung sind zwei Mechanismen verantwortlich.
Der häufigere Mechanismus ist die Entwicklung einer Efflux-Pumpe;
dies kommt überwiegend dadurch zustande, dass Bakterien
unter subinhibitorischen Konzentrationen einen Pumpmechanismus
aktivieren, der das Antibiotikum aus dem Antibiotikum ausschleust,
und so keine wirksamen Konzentrationen im Mikroorganismus aufrecht
zu halten sind (Abbildung 3).
Abbildung
3: Mechanismen der Makrolid-Resistenz von S. pneumoniae
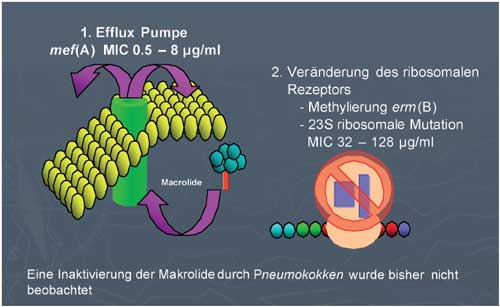
Die zweite Möglichkeit der Resistenzentwicklung ist eine
Änderung des ribosomalen Rezeptors, wodurch Makrolide nicht
mehr in der Lage sind, die Proteinsynthese zu inhibieren. Es
handelt sich dabei um eine Hochresistenz mit MHK-Werten zwischen
32 und 128 µg/ml. Die Methylierung des Adenins an der
23S-Ribonukleinsäure erfolgt durch verschiedene Methylasen
durch erm-Gene (Erythromycin-Methylase-Gene). Diese Keime
sind vollkommen unempfindlich gegen alle Makrolid-Antibiotika.
35,6% der 430 Makrolid-resistenten Stämme waren in der
Untersuchung von Reinert erm(B)-positiv, 63,5% waren
mef(A)-positiv. Gegenwärtig wird eine Zunahme von
Pneumokokken mit einer Kombination von mef-und erm-Resistenz
beobachtet.
Resistenzentwicklung
in Abhängigkeit von der Pharmakokinetik
Ein
prädisponierender Faktor für die Entwicklung der mef-Resistenz
besteht in lang anhaltenden subinhibitorischen Wirkstoffkonzentrationen.
Bei Konzentrationen unterhalb des MHK-Wertes kommt es zu keiner
Eradikation der Keime, jedoch zu funktionellen Veränderungen
der Mikroorganismen auf mehrfache Weise:
Mikroorganismen bilden unter subinhibitorischen Konzentrationen
weniger Lipooligo- und Lipopolysaccharide in der Zellwand aus
und sind so weniger elektronegativ, leichter phagozytierbar
und induzieren eine geringere Entzündungsreaktion. Untersuchungen
haben auch gezeigt, dass diese Mikroorganismen auch Virulenzfaktoren
wie Adhärenz und Toxinbildung einbüßen.
Subinhibitorische
Wirkstoffkonzentrationen über 10 bis 14 Tage induzieren
die Entwicklung einer mef-Resistenz, d. h. die Entwicklung
einer Efflux-Pumpe. Bacquero kreierte für den Konzentrationsbereich
zwischen dem MHK-Wert und der minimalen Antibiotikakonzentration
(MAK-Wert, d. h. keine nachweisbare antimikrobielle Wirksamkeit)
den Begriff des selektiven Fensters. Je größer dieses
„Fenster“ ist, umso höher ist die Wahrscheinlichkeit
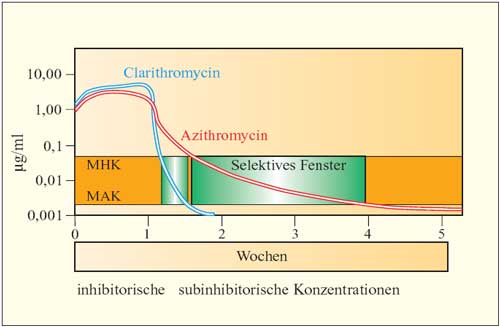
einer Induktion einer mef-Resistenz (Abbildung 4).
Abbildung
4: Schematisierter Konzentrationsverlauf von Clarithromycin
und Azithromycin in der Epithelial-Lining-Fluid (ELF). Der Konzentrationsbereich
zwischen MHK-Wert und MAK-Wert wird als selektives Fenster (Bacquero)
bezeichnet. Je größer dieses selektive Fenster umso
größer ist das Risiko einer Resistenzentwicklung
der Mikroorganismen auf Makrolid-Antibiotika.
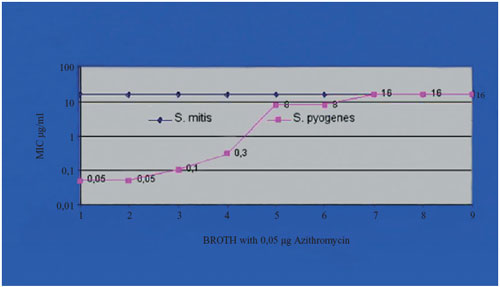
Die mef-Resistenz ist übertragbar. Der Transfer
der mef-Resistenz z. B. von einem Makrolid-resistenten
Streptococcus mitis auf einen Penicillin-empfindlichen
Streptococcus pyogenes erfolgt unter subinhibitorischen
Wirkstoffkonzentrationen innerhalb von 5 Tagen. Im antibiotikafreien
Medium kommt es zu keiner Übertragung der Resistenzgene
(Abbildung 5).
Abbildung
5: Transfer der Makrolid-Resistenz von einem Makrolid-resistenten
Streptococcus mitis auf einen Streptococcus pyogenes
unter subinhibitorischen Konzentrationen eines Makrolid-Antibiotikums.
Anstieg des MHK-Wertes von S. pyogenes von 0,05 µg/ml
auf 16 µg/ml
Untersuchungen
haben gezeigt, dass nach Gabe von Azithromycin mit einer Halbwertszeit
von 48–96 Stunden über 6 Wochen subinhibitorische
Wirkstoffkonzentrationen im Rachensekret nachzuweisen sind.
Der Einfluss verschiedener Makrolid-Antibiotika auf die Rachenflora
wurde in einer klinischen Studie bei 180 Patienten, bei denen
eine Makrolidbehandlung indiziert war, untersucht, Ausschlusskriterium
war der Nachweis eines Makrolid-resistenten Keims in der Rachenflora
vor Beginn der Antibiotikatherapie. 135 Patienten waren auswertbar.
Es wurde in wöchentlichem Abstand nach 1, 2, 3, 4 und 6
Wochen die Rachenflora untersucht. Die Untersuchung auf Makrolid-resistente
Mikroorganismen erfolgte mit dem e-Teststreifen, mit dem eine
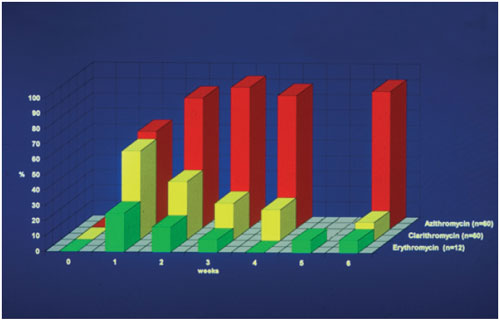
semiquantitative MHK-Bewertung möglich ist (Abbildung 6).
Abbildung
6: Einfluss verschiedener Makrolid-Antibiotika auf die Rachenflora
von Patienten, die mit einem Makrolid (Erythromycin und Clarithromycin
7 Tage, Azithromycin 3 Tage) behandelt wurden. Wöchentliche
Untersuchung der Rachenflora mit dem e-Test. Vor Behandlungsbeginn
wurden keine Makrolid-unempfindlichen Mikroorganismen in der
Rachenflora isoliert (Einschlusskriterium) nach 1, 2, 3, 4 und
6 Wochen wurde die Rachenflora mit dem semiquantitativen e-Test
auf das Vorhandensein Makrolid-resistenter Keime untersucht.
Am Therapieende (nach 1 Woche) wurde bei 25% der Patienten,
die Erythromycin (40 mg/kg KG) erhielten, bei 45% der Patienten
nach Clarithromycingabe (12 mg/kg KG) und bei 50% der Patienten
nach Azithromycingabe (10 mg/kg KG) Makrolid-unempfindliche
Mikroorganismen in der Rachenflora isoliert. Während die
Zahl der Patienten, die nach Gabe von Erythromycin und Clarithromycin
mit Makrolid-resistenten Keimen besiedelt waren, kontinuierlich
abnahm, nahm die Zahl der Patienten mit Makrolid-resistenten
Mikroorganismen nach Gabe von Azithromycin kontinuierlich bis
6 Wochen auf > 90% zu.
Ergebnisse der Untersuchung nach Gabe von Erythromycin, Roxithromycin
und Azithromycin:
Die Zusammensetzung der Rachenflora 2, 3, 4 und 6 Wochen nach
Gabe von Azithromycin zeigt steigende Prozentzahlen bis zu 94%
Makrolid-resistente Mikroorganismen in der Rachenflora im Gegensatz
zu von 45% auf 20% fallende Konzentrationen bei Patienten unter
Clarithromycin und 10% nach Gabe von Erythromycin.
Die
Zusammensetzung der Makrolid-unempfindlichen Mikroorganismen
zeigt bei 50% der Patienten Makrolid-resistente Gram-positive
Mikroorganismen wie
Streptococcus
viridans spp,
Peptostreptokokken,
S. aureus,
S. epidermidis,
Pneumokokken,
H. influenzae,
Moraxella catarrhalis.
Bei
40% der Patienten wurden folgende Gram-negative Mikroorganismen
bzw. eine Mischinfektion mit Gram-positiven und Gram-negativen
Keimen isoliert:
Pseudomonas
aeruginosa
Serratia marcescens
Enterobacter spp
Klebsiella spp
Bei
10% der Patienten war der dominante Keim der Rachenflora Candida
albicans.
Auch
die klinische Auswirkung wurde untersucht:
7
der 60 Patienten in der Azithromycin-Gruppe hatten innerhalb
von 6 Wochen eine Reinfektion mit einem Makrolid-resistenten
Keim im Gegensatz zur Clarithromycin-Gruppe, bei der nur 1 Patient
an einer Reinfektion erkrankte.
Über die globalen Folgen einer Resistenzinduktion auf der
Basis von mef-Genen durch Makrolide mit langer Halbwertszeit
berichtet eine Studie von Allison McGeer aus Kanada: Sie korrelierte
bei 8.000 Patienten mit einer Pneumokokken-positiven Blutkultur
die Empfindlichkeit der Mikroorganismen auf Makrolid-Antibiotika
mit einer vorausgegangenen Antibiotikatherapie. Sie beobachtete,
dass zwar eine Vorbehandlung mit allen Makrolid-Antibiotika
mit einem erhöhten Risiko für die Entwicklung Makrolid-resistenter
Pneumokokken einhergeht, dies aber nach Gabe von Azithromycin
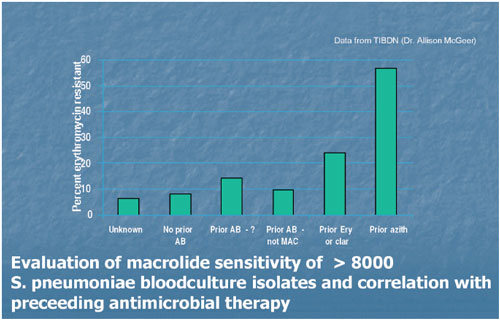
besonders eindrücklich ist (Abbildung 7).
Abbildung
7: Prozentsatz Makrolid-resistenter Pneumokokken aus Blutkulturen
von 8.000 Patienten in Korrelation mit einer vorangegangenen
antimikrobiellen Behandlung. Nach Vorbehandlung mit Erythromycin
oder Clarithromycin ist der Prozentsatz Makrolid-resistenter
Pneumokokken 25%, nach Gabe von Azithromycin 68%. Wenn die Patienten
entweder kein, ein nicht näher definiertes oder ein anderes
Antibiotikum als ein Makrolid erhielten, betrug der Prozentsatz
Makrolid-resistenter Pneumokokken zwischen 8 und 15%.
|
| Pharmakokinetik
Die
Pharmakokinetik oral verabreichter Makrolide weist einen entscheidenden
Unterschied zur Pharmakokinetik der ß-Laktam-Antibiotika
auf. Während ß-Laktam-Antibiotika aus dem Intestinaltrakt
in die Blutbahn resorbiert werden und sich dann im interstitiellen
Flüssigkeitskompartment verteilen, ist die Situation bei
den Makrolid-Antibiotika anders. Makrolide werden aus dem Intestinaltrakt
in das Pfortaderblut resorbiert und füllen zuerst die Leber-,
danach die Makrolidspeicher der Lunge intrazellulär und
reichern sich in der Mucinschicht = epithelial lining fluid
(ELF) an. Dabei kommt es zu sehr hohen Wirkstoffkonzentrationen
intrazellulär, in Makrophagen und Granulozyten sowie zu
hohen Konzentrationen in der Mucinschicht der Schleimhautoberflächen
(ELF). Erst die nichtgebundene Wirkstoffmenge gelangt in die
Blutbahn. Dies erklärt die 10-fach höheren Wirkstoffkonzentrationen
z. B. im Tonsillengewebe als im Blut.
Die
einzelnen Makrolid-Antibiotika unterscheiden sich erheblich
in ihrer Bioverfügbarkeit und Pharmakokinetik. Insgesamt
haben Makrolide eine geringe Säurestabilität, die
sich bei den einzelnen Präparaten und entsprechend der
Galenik noch unterscheidet (Tabelle 1).
Tabelle
1: Bioverfügbarkeit und Pharmakokinetik einzelner Makrolid-Antibiotika
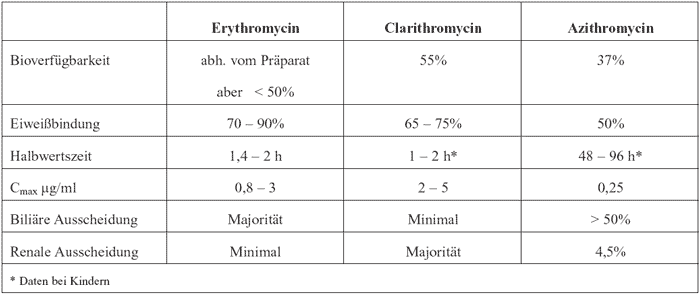
Erythromycin,
die eigentliche Wirksubstanz, ist eine schwache Base, die mit
organischen Säuren leicht Salze und Ester bildet, aus denen
im Blut die antimikrobiell wirksame Erythromycin-Base ensteht.
Vor allem die Erythromycin-Base, aber auch die einzelnen Ester
und Salze werden in unterschiedlichem Maß durch die Magensäure
inaktiviert. Die Erythromycin-Base kann nur als Tablette mit
einem Magensaft-resistenten Überzug verwendet werden, es
gibt zu diesem Zeitpunkt jedoch kein verfügbares Präparat
in Österreich. Die gegenwärtig verwendeten Präparate
sind Salze, z. B. das Erythromycin-Äthylsuccinat und das
Erythromycin-Stearat, die ebenso säurelabil sind und als
Magensaft-resistente Tablette (für ältere Kinder und
Jugendliche) oder in Saftform mit einem Puffer verabreicht werden.
Das Erythromycin-Estolat (Propionyl-Erythromycinester-Laurylsulfat)
ist gegenüber saurem Magensaft resistenter. Die Aufnahme
erfolgt als Propionylester, der zu Erythromycin-Base hydrolysiert
wird. Es entfallen jedoch nur 20–30% des resorbierten
Antibiotikums auf die Erythromycin-Base, der Rest ist der antimikrobiell
unwirksame Ester. Das Erythromycin-Stinoprat zeigt zwar im Vergleich
zu Erythromycin-Äthylsuccinat einen um den Faktor 4,5 höheren
Blutspiegel, ist aber kommerziell nicht verfügbar. Es besteht
aber nach wie vor Uneinigkeit, welches Präparat die biologisch
höchste Konzentration am Wirkort entfaltet.
Neuere
Makrolide wie das Roxithromycin und das Clarithromycin zeigen
eine erheblich bessere Bioverfügbarkeit. Die höchsten
Serumkonzentrationen mit 9,1 µg/ml werden nach Gabe von
10 mg/kg KG Roxithromycin erreicht. Dies ist jedoch auf Kosten
niedrigerer Konzentrationen intrazellulär und in der Epithelial
Lining Fluid. Die Halbwertszeit beträgt 8 Stunden, dadurch
ist eine einmal tägliche Verabreichung möglich.
Clarithromycin
zeigt eine Bioverfügbarkeit von 55% und bei Verabreichung
von 10 mg/kg KG Serumkonzentrationen bei Säuglingen und
Kleinkindern von 2–5 µg/ml. Die Halbwertszeit beträgt
2,5 Stunden.
Azithromycin
zeigt die niedrigsten Serum- und ELF-Konzentrationen. Durch
die extrem lange Halbwertszeit ist durch eine ausreichende Fläche
unter der Konzentrationskurve (AUC) jedoch eine antimikrobielle
Wirksamkeit gegeben. Die niedrigen Serumkonzentrationen können
aber dazu führen, dass Mikroorganismen in der Blutbahn
überleben. Auch die intrazellulären Wirkstoffkonzentrationen
sind 1/10 derer von Clarithromycin.
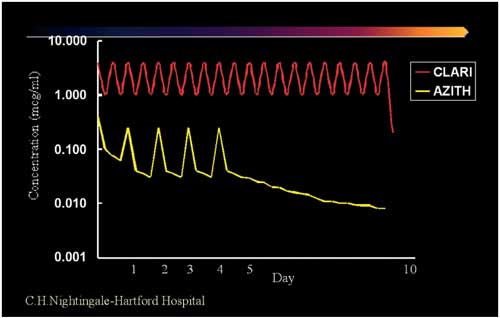
Abbildungen
8a, b, c: Wirkstoffkonzentrationen von Clarithromycin versus
Azithromycin in verschiedenen Kompartments nach Nightingale/Rodvold.
Abbildung
8a: Plasma-Konzentration: Clarithromycin vs. Azithromycin
nach Gabe von 10 mg/kg KG
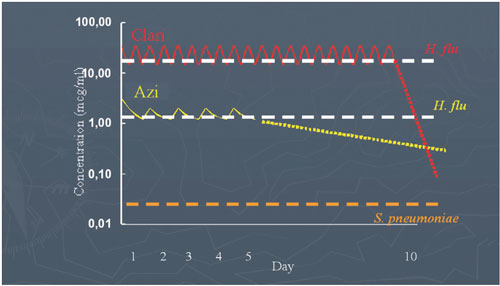
Abbildung
8b: ELF-Konzentrationen von Clarithromycin und Azithromycin
nach Gabe von 10 mg/kg KG in Relation zur MIC90
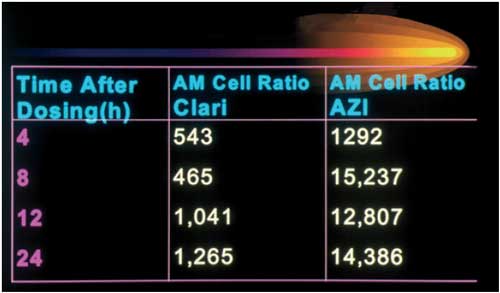
Abbildung
8c: Konzentration in alveolären Makrophagen Clarithromycin
vs. Azithromycin
Von
Bedeutung sind die aktuellen Werte, die nach Gabe von 5 mg/kg
KG bei freiwilligen Probanden ermittelt wurden. Eine Ratio zwischen
Serum und alveolären Makrophagen zu berechnen, wie vielfach
gemacht, ist klinisch nicht relevant.
Zur
parenteralen, d. h. intravösen Verabreichung, liegt Erythromycin
als Lactobionat vor. Auch Clarithromycin liegt in einer parenteral
verabreichbaren Form als Lactobionsäure vor.
Korrelation
der Grenzwerte für Empfindlichkeit und Pharmakokinetik
Die
Resistenz von Mikroorganismen auf Makrolide ist aber nicht nur
aus einer mikrobiologischen Sicht zu bewerten, sondern auch
als Korrelation der Pharmakokinetik, d. h. der erreichbaren
Serum-, Gewebs- und intrazellulären Konzentrationen mit
den MHK-Werten. Die mef-Resistenz ist eine sogenannte
niedrige Resistenz mit MHK-Wert von 0,5–8 µg/ml.
Dies bedeutet aber, dass Präparate, die hohe Wirkstoffkonzentrationen
am Infektionsort z. B. in der ELF erreichen, die Keime trotzdem
eradizieren können. Untersuchungen von Zahnel zeigten,
dass Makrolid-resistente Stämme mit einem MHK-Wert von
bis zu 8 µg/ml durch Clarithromycin unter klinischen Bedingungen
eradiziert werden, da Wirkstoffkonzentrationen in der ELF diese
Werte deutlich überschreiten. Im Gegensatz dazu werden
Makrolid-resistente Pneumokokken mit einem MHK-Wert von 2 durch
Azithromycin nicht eradiziert, da die entsprechenden Wirkstoffkonzentrationen
am Infektionsort nicht erreicht werden (Abbildung 9, 10).
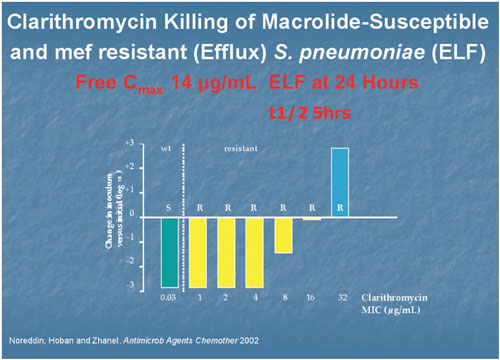
Abbildung
9: Absterbekinetik von Makrolid-empfindlichen und mef-resistenten
Pneumokokken unter Wirkstoffkonzentrationen, die nach Gabe von
Clarithromycin in der ELF erreicht werden (nach Zhanel)
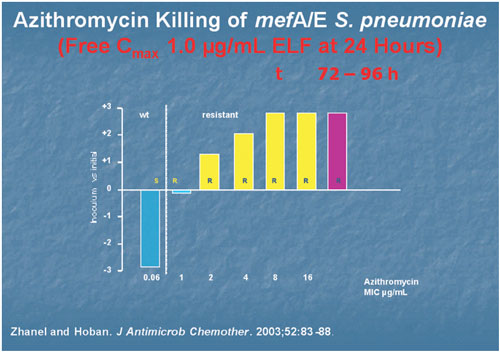
Abbildung
10: Absterbekinetik von Makrolid-empfindlichen und mef-resistenten
Pneumokokken unter Wirkstoffkonzentrationen, die nach Gabe von
Azithromycin in der ELF erreicht werden (nach Zhanel)
Ein
Nachteil der neueren Makrolide wie Roxithromycin und Clarithromycin
ist der Geschmack der oralen Präparation in Saftform. Trotz
intensiver Entwicklungstätigkeit konnte man den bitteren
Nachgeschmack weder durch Bananen noch Erdbeeraroma bzw. auch
nicht durch Löstabletten (Roxithromycin) kaschieren.
|
| Proteinbindung
und Gewebsverteilung Die
Proteinbindung der Makrolide ist konzentrationsabhängig.
Sie ist innerhalb der therapeutisch erzielbaren Konzentrationen
gesättigt, bei steigender Konzentration sind Makrolide
jedoch frei verfügbar. Makrolid-Antibiotika zeichnen sich
durch eine sehr gute Gewebegängigkeit aus, allerdings mit
der Ausnahme der Liquor- und Gehirnpenetration. |
| Zusätzliche
Wirksamkeit Neben
der bakteriostatischen/bakteriziden Wirksamkeit von Makroliden
wurden auch Mechanismen beschrieben, die die Virulenzfaktoren
von bakteriellen Mikroorganismen hemmen; es sind dies eine Herabregulierung
der Adhärenz von Haftrezeptoren und eine Hemmung der Biofilmbildung.
Die Wirksamkeit von Makroliden auf Pseudomonas aeruginosa
beruht nicht so sehr in einer antibakteriellen Wirksamkeit,
sondern durch Hemmung der Proteinsynthese in einer Verminderung
der Alginatbildung und einer dadurch erleichterten Angreifbarkeit
durch klassische Antibiotika mit Pseudomonaswirkung.
Es
wurden zudem bei Makrolid-Antibiotika eine Reihe von Eigenschaften
beschrieben, die unabhängig von der antimikrobiellen Wirksamkeit
einen günstigen Effekt auf chronische entzündliche
Prozesse besitzen, wie z. B. eine verminderte Chemotaxis der
neutrophilen Granulozyten und Infiltration des Epithels der
Bronchen. Eine Hemmung des Transkriptionsfaktors ergibt eine
Verminderung der Bildung proinflammatorischer Zytokine sowie
eine reduzierte Bildung freier Sauerstoffradikale, einer gesteigerten
Apoptose von neutrophilen Granulozyten.
Immunmodulatorische
Eigenschaften wurden bei Makroliden im Rahmen therapeutischer
Erfolge bei der chronischen diffusen Panbronchiolitis (DPB)
beobachtet. Auch auf die mukoziliäre Clearance haben Makrolide
eine günstige Wirkung, wie z. B. eine Verminderung der
Schleimproduktion und eine Harmonisierung der Viskosität
der Mucinschicht. Kontinuierliche Verabreichung von Makroliden
führt zu einem günstigen klinischen Effekt bei der
Verhinderung von Rezidiven und einer Verbesserung der Lungenfunktion
bei Patienten mit bronchialer Hyperreagibilität, Mucoviscidose
und intrinsic Asthma.
Tacrolimus,
aus dem Bakterium Streptomyces tsukubaensis, ist ein
Makrolid mit sehr geringer antimikrobieller Wirksamkeit. Tacrolimus
wird als Arzneistoff aus der Gruppe der Immunmodulatoren oder
Calcineurinhemmer verwendet. Tacrolimus wird als selektives
Immunsuppressivum gegen Abstoßungsreaktionen bei der Organtransplantation
(Handelsname: Prograf®), sowie als Alternative zu den Glucocorticoiden
beim atopischen Ekzem bzw. der atopischen Dermatitis (Handelsname:
Protopic®) verwendet. Diese Eigenschaften sind auch rudimentär
bei allen Makroliden zu beobachten. |
| Metabolismus
und Elimination Erythromycin
wird wie auch Josamycin zu 50% in der Leber metabolisiert. Bemerkenswert
ist, dass sowohl Josamycin als auch Clarithromycin (z. B. das
14-Hydroxy-Clarithromycin) antimikrobiell aktive Metaboliten
bilden, die synergistisch mit der Muttersubstanz wirken. Clarithromycin
ist gegen H. influenzae weniger wirksam als Erythromycin,
der Metabolit zeigt jedoch die gleiche Wirksamkeit wie Erythromycin. |
| Interaktionen
mit anderen Medikamenten Die
Dosierung von Erythromycin beträgt 40–50 mg/kg KG.
Dies erfordert eine aktive Metabolisierung durch die Leber.
Makrolide, insbesondere Erythromycin, führen zu einer Komplexbildung
und Hemmung von Cytochrom P-450 IIIA4 (CYP3A4) in der Leber
und in Enterozyten. Bei gleichzeitiger Gabe von Erythromycin
und anderen Präparaten, die in der Leber metabolisiert
werden, wie z. B. Theophyllin, sind die Theophyllinkonzentrationen
im Blut erhöht und es kann zu toxischen Nebenwirkungen
von Theophyllin (Erbrechen, Herzrhythmusstörungen, Krampfanfälle)
kommen. Auch bei gleichzeitiger Verabreichung von Dihydroergotamin
oder einem nichthydrierten Mutterkorn-Alkaloid kann es zu einer
verstärkten Vasokonstriktion kommen. Erythromycin kann
die nephrotoxische Wirkung von Ciclosporin A (vor allem bei
Nierentransplantierten Patienten) verstärken. Die Elimination
von Methylprednisolon, Carbamazepin und Coumarinderivaten wird
verzögert. Bei digitalisierten Patienten kann Erythromycin
zur Erhöhung der Digoxinspiegel führen.
Die
neueren Makrolide werden in einer Dosierung von 8–12 mg/kg
KG verabreicht. Dadurch ist die Interaktion mit anderen Medikamenten
erheblich geringer. |
| Toxizität
und Nebenwirkungen Makrolide
werden im Kindesalter meist sehr gut vertragen. Eine Überempfindlichkeit
ist bekannt, jedoch im Kindesalter sehr selten. Allergische
Exantheme sind sehr selten.
Gastrointestinale
Nebenwirkungen (Bauchschmerzen, Übelkeit, durchfällige
Stühle, Flatulenz) werden vor allem bei höheren Dosen
beobachtet, da Erythromycin als Motilin-Rezeptor-Agonist die
intestinale Peristaltik beschleunigt. Bei anhaltenden Durchfällen
ist eine pseudomembranöse Enterokolitis auszuschließen
und die Behandlung abzubrechen.
Bei
Verabreichung von Erythromycin-Estolat wurde in einem vermehrten
Maße eine intrahepatische Cholostase mit oder ohne Ikterus
beschrieben, besonders bei schon bestehender Leberschädigung.
In prospektiven randomisierten Untersuchungen konnte diese Beobachtung
jedoch nicht bestätigt werden, es empfiehlt sich dennoch,
Erythromycin-Estolat nicht länger als 7–10 Tage zu
verabreichen und bei Patienten mit bestehender Leberschädigung
auf ein anderes Präparat umzustellen. Auch bei anderen
Erythromycinderivaten wurden Störungen der Leberfunktion
und eine Transaminasen-Erhöhung beschrieben. Clarithromycin,
Josamycin, aber auch Azithromycin werden besser vertragen.
Eine
Verlängerung der QT-Zeit wird bei allen Makroliden und
Ketoliden beobachtet, Herzrhythmusstörungen sind allerdings
selten. Klinisch relevante Probleme treten beim autosomal rezessiv
vererbten Long-QT-Syndrom Jervell Jarvis bzw. beim dominant
vererbten Romano-Ward-Syndrom auf.
Eine
sehr seltene Nebenwirkung aller 14- und 15-gliedrigen Makrolide
ist eine Neutropenie und Eosinophilie sowie eine hämolytische
Anämie.
Bei
intravenöser Verabreichung von Erythromycin-Lactobionat
wird häufig Venenwandreizung an der Infusionsstelle und
Thrombosierung der Vene beobachtet. Gastrointestinale Nebenwirkungen
treten auch bei parenteraler Verabreichung von Erythromycin-Lactobionat
auf.
Ein
Nachteil bei der oralen Verabreichung der neuen Makrolid-Antibiotika
wie Roxithromycin und Clarithromycin in Saftform ist der bittere
Nachgeschmack. Trotz intensiver Bemühungen für eine
Verbesserung der Galenik durch Erdbeer-Bananenaroma bzw. der
Entwicklung von Löstabletten (Roxithromycin) konnte man
dieses in der Kinderheilkunde gravierende Manko nicht lösen.
Der Geschmack von Josamycin ist im Gegensatz dazu ausgezeichnet.
|
| Therapeutische
Indikationen Makrolid-Antibiotika
haben einen hohen Stellenwert bei der Behandlung von Infektionen
sowohl des oberen als auch des unteren Respirationstraktes.
Infektionen
des oberen Respirationstraktes
Sinusitis
Einer akuten Sinusitis geht üblicherweise eine Virusinfektion
der Nasenschleimhäute voraus. Durch die Virusinfektion
werden vor allem unspezifische Abwehrmechanismen wie die mucoziliäre
Clearance, die Zilienmotilität, die Viskosität der
Schleimschicht nachhaltig gestört. Virusinfizierte Epithelzellen
werden mit 100-fach höheren Keimzahlen besiedelt als nicht
virusinfizierte Zellen. Die Schleimhautschwellung, die durch
proinflammatorische Zytokine bedingt ist, die für die Virenabwehr
wichtig sind, führt zur Obstruktion von Öffnungen,
wodurch es zum Sekretstopp in den Nasennebenhöhlen kommt.
Diese Mechanismen führen bei 9–12% der Säuglinge
und Kleinkinder zu einer bakteriellen Superinfektion der Nasennebenhöhlen.
Mikroorganismen,
die dabei beobachtet werden, sind Pneumokokken, H. influenzae,
Moraxella catarrhalis, seltener Staphylococcus aureus
und Streptococcus pyogenes. Oft besteht eine Mischinfektion
mit Anaerobiern wie Bacteroides spp.
Klinische
Studien zeigten sehr gute therapeutische Erfolge durch Erythromycin,
aber vor allem Clarithromycin, Josamycin, Roxithromycin und
Azithromycin sowohl bei der Behandlung der akuten aber auch
chronisch schwelenden Sinusitis. Diese Mikroorganismen werden
bei uns noch weitgehend durch das Spektrum der neueren Makrolide
abgedeckt.
Bei
einer Orbitalphlegmone sind jedoch die oral verabreichten Makrolide
überfordert. In diesem Fall ist eine parenterale Therapie
mit einem Cephalosporin der Cefuroximgruppe in Kombination mit
Fosfomycin gefordert.
Otitis
media
Auch einer Otitis media geht in den meisten Fällen eine
Virusinfektion der oberen Luftwege voraus. Die Leitkeime für
eine Otitis media sind weitgehend dieselben, die auch bei einer
Sinusitis isoliert werden, und sind im Spektrum der Makrolide
enthalten. Im entzündlichen Sekret der Paukenhöhle
werden von allen Makroliden Wirkstoffkonzentrationen erreicht,
die über dem MHK-Wert der entsprechenden Mikroorganismen
liegen. Resistenzprobleme treten allerdings in einem vermehrten
Maße in den letzten Jahren auf und nehmen weiter zu, wie
vorher beschrieben.
Klinische
Behandlungserfolge sind mit Makroliden zu erreichen. Eigene
Erfahrungen zeigten jedoch, dass der Prozentsatz von Patienten
mit einem persistierenden Tuben-Paukenhöhlen-Katarrh nach
Behandlung mit einem Makrolid-Antibiotikum und dadurch die Rate
an Rezidiven nach Verabreichung von Makrolid-Antibiotika höher
ist als nach Gabe eines ß-Laktam-Antibiotikums. Dies ist
möglicherweise auf die langsamere Keimelimination zurückzuführen.
Tonsillitis/Pharyngitis
Die Behandlung der Tonsillitis ist eine Domäne des Penicillins
bzw. der Oralcephalosporine. Makrolide können bei Penicillin-Überempfindlichkeit
als Alternative verabreicht werden. Während man sich auf
die Empfindlichkeit von Streptococcus pyogenes auf Penicillin
verlassen kann, ist die Rate an Makrolid-resistenten Mikroorganismen
regional unterschiedlich zwischen 5 und 50%. Auch hier bestehen
deutliche Unterschiede im therapeutischen Erfolg zwischen den
einzelnen Makrolid-Antibiotika.
Unterschiede
im therapeutischen Erfolg ergeben sich zwischen Clarithromycin
und Azithromycin. Rondini berichtet klinische und mikrobiologische
Erfolgsraten bei der Behandlung der Streptokokkenangina mit
Azithromycin von 85,3% und 73,3%, mit Clarithromycin von 90,0%
und 85,3% respektive. Besonders bemerkenswert erscheint, dass
6 Patienten mit einem Makrolid-unempfindlichen Streptococcus
pyogenes mit Clarithromycin geheilt werden konnten, während
bei 4 Patienten, die mit Azithromycin behandelt wurden, während
der Behandlung Makrolid-resistente Streptokokken auftraten.
Josamycin
hat die geringste Resistenzproblematik von allen Makrolid-Antibiotika.
Prinzipiell sollte die Behandlung einer Streptokokken-Angina
mit einem Makrolid-Antibiotikum nur nach Keimisolierung und
Resistenzprüfung erfolgen, der Einsatz von Josamycin ist
ohne mikrobiologische Diagnostik jedoch möglich und mit
einem sehr geringen Risiko behaftet.
Es
gibt eine weitere Facette dieses Problems:
Während bisher praktisch ausschließlich ß-hämolysierende
Streptokokken als Erreger einer bakteriellen Tonsillitis in
Frage kamen, mehren sich Berichte in der Literatur, dass auch
Mycoplasma oder Chlamydia pneumoniae in 5–15%
der Fälle als Ursache einer akuten Tonsillopharyngitis
ätiologisch in Betracht zu ziehen sind. Der klinische Verlauf
ist keineswegs unkompliziert, und eine Tonsillopharyngitis durch
diese Mikroorganismen hat eine Tendenz zur Chronifizierung mit
häufigen Exazerbationen. Kokardenförmige Hautausschläge
(Seidlmayersche Kokardenpurpura), Bronchitis, Conjunctivitis,
Urethritis, Arthritis sind weitere Komplikationen. In diesen
Fällen ist eine Behandlung mit einem Makrolid-Antibiotikum
indiziert.
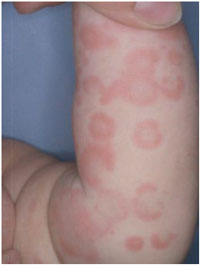
Abbildung
11 zeigt Seidlmayersche Kokardenpurpura bei einem Patienten
mit einer Mycoplasma pneumoniae-Infektion der Tonsillen
und Bronchen.
Abbildung
11: Seidlmayersche Kokardenpurpura bei einem Patienten mit
einer Mycoplasma pneumoniae-Infektion der Tonsillen und
Bronchen
Infektionen
der unteren Luftwege
An einer Pneumonie erkranken jährlich ca. 40 von 1.000
Säuglingen und Kleinkindern unter 3 Jahren und 15 von 1.000
älteren Kindern. Das klinische Bild ist vielfältig.
Es unterscheidet sich je nach Lebensalter, der individuellen
Reaktionslage des Körpers, zugrunde liegenden Erkrankungen.
Probleme bestehen nach wie vor bei der klinischen und mikrobiologischen
Diagnose und damit auch in der gezielten Wahl eines Therapeutikums.
Makrolide
eignen sich besonders zur initialen empirischen Behandlung einer
„Community Acquired Pneumonia“, CAP, wobei die Leitkeime
im Spektrum der Makrolide enthalten sind.
Ab
dem 3. Lebensjahr kommen sowohl virale als auch bakterielle
Pneumonien gleich häufig vor. Bakterielle Erreger sind
Pneumokokken, Haemophilus influenzae sowie Mycoplasma
und Chlamydia pneumoniae. Zur Behandlung einer sog. atypischen
Pneumonie eignen sich im Kindesalter ausschließlich Makrolid-Antibiotika,
bei Pneumokokken ist eher ein ß-Laktam-Antibiotikum vorzuziehen.
Da aber eine mikrobiologische Diagnose meist nicht möglich
ist, muss man empirisch mit der Behandlung beginnen, wobei Pneumokokken
und Haemophilus influenzae sich von Mycoplasma pneumoniae
sowohl in ihrer Proliferationsrate, in der Bildung von Toxinen
und dadurch im Pathomechanismus und der klinischen Präsentation
des Krankheitsbildes unterscheiden. Pneumokokken führen
durch ihre Toxine zu einer Kapillarschädigung und einer
Exsudation in den Alveolarbaum. Dabei hört man die typischen
feinblasigen Rasselgeräusche, das Knisterrasseln. Mykoplasmen
hingegen führen zu einer terminalen Bronchiolitis mit Resorption
der Luft aus den Alveolen und einer Segment- und Subsegmentatelektase.
Dies hat einen Volumenverlust des betroffenen Lungenareals zur
Folge und abgeschwächte bis fehlende Atemgeräusche.
Bemerkenswert ist, dass erst ab dem 3. Lebensjahr Haftrezeptoren
für Mykoplasmen in den terminalen Bronchiolen vorhanden
sind. Vorher führen Mykoplasmen und Chlamydien zu einer
Bronchitis oft mit obstruktiver Komponente (Tabelle 2, Abbildung
12a, 12b).
Tabelle
2: Korrelation von klinischen Symptomen mit Erregern bakterieller
Pneumonien (Mycoplasma pneumoniae versus Pneumokokken)
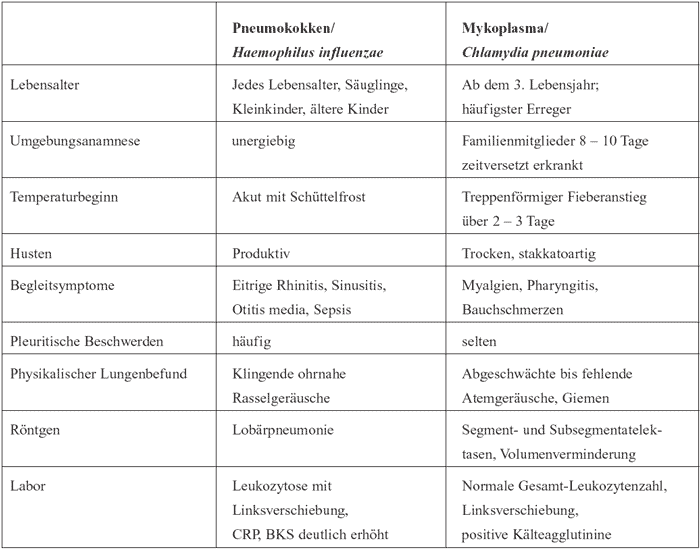
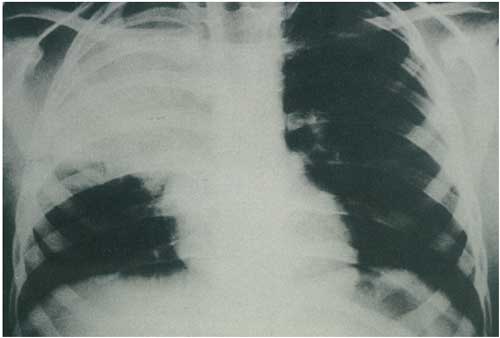
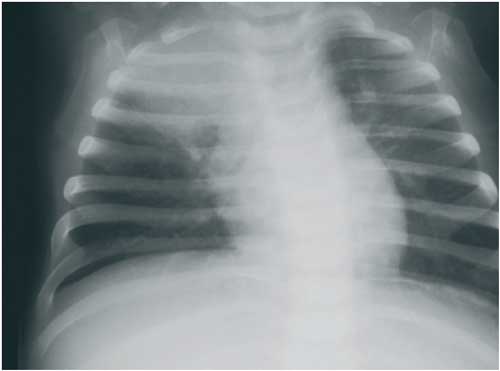
Abbildung
12a: Lobärpneumonie im Rahmen einer Pneumokokkenpneumonie
Abbildung
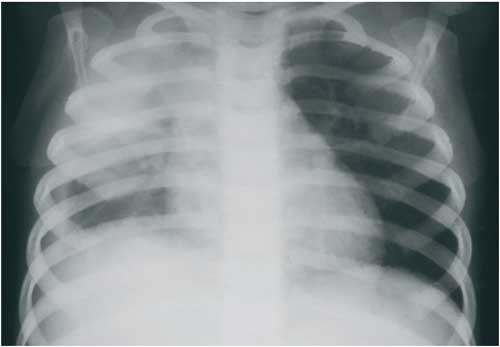
12b: Mykoplasmen-/Chlamydien-Pneumonie: Volumenverlust des
rechten oberen Lungensegmentes. Das Zwerchfell steht als Ausdruck
einer Volumenverminderung im rechten Thorax um ca. 1 1/2 Rippenräume
höher. Der Mittelschatten ist zur Seite der Läsion
hin verschoben.
Mycoplasma
pneumoniae, ein zellwandloser intrazellulärer Mikroorganismus,
ist in vitro auf ß-Laktam-Antibiotika unempfindlich.
Er zeigt im Vergleich zu Pneumokokken (Proliferationszeit 12
Minuten) eine langsame Proliferation (6–8 Stunden) sowie
eine geringe Bildung von Pyrogenen.
Für
ambulant erworbene Pneumonien bieten sich zwei Möglichkeiten
einer Behandlung an:
-
Entweder
man beginnt mit einem Aminopenicillin (mit oder ohne ß-Laktamase-Inhibitor)
bzw. einem Oralcephalosporin (z. B. Cefpodoxim-Proxetil)
und stellt bei mangelndem klinischen Erfolg auf ein Makrolid-Antibiotikum
um, oder
-
Man
beginnt mit einem Makrolid-Antibiotikum, z. B. Clarithromycin
oder Josamycin, und setzt die Behandlung bei Unwirksamkeit
nach 48 Stunden auf ein ß-Laktam-Antibiotikum um.
Dabei kommt es allerdings oft zu einer Notwendigkeit einer
stationären Aufnahme mit parenteraler Therapie.
-
Man
kann auch ein Oralcephalosporin mit einem Makrolid kombinieren.
-
Das
klinische Erscheinungsbild, Laborbefunde und das Röntgen
helfen in der Wahl der empirischen Behandlung. Insgesamt
kann man jedoch nach der klinischen Präsentation empirisch
die erste oder die zweite Variante wählen (educated
guess)
Auch
auf Grund der altersspezifisch unterschiedlichen Erregerwahrscheinlichkeit
sollte bei Kindern unter 3 1/2 Jahren die erste Variante gewählt
werden, bei Kindern über 3 Jahren die zweite Variante bevorzugt
werden. Im Schulalter sind Mykoplasmen für mehr als 50%
der Erkrankungen verantwortlich. Außerdem ist auch die
epidemiologische Situation in Familie/Schule/Kindergarten zu
berücksichtigen.
Eine
abszedierende Staphylokokkenpneumonie bedarf einer parenteralen
Therapie mit einem Cephalosporin der Cefuroxim-Gruppe, vorzugsweise
in Kombination mit Fosfomycin. Bei Patienten, die in ihrer Abwehr
geschwächt sind (z. B. nach Nierentransplantation, exzessivem
Leistungssport), kommen Legionellen als Erreger in Frage. Diese
werden im Kindesalter mit Makroliden behandelt. Die Symptomatik
besteht in einer zunehmenden Störung der Lungenfunktion
mit Tachypnoe, Dyspnoe mit jugulären und intercostalen
Einziehungen und Cyanose durch eine Ventilations-Perfusions-Dissoziation
mit Rechts-Links-Shunt auf Lungenebene.
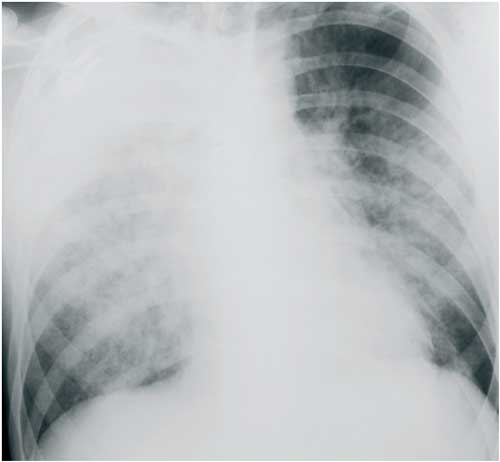
Abbildung
13: Legionellenpneumonie bei einer 16 Jahre alten Leistungssportlerin,
die nach dem Training regelmäßig in der Turnhalle
duschte. Die Patientin zeigte eine massive Lungenfunktionsstörung,
Tachypnoe und Cyanose. Der Auskultationsbefund war durch den
massiv eingeschränkten Gasaustausch bemerkenswert unergiebig
und manifestierte sich mit verminderten Atemgeräuschen.
Die Behandlung bei dieser Patientin bestand in der intravenösen
Verabreichung von Clarithromycin am ersten Tag 20 mg/kg KG,
danach 12 mg/kgKG, aufgeteilt auf 2 Tagesdosen.
Abbildung
13: Pneumonie bei einem 16 Jahre alten Mädchen durch
Legionella pneumophila
Behandlung
der Chlamydia trachomatis-Pneumonie bei Früh- und Neugeborenen
Chlamydien-Infektionen werden bei Neugeborenen, deren Mutter
an einer Urethritis mit diesen Erregern leidet, bei Durchtritt
durch die Geburtswege acquiriert. Andere Infektionswege sind
bei Kindern praktisch ausgeschlossen. Die Inkubationszeit beträgt
5–14 Tage, Symptome treten zwischen der 3. und 6. Lebenswoche
auf. Die Erkrankung manifestiert sich mit einer Rhinitis und
Trinkproblemen, zunehmenden stakkatoartigem Husten, Tachypnoe
und Tachycardie ohne Fieber, oft mit einer meist einseitigen
Conjunctivitis. Die Erkrankung präsentiert sich als milde
Entzündungsreaktion bis zu massivem mukopurulentem Ausfluss.
Auch eine Infektion des Rektums und der Vagina mit eitrigem
Ausfluss sind möglich. Der Auskultationsbefund ergibt Zeichen
einer obstruktiven Bronchitis. Im Röntgenbild finden sich
diffuse kleine Infiltrate mit Segment und Subsegmentatelektasen.
Das Blutbild zeigt keine erhöhten Entzündungsparameter,
aber häufig eine Eosinophilie.
Die
Diagnose gelingt durch den kulturellen Nachweis von Chlamydia
trachomatis in entsprechenden Sekreten. Dies erfordert jedoch
Zeit (>1 Woche). Als orientierende Untersuchung ist der Nachweis
von Einschlusskörperchen z. B. aus dem Trachealsekret oder
aus dem Conjunctivalabstrich möglich. Der Nachweis von
Chlamydien gelingt auch mit einem Enzym Immunoassays und der
PCR. Der direkte Nachweis einer Chlamydia trachomatis-Urethritis
bei der Mutter peri- oder postpartal gibt einen guten Hinweis,
da Tests primär für den Nachweis einer Chlamydieninfektion
bei der Mutter mit hoher Spezifität und Sensitivität
entwickelt und zertifiziert wurden. Die serologische Diagnostik
ist schwierig, da mütterliche übertragene Antikörper
auch bei einer Ausheilung der Infektion bei der Mutter bei dem
Kind in den ersten 6–9 Monaten nachweisbar sind. Die Erkrankungen
sind in unserem Krankengut selten.
Eine
unspezifische Urethritis einer Schwangeren prädisponiert
zu Frühgeburtlichkeit. Bei Durchtritt des Früh- bzw.
Neugeborenen durch die Geburtswege ist eine Aspiration dieser
Mikroorganismen und eine Ansteckung mit Chlamydia trachomatis
möglich, die in den ersten Lebenstagen symptomlos bleibt.
Bei einem beatmeten Früh- oder Neugeborenen aufgrund eines
hyalinen Membran-Syndroms oder einer perinatalen Asphyxie kann
es im Laufe der weiteren Beatmung zu einer Doppelinfektion einerseits
mit einem nosocomialen Infektionserreger wie P. aeruginosa,
Klebsiella spp oder Enterobacter spp, anderseits
mit Chlamydia trachomatis, Ureaplasma urealyticum
kommen. Diese Doppelinfektionen prädisponieren zur Langzeitbeatmung
und der Entwicklung einer bronchopulmonalen Dysplasie. Diese
Kinder sind auch über Monate nach der Entwöhnung vom
Respiratorsauerstoff abhängig.
Die
Behandlung vor allem bei Frühgeborenen besteht in der Verabreichung
eines Makrolid-Antibiotikums, vorzugsweise von Clarithromycin
in der Dosierung von 6 mg/kg KG bei Frühgeborenen <1500
g bis 8 mg/kgKG bei Neugeborenen in 1 Tagesdosis. Chlamydien
können, wenn unbehandelt, bis zu 2 Jahre im Nasopharyngealsekret
nachgewiesen werden. Infektionen mit Chlamydia trachomatis führen
zu Lungenfunktionsstörungen im Kindesalter (Abbildung 14,
15).
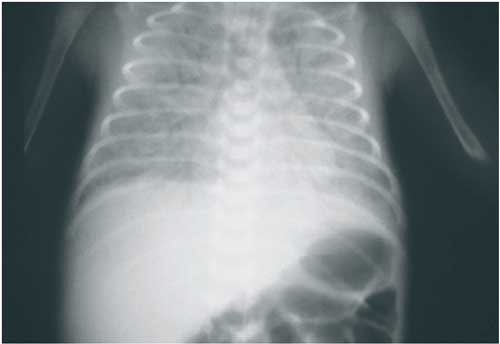
Abbildung
14: Bronchopulmonale Dysplasie nach Langzeitbeatmung bei
Doppelinfektion Chlamydia trachomatis + Klebsiella
pneumoniae
Abbildung
15: Chlamydia trachomatis-Infektion bei einem 3 Wochen
alten Säugling
Pseudomonasinfektionen
bei Mucoviscidose
Makrolide werden auch bei der Behandlung einer Pseudomonasinfektion
bei Patienten mit Mucoviscidose eingesetzt: Obwohl Makrolide
gegen verschiedene Pseudomonas spp keine ausreichende
antimikrobielle Wirksamkeit aufweisen, hat sich die Zugabe von
Makroliden insbesondere von Azithromycin oral zur intravenösen
Behandlung einer Exacerbation einer Infektion mit Pseudomonas
aeruginosa bei Patienten mit Mucoviscidose als günstig
erwiesen. Dabei wird der Einfluss der Makrolide auf die Bildung
von Virulenzfaktoren der Keime wie eine Hemmung der Alginatbildung
ausgenützt. Dadurch sind diese Mikroorganismen besser mit
der Standardtherapie (Kombination eines Aminoglykosids mit einem
Pseudomonas-wirksamen ß-Laktam-Antibiotikum) zu
erreichen. Außerdem werden die antiinflammatorischen und
immunmodulatorischen Eigenschaften der Makrolide sowie die Verbesserung
der mucociliären Clearance ausgenützt.
Makrolide
bei obstruktiver Bronchitis
Eine obstruktive Komponente bei einer Bronchitis ist im Säuglings-
und Kleinkindesalter bei 10–15% der Patienten häufig
und zeigt eine hohe Tendenz zu Rezidiven. Der Auslöser
einer obstruktiven Bronchitis bei Säuglingen und Kleinkindern
<2 Jahre ist überwiegend eine Virusinfektion bei bronchopulmonaler
Hyperreagibilität (intrinsic Asthma). Es werden aber auch
Infektionen mit Mycoplasma pneumoniae als Ursache einer
obstruktiven (asthmoiden) Bronchitis in 5–15% der Patienten
beschrieben. Als praktische Vorgangsweise bietet sich an, ab
dem 5. Tage bei mangelndem therapeutischen Erfolg unter der
üblichen Inhalationsbehandlung mit ß-Sympathikomimetika,
Ipratropium Bromid, Budesonid, Theophyllin, mit einem Makrolid-Antibiotikum,
z. B. Josamycin, zu behandeln.
Pertussis
Trotz der Verfügbarkeit und der nahezu lückenlosen
Durchimpfung der Säuglinge mit dem gut verträglichen
azellulären Komponenten-Impfstoff gegen Keuchhusten kommt
es immer wieder zu Kleinepidemien mit Bordetella pertussis.
Makrolide eignen sich zur Behandlung einer Pertussis. Erythroymcin
und Josamycin werden in einer Dosierung von 50 mg/kg KG für
14 Tage, Clarithromycin in einer Dosierung von 12 mg/kg KG für
10 Tage als erfolgreiche Behandlung beschrieben.
Haut-
und Weichteilinfektionen
Impetigo
Die Impetigo contagiosa ist eine primär vesikulöse,
oberflächliche Infektion der Haut. Die Erreger sind ß-hämolysierende
Streptopkokken der Gruppe A, die auf kleinen Hautschädigungen
(Insektenstich, Mazeration der Haut durch Speichel) als transiente
Flora Fuß fassen können. Gleichzeitig kommt es auf
der geschädigten, entzündlich veränderten Haut
zu einer substanziellen Zunahme der residenten Flora (S.
aureus, S. epidermidis).Die Erkrankung ist ansteckend
und kann als Problem bei Vorliegen nephritogener Stämmen
zu einer Poststreptokokken-Glomerulonephritis führen.
Die
Behandlung besteht in erster Linie in der Elimination der transienten
Flora von Streptococcus pyogenes. Eine Reduktion der
residenten Flora ist sicher nützlich. Makrolide decken
– unter Berücksichtigung der Resistenzproblematik
von Streptokokken – das Erregerspektrum ab und sind auch
gegen ß-Laktamase-bildende Staphylokokken wirksam. Das
Ekthym ist der Impetigo contagiosa verwandt und unterliegt den
gleichen therapeutischen Überlegungen. Einsatz von Makroliden
nach Erregerisolation und Resistenzprüfung, Josamycin kann
wegen der weitgehend erhaltenen Wirksamkeit gegen Staphylokokken
und Streptokokken empirisch gegeben werden.
Akne,
Follikulitis, Furunkel, Pemphigoid
Propionbacterium acnes führt zur Spaltung von Fetten
der Talgdrüsen in Glyzerin und Fettsäuren, die wiederum
zu einer chemischen Entzündung der Talgdrüsen führen.
Auf der geschädigten Haut breiten sich Staphylokokken und
andere Kommensalen ungehindert aus. Bei der Behandlung der schweren
papulo-pustulösen Akne ist daher eine systemische antimikrobielle
Therapie mit Makroliden zusätzlich zur lokalen Behandlung
günstig. Auch die antientzündlichen Eigenschaften
der Makrolide unterstützen den Heilerfolg. Makrolide akkumulieren
auf der Haut und erreichen 2-–5-fach höhere Wirkstoffkonzentrationen
als im Blut. Sie eignen sich dadurch auch zur Behandlung von
Furunkeln und Karbunkeln zusätzlich zur chirurgischen und
lokalen antiseptischen Therapie.
Erysipel
Bei anderen infektiösen Hauterkrankungen wie z. B. dem
Erysipel sind Makrolide als zweite Wahl nach Penicillin zu betrachten.
Dies ist auch durch die unsichere Empfindlichkeit der Streptokokken
auf Makrolid-Antibiotika bedingt. Der Einsatz der Makrolide
bedarf einer Isolierung und Resistenzprüfung des Keimes.
Spezielle
Indikationen
Borreliose
Die Behandlung der Borreliose Stadium 1, d. h. des Erythema
chronicum migrans, kann gut mit einem Makrolid-Antibiotikum
erfolgen. In dieser Indikation kann auch Azithromycin verwendet
werden, da zur Eradikation von Borrelien vor allem protrahierte
Wirkstoffspiegel erforderlich sind. Erythromycin wird für
3 Wochen, Clarithromycin für 14 Tage, Azithromycin für
7 Tage verabreicht.
Die
Behandlung der Borreliose Stadium 2 und 3 bedarf einer parenteralen
Behandlung mit einem Ceftriaxon 75 – max. 100 mg/kg KG
über 14 Tage. Eigene Erfahrungen haben gezeigt, dass mit
Clarithromycin auch im Stadium 2, mit Ausnahme einer Borrelienmeningitis,
und evtl. 3 Symptome, z. B. die lanzinierenden einschießenden
Schmerzen gelindert werden können, wenn wegen einer Überempfindlichkeitsreaktion
das parenterale Cephalosporin vorzeitig abgesetzt werden muss
(Abb. 16)
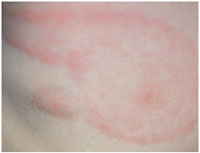
Abbildung
16: Erythema chronicum migrans
Katzen-Kratz-Krankheit
Die Katzen-Kratz-Krankheit ist eine suppurative Lymphadenitis
der tributären Lymphknoten einer Kratzverletzung durch
Katzen. Als Erreger der Katzen-Kratz-Krankheit (Cat scratch
disease) wurde das Proteobakterium Bartonella henselae
identifiziert.
Die
Erkrankung manifestiert sich nach einer Inkubationszeit von
7–12 Tagen mit indurierten Knötchen bzw. einer diffusen
Rötung an der Stelle der Kratz- oder Bissverletzung durch
Katzen. Nach 1–4 Wochen stellt sich eine Lymphadenitis
der zugehörigen Lymphknoten dar. Die Lymphknoten sind schmerzhaft,
die darüberliegende Haut ist gerötet. Bis zu 40% der
Lymphknoten vereitern und führen zu einer chronisch eiternden
Fistel. Die Dauer der Lymphadenitis kann bis zu einem Jahr betragen.
Die
Patienten klagen über Müdigkeit, Appetitlosigkeit,
Kopfschmerzen, bei 30% der Patienten besteht Fieber bis 39°C.
Eine schwere Komplikation besteht in Form einer Encephalitis
mit Krampfanfällen. Beim okuloglandulären Syndrom
(Parinaud) ist die Eintrittspforte für Bartonellen die
Conjunctiva mit Conjunctivitis und Entzündung der präauriculären
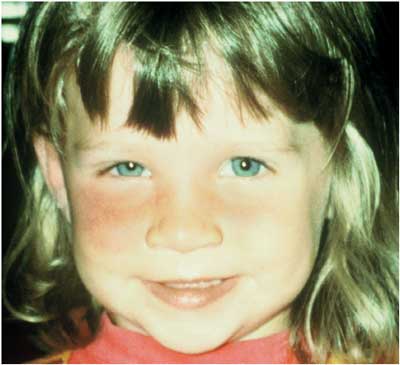
Lymph-knoten (Abbildung 17).
Abbildung
17: Patient mit einer präauriculären Lymphadenitis
und Rötung der darüberliegenden Haut durch Infektion
mit Bartonella henselae
Die
Diagnose ist oft schwierig zu stellen. Sie kann am besten aus
dem Lymphknoten-Biopsat mit der Hämatoxilin-Eosin-Färbung
bzw. der Wharton-Starry-Silberfärbung gestellt werden.
Serologische Teste sind nicht verlässlich, eine PCR bzw.
eine indirekte Immunfluoreszenzmethode ist meist nicht verfügbar.
Es
bewährt sich jedoch bei Verdacht auf eine Katzen-Kratz-Krankheit
eine Behandlung mit Erythromycin (50 mg/kg KG) über 3–4
Wochen bzw. Clarithromycin oder Azithromycin (Präparat
mit dem niedrigsten MHK-Wert) je 10 mg/kg KG einzuleiten.
Helicobacter
pylori-Infektionen
Die Behandlung der erosiven Gastritits und des Magenulkus wurde
durch eine antiinfektiöse Therapie revolutioniert, nachdem
Helicobacter pylorials ätiologisches Agens identifiziert
wurde. Im Kindesalter sind jedoch die typischen Ulkusbeschwerden
nicht ausgeprägt, sondern Symptome bestehen in epigastrischen
Bauchschmerzen, nächtlichem Erwachen mit Bauchschmerzen,
rezidivierendem Erbrechen evtl. mit Hämatemesis. Diese
Symptome treten vor allem bei Duodenalulzera auf, der positive
mikrobiologische Befund geht sehr häufig ohne klinische
Befunde einher.
Als
Komplikation einer Helicobacter-Infektion wird gelegentlich
eine proteinverlierende Enteropathie beobachtet, wobei jedoch
H. pylorials Ursache nicht gesichert ist.
Die
pragmatische Vorgangsweise besteht darin, dass bei Kindern mit
Beschwerden im Oberbauch eine Helicobacter pylori-Diagnostik
durchgeführt werden muss. Der Goldstandard ist zwar die
Gastroskopie und Antrumbiospie, da eine Biopsie der Antrumschleimhaut
für Kleinkinder sehr belastend ist, ist die serologische
Diagnose im Blut und im Speichel, der Ureasenachweis im Atemtest
und der Nachweis von Helicobacter im Stuhl durch eine
PCR eine wesentlich attraktivere Methode.
Helicobacter
ist schwer zu eradizieren. Eine erfolgreiche Behandlung erfordert
den Einsatz von mindestens 2 Antibiotika mit einem Säureblocker.
Clarithromycin ist im Kindesalter ein Standbein der Behandlung.
Der Kombinationspartner ist häufig Metronidazol, der jedoch
in den letzten Jahren wegen Resistenzentwicklung an Attraktivität
verloren hat. Als Kombinationspartner kommt auch Amoxicillin
in Betracht. Gleichzeitig wird ein Säureblocker wie Cimetidin
verabreicht. Die Behandlungsdauer beträgt 14 Tage. Damit
sind im Kindesalter Eradikationsraten von 95% zu erzielen, wobei
jedoch besonders bei Kindern in Entwicklungsländern, aber
auch bei Kindern türkischer Herkunft in Zentraleuropa die
Rezidivrate hoch ist. Eine Bestätigung einer erfolgreichen
Behandlung nach 1 Monat sollte mit dem Urease-Atemtest erfolgen.
Eine chronische Helicobacter pylori-Infektion steigert
das Risiko für Magenkarzinom und Lymphom.
Die
Behandlung einer Gastroenteritis durch Campylobacter jejuni,
die mit blutigen Stühlen einhergeht, kann man mit einem
Makrolid behandeln. In der Realität erübrigt sich
jedoch meist eine Antibiotikagabe, da die Erkrankung mit 1–3
Tagen selbstlimitierend ist und zum Zeitpunkt der Befundübermittlung,
die 3–4 Tage dauert, die klinischen Symptome bereits abgeklungen
sind. Eine schwere Campylobacter-Gastroenteritis, die sicher
eine Ausnahme bildet, sollte jedoch mit einem Makrolid, in erster
Linie mit Erythromycin, behandelt werden.
Mycobacterium
avium-Infektionen
wurden meist mit einer eingeschränkten körpereigenen
Abwehr, z. B. bei AIDS, assoziiert. Diese Erkrankung kommt aber
durchaus häufig als Ursache einer Lymphadenitis bei Säuglingen
und Kleinkindern in Frage. Die Erkrankung manifestiert sich
mit der Lymphadenitis cervicalis/nuchalis, wobei das Wachstum
der Lymphknoten langsam progredient verläuft. Die Lymphknoten
sind üblicherweise indolent, mit der Unterlage und der
darüber liegenden Haut verbacken und polyzyklisch begrenzt.
Die Diagnose wird durch Biopsie gestellt, wobei die komplette
Exstirpation des Lymphknotens bereits einen wesentlichen Teil
der Behandlung darstellt. Erfahrungen zeigen jedoch, dass im
Gegensatz zur Literatur, nach der die chirurgische Entfernung
des Lymphknotens bereits ausreicht, auch eine Folgetherapie
mit einem Makrolid (z. B. Clarithromycin) in Kombination mit
Isoniacid für mindestens 3, eher 4–6 Wochen nötig
ist.
Dosierung
Die Dosierung von Erythromycin beträgt 40–60 mg/kg
KG, aufgeteilt auf 3 Tagesdosen.
Clarithromycin
wird nach der Neugeborenenperiode in einer Dosierung von 10–12
mg/kg KG, aufgeteilt auf 2 Tagesdosen, Roxithromycin in einer
Tagesdosis von 6–8 mg/kg KG als einmal tägliche Dosis
verabreicht. Josamycin wird in einer Tagesdosis von 40 mg/kg
KG aufgeteilt auf 2–3 Tagesdosen verabreicht.
Azithromycin
wird in einer Dosierung von 10 mg/kg KG über 3 Tage, bei
der Streptokokken-Tonsillitis über 5 Tage verabreicht.
Gegenwärtig wird die Einmalgabe von 30 mg/kg KG empfohlen.
Dies ergibt zwar initial höhere Wirkstoffkonzentrationen,
verlängert jedoch den Zeitraum mit subinhibitorischen Konzentrationen.
Kontraindikationen
Schwere bakterielle Infektionen mit einem septischen Zustandsbild.
Bei
Lebererkrankungen sollen Erythromycin-Derivate mit Vorsicht
oder nicht eingesetzt werden. Für Clarithromycin, das überwiegend
renal eliminiert wird, ist bei eingeschränkter Nierenfunktion
eine Dosisanpassung erforderlich. |
| Ketolide
Ketolide
sind eine neue Antibiotikaklasse, die aus der Erythromycin-Familie
hervorgegangen sind.
Ketolide
besitzen wie Erythromycin einen makrozyklischen Lactonring.
Der Wirkmechanismus und das Wirkspektrum ist prinzipiell mit
dem Wirkmechanismus der Makrolide vergleichbar. Ketolide weisen
jedoch an den Seitenketten Veränderungen auf, die wesentliche
Struktur-Wirkungsbeziehungen bedingen. Ketolide unterscheiden
sich auch von den Makroliden in der Stärke der Wechselwirkung.
Die
C11 – C12 Carbamat-Seitenkette ist für
- eine
direkte Wirkung auf die Bildung von 50S- und 30S-Untereinheiten
der Ribosomen verantwortlich. Der besondere duale Wirkmechanismus
mit Wechselwirkung in der Domäne II und V der 23S rRNA
bedingt, dass der Aufbau der 30S- und 50S-Ribosomenuntereinheiten
gehemmt wird. Darüber hinaus besteht eine
- hohe
In vitro-Aktivität sowohl gegen Penicillin-empfindliche
als auch Penicillin- und Erythromycin-resistente Pneumokokken,
Haemophilus influenzae, Moraxella catarrhalis
und Coagulase-positive und -negative Staphylokokken. MHK-Werte
von Ketoliden sind gegen Streptokokken um mindestens 1 Titerstufe
niedriger als die von Clarithromycin und Azithromycin. Selbstverständlich
sind intrazelluläre Mikroorganismen wie Mykoplasmen und
Chlamydien im Spektrum weiterhin enthalten.
- Die
günstige Pharmakokinetik mit einer Bioverfügbarkeit
von nahezu 60%, der schnellen Anflutung, den hohen Serumkonzentrationen
und hohen Konzentrationen über die Zeit (AUC) sowie die
hohen Gewebekonzentrationen vor allem in entzündlichen
Geweben, wo die Konzentrationen im Plasma bei Weitem überschritten
werden, ist ebenso vorteilhaft gesehen.
Klinisch
hat dies zur Folge, dass die Proteinbiosynthese wirkungsvoll
blockiert wird, und dass Ketolide
- eine
bakterizide Wirksamkeit aufweisen und
- eine
hohe Wahrscheinlichkeit besteht, dass mef-kodierte
Resistenzen nicht aktiviert werden. Diese günstige Resistenzsituation
ist vergleichsweise auch stabil, d. h., dass auch mehrfache
Passagen der Keime in subinhibitorische Konzentrationen von
Telithromycin keine Resistenzen selektionieren.
Die
Ketofunktion an der C3-Stelle ist für die Säurestabilität
verantwortlich und trägt auch zur Verhinderung der Resistenzinduktion
bei. Die Methoxyfunktion an C6 verhindert die Ketalisierung
mit der Ketogruppe an C3.
Die
Verträglichkeit der Ketolide ist jedoch im Vergleich zu
den neueren Makroliden und Josamycin schlechter. Als Nebenwirkungen
werden eine stärkere gastrointestinale Beeinträchtigung
wie Appetitlosigkeit, Bauchschmerzen, Durchfälle, Erbrechen
beschrieben. Auch ein Anstieg der Leberenzyme und ein cholostatischer
Ikterus wird berichtet. Als besondere Nebenwirkung werden Geschmacksstörungen
sowie verschwommenes Sehen, eine Akkomodationsstörung sowie
Störung des Farbsehens beschrieben. Auch die QT-Verlängerung
ist nach Gabe von Ketoliden ausgeprägter als bei den neueren
Makroliden. Die Beeinflussung der körpereigenen Flora mit
Überwucherung mit Candida albicans und – sehr
selten – die Entwicklung einer pseudo-membranösen
Enterocolitis wird wie bei anderen Makrolid-Antibiotika beobachtet.
Klinische
Erfahrungen bestehen weltweit bei mehreren 100.000 Erwachsenen.
Klinische Studien im Kindesalter liegen erst bei älteren
Kindern ab 12 Jahren z. B. zur Behandlung einer Streptokokkentonsillitis,
einer Sinusitis und Otitis media mit ausgezeichneten klinischen
und mikrobiologischen Ergebnissen vor. Ketolide eignen sich
auch wegen des sicheren Wirkspektrums und des Fehlens resistenter
Mikroorganismen als empirische Behandlung einer ambulant erworbenen
Pneumonie.
Die
klinischen Erfahrungen im Kindesalter sind jedoch bescheiden.
Dies ist nicht zuletzt die Folge, dass für Ketolide bisher
keine orale Verabreichungsform als Saft zur Verfügung steht.
Die Zulassung besteht bisher für Behandlung von Infektionen
mit empfindlichen Mikroorganismen ab dem12. Lebensjahr. Die
Dosierung beträgt 10 mg/kg KG als Einzeldosis. Die Zulassung
für Kinder und der dokumentierte Einsatz bei Säuglingen
und Kleinkindern wäre im Angesicht der zunehmenden Resistenzen
auf die klassischen Makrolid-Antibiotika von Vorteil.
Das
Auftreten schwerer Nebenwirkungen, insbesondere schwere Leberschäden,
verändern jedoch das Risikoprofil. In Kanada wurde deshalb
die Behandlung von Sinusitiden und der Streptokokkentonsillitis
aus dem Indikationskatalog gestrichen. Es verbleibt der Einsatz
bei ambulant erworbenen Pneumonien. Der Einsatz in der Kinderheilkunde
bedarf deshalb einer sorgfältigen Abwiegung. |
| Lincosamide
resp. Clindamycin Lincosamide
sind eine Gruppe von Antibiotika, die im Wirkmechanismus, im
Wirkspektrum und in der Pharmakologie viele Gemeinsamkeiten
mit den Makroliden aufweisen. Sie binden wie Makrolide an die
50S-Subeinheit bakterieller Ribosomen und unterbinden die Proteinsynthese.
Der erste Vertreter dieser Gruppe ist das Lincomycin, das jedoch
vom semisynthetischen Clindamycin völlig abgelöst
wurde. Chemisch hat diese Gruppe von Antibiotika keine Ähnlichkeit
mit anderen Antibiotika.
Wirkspektrum
Clindamycin wirkt gegen Staphylokokken, Streptococcus pyogenes
und Streptokokken der Viridansgruppe, Peptostreptokokken und
Pneumokokken bakterizid. Die gute Aktivität gegen viele
Anaerobier wie Bacteroides spp, Fusobacterium
und die meisten Clostridium perfringens-Stämme weisen
dieser Wirksubstanz einen besonderen Stellenwert zu. Andere
Clostridienstämme, wie Clostridium difficile, sind
unwirksam.
Außerdem
wirkt Clindamycin gegen Corynebacterium diphtheriae,
Milzbrand, Nokardien, Aktinomyzeten und Campylobacter jejuni.
Die Wirksamkeit gegen Propionibacterium acnes weist dieser
Substanz ein Alleinstellungsmerkmal bei der Behandlung der Akne
zu.
Enterobakterien,
Pseudomonas spp, Acinetobacter, Klebsiellen aber
auch Haemophilus, Enterokokken, Meningokokken und Listerien
sind unempfindlich. Unwirksam ist Clindamycin aber auch gegen
Mykoplasma (Chlamydia pneumoniae).
Clindamycin
kann mit ß-Laktam-Antibiotika kombiniert werden und wirkt
meist synergistisch bzw. zumindest additiv.
Resistenzentwicklung
Folgende Mechanismen spielen für die Resistenzentwicklung
gegen Clindamycin eine Rolle:
- Veränderung
eines einzelnen Proteins in der 50S-Ribosomen-Untereinheit
- Methylierung
der 23S-ribosomalen RNA der 50S-Untereinheit. Es ist dies
eine meist durch Plasmide übertragene kombinierte Makrolid-,
Clindamycin- und Streptogramin-Resistenz. Dieser Resistenztyp
kann sich, wenn auch selten, unter einer Behandlung mit Clindamycin
entwickeln.
- Die enzymatische
Inaktivierung von Clindamycin spielt eine untergeordnete Rolle.
Wie
auch bei den Makrolid-Antibiotika bereits beobachtet zeigen
auch viele Mikroorganismen gegen Clindamycin eine zunehmende
Resistenz, wenn auch in einem erheblich geringeren Ausmaß.
Es besteht eine gewisse Kreuzresistenz mit Makroliden mit dem
erm-Resistenzgen. Clindamycin-resistente Streptokokken
sind selten (< 3%). Zwischen 3–5% der Staphylokokken
sind resistent. Penicillin G-resistente Pneumokokken sind meist
auch gegen Clindamycin unempfindlich.
Pharmakokinetik
Clindamycin wird nach oraler Gabe weitgehend unabhängig
von der Nahrungsaufnahme resorbiert. Die Bioverfügbarkeit
beträgt 80%. Das Blutspiegelmaximum wird nach ca. 45 Minuten
erreicht, die Halbwertszeit beträgt 2 1/2 Stunden. Die
Plasmaeiweißbindung beträgt 85%.
Clindamycin
liegt auch in einer parenteral verabreichbaren Form vor.
Clindamycin
zeigt eine gute Gewebegängigkeit z. B. in das Knochengewebe
und auch intrazellulär ins endoplasmatische Retikulum von
Granulozyten, Alveolärmakrophagen und in Abszesse.
Die Liquorgängigkeit ist unzureichend.
Die Elimination erfolgt nach hepatischer Glukorunierung überwiegend
durch die Leber. Es entstehen antimikrobiell aktive Metaboliten.
Die renale Elimination beträgt 15–35%. Eine Dosisanpassung
ist bei schwerer Leberschädigung sowie bei einer wesentlichen
Einschränkung der Kreatininclearance (> 75%) nötig.
Toxizität
und Nebenwirkungen
Clindamycin wird weniger gut als die Makrolide vertragen. Im
Darm liegen, bedingt durch die hohe biliäre Elimination
und die aktiven Metaboliten, hohe lokale Wirkstoffkonzentrationen
mit erheblichem Einfluss auf die Darmflora vor. Besonders problematisch
ist daher der Intestinaltrakt bei durchfälligen Stühlen,
die in bis zu 20% der Patienten auftreten, aber meist nicht
zum Therapieabbruch führen. Problematisch ist die Entwicklung
einer pseudomembranösen Colitis, die zwar selten ist, aber
mit schweren blutigen Durchfällen, Tenesmen, Kreislaufeinschränkung
und in Einzelfällen lebensbedrohlich verläuft. Die
Ursache ist die unter dem Selektionsdruck auftretende Überwucherung
der Darmflora mit Clostridium difficile. Mit gastrointestinalen
Nebenwirkungen muss bis zu 10 Tage nach Therapieende gerechnet
werden.
Weitere
seltene, aber schwerwiegende Nebenwirkungen sind Blutbildveränderungen
bis zur Agranulozytose, Transaminasenerhöhung und neuro-muskuläre
Blockaden, die insbesondere bei bestehenden neuromuskulären
Erkrankungen und Narkose zum Tragen kommen. Unter Dauertherapie
ist eine regelmäßige Blutdruckkontrolle nötig.
Allergische Manifestationen, Hautreaktionen und anaphylaktischer
Schock sind sehr selten.
Bei
intravenöser Verabreichung kann ein metallischer Geschmack
im Mund auftreten.
Interaktionen
mit anderen Substanzen
Clindamycin kann aufgrund seiner neuromuskulären Blockade
die Wirkung von Muskelrelaxantien verstärken, was zu lebensbedrohlichen
Narkosezwischenfällen führen kann.
Physikalische Unverträglichkeit schließt eine gemeinsame
parenterale Verabreichung mit Theophyllin, Barbituraten, Calcium-Glukonat
und Phenytoin aus.
Therapeutische
Indikation
Die Domäne für eine Verabreichung von Clindamycin
sind Mischinfektionen mit Staphylokokken und Anaerobiern.
Solche Situationen bestehen z. B. bei einer akuten, vor allem
aber bei der chronisch schwelenden Sinusitis.Auch bei einem
Lungenabszess und Aspirationspneumonie bzw. bei Fremdkörperaspiration
organischen Materials (z. B. Grasrispen) sind aerob/anaerobe
Mischinfektionen häufig. Bei eitrigen Prozessen im Mundhöhlen-
und im Zahnbereich sind Anaerobier beteiligt, die das ß-Laktamase-instabile
Penicillin hydrolysieren. Clindamycin ist hier das Mittel der
ersten Wahl.
Clindamycin
wird als Kombinations-partner bei intraabdominalen aerob/anaeroben
Mischinfektionen, z.B. beieinem perityphlitischen Abszess nachAppendicitis
perforata oder bei einerTubo-Ovarialinfektion -abszess inKombination
mit einem Azyl-ureidopenicillin oder Cephalosporinder Cefotaxim-Gruppe
verwendet.
Wegen der guten Knochengängigkeit wird Clindamycin als
Mittel der Wahl bei der Behandlung der Osteomyelitis empfohlen.
Neue Erkenntnisse über den Pathomechanismus der akuten
hämatogenen Osteomyelitis weisen darauf hin, dass intrazellulär
in phagozytären Vakuolen von Granulozyten, Makrophagen
und Osteoblasten überlebende Staphylokokken für die
Infektion im Knochenmark ein dauerndes Keimreservoir darstellen
und die Elimination der intrazellulären Staphylokokken
ein entscheidender therapeutischer Ansatz sein muss. Clindamycin
penetriert jedoch in das endoplasmatische Reticulum, nicht aber
in die phagozytäre Vakuole.
Clindamycin
wird bei Penicillin-Allergie zur Endocarditisprophylaxe im Rahmen
von Zahn- und HNO-ärztlichen Eingriffen, jedoch nicht zur
Endocarditistherapie empfohlen.
In
der Therapie der nekrotisierenden Fasciitis durch Streptococcus
pyogenes bzw. des Streptokokken-Toxic-Shock-Syndroms stellt
Clindamycin in Kombination mit Penicillin wegen der hemmenden
Wirkung auf die Toxinproduktion die Therapie der Wahl dar. Auch
bei Infektionen durch Clostridium perfringens ist eine
Kombinationstherapie Clindamycin mit Penicillin einer Monotherapie
mit einem der beiden Präparate zu überlegen.
Clindamycin
wird in der Literatur in Kombination mit anderen Präparaten
zur Behandlung einer Toxoplasma-Encephalitis und -Chorioretinitis
empfohlen, wohl wissend, dass die Liquorpenetration nicht gut
ist.
Clindamycin zeigt auch eine sehr gute Wirksamkeit bei der Eradikation
von Streptococcus pyogenes bei chronischen oropharyngealen
Trägern.
Die
Hauptanwendung für eine topische Anwendung von Clindamycin
ist die Aknetherapie. |
Literatur
| 1.
Guay DR. Macrolide antibiotics inpaediatric infectious diseases.
Drugs 1996;51(4):515-36. |
| 2.
van der Linden M, Al-Lahham A, HauptsS, Reinert RR. Clonal
spread of mef-positive macrolide-resistant Streptococcus
pneumoniae isolates causing invasive disease in adults in
Germany. AntimicrobAgents Chemother. 2007 May;51(5):1830-1834. |
| 3.
Reinert RR, Reinert S, van der Linden M,Cil MY, Al-Lahham
A, Appelbaum P. Anti-microbial susceptibility of Streptococcus
pneumoniae in eight European countries from 2001 to 2003.
Antimicrob AgentsChemother. 2005 Jul;49(7):2903-13. |
| 4.
Noguchi N, Tano J, Nasu Y, Koyama M,Narui K, Kamishima H,
Saito T, Tsuyuki K,Sasatsu M. Antimicrobial susceptibilities
and distribution of resistance genes forbeta-lactams and
macrolides in Streptococcus pneumoniae isolated between
2002 and 2004 in Tokyo. Int J Antimicrob Agents.2007 Jan;29(1):26-33. |
| 5.
Doern GV. Macrolide and ketolide resistance with Streptococcus
pneumoniae. MedClin North Am. 2006 Nov;90(6):1109-24.Review. |
| 6.
Doern GV, Ferraro MJ, BrueggemannAB, Ruoff KL. Emergence
of high resistance among viridans group streptococci in
the United States. Antimicr Agents Chemother. 40 891 –
894, 1996. |
| 7.
Nightingale CH. Future in vitroand animal studies: development
of pharmacokinetic and pharmacodynamic efficacy predictors
for tissue-based antibiotics.Pharmacotherapy. 2005 Dec;25(12
Pt 2):146-149. |
| 8.
Norrby SR, Quinn J, Rangaraju M, LeroyB. Evaluation of 5-day
therapy with telithromycin, a novel ketolide antibacterial,
for the treatment of tonsillopharyngitis.Clin Microbiol
Infect. 2004 Jul;10(7):615-23. |
| 9.
Noreddin AM, Roberts D, Nichol K,Wierzbowski A, Hoban DJ,
Zhanel GG.Pharmacodynamic modeling of clarithromycin against
macrolide-resistant [PCR-positive mef(A) or erm(B)] Streptococcus
pneumoniae simulating clinically achievable serum and epithelial
lining fluid free-drug concentrations. AntimicrobAgents
Chemother. 2002 Dec;46(12):4029-34. |
| 10.
Hoffman HL, Klepser ME, Ernst EJ,Petzold CR, Sa'adah LM,
Doern GV. Influence of macrolide susceptibility on efficacies
of clarithromycin and azithromycin against Streptococcus
pneumoniae in a murine lung infection model. Anti-microb
Agents Chemother. 2003 Feb;47(2):739-46. |
| 11.
Kays MB, Denys GA. In vitro activity and pharmacodynamics
of azithromycin and clarithromycin against Streptococcus
pneumoniae based on serum and intrapulmonary pharmacokinetics.
Clin Ther. 2001Mar;23(3):413-24. |
| 12.
Bryskier. Ketolides-telithromycin, an example of a new class
of antibacterial agents. Clin Microbiol Infect. 2000Dec;6(12):661-9. |
| 13.
Reinert RR. Clinical efficacy of ketolides in the treatment
of respiratory tract infections. J Antimicrob Chemother.
2004Jun;53(6):918-27. |
| 14.
Shackcloth J, Williams L, Farrell DJ.Streptococcus pneumoniae
and Streptococcus pyogenes isolated from a paediatric population
in Great Britain and Ireland: the in vitro activity of telithromcycin
versus comparators. J Infect. 2004 Apr;48(3):229-35. |
| 15.
Felmingham D, Farrell DJ, Reinert RR,Morrissey I. Antibacterial
resistance among children with community-acquired respiratory
tract infections (PROTEKT 1999-2000). J Infect. 2004 Jan;48(1):39-55. |
| 16.
Weisblum B. Erythromycin resistance by ribosome modification.
Antimic AgentsChemoth. 39, 577 – 585, 1995. |
| 17.
Bingen E, Doit C, Loukil C, Brahimi N,Bidet P, Deforche
D, Geslin P. Activity of telithromycin against penicillin-resistant
Streptococcus pneumoniae isolates recovered from French
children with invasive and noninvasive infections. Anti-microb
Agents Chemother. 2003 Jul;47(7):2345-7 |
| 18.
Hoban D, Felmingham D. The PRO-TEKT surveillance study:
antimicrobial susceptibility of Haemophilus influenzae and
Moraxella catarrhalis from community-acquired respiratory
tract infections. J Antimicrob Chemother. 2002 Sep;50 SupplS1:49-59. |
| 19.
Benninger P, Cooper A, Moisan R, PatelP, Elvin A, Thiessen
JJ. A comparative clarithromycin bioavailability study:
determination of clarithromycin and 14-(R)-hydroxyclarithromycin
under fasting and fed conditions. Int J Clin Pharmacol Ther.2004
Jun;42(6):342-9. |
| 20.
Buxbaum A, Forsthuber S, GraningerW, Georgopoulos A. Austrian
Bacterial Surveillance Network Serotype distribution and
antimicrobial resistance of Streptococcus pneumoniae in
Austria. J AntimicrobChemother. 2004 Jul;54(1):247-50. |
| 21)
Seppälä H, Nissinen A, Järvinen H,Huovinen
S, Henriksson T, Herva E, HolmSE, Jahkola M, Katila ML,
Klaukka T.Resistance to erythromycin in group Astreptococci.
N Engl J Med. 1992 Jan30;326(5):339-40. |
| 22.
Buxbaum A, Forsthuber S, GraningerW, Georgopoulos A. Comparative
activity of telithromycin against typical community-acquired
respiratory pathogens. J Anti-microb Chemother. 2003 Sep;52(3):371-4 |
| 23.
Kastner U, Guggenbichler JP. Influence of macrolide antibiotics
on promotion of resistance in the oral flora of children.Infection.
2001 Oct;29(5):251-6. |
| 24.
Leclercq R, Couvalin P. Mechanism of resistance to macrolide,
lincosamides and streptogramin antibiotics by target modification.
Antimic Agents Chemoth. 35, 1267-1272, 1993. |
| 25.
Scaglione F, Demartini G, Dugnani S,Fraschini F. In vitro
comparative dynamics of modified-release clarithromycin
and of azithromycin. Chemotherapy. 2000 Sep-Oct;46(5):342-52. |
| 26.
Nightingale CH. Pharmacokinetics and pharmacodynamics of
newer macrolides.Pediatr Infect Dis J. 1997 Apr;16(4):438-43. |
| 27.
Vanderkooi Powis JE, Green K, LowDE, Pong-Porter S, Shigayeva
A, Plevneshi, McGeer A, and the Toronto invasive Network.
Predicting pneumocoiccal resistance on basis of antimicrobial
history. |
| 28.
R. J. Davidson, C. C. K. Chan, G.Doern, G. G. Zhanel. Macrolide-resistant
Streptococcus pneumoniae in Canada: correlation with azithromycin
use. 13th European Congress of Clinical Microbiology and
Infectious Diseases 10-13 May 2003,Glasgow, UK. |
| 29.
Maglio D, Capitano B, Banevicius MA,Geng Q, Nightingale
CH, Nicolau DP. Differential efficacy of clarithromyc in
in lung versus thigh infection models. Chemotherapy. 2004
Jun;50(2):63-6. |
| 30.
Maglio D, Capitano B, Banevicius MA,Tessier PR, Nightingale
CH, Nicolau DP. Efficacy of clarithromycin against Streptococcus
pneumoniae expressing mef(A)-mediated resistance. Int J
AntimicrobAgents. 2004 May;23(5):498-501. |
| 31.
Bauernfeind A, Jungwirth R, EberleinE. Comparative pharmacodynamics
of clarithromycin and azithromycin against respiratory pathogens.
Infection. 1995 Sep-Oct;23(5):316-21. |
| 32.
Seppälä H, Nissinen A, Huovinen Q.Three different
phenotypes of erythromycin resistant streptococci in Finland.
J. Anti-micr. Chemotherapy. 32, 885-891, 1993. |
| 33.
Rondini G, Cocuzza CE, Cianflone M,Lanzafame A, Santini
L, Mattina R. Bacteriological and clinical efficacy of various
antibiotics used in the treatment of streptococcal pharyngitis
in Italy. An epidemiological study. Int J Antimicrob Agents.
2001Jul;18(1):9-17. |
| 34.
Varaldo PE, Debbia EA, Nicoletti G,Pavesio D, Ripa S, Schito
GC, Tempera G.Nationwide survey in Italy of treatment of
Streptococcus pyogenes pharyngitis in children: influence
of macrolide resistance on clinical and microbiological
outcomes.Artemis-Italy Study Group. Clin InfectDis. 1999
Oct;29(4):869-73. |
| 35.
Lode HM H. Managing community-acquired pneumonia: A European
perspective. Respir Med. 2007 Sep;101(9):1864-73. |
| 36.
Schmitzberger R, Guggenbichler JP,Zeman E. Diagnosis and
therapeutic strategies in pneumonia in childhood. PadiatrPadol.
1989;24(1):49-61. |
| 37.
Bui KQ, Banevicius MA, NightingaleCH, Quintiliani R, Nicolau
DP. In vitro and in vivo influence of adjunct clarithromycin
on the treatment of mucoid Pseudomonas aeruginosa. J Antimicrob
Chemother. 2000Jan;45(1):57-62. |
| 38.
Felmingham D, Zahnel G, Hoban D.Activity of ketolide antibacterial
telithromycin against typical community acquired respiratory
pathogens. J Anti-microb Chemother. 48, 33- 42, 2001. |
| 39.
Leclerc R. Safeguarding future anti-microbial options: strategies
to minimise resistance. Clin Microb Infect Dis 7 Suppl3,
18-23, 2001. |
| 40.
Douthwaite S. Structure-activity relationship of ketolides
vs macrolides. ClinMicrob Infect Dis 7 Suppl 3, 11-17, 2001. |
| 41.
Georgopoulos A, Buxbaum A, StraschilU. The Austrian bacterial
surveillance network.Scan J Inf Dis 30, 345 349, 1998. |
| 42.
Drusano G. Pharmacodynamic and pharmacokinetic considerations
in anti-microbial selection. Focus on telithromycin.Clin
Microb Infect Dis 7 Suppl 3, 2-10,2001. |
| 43.
Malhotra-Kumar S, Lammens C, Coenen S, Van Herck K, Goossens
H. Effect of azithromycin and clarithromycin therapy on
pharyngeal carriage of macrolide-resistant streptococci
in healthy volunteers: a randomised, double-blind, placebo-controlled
study. Lancet. 2007 Feb 10;369(9560):482-90. |
| 44.
Hoban DJ, Zhanel GG. Clinical implications of macrolide
resistance in community-acquired respiratory tract infections.Expert
Rev Anti Infect Ther. 2006Dec;4(6):973-80. Review. |
Anschrift
des Verfassers:
Univ.-Prof. Dr. J. Peter Guggenbichler
Klinik mit Poliklinik der Universität Erlangen-Nürnberg
D-91054 Erlangen, Loschgestraße 15
E-Mail: prof.guggenbichler@gmx.de
|
|
|