| Therapie der
Influenzavirus-Infektion |
Ch. Steininger
Abteilung für Infektiologie und Tropenmedizin, Universitätsklinik
für Innere Medizin I, Medizinische Universität
Wien |
|
|
Schlüsselwörter:
Antivirale Therapie,
Influenza, respiratorische Virusinfektion, Epidemie, Pandemie |
|
Zusammenfassung
Die
effektive Prävention und Therapie der epidemischen und
pandemischen Influenzavirus-Infektion ist von hoher klinischer
und sozioökonomischer Relevanz. M2-Kanal-Blocker (Amantadin
und Rimantadin) wurden über mehrere Jahrzehnte für
diese Indikation verwendet. Unter Therapie kam es jedoch rasch
zu Resistenzentwicklung, reversiblen, zentralnervösen Nebenwirkungen
und diese Substanzen waren nur gegen Influenza A-Viren wirksam.
Die Neuraminidase-Inhibitoren (Oseltamivir und Zanamivir) lösten
die M2-Kanal-Blocker in der medikamentösen Prävention
und Therapie der epidemischen Influenza wegen eines günstigeren
Nebenwirkungsprofils und Wirksamkeit auch gegen Influenza B-Viren
ab. Allerdings wäre Amantadin in der Prävention und
Therapie in Kombination mit Neuraminidase-Inhibitoren sowie
als Reservemedikament erwägenswert.
|
Key-words:
Antiviral
therapy, influenza, respiratory virus infection, epidemic, pandemic |
|
Summary
Effective
prevention and therapy of epidemic and pandemic influenzavirus
infections is of high clinical and socioeconomic relevance.
The M2-channel-blockers (Amantadin and Rimantadin) were used
for several decades for prevention and treatment of influenza.
Nevertheless, resistant influenza strains emerged rapidly and
central-nervous sideeffects were commonly associated with this
antiviral therapy. The neuraminidase-inhibitors (Oseltamivir
and Zanamivir) replaced the M2-channel-blockers for the prevention
and treatment of epidemic influenza due to the low incidence
of sideeffects and effectiveness also against influenza B viruses.
M2-channel-blockers may be considered as second line drugs in
the case of pandemic influenza.
|
Einleitung
Influenzavirus-Infektionen
haben eine große klinische, als auch sozioökomomische
Bedeutung. Prävention und effektive Therapie sind daher
von großem individuellen und öffentlichem Interesse.
Die beste präventive Maßnahme vor einer epidemischen
Influenzavirus-Infektion, eine aktive Schutzimpfung, wird in
Österreich schlecht angenommen – die jährlichen
Impfraten liegen sogar unter dem ohnehin niedrigen europäischen
Durchschnitt von rund 20%. Eine antivirale, medikamentöse
Prävention und Therapie hat neben Resistenzentwicklung
und Nebenwirkungen Nachteile, die bei Verordnung der entsprechenden
Präparate bedacht werden muss.
Die antivirale Therapie muss spätestens innerhalb von 48
Stunden nach Erkrankungsbeginn begonnen werden, um einen messbaren
Therapieerfolg zu erzielen. Die höchsten Virusmengen werden
in respiratorischen Sekreten unmittelbar nach Beginn der klinischen
Symptomatik gemessen, so dass zu diesem Zeitpunkt auch die maximale
Wirkung erzielt werden kann. Die Diagnose einer Influenzavirus-Infektion
und damit die Indikationsstellung für eine antivirale Therapie
ist mittels Laboruntersuchung in der Regel nicht innerhalb dieses
Zeitraums möglich. Die Entscheidung für oder gegen
eine antivirale Therapie muss daher auf der klinischen Diagnose
basieren, die eine Sensitivität von ~60–75% und Spezifizität
von ~55% während der Influenza-Saison erreicht [1]. Ein
beträchtlicher Anteil von Patienten mit grippalem Infekt
anderer Genese wird daher unnötigerweise antivirale und
antibakterielle Substanzen erhalten. Die Wichtigkeit der jährlichen
aktiven Immunisierung gegen die epidemische Influenza kann daher
nicht ausreichend betont werden. |
| Epidemische
Influenza M2-Kanal-Blocker
Amantadin und Rimantadin wirken durch die Blockade des viralen
M2-Proteinionenkanals von Influenza A-Viren (Tabelle 1). Das
M2-Protein ist essentiell für die Freisetzung der viralen
Nukleinsäure und die Regulation des intrazellulären
pH-Werts. Insbesondere Amantadin wurde über rund 30 Jahre
für die Prävention und Therapie von Influenzavirus-Infektionen
angewandt. M2-Inhibitoren haben jedoch mehrere entscheidende
Nachteile. Sie wirken ausschließlich gegen Influenza A-Viren,
weil Influenza B-Viren die entsprechende Zielstruktur, das Matrixprotein
M2, nicht besitzen und es treten unter Therapie rasch resistente
Influenzastämme auf. Amantadin und Rimantadin verkürzen
die Influenza-Erkrankung um einen Tag, beeinflussen aber nicht
die Dauer der Virusausscheidung oder den Verlauf einer asymptomatischen
Influenzavirus-Infektion [2]. Amantadin wird auch in der Therapie
des Morbus Parkinson eingesetzt. In Analogie sind primär
reversible, zentralnervöse Nebenwirkungen zu erwarten,
mit Schlaflosigkeit, Benommenheit, Reizbarkeit und Konzentrationsschwierigkeiten.
Diese Nachteile limitierten wesentlich den klinischen Einsatz.
Seit der Entwicklung modernerer Substanzen (Neuraminidase-Inhibitoren)
ist der Einsatz von M2-Inhibitoren für die saisonale Influenza
obsolet geworden und sollte nur in einer Influenza-Pandemie
erwogen werden.
Tabelle
1: Antivirale Medikamente mit Wirksamkeit gegen Influenzaviren
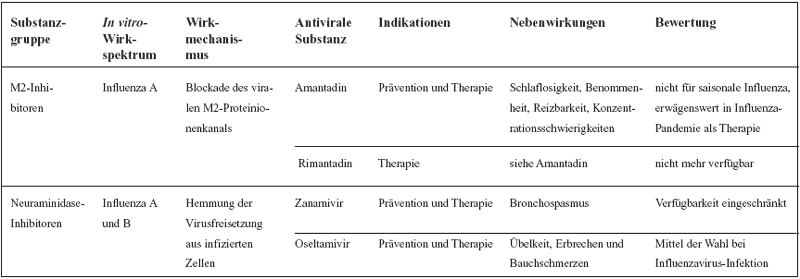
Neuraminidase-Inhibitoren
Neuraminidase-Inhibitoren wirken ausschließlich gegen
Influenza-Viren, aber im Gegensatz zu M2-Blockern ebenfalls
auf Influenza B-Viren und Vogelgrippe-Viren (Tabelle 1). Zanamivir
ist ein inhalativer Neuraminidase-Inhibitor, der kaum Nebenwirkungen
hat. Wegen der Gefahr eines Bronchospasmus ist dieses Medikament
nicht für den Einsatz bei Patienten mit bekannter Hyperreagibilität
des Bronchialssystems (Asthmatiker) zugelassen. Durch die inhalative
Applikation ist eine ausreichende Wirkstoffzufuhr bei Patienten
ohne entsprechender Inhalationstechnik zweifelhaft [3].
Oseltamivir kann oral appliziert werden und ist für die
Behandlung der Virusgrippe ab dem 1. Lebensjahr zugelassen (Tabelle
2). Oseltamivir verkürzt die Dauer einer Influenzaerkrankung
im Median um 36 Stunden [4], führt zu einer deutlichen
Reduktion der bakteriellen Komplikationen trotz reduziertem
Antibiotika-Gebrauch und der Hospitalisierungsrate [5]. Die
Therapie sollte jedenfalls innerhalb der ersten zwei Tage nach
Auftreten der Symptome einer Influenza begonnen werden. Im Falle
einer Influenza-Pandemie ist ebenfalls mit einer wesentlichen
Reduktion von Hospitalisierungen und Mortalität durch den
Einsatz von Oseltamivir auszugehen [6]. Mathematische Modelle
sprechen für eine Prävention oder zumindest deutliche
Verzögerung einer entstehenden Pandemie durch den großflächigen
Einsatz einer Chemoprophylaxe [7, 8]. Die Effizienz von Oseltamivir
zur Prävention der saisonalen Influenza beträgt jedoch
nur 61–73% [9]; bei der Prävention von Komplikationen
des unteren Respirationstrakts ist sie aber signifikant höher
als mit Placebo [9].
Tabelle
2: Dosierung antiviraler Medikamente mit Wirksamkeit
gegen Influenzaviren (Österreich)
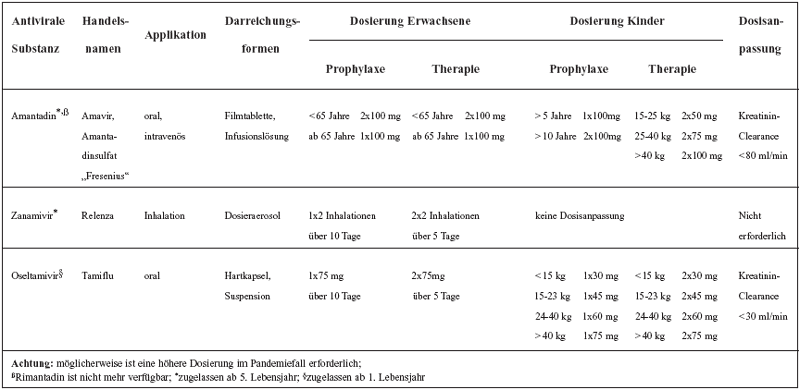
Eine
Resistenz gegenüber Oseltamivir wurde bisher sehr selten
in klinischen Isolaten beobachtet. In klinischen Studien zur
Wirksamkeit von Oseltamivir waren weniger als 1% aller klinischen
Isolate resistent. Suboptimale Dosierung und Dauer der antiviralen
Therapie kann jedoch rasch zur Entwicklung einer antiviralen
Resistenz führen. In zwei klinischen Studien wurden Kleinkinder
mit Influenza A-Virusinfektion mit einer vergleichsweise geringen
Dosis von Oseltamivir behandelt und es wurde eine Resistenzentwicklung
bei rund 16% der behandelten Patienten beobachtet. In einer
weiteren Studie trat eine Resistenz gegenüber Oseltamivir
in rund 25% der Patienten mit A/H5N1-Infektion auf [10]. N1-Influenzaviren
mit His274 Tyr-Mutation sind hochresistent gegenüber Oseltamivir,
aber auch deutlich geringer Replikations-kompetent und weiterhin
sensitiv gegenüber Zanamivir [11,12].
|
| Pandemische
Influenza Die
Neuraminidase-Inhibitoren Oseltamivir und Zanamivir sind nicht
nur gegen Influenza A-Viren wirksam, sondern auch Influenza
B-Viren und Vogelgrippe-Viren, und haben ein günstiges
Nebenwirkungsprofil, sodass primär diese Medikamente in
allen nationalen Pandemieplänen für die Therapie und
Chemoprophylaxe in einer Influenza-Pandemie aufgeführt
werden. Im Falle einer Influenza-Pandemie ist eine wesentliche
Reduktion von Hospitalisierungen und Mortalität durch den
Einsatz von Neuraminidase-Inhibitoren zu erwarten [6]. Mathematische
Modelle sprechen für eine Prävention oder zumindest
deutliche Verzögerung einer entstehenden Pandemie durch
den großflächigen Einsatz einer wirksamen Chemoprophylaxe
[7, 8]. Die Effizienz von Oseltamivir zur Prävention der
saisonalen Influenza beträgt jedoch nur 61–73% [9].
Eine antivirale Resistenzentwicklung unter Therapie mit Neuraminidase-Inhibitoren
bzw. Zunahme der resistenten Influenzastämme während
einer Pandemie könnte die Wirksamkeit dieser Substanzklasse
weiter reduzieren.
Eine Resistenz gegenüber Oseltamivir wurde bisher sehr
selten in klinischen Isolaten beobachtet. In klinischen Studien
zur Wirksamkeit von Oseltamivir waren weniger als 1% aller klinischen
Isolate resistent. In einer Pandemie-Situation ist mit einer
deutlich höheren Resistenzrate zu rechnen, als bisher in
kontrollierten klinischen Studien beobachtet wurde. Der großflächige
Einsatz antiviraler Medikamente, wie von Nationalen Pandemieplänen
vorgesehen, und die große Anzahl an Influenzaerkrankungen
während einer Pandemie macht selbst eine Resistenzrate
von ~1% klinisch relevant und erhöht gleichzeitig den Selektionsdruck
auf sensible Influenzastämme. Suboptimale Dosierung und
Dauer der antiviralen Therapie, z. B. durch Knappheit der antiviralen
Medikamente oder Selbstmedikation durch Laien, kann die Resistenzentwicklung
zusätzlich fördern. In zwei klinischen Studien wurden
Kleinkinder mit Influenza A-Virusinfektion behandelt und eine
Resistenzentwicklung bei rund 16% der behandelten Patienten
beobachtet [10, 13]. Als wahrscheinlichste Ursache wurde eine
zu niedrige Dosierung des Neuraminidase-Inhibitors identifiziert
– die Dosierung wurde nicht ausreichend an das Körpergewicht
angepasst [10].
Klinische Isolate mit Resistenz gegenüber Neuraminidase-Inhibitoren
waren bisher deutlich geringer Replikations-kompetent in
vitro als Wildvirus-Stämme [11, 12]. Die Fitness eines
pandemischen, Oseltamivir-resistenten Influenzastammes lässt
sich jedoch nicht vorhersagen. Nationale Pandemiepläne
sollten daher Alternativen für den Fall Replikations-kompetenter,
Oseltamivir-resistenter Influenzastämme enthalten. In der
Behandlung und Prävention Oseltamivir-resistenter Stämme
erscheint die Kombination mit Amantadin wegen unterschiedlicher
Wirkmechanismen theoretisch sinnvoll. Im Mausmodell zeigte die
Kombination eine bessere Wirksamkeit im Schutz vor einer Influenzavirus-Erkrankung
als die jeweilige Einzelsubstanz [14] und in der Prävention
einer Resistenzentstehung [15]. Daten aus kontrollierten klinischen
Studien liegen für die Wirksamkeit der Kombinationstherapie
derzeit keine vor. Im Gegensatz zum aktuellen österreichischen
Pandemieplan wird z. B. im deutschen Pandemieplan dieser Unsicherheit
Rechnung getragen und nicht von der Verwendung von Amantadin
abgeraten (siehe www.rki.de).
Allerdings verfügen nur in wenigen europäischen Ländern
Amantadin-enthaltende Antiparkinsonarzneimittel über die
Zusatzindikation Therapie und Prophylaxe der Influenza A-Virusgrippe
(ab dem 5. Lebensjahr), da diese Teilindikation in einigen Mitgliedsstaaten
der EU zurückgezogen wurde.
|
| Symptomatisch-supportive
und adjuvanteTherapie Glucocorticoide
Die Datenlage zur Gabe von Glucocorticoiden bei viralen Infektionen
des unteren Respirationstrakts ist derzeit heterogen. Eine Meta-Analyse
zeigte einen positiven Effekt von Steroiden auf den Verlauf
einer Influenza A-Virus-Pneumonie [16]. Eine Verdoppelung der
Dosis inhalativer Steroide bei akuter Exazerbation eines Asthma
bronchiale und eine systemische Kortisontherapie bei Kindern
mit akuter viraler Bronchiolitis erbrachten keinen nachweisbaren
positiven Effekt [17, 18, 19]. Ein Schutz vor Exazerbationen
eines Asthma bronchiale konnte bei Schulkindern mit moderaten
Dosen eines inhalativen Steroids (400 µg Beclomethason
täglich) nicht erzielt werden [20, 21]. Der Einsatz von
Kortikosteroiden in der Prävention und Therapie einer viralen
Erkrankung des unteren Respirationstrakts bleibt insgesamt kontrovers
diskutiert, scheint aber bei der Therapie der Influenzavirus-Infektion
und viralen Pneumonie positive Effekte zu erzielen.
Antiobstruktive
Therapie in der akuten viralen Erkrankung
Bronchodilatoren sind ein wichtiger Bestandteil in der antiobstruktiven
Therapie der infekt-exazerbierten COPD. Die Verwendung von Bronchodilatatoren
bei der Bronchiolitis wird ebenfalls kontrovers diskutiert.
Eine Meta-Analyse bisheriger Studien fand keinen eindeutigen
Benefit, während eine andere Meta-Analyse minimale, kurzzeitige
Verbesserungen der klinischen Symptomatik nachwies [22]. In
letzterer Studie zeigte sich nur bei einem von vier mit Bronchodilatatoren
behandelter Kinder eine vorübergehende Besserung der klinischen
Symptomatik. Bronchodilatatoren werden daher nicht routinemäßig
in der Therapie der Bronchiolitis eingesetzt [23]. Die empirisch-probatorische
Therapie mit a-adrenergen oder b-adrenergen Medikamenten ist
eine Option, die jedoch nur bei raschem klinischen Erfolg fortgeführt
werden sollte. Inhalationen mit warmer, angefeuchteter Luft
zeigten in drei klinischen Studien einen Benefit bei Infektionserkrankungen
der oberen Atemwege, während drei weitere Studien diese
Resultate nicht bestätigen konnten [24]. Studien zur viralen
Infektion der unteren Atemwege liegen nicht vor.
Vitamine,
Echinacea und Hühnersuppe
Die Einnahme von Nahrungsergänzungen zur Stärkung
des Immunsystems ist en vogue. Die Wirksamkeit konnte allerdings
nur in Ausnahmen bewiesen werden. Vitamin C reduzierte in einer
klinischen Studie die Inzidenz und Krankheitsdauer oberer Atemwegsinfektionen
[25]. Vitamin A-Defizienz ist ein bekannter Risikofaktor für
einen schweren Verlauf einer Maserninfektion. In einer Meta-Analyse
zeigte die Gabe von Vitamin A in zwei Einzeldosen eine signifikant
reduzierte Pneumonie-assoziierte Letalität bei Kindern
unter dem 2. Lebensjahr [26]. Patienten mit Pneumonien durch
andere virale Erreger profitierten nicht von der Gabe von Vitamin
A [27]. Die Wirksamkeit anderer Substanzen in der traditionellen
Volksmedizin konnte in klinischen Studien nicht bestätigt
werden. Echinacea hatte keine messbaren Effekte auf Rhinovirusinfektionen
in sorgfältig geplanten Studien [28]. Die Gabe von Zink
hatte keinen Einfluss auf Infektionen der oberen Atemwege [29]
und zur Einnahme von Hühnersuppe kann derzeit nur auf Basis
kulinarischer Erfahrungswerte angeraten werden. |
Literatur
| 1.
Monto AS, Gravenstein S, Elliott M, Colopy M, Schweinle
J. Clinical signs and symptoms predicting influenza infection.
Arch Intern Med 2000; 160:3243-7. |
| 2.
Jefferson T, Demicheli V, Di Pietrantonj C, Rivetti D. Amantadine
and rimantadine for influenza A in adults. Cochrane Database
Syst Rev 2006;CD001169. |
| 3.
Diggory P, Fernandez C, Humphrey A, Jones V, Murphy M. Comparison
of elderly people's technique in using two dry powder inhalers
to deliver zanamivir: randomised controlled trial. BMJ 2001;
322:577-9. |
| 4.
Matheson NJ, Symmonds-Abrahams M, Sheikh A, Shepperd S,
Harnden A. Neuraminidase inhibitors for preventing and treating
influenza in children. Cochrane Database Syst Rev 2003;CD
002744. |
| 5.
Hayden FG, Pavia AT. Antiviral management of seasonal and
pandemic influenza. J Infect Dis 2006; 194 Suppl 2:119-126. |
| 6.
Gani R, Hughes H, Fleming D, Griffin T, Medlock J, Leach
S. Potential impact of antiviral drug use during influenza
pandemic. Emerg Infect Dis 2005; 11:1355-62. |
| 7.
Ferguson NM, Cummings DA, Cauchemez S, et al. Strategies
for containing an emerging influenza pandemic in Southeast
Asia. Nature 2005; 437:209-14. |
| 8.
Longini IM, Jr., Nizam A, Xu S, et al. Containing pandemic
influenza at the source. Science 2005; 309:1083-7. |
| 9.
Jefferson TO, Demicheli V, Di Pietrantonj C, Jones M, Rivetti
D. Neuraminidase inhibitors for preventing and treating
influenza in healthy adults. Cochrane Database Syst Rev
2006; 3:CD001265. |
| 10.
Ward P, Small I, Smith J, Suter P, Dutkowski R. Oseltamivir
(Tamiflu) and its potential for use in the event of an influenza
pandemic. J Antimicrob Chemother 2005; 55 Suppl 1:i5-i21. |
| 11.
Le QM, Kiso M, Someya K, et al. Avianflu: isolation of drug-resistant
H5N1 virus. Nature 2005; 437:1108. |
| 12.
Mishin VP, Hayden FG, Gubareva LV. Susceptibilities of antiviral-resistant
influenza viruses to novel neuraminidase inhibitors. Antimicrob
Agents Chemother 2005; 49:4515-20. |
| 13.
Kiso M, Mitamura K, Sakai-Tagawa Y, et al. Resistant influenza
A viruses in children treated with oseltamivir: descriptive
study. Lancet 2004; 364:759-65. |
| 14.
Masihi KN, Schweiger B, Finsterbusch T, Hengel H. Low dose
oral combination chemoprophylaxis with oseltamivir and amantadine
for influenza a virus infections in mice. J Chemother 2007;
19:295-303. |
| 15.
Ilyushina NA, Bovin NV, Webster RG, Govorkova EA. Combination
chemotherapy, a potential strategy for reducing the emergence
of drug-resistant influenza Avariants. Antiviral Res 2006;
70:121-31. |
| 16.
Cheng VC, Tang BS, Wu AK, Chu CM, Yuen KY. Medical treatment
of viral pneumonia including SARS in immuno competent adult.
J Infect 2004; 49:262-73. |
| 17.
Harrison TW, Oborne J, Newton S, Tattersfield AE. Doubling
the dose of inhaled corticosteroid to prevent asthma exacerbations:
randomised controlled trial. Lancet 2004; 363:271-5. |
| 18.
Fitz Gerald JM, Becker A, Sears MR, Mink S, Chung K, Lee
J. Doubling the dose of budesonide versus maintenance treatment
in asthma exacerbations. Thorax 2004; 59:550-6. |
| 19.
Patel H, Platt R, Lozano JM, Wang EE. Glucocorticoids for
acute viral bronchiolitis in infants and young children.
Cochrane Database Syst Rev 2004;CD004878. |
| 20.
Doull IJ, Lampe FC, Smith S, Schreiber J, Freezer NJ, Holgate
ST. Effect of inhaled corticosteroids on episodes of wheezing
associated with viral infection in school age children:
randomised doubleblind placebo controlled trial [see comments].
BMJ 1997; 315:858-62. |
| 21.
McKean M, Ducharme F. Inhaled steroids for episodic viral
wheeze of childhood. Cochrane Database Syst Rev 2000;CD001107. |
| 22.
Kellner JD, Ohlsson A, Gadomski AM, Wang EE. Bronchodilators
for bronchiolitis. Cochrane Database Syst Rev 2000;CD001266. |
| 23.
Diagnosis and management of bronchiolitis. Pediatrics 2006;
118:1774-93. |
| 24.
Singh M. Heated, humidified air for the common cold. Cochrane
Database SystRev 2006; 3:CD001728. |
| 25.
Van Straten M, Josling P. Preventing the common cold with
a vitamin C supplement: a double-blind, placebo-controlled
survey. Adv Ther 2002; 19:151-9. |
| 26.
Huiming Y, Chaomin W, Meng M. Vitamin A for treating measles
in children. Cochrane Database Syst Rev 2005;CD001479. |
| 27.
Ni J, Wei J, Wu T. Vitamin A for non-measles pneumonia in
children. Cochrane Database Syst Rev 2005;CD003700. |
| 28.
Turner RB, Bauer R, Woelkart K, Hulsey TC, Gangemi JD. An
evaluation of Echinacea angustifolia in experimental rhinovirus
infections. N Engl J Med 2005;353:341-8. |
| 29.
Marshall I. Zinc for the common cold. Cochrane Database
Syst Rev 2000;CD001364. |
Anschrift
des Verfassers:
Dr. Christoph Steininger
Univ.-Klinik für Innere Medizin I, Klin.Abt. für Infektionen
und Tropenmedizin
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: christoph.steininger@meduniwien.ac.at
|
|
|