Staphylococcus
aureus-Endokarditis
15 Jahre nach Ross-Operation |
S. Hennig1,
K.B. Gattringer1, W. Graninger1, E.
Presterl1, F. Thalhammer1, W. Wisser2,
E. Wiesinger3
1 Univ.-Klinik für Innere Medizin I, Klin.
Abt. für Infektionen und Tropenmedizin, Medizinische
Universität Wien
2 Univ.-Klinik für Chirurgie, Klin. Abt.
für Herz-Thoraxchirurgie, Medizinische Universität
Wien
3 Sonderkrankenanstalt Herz-Kreislaufzentrum
Groß Gerungs |
|
|
Schlüsselwörter:
kongenitale Herzklappenfehler, infektiöse Endokarditis, Ross-Operation |
|
Zusammenfassung
Wir
berichten über einen 23-jährigen Patienten, der 15
Jahre nach einer Ross-Operation (Aortenklappenersatz durch autologe
Pulmonalklappe und Pulmonalishomograft) eine Staphylococcus
aureus-Endokarditis des pulmonalen Homografts und eine
Sepsis entwickelte. Der Patient hatte eine kongenitale Aortenklappenstenose
und in Folge drei Valvolotomien. Da sich der Gesundheitszustand
des Patienten im Rahmen der Endokarditis massiv verschlechterte,
musste er sich im Juli 2007 erneut einer Herzoperation unterziehen:
der alte Homograft wurde explantiert, ein neuer Homograft implantiert,
und zusätzlich wurde eine Tricuspidalringrekonstruktion
durchgeführt. Vor und nach der Operation erhielt der Patient
Antibiotika. Nach einem 4-wöchigen Krankenhausaufenthalt
konnte der Patient in gutem Allgemeinzustand entlassen werden.
|
Key-words:
congenital
cardiac valvular defect, infectious endocarditis, Ross Operation |
|
Summary
We
report the case of a 23 years old male patient who suffered
from Staphylococcus aureus endocarditis of a pulmonary
homograft valve and sepsis 15 years after he had undergone a
Ross procedure (replacement of the aortic valve by a pulmonary
autograft). The patient was born with congenital aortic valve
stenosis and had therefore undergone three valvulotomies and
valvuloplasties. Because of his poor health he underwent cardiothoracic
surgery again: On July 2007 a homograft was implanted at the
site of the pulmonary valve and tricuspid annuloplasty was performed.
Before and after surgery antibiotics were administered. After
hospitalization for four weeks the patient was discharged in
fairly good health on August 2007. |
Einleitung
Eine
Endokarditis des pulmonalen Homografts ist eine extrem seltene
Komplikation nach einer Ross-Operation; die Mehrheit der postoperativen
Endokarditisfälle tritt in den ersten postoperativen Jahren
auf und betrifft meist den Autograft der Aorta [1]. Wir berichten
den seltenen Fall einer Staphylococcus aureus-Endokarditis,
bei welcher der pulmonale Homograft betroffen war. Diese trat
15 Jahre nach einer Ross-Operation und fast 21 Jahre nach drei
Valvuloplastien auf. Der Patient hatte keinerlei Risikofaktoren
wie intravenösen Drogenabusus, Lebererkrankungen, Diabetes
mellitus, Tumorkachexie, immunsuppressive Therapie, kurz zurückliegende
Tonsillektomie oder Parodontitis, und er wurde auch nicht von
einer Katze gebissen oder hatte Haustiere [1]. |
| Kasuistik
Mitte
Juni 2007 hatte ein normalerweise gesunder 23-jähriger
Mann plötzlich hohes Fieber (39,7°C), starken Schüttelfrost,
Muskel- und Gelenksschmerzen sowie Diarrhoe, die er allerdings
auf sein chinesisches Essen zurückführte. Einige Tage
vor Auftreten der Symptome war der Patient auf einem dreitägigen
Rockfestival (150 000 Personen, geringe Hygienestandards, extreme
Hitze, mangelnde Ernährung, maximal drei Stunden Schlaf
pro Tag, und einem Bierkonsum von einigen Litern Bier täglich).
Einen Monat vorher hatte er ebenfalls drei Tage Fieber bis 38°C
und Muskelschmerzen, beide Symptome verschwanden jedoch ohne
Einnahme von Medikamenten. Eine Woche später suchte der
Patient einen praktischen Arzt auf, der ihm 500 mg Mefenaminsäure
(Parkemed®) verschrieb, welches er 4- – 5-mal täglich
einnahm, und für einmal täglich abends Neocitran®
(500 mg Paracetamol, 20 mg Pheniramin Maleat, 10 mg Phenylephrin
Hydrochlorid und 50 mg Ascorbinsäure). Das Fieber fiel
vorübergehend, stieg jedoch wieder an, bis der Patient
sich so schwach fühlte, dass er ein Spital aufsuchte. Hier
wurden folgende Untersuchungen durchgeführt: Herzthoraxröntgen,
BB, Abdomen-Sono und Harn- u. Stuhluntersuchung. Bis auf eine
erhöhte alkalische Phosphatase und erhöhte Transaminasen
waren alle Befunde unauffällig. Aufgrund dieser erhöhten
Werte und der zuvor durchgemachten Diarrhoe wurde eine Cholezystitis
vermutet und die antibiotische Therapie mit Ciprofloxacin begonnen.
Auch unter dieser Therapie sank das Fieber nicht, im Gegenteil:
der Patient wurde septisch, er litt unter schwerer Dyspnoe und
war tachykard. In der Herzauskultation war ein 2/6 Systolikum
mit Punctum maximum am Erb’schen Punkt zu hören,
zusätzlich waren beidseits minimale Rasselgeräusche
zu vernehmen. Die Entzündungsparameter wie C-reaktives
Protein (CRP) und Leukozyten sowie die Transaminasen waren erhöht.
Die Beachtung von rein klinischen Risikofaktoren kann dazu führen,
dass eine Endokarditis nicht diagnostiziert wird. Deshalb wird
oftmals zur Diagnose einer Staphylococcus aureus-Endokarditis
ein transösophageales Herzecho (TEE) empfohlen [2]. Ein
TEE wurde durchgeführt; in diesem wurde eine Endokarditis
zwar ausgeschlossen, allerdings war die Pulmonalklappe nicht
gut einsehbar. Im weiteren Verlauf kam es zu einer klinischen
Verschlechterung im Sinne einer respiratorischen Partialinsuffizienz,
sodass der Patient mit einer permanenten O2-Maske mit sechs
Liter Sauerstoff behandelt bzw. mit einer intermittierenden
CPAP-Therapie mit 5 Peep beatmet werden musste (Blutgasanalyse:
pO2: 82 mmHg, CO2: 28 mmHg, pH: 7,4). Das am nächsten Tag
duchgeführte TEE zeigte eine gute LVF, eine deutliche Volumsbelastung
des rechten Ventrikels bei dilatiertem Rechtsherz sowie eine
starke Trikuspidalinsuffizienz und pulmonale Hypertension von
70 mmHg. Der Homograft in Pulmonalposition zeigte eine Pulmonalstenose
und fragliche kleine Vegetationen, Gradient 55/34 mmHg, TI II-III
(SPAP 70 mmHg), AI I. In den abgenommenen Blutkulturen konnte
Staphyloccocus aureus nachgewiesen werden, sodass die
antibiotische Therapie von Ciprofloxacin auf Cefuroxim 3 g und
Fosfomycin 8 g zweimal täglich als Kurzinfusion abgeändert
wurde. Im Antibiogramm wies der Staphylococcus aureus
nur eine Resistenz gegen Penicillin G auf. Die aufgrund der
progredienten Atemnot durchgeführte Computertomographie
des Thorax zeigte septisch embolische Lungenabszesse. Nun erfolgte
eine Transferierung des Patienten auf die Wiener Universitätsklinik
(Infektiologie). Inzwischen entwickelt der Patient Ödeme
3. Grades; das Normalgewicht des Patienten beträgt 77 kg,
das Maximalgewicht im Spital betrug 103 kg. Am 30. 6. 07 wurde
erneut ein Herzultraschall [3] durchgeführt. Es zeigten
sich eine reduzierte Rechtsventrikelfunktion und ein stark vergrößerter
rechter Ventrikel. Der PAP betrug 72 mmHg. Es fand sich eine
0,3 mal 0,3 cm große flottierende Struktur der Pulmonalklappe
mit einer Pulmonalinsuffizienz Grad II-III. Der Patient erhielt
Flucloxacillin 2 x 4 g und Gentamicin einmal täglich nach
Spiegel. Seit Anfang Juli bestand die Antibiotikatherapie aus
Flucloxacillin 4 g und Fosfomycin 8 g dreimal täglich parenteral
sowie zweimal täglich Levofloxacin 750 mg. Sein CRP betrug
10,6 mg/dl, Leukozyten 12,9 G/l und die Blutsenkungsgeschwindigkeit
war 26/34 n.W. Mitte Juli wurde die Echokardiographie wiederholt,
wobei nun klar ein destruierter hochgradig stenosierter Homograft
in Pulmonalposition als Ursache des deutlich vergrößerten
rechten Ventrikels mit mittelgradig reduzierter Rechtsventrikelfunktion
identifiziert werden konnte. Zusätzlich zeigte sich eine
mittel- bis höhergradige Trikuspidalinsuffizienz. Aus diesem
Grund wurde die Herzthoraxchirurgie konsultiert und die Indikation
zu einer Akutoperation gestellt (Abbildung 1).
Abbildung
1: Indikationen zur chirurgischen Intervention (nach
den Leitlinien der Deutschen Gesellschaft für Kardiologie,
2004)

Mitte Juli wurde der stenotische Pulmonalishomograft explantiert,
ein neuer Homograft implantiert und eine Tricuspidalringrekonstruktion
durchgeführt. Postoperativ verbrachte der Patient drei
Tage lang auf der Intensivstation (hier war er afebril und zeigte
keine Leukozytose mehr, daher wurden Levofloxacin und Fosfomycin
abgesetzt); im Anschluss daran wurde der Patient auf die Infektiologie
retransferiert und die Therapie mit Flucloxacillin fortgesetzt.
Mittels Furosemid konnten die Ödeme reduziert werden. Das
Kontrollherzecho Ende Juli zeigte normal große Ventrikel
und Vorhöfe, normale systolische und diastolische Funktion
und eine leichtgradige Mitralinsuffizienz. Auto/Homograft befanden
sich in gewünschter Position. Ende Juli konnte der Patient
in gutem Allgemeinzustand entlassen und zum dreiwöchigen
Rehabilitationsaufenthalt geschickt werden. Die weitere Therapie
bestand aus Flucloxacillin für weitere vier Wochen parenteral
[4].
|
| Diskussion
Herzklappenersatzoperationen
und Ross-Operationen werden seit dem Jahre 1967 bei schweren
bzw. angeborenen Herzklappenfehlern durchgeführt, Ross-Operationen
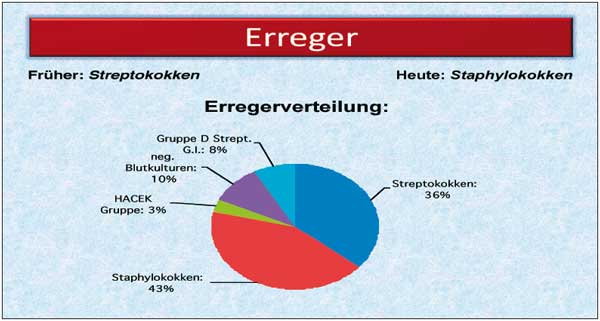
vor allem bei Kindern und Jugendlichen. Künstliche Herzklappen
können mit Streptococcus viridans (36%), Streptococcus
gordonii, Staphylococcus epidermidis und Staphylococcus aureus
(43%) infiziert werden. Die Gruppe D-Streptokokken des Gastrointestinaltraktes
verursachen ca. 20% der Endokarditisfälle. Enterobakterien
und Bakterien aus der HACEK-Gruppe (Haemophilus, Actinobacillus,
Cardiobacterium etc.) sind selten für eine Endokarditis
verantwortlich und wurden in 3% der Fälle isoliert. Weiters
werden Endokarditiden selten durch Q-Fieber, Chlamydien oder
durch Pilze, wie Candida, ausgelöst. In 10% der Fälle
tritt eine Endokarditis mit negativen Blutkulturen auf (Abbildung
2) [5].
Abbildung
2: Erregerverteilung
Streptokokkenendokarditiden
wurden im Laufe der letzten Jahre von Staphylococcus aureus-Endokarditiden
abgelöst, wie Studien aus den Jahren 1977–1996 belegen.
Die Therapie und Heilung einer Endokarditis der künstlichen
Klappe erfordert meist die Explantation der alten und die Implantation
einer neuen Klappe. Patienten, die kardiale Komplikationen entwickelten
und sich einer frühzeitigen Herzoperation unterzogen, hatten
die geringste Mortalitätsrate (28,6%). Zwischen 1978 und
1992 wurden bei 122 Patienten mit einer Endokarditis der künstlichen
Klappe die Prognosefaktoren erhoben. Die 4-Monatsüberlebensrate
betrug 66% (42 Tote). Die Haupttodesursache war eine Staphylococcus
aureus-Infektion (75% vs. 15% bei anderen Mikroorganismen).
Bei S. aureus-Infektionen zeigten Studien, dass folgende Faktoren
die Mortalität erhöhten: eine Prothrombin ratio von
weniger als 30% (RR = 8,3), Mediastinitis (RR = 4,9), Herzversagen
(RR = 4,4) und septischer Schock (RR = 2,6). Bei Infektionen
mit anderen Mikroorganismen erhöhten folgende Faktoren
die Mortalität: eine Prothrombinratio von weniger als 30%
(RR = 32,26), Nierenversagen (RR = 7,31) und Herzversagen (RR
= 6,07). Bei Patienten, die eine Staphylococcus aureus-Infektion
hatten, war die Überlebensrate nach einer Operation deutlich
höher als nach alleiniger medikamentöser Therapie
9/20 (45%) versus 0/20 (p < 0,001), bei anderen Erregern
besteht kein signifikanter Unterschied: Die postoperative Überlebenswahrscheinlichkeit
beträgt 89% versus 81% bei konservativer Therapie. Bei
allen Endokarditispatienten wird allerdings eine lange Antibiotikatherapie
empfohlen. Sollte das zentrale Nervensystem (Meningitis oder
meningeale Sepsis) betroffen sein, muss schon sehr früh
die Indikation für eine Operation gestellt werden [6, 7].
Eine
Staphylococcus aureus-Bakteriämie ist mit einer hohen Endokarditisrate
assoziiert. MSSA (Methicillinsensitiver Staphylococcus aureus)
stammt meist von nosokomialen Quellen wie z.B. von intravenösen
oder arteriellen Kathetern, Herzschrittmachern oder künstlichen
Herzklappen ab. MSSA wird mit einer höheren Endokarditisrate
als MRSA assoziiert [8]. Obwohl bei allen Patienten mit Bakteriämie
das Risiko einer Endokarditis besteht, wird nur ein kleiner
Anteil auch tatsächlich kardiale Probleme bekommen. Die
Inzidenz einer infektiösen Endokarditis (IE) beträgt
in der Allgemeinbevölkerung 4/100 000 Personen/Jahr und
15/100 000 bei den über 50-jährigen Patienten. Zu
den Risikofaktoren einer IE zählen Patienten mit kurz zuvor
durchgemachten Herzerkrankungen (z.B.: bicuspide Aortenklappe,
Fallot’sche Tetralogie, rheumatische Herzerkrankungen,
ein Zustand n. Endokarditis, Myxome), kongenitale Herzerkrankungen
(z.B. Aortenisthmusstenose, offener Ductus arteriosus, Ventrikelseptumdefekt),
Herzchirurgie (Ross-Procedure, künstliche Herzklappen),
bei i.v. Drogenabhängigen, nach Nabel-, Ohr- oder Zungenpiercings,
bei Patienten mit Verbrennungen oder bei Patienten, die an einer
Hepatitis oder einer anderen Lebererkrankung leiden [9, 10,
11, 12, 13]. Die Mortalitätsrate einer Staphylococcus aureus-Endokarditis
beträgt ca. 20% bis 40%, wenn die Nativklappe betroffen
ist; bei einer künstlichen Klappe ist sie sogar noch höher,
nämlich 47,5% [7, 11]. Eine Endokarditis geht häufig
mit pulmonalen Komplikationen einher, wie dies bei unserem Patienten
der Fall war, er bekam zusätzlich septische Lungenabszesse.
Herzklappenersatzoperationen
begünstigen das Entstehen von Endokarditiden, auch wenn
sie nur eine seltene postoperative Komplikation darstellen,
kann es nach einer Ross-Op zum Auftreten einer solchen Endokarditis
kommen. Einige wenige Fallberichte sind bisher bekannt: Im Jahre
1976 bekam ein 17-jähriger Patient 5 Jahre nach einer Rastelli-Ross-Operation
eine schwere Staphylokokkenendokarditis, die die künstliche
Herzklappe betraf. Der klinische Verlauf wurde durch eine extensive
bilaterale Pneumonie, eine Glomerulonephritis und eine diffuse
intravaskuläre Koagulation verschlechtert. Nach einer 4-wöchigen
konservativen Therapie mit Cloxacillin wurde der Patient wegen
eines progressiven falschen Aneurysmas operiert. Cloxacillin
wurde postoperativ noch für 6 Monate weitergegeben. Nach
dieser Therapie verschwanden die Symptome der Infektionskrankheit
[14]. Von März 1969 bis Juni 1971 unterzogen sich in New
Jersey 12 Patienten einer Ross-Operation. Das Durchschnittsalter
betrug 42,7 Jahre (21 bis 52 Jahre). Postoperativ entwickelten
3 Patienten eine infektiöse Endokarditis: nach 15 und 73
Monaten und einer nach 13 Jahren [15]. Zwischen 1990 und 2000
hatten 260 Patienten (Alter 3 Monate bis 18 Jahre) in Saudi-Arabien
eine Ross-Operation. 136 Patienten waren jünger als 18
Jahre, 53% dieser Patienten hatten eine kongenitale Aortenklappenerkrankung.
Ein Patient benötigte wegen einer Endokarditis einen neuen
Autograft [16]. In Taipei, Taiwan, wurden zwischen September
1996 und Dezember 2003 13 pädiatrische Patienten (Alter
1 – 17 Jahre) (Ross) operiert. Zuvor hatten 10 dieser
Patienten eine Ballon-Dilatation der Aortenklappe, und 3 hatten
eine aortale Valvuloplastie. Ein Patient bekam zwei Wochen nach
der Ross-Operation eine infektiöse Endokarditis mit einem
periaortalen Abszess, 11 weitere Patienten folgten durchschnittlich
3,3 Jahre später [17]. In Madrid, Spanien, unterzogen sich
zwischen 1997 und 2003 100 Patienten einer Ross-Operation. 70%
dieser
Patienten waren männlich, das Durchschnittsalter betrug
29,3 Jahre, 20 Patienten waren jünger als 16, und 6 Patienten
waren jünger als 10 Jahre. Zwei Patienten benötigten
einen Ersatz des Autografts, einer entwickelte eine 44-mm-Dilatation
des Autografts und ein 13 Jahre altes Mädchen bekam eine
Autograft-Endokarditis. Sechs Patienten litten unter einer schweren
Homograft-Stenose (> 50 mmHg) [18]. In Frankreich bekam ein
36 Jahre alter Patient 2 Jahre nach seiner Ross-Operation eine
akute Endokarditis des pulmonalen Homografts [19]. Zwischen
1995 und 2005 hatten in Brasilien 220 Patienten eine Ross-Operation.
Im postoperativen Follow-up (1 – 118 Monate, Durchschnitt
= 45,5 Monate) gab es nur zwei Endokarditisfälle [20].
Seit 1991 unterzogen sich 109 Patienten an der Wiener Universitätsklinik
einer Ross-Operation und wurden in einem postoperativen Follow-up
untersucht (durchschnittlich 2,8 Jahre; Zeitraum zwischen 1
Monat und 8 Jahren). Zwei Patienten hatten eine Autograft- Reoperation
und zwei entwickelten eine Endokarditis, die keinerlei Symptome
zeigte [21]. Es wird von einem Fall berichtet, in dem eine durch
Streptococcus agalactiae bedingte pulmonale Homograft-Endokarditis
nach einem Katzenbiss und 19 Jahre nach einer Ross-Operation
auftrat [1]; es gibt einen weiteren Fallbericht von einer Post-Ross-Endokarditis
des pulmonalen Homografts, hier handelte es sich beim Erreger
um Staphylococcus epidermidis [22]. Drei Patienten bekamen 2,
3 und 4 Jahre nach der Ross-Operation eine durch Streptococcus
gordonii verursachte kombinierte Autograft- und Homograft-Endokarditis.
Bei einem Patienten handelte es sich um einen HIV-infizierten
Drogenabhängigen, der andere Patient hatte wegen einer
regurgitierenden Pulmonalklappe einen perkutanen Stent [23].
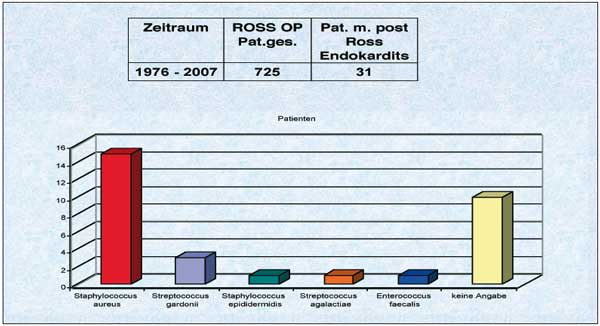
Zwischen 1967 und 1984 unterzogen sich 131 Patienten einer Ross-Operation
im National Heart Hospital in London. Das Alter betrug zum Zeitpunkt
der Operation 11 bis 52 Jahre, 109 Patienten waren männlich.
Die Überlebensrate betrug nach 10 Jahren 85% und nach 20
Jahren 61%. 7 Patienten verstarben an einer postoperativen Endokarditis
(Abbildung 3) [24].
Abbildung
3: Erregerverteilung
Im
Allgemeinen wird beobachtet, dass die Mehrheit der Endokarditis-Fälle
nach Ross-Operationen in den ersten postoperativen Jahren auftritt
und vor allem den Homograft der Aorta befällt, wohingegen
Endokarditiden 10 Jahre und mehr nach Ross-Operationen extrem
selten vorkommen, und in den wenigen Berichten, die darüber
vorhanden sind, ist der pulmonale Homograft befallen.
Ob
die Erkrankung tödlich verläuft oder nicht, hängt
von der Schwere der Erkrankung (Bakteriämie), vom Alter
(> 60-Jährige haben ein höheres Risiko), Geschlecht
(Frauen!), Begleiterkrankungen, der Abwesenheit eines Herzgeräusches,
der Anwesenheit eines AV-Blocks oder eines Herzversagens oder
der Beteiligung des zentralen Nervensystems ab [8, 9, 10].
|
Schlussfolgerung
Eine
Staphylococcus aureus-Endokarditis stellt auch heute noch eine
lebensgefährliche Erkrankung dar, vor allem wenn, wie in
unserem Falle, der Pulmonalishomograft betroffen ist. Die richtige
Diagnose und Therapie ist nach wie vor eine Herausforderung,
da das Beschwerdebild einer Endokarditis vielen harmlosen Erkrankungen
gleichen kann. Wird eine Endokarditis diagnostiziert, sollte
sie sofort von Infektiologen (Antibiotikatherapie!) und wenn
notwendig von Herzthoraxchirurgen behandelt werden. Eine möglichst
frühe Operation ist mit einer reduzierten Gesamtmortalität
und mit dem geringeren Risiko einer rekurrenten Endokarditis
assoziiert und sollte daher in besonderen Fällen in Betracht
gezogen werden [7, 10]. |
Literatur
| 1.
Ashrafin H, Griselli M, Rubens MB, Mullen MJ, Sethia B.
Pulmonary Homograft Endocarditis 19 years after a Ross Procedure.
Thorac Cardiovasc Surg. 2007; 55(1): 55-6. |
| 2.
Sullenberger AL, Avedissian LS, Kent SM. Importance of transoesophageal
echocardiography in the evaluation of Staphylococcus aureus
bacteremia. J Heart Valve Dis 2005; 14(1): 23-8. |
| 3.
Chamis AL, Gesty-Palmer D, Fowler VG, Corey GR. Echocardiography
for the Diagnosis of Staphylococcus aureus Infective Endocarditis.
Curr Infect Dis Rep 1999; 1(2): 129-135. |
| 4.
Murray RJ. Staphylococcus aureus infective endocarditis:
diagnosis and management guidelines. Intern Med J. 2005;
35(2): 25-44. |
| 5.
Gagliardi JP, Nettles RE, McCarty DE, Sanders LL, Corey
GR, Sexton DJ. Native valve infective endocarditis in elderly
and younger adult patients: comparison of clinical features
and outcomes with use of the Duke criteria and the Duke
Endocarditis Database. Clin Infect Dis 1998; 26:1165.8. |
| 6.
Roder BL, Wandall DA, Frimodt-Moller N, Espersen F, Skinhoj
P, Rosdahl VT. Staphylococcus aureus endocarditis in Denmark
1982-1991. Clinical picture, complications and antibiotic
therapy in nondrug addicts. Ugeskr Laeger 2000; 162(3):
345-9. |
| 7.
Chirouze C, Cabell CH, Fowler VG Jr, Khayat N, Olaison L,
Miro JM, Habib G, Abrutyn E, Eykyn S, Corey GR, Selton-Suty
C, Hoen B. International Collaboration on Endocarditis Study
Group. Prognostic factors in 61 cases of Staphylococcus
aureus prosthetic valve infective endocarditis from the
International Collaboration on Endocarditis merged database.
Clin Infect Dis 2004; 38(9): 1323-7. |
8.
Abraham J, Mansour C, Veledar E, Khan B, Lerakis S. Staphylococcus
aureus bacteremia and endocarditis: the Grady Memorial Hospital
experience with methicillinsensitive
S. aureus and methicillin-resistant S. aureus bacteremia.
AM Heart J 2004; 147(3): 536-9. |
| 9.
Paganini H, Firpo V, Villa A, Debbag R, Berberian G, Casimir
L, Bologna R. Clinical study and analysis of risk factors
for mortality in 86 cases of infectious endocarditis in
children in adolescents in Argentinia: 1988-2000. Enferm
Infect Microbiol Clin. 2004; 57(10): 993-6. |
| 10.
Chang FY, Mac Donald BB, Peacock JE Jr, Musher DM, Triplett
P, Mylotte JM, O´Donell A, Wagener MM, Yu VL. A prospective
multicenter study of Staphylococcus aureus bacteremia: incidence
of endocarditis, risk factors of mortality, and clinical
impact of methicillin resistance. Medicine (Baltimore) 2003;
82(5): 322-32. |
| 11.
Tak T, Reed KD, Haselby RC, McCauley CS Jr, Shukla SK. An
update on epidemiology, pathogenesis and management of infective
endocarditis with emphasis on Staphylococcus aureus. WMJ
2002; 101(7): 24-33. |
| 12.
Paterson P, Dunn KW. Bacterial endocarditis following a
minor burn injury. Case report and review. Burns 1999; 25(6):
515-7. |
| 13.
Cartotto RC, Macdonald DB, Wasan SM. Acute bacterial endocarditis
following burns: case report and review. Burns 1998; 24(4):
369-73. |
| 14.
Thompson J, Dirksen T, Nube M, Brom AG. Prosthesis endocarditis:
treatment of a case occuring 5 years after a Rastelli-Ross
operation. J thorac Cardiovasc Surg. 1976; 72(1): 28-32. |
| 15.
Gonzalez-Lavin L, Robles A, Graf D. Morbidity following
the Ross operation. J Card Surg. 1988; 3(3): 305-8. |
| 16.
Al- Halees Z, Pieters F, Qadoura F, Shahid M, Al-Amri M,
Al-Fadley F. The Ross Procedure is the procedure of choice
for congenital aortic valve disease. J Thorac Cardiovasc
Surg. 2002; 123(3): 437-41. |
| 17.
Chang Cl, Ke YC, Wang JK, Wu MH. Ross procedure for pediatric
aortic valve disease. J Formos Med Assoc 2005; 104(7): 487-92. |
| 18.
Concha Ruiz M. Replacement of the aortic valve with pulmonary
autograft (the ross procedure). An R Acad Nac Med (Madr)
2005; 122(1): 45-46. |
| 19.
Grinda Jm, Brazille P, Bricourt MO, Mainardi JL, Gonzales-Canali
G, Piketti C, Deloche A. Pulmonary homograft endocarditis
after Ross procedure. Ann Thorac Surg 2004; 78(2): 687-9. |
| 20.
Da Costa FD, Pereira EW, Barboza LE, Haggi Filho H, Collatusso
C, Gomes CH, Lopes SA, Sardetto EA, Ferreira AD, da Costa
MB, da Costa IA. Ten year experience with the Ross operation.
Arq Bras Cariol 2006; 87(5): 583-91. |
| 21.
Moidl R, Simon P, Aschauer C, Chevtchik O, Kupilik N, Rodler
S, Wolner E, Laufer G. Does the Ross operation fulfil the
objective performance criteria established for new prosthetic
heart valves? J Heart Valve Dis. 2000; 9(2): 190-4. |
| 22.
Frutos López M, de Alarcón A, Romero-Rodríguez
N. Endocarditis sobre autoinjerto en procedimiento de Ross.
(Endocarditis in a patient with autograft by the Ross procedure).
Enferm Infecc Microbiol Clin 2005; 23:511-512. |
| 23.
Prat A, Saez de Ibarra J, Vincentelli A, Decoene C, Savoye
C, Goffin Y. Late autograft and homograft endocarditis after
the Ross operation. J Thorac Cardiovasc Surg 1998; 115:
1388-1389. |
| 24.
Chambers JC, Sommerville J, Stone S, Ross DN. Pulmonary
autograft procedure for aortic valve disease: long term
results of the pioneer series. Circul 1997; 96: 2206-2214. |
Korrespondierende
Autorin:
Dr. Stefanie
Hennig
Univ.-Klinik für Innere Medizin I, Klin.
Abt. für Infektionen und Tropenmedizin
1090 Wien, Währingergürtel 18-20
E-Mail: jamie3_hennig@yahoo.de
|
|
|