| Ausbruch einer
akuten Gastroenteritis in einem österreichischen Internat
verursacht durch Staphylokokken-Enterotoxine |
H. Lagler1, K.
Stich1, D. Schmid2, R. Gattringer1,
S. Huhulescu2, F. Allerberger2, W.
Graninger1, S. Knapp1
1 Univ.-Klinik für Innere Medizin 1, Klin.
Abt. für Infektionen und Tropenmedizin, Medizinische
Universität Wien
2Österreichische Agentur für Gesundheit
und Ernährungssicherheit (AGES), Wien |
|
|
|
Einleitung
Am
21. September 2006 kam es in einer Großküche eines
Internates in Eisenstadt (Burgenland, Österreich) zum Ausbruch
einer Lebensmittelvergiftung. Wenige Stunden nach dem Mittagessen
erkrankten 113 von 240 Personen, zwischen 16 und 17 Uhr erkrankten
70 Patienten gleichzeitig.
Die Leitsymptome waren Übelkeit/Erbrechen (91,2%), Durchfall
(70,8%), abdominelle Krämpfe (68,1%) sowie ein symptomatischer
Blutdruckabfall (53%). Nur 24,8% der Patienten entwickelten
Fieber über 38°C. Es war bei den meisten Patienten
eine intravenöse Flüssigkeitszufuhr erforderlich und
es kam zu einem Großeinsatz der Rettung. Insgesamt wurden
noch am selben Tag 101 Patienten in 8 verschiedene Krankenhäuser
in Burgenland und Niederösterreich stationär aufgenommen.
Alle 113 Patienten erholten sich jedoch rasch innerhalb von
24 Stunden. Die durchschnittliche Aufenthaltsdauer im Spital
betrug nur einen Tag, die maximale 3 Tage [1].
|
| Methoden
und Ergebnisse
Es
wurde noch am selben Tag von 5 Stuhlproben eine Norovirus-PCR
[2] durchgeführt, die in zwei Fällen positiv war.
Alle weiteren verfügbaren Stuhlproben (n = 45) zeigten
in den darauf folgenden Tagen kein Wachstum von Salmonella,
enterohämorrhagischen E. coli, Yersinia und Campylobacter,
jedoch 44 Proben zeigten ein Wachstum von Staphylococcus aureus
[3]. Die Norovirus-PCR war letztendlich nur in insgesamt drei
Fällen positiv (Genotyp II). Es konnte weiters S. aureus
aus dem Mittagessen (Reisgericht) und aus Nasen- und Handabstrichen
vom Küchenpersonal isoliert werden. Diese Stämme wurden
zur weiteren Typisierung molekularbiologisch untersucht. Es
wurde eine Pulsfeldgelelektrophorese (PFGE) [4] und eine Staphylokokken-Protein
A-Gen (spa)-Typisierung [5] durchgeführt.
Es zeigte sich der Nachweis eines klonalen Ausbruches. Sowohl
die S. aureus-Stämme aus dem Reis und jene von der Handfläche
eines Kochs, welcher palmar eine chronische Wunde hatte, als
auch jene aus der überwiegenden Anzahl der Stuhlproben,
zeigten in der Typisierung eine 100%-ige Übereinstimmung
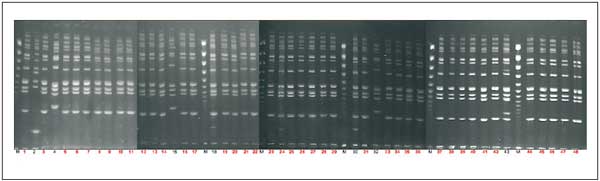
(Abbildung 1). Interessant war auch, dass es sich um einen noch
nicht bekannten spa-Typ handelte.Er wurde in der spa-Daten bank
(www.ridom.de)
unter der Nummer t2046 registriert [1].
Abbildung
1: PFGE-Muster von S. aureus chromosomale DNA-Aufspaltung
durch SmaI; Spalte 1: Mittagessen/
Reisgericht; Spalte 2 - 4: Hand- und Nasenabstrich des Küchenpersonals;
Spalte 5 - 48: Stuhl von Patienten;
M: Längenstandard; Rot markierte Spalten: identisches PFGE-Muster
Der
klonale S. aureus-Stamm wurde weiters auf 19 verschiedene Exotoxingene
wie toxic shock syndrome-1 (tst-1), staphylococcal enterotoxin-(se)
und enterotoxin-like (sel) Gene (sea - see, seg - selr und selu),
sowie auf den übergeordneten accessory gene regulator (agr)
Locus mittels PCR untersucht. Es zeigte sich das Genmuster:
agr I, sea, sed, selj, selr. |
| Zusammenfassung
Es
konnte mittels epidemiologischer und molekularbiologischer Methoden
der anfängliche Verdacht einer Norovirus-Infektion entkräftet
und der Beweis einer Lebensmittelvergiftung verursacht durch
Enterotoxine (SEA, SED, SELJ SELR) von S. aureus erbracht werden.
Es ist auch rückblickend von der Klinik eine Norovirus-Infektion
unwahrscheinlich, weil dafür die IKZ zu kurz war (wenige
Stunden) und die klinische Besserung der Patienten zu rasch
(meist <12 Stunden) eingetreten ist [6]. Weiters zeigt sich
auch, dass dieser Ausbruch durch Einhaltung der Hygienerichtlinien
verhindert hätte werden können. |
Literatur
| 1.
Schmid et al., 2007, Euro Surveill, 12, 224. |
| 2.
Schmid et al., 2005, Wien Klin Wochenschr, 117, 802-8. |
| 3.
Anonymous, 2001, ISBN 3-86123-126-0, Standardisierung und
Qualitätssicherung in mikrobiologischer Labordiagnostik.
Richtlinien. |
| 4.
Bannerman et al., 1995, J Clin Microbiol, 33, 551-5. |
| 5.
Ruppitsch et al., 2006, J Clin Microbiol, 44, 2442-8. |
| 6.
Kaplan et al., 1982, Ann Intern Med, 96, 756-61. |
Korrespondierender
Autor:
Dr. Heimo Lagler
Univ.-Klinik für Innere Medizin I, Klin.
Abt. für Infektionen und Tropenmedizin
1090 Wien, Währingergürtel 18-20
E-Mail: heimo.lagler@meduniwien.ac.at
|
|
|