| Epidemiologie, Klinik und mikrobiologische Diagnostik der Tularämie |
|
E. Hofer |
| Schlüsselwörter:
Tularämie, Francisella tularensis, Labordiagnostik, Naturherd, Zoonose, Epidemiologie, Österreich |
|
Epidemiologie, Klinik und Labordiagnostik der Tularämie werden besprochen. |
Key-words: Tularemia, Francisella tularensis, laboratory-diagnosis, natural focus, zoonosis, epidemiology, Austria |
Summary The epidemic occurrence of tularemia since 1994 in the north-eastern part of Austria, a well-known natural focus, is described. From 1994 to 2001 Francisella tularensis subsp. holarctica Biovar II Ery r was detected in 167 European brown hares (Lepus europaeus) by means of direct culture. Epidemiology, clinical picture and laboratory-diagnosis of tularemia are discussed. |
| Einleitung
Die Tularämie (Hasenpest, Nagerpest,
Lemmingfieber, Hirschfliegenfieber, Ohara-Krankheit) ist eine auf
der ganzen nördlichen Hemisphäre vorkommende, auf den
Menschen übertragbare, bakterielle Naturherdinfektion, die
durch Francisella (F.) tularensis verursacht wird. Der erste Tularämiefall in Österreich
wurde von Pillat und David im Oktober 1935 bei einem Mann klinisch,
bakteriologisch und serologisch festgestellt, der im Marchfeld in
Niederösterreich einen krank aufgefundenen Feldhasen abgehäutet
hatte und 3 Tage später erkrankt war [3]. |
| Ätiologie
F. tularensis, eine von zwei
Species der einzigen Gattung Francisella der Familie Francisellaceae,
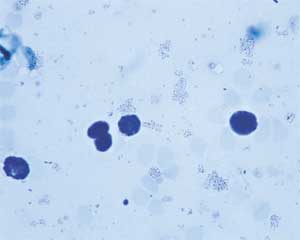
ist ein mit 0,2-0,7 µm x 0,2 µm sehr kleines, pleomorphes,
oft kokkoides (Abb. 1), unbewegliches, gramnegatives, strikt aerob
wachsendes, fakultativ intrazelluläres Bakterium mit einem
sehr weit gefächerten Infektionsspektrum. Die Species F.
tularensis umfasst die vier Subspecies (ssp.) tularensis,
holarctica, mediaasiatica und novicida, wobei vor allem
die ersten drei klinisch von Bedeutung sind [7, 8, 9]. Bei der ssp.
holarctica (früher palaearctica oder Typ B) lassen
sich 3 Biovare unterscheiden (Tab. 2), Biovar I Ery s (Erythromycin
sensibel), Biovar II Ery r (Erythromycin resistent) und Biovar
japonica [10].
Die ssp. holarctica, die in
Europa, Nordamerika und Japan vorkommt, und die spp. mediaasiatica,
die in Zentralasien vorkommt, verursachen beim Menschen meist weniger
schwere, lokalisierte Erkrankungen, während bei einer Infektion
durch die in Nordamerika vorkommende für Menschen hochvirulente
ssp. tularensis (früher Typ A) auch lebensbedrohende,
generalisierte Krankheitsformen möglich sind. Auch ein Stamm, der 1990 bei einer
aus der Umgebung von Graz stammenden Ixodes ricinus-Zecke
in der Slowakei gezüchtet werden konnte, zeigte die Eigenschaften
der für Menschen und Kaninchen hochvirulenten ssp. tularensis
[12]. |
| Epidemiologie
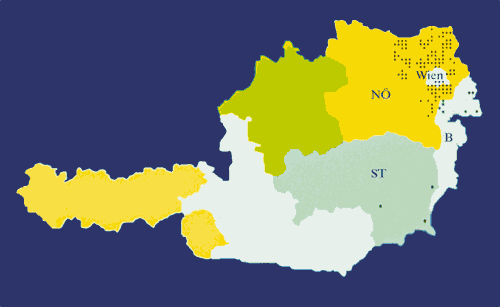
Im äußersten Nordosten Österreichs
besteht ein aktiver Tularämie-Naturherd (Abb. 2), der mit den
Endemiegebieten in der Slowakei und Tschechien entlang den Flüssen
March und Thaya zusammenhängt. Bei einer Massenvermehrung von
Feldmäusen (Microtus arvalis), die witterungsabhängig
in mehrjährigen Zyklen auftritt, ist hier mit einem Seuchenausbruch
und einer Häufung der Tularämiefälle beim Menschen
zu rechnen [31].
Während der ersten in Österreich
nachgewiesenen Epidemie erkrankten von Ende November 1936 bis Anfang
Jänner 1937 in den Bezirken Mistelbach und Gänserndorf
in einem etwa 20 km breiten Geländestreifen westlich der March
ungefähr 200 Menschen an Tularämie, wobei in der Mehrzahl
Personen betroffen waren, die tot oder krank aufgefundene Feldhasen
abgebalgt, zerlegt oder verzehrt hatten.
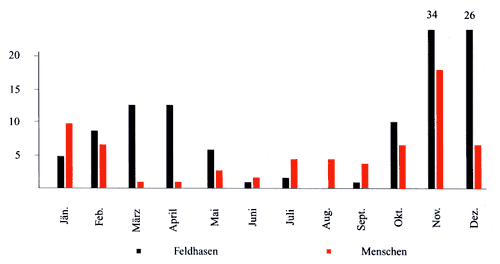
1994/95 wurden Tularämiefälle
bei Feldhasen und Menschen (Tab. 1) zunächst vorwiegend in
den östlichen Bezirken Mistelbach und Gänserndorf nachgewiesen,
1997/98 waren auch Bezirke im Norden Niederösterreichs betroffen
[5, 6].
Wie bereits bei der ersten Epidemie
konnte auch bei den letzten beiden Epidemien eine vorausgehende
Mäuseplage beobachtet werden [17]. Vermutlich bricht die Seuche
zuerst unter den Mäusen aus und wird dann auf Feldhasen übertragen
[18, 19]. |
||||||||||||||||||||||||||||||
| Klinik
Die klinische Form der Tularämie
beim Menschen reicht von subklinischen Fällen, wie in Norwegen,
wo unter gesunden Schulkindern eine Seroprävalenz von 4,7%
festgestellt wurde, bis zur, in Europa seltenen, generalisierten
Form, wo der Erreger aus dem Blut isoliert werden kann [21]. Eine Verschiebung des typischen saisonalen
Auftretens in der kalten Jahreszeit hin zum Sommer durch den Anstieg
der Übertragungen infolge von Zeckenbissen oder Insektenstichen
wurde in der Slowakei beobachtet. |
| Mikrobiologische
Diagnostik
In Gram- oder besser Giemsa-, und Immunfluoreszenz-gefärbten
Organausstrichen septikämisch verendeter Feldhasen sind die
Francisellen bei hoher Keimdichte und nestförmiger Lagerung
mikroskopisch gut darstellbar [5]. Vereinzelte Erreger sind jedoch
aufgrund ihrer geringen Größe und kokkoiden Form in gefärbten
Ausstrichen mikroskopisch kaum zu erkennen.
Die sichere Identifizierung des isolierten
Erregers kann mittels spezifischem Antiserum im Objektträgerverfahren
und Analyse der 16S rRNA-Gensequenz vorgenommen werden [35].
Als Alternative zur Erregerisolierung
bei ulceroglandulärer Tularämie wurden viel versprechende
Ansätze der Polymerase-Kettenreaktion (PCR) entwickelt [32,
33, 34]. Auch ein hoch sensitiver Capture-ELISA (Enzyme Linked Immunosorbent
Assay) und ein immunochromatographischer Schnelltest wurden erfolgreich
aufgebaut [36]. |
| Literatur:
1. Horne H.: „Eine Lemmingpest und eine Meerschweinchenepizootie. Ein Beitrag zur Beleuchtung der Ursachen der Lemmingsterbe in den so genannten Lemmingjahren.“ Zentralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten und Hygiene I Abt. Orig. Bd. 66 (1912) 169-193. 2. Bell J.F.: „Francisella.“ In: „Handbuch der bakteriellen Infektionen bei Tieren.“ Bd. III. Blobel H., Schliesser T., Fischer, Stuttgart (1981) 172-256. 3. David H.: „Zum Auftreten der Tularämie in Österreich (Epidemiologie und Diagnose).“ Wien. Klin. Wochenschr. 50 (1937) 459-462. 4. Puntigam F.: „Thorakale Formen im Seuchengeschehen der Tularämie in Österreich.“ Wien. Klin. Wochenschr. 72 (1960) 813-816. 5. Hofer E., Schildorfer H., Flatscher J., Müller M.: „Zum Nachweis der Tularämie bei Feldhasen (Lepus europaeus) in Österreich.“ Wien. Tierärztl. Mschr. 81 (1997) 301-308. 6. Steineck Th., Hofer E.: „Zum Vorkommen der Tularämie in Österreich.“ Verh. ber. Erkrg. Zootiere 39. Internationales Symposium Wien (1999) 263-269. 7. Johansson A., Ibrahim A., Göransson I., Eriksson U., Gurycova D., Clarridge III J.E., Sjöstedt A.: „Evaluation of PCR-Based Methods for Discrimination of Francisella Species and Subspecies and Development of a Specific PCR That Distinguishes the Two Major Subspecies of Francisella tularensis.“ J. Clin. Microbiol. 38 (2000) 4180-4185. 8. Grunow R., Splettstößer W., Hirsch F.W., Kleemann D., Finke E.-J.: „Differentialdiagnose der Tularämie.“ Dtsch. Med. Wschr. 126 (2001) 408-413. 9. Forsman M., Sandström G., Sjöstedt A.: „Analysis of 16S Ribosomal DNA Sequences of Francisella Strains and Utilization for Determination of the Phylogeny of the Genus and for Identification of Strains by PCR.“ Int. J. Syst. Bacter. 44 (1994) 38-46. 10. Olsufiev N.G., Meshcheryakova I.S.: „Subspecific taxonomy of Francisella tularensis McCoy and Chapin 1912.“ Int. J. Syst. Bacter. 33 (1983) 872-874. 11. Gurycova D.: „First isolation of Francisella tularensis subsp. tularensis in Europe.“ Eur. J. Epidemiol. 14 (1998) 797-802. 12. Gurycova D.: „Characterisation and Classification of different strains of Francisella tularensis isolated in Central Europe.“ Second International Conference on Tularemia, Hradec Kralove, Czech Republic, Vojenske Zdravotnicke Listy – Supplementum, Rocnik LXVI, c. 1 (1997) 24. 13. Vyrostekova V., Khanakah G., Gurycova D., Kocianova E., Kmety E., Stanek G., Rehacek J.: „Dynamics of infection with Francisella tularensis and Borellia burgdorferi S.L. in reservoir animals and ticks – March River Basin, Austria, 1994/1995.“ Second International Conference on Tularemia, Hradec Kralove, Czech Republic, Vojenske Zdravotnicke Listy – Supplementum, Rocnik LXVI, c. 1 (1997) 3. 14. Hubalek Z., Sixl W., Halouzka J., Mikulaskova M.: „Prevalence of Francisella tularensis in Dermacentor reticulatus ticks collected in adjacent areas of the Czech and Austrian Republics.“ Cent. Eur. J. Public Health 5 (1997) 199-201. 15. Hayek H., Flamm H.: „Zum Problem der Reservoirtiere der Tularämieerreger im Marchfeld.“ Wien. Med. Wschr. 32-34 (1967) 765-767. 16. David H.: „Untersuchungen über die Tularämie in Österreich (1935-1945).“ Wien. Tierärztl. Mschr. 10 (1947) 523-544. 17. Bsteh O.: „Fälle von Tularämie.“ Wien. Klin. Wochenschr. 50 (1937) 108. 18. Knothe H., Zimmermann O., Havemeister G.: „Über die Tularämie in Schleswig-Holstein. Ein epidemiologischer Bericht anlässlich des Wiederauftretens der Tularämie in Eiderstedt im Winter 1957/1958.“ Dtsch. Med. Wschr. 84 (1959) 906-909. 19. Michalka J.: „Die Tularämie in Österreich.“ Wien. Tierärztl. Mschr. 47 (1960) 341-348. 20. Gurycova D., Vyrostekova V.: „Epidemiology and clinical characteristics of tularemia.“ Antibiotika Monitor tom. XIV, 3/4 (1998) 61-66. 21. Berdal B.P., Mehl R., Meidell N.K., Lorentzen-Styr A.-M., Scheel O.: „Field investigations of tularemia in Norway.“ FEMS Immunol. Med. Microbio. 13 (1996) 191-195. 22. Hubalek Z., Sixl W., Halouzka J.: „Francisella tularensis in Dermacentor reticulatus ticks from the Czech Republic and Austria.“ Wien. Klin. Wochenschr. 110/24 (1998) 909-910. 23. Gurycova D., Vyrostekova V., Khanakah G., Kocianova E., Kmety E., Stanek G.: „Importance of surveillance of tularemia natural foci in the known endemic area of Central Europe, 1991-1997.“ Wien. Klin. Wochenschr. 113/11-12 (2001) 433-438. 24. „Tularämie.“ In: „Bakterielle Zoonosen bei Tier und Mensch. Epidemiologie, Pathologie, Klinik, Diagnostik und Bekämpfung.“ Dedie K., Bockemühl J., Kühn H., Volkmer K.-J., Weinke T., Enke Verlag, Stuttgart (1993) 363-376. 25. Deutz A., Hinterdorfer F.: „Untersuchungen zu Krankheiten des Feldhasen – Sektionsbefunde, Erregerspektrum, Zoonosen.“ Verh. ber. Erkrg. Zootiere 39. Internationales Symposium Wien (1999) 445. 26. Gurycova D., Vyrostekova V.: „Microbiological diagnosis of tularemia." Antibiotika Monitor tom. XIV, 3/4 (1998) 67-72. 27. Hirsch F.W., Kleemann D., Grunow R.: „Fallbeispiele der Tularämie.“ Dtsch. Med. Wschr. 126 (2001) 393-394. 28. Johansson A., Berglund L., Gothefors L., Sjöstedt A., Tärnvik A.: „Ciprofloxacin for treatment of tularemia in children.“ Pediatr. Infect. Dis. J. 19/5 (2000) 449-453. 29. Perez-Castrillon J.L., Bachiller-Luque P., Martin- Luquero M., Mena-Martin F.J., Herreros V.: „Tularemia epidemic in northwestern Spain: clinical description and therapeutic response.“ Clin. Infect. Dis. 33/4 (2001) 573-576. 30. Sandström G.: „The Tularemia Vaccine.“ J. Chem. Tech. Biotechnol. 59 (1994) 315-320. 31. Jusatz H.J.: „Dritter Bericht über das Vordringen der Tularämie nach Mittel- und Westeuropa über den Zeitraum von 1950 bis 1960.“ Z. Hyg. Infekt.-Kr. 148 (1961) 69-93. 32. Sjöstedt A., Eriksson U., Berglund L., Tarnvik A.: „Detection of Francisella tularensis in ulcers of patients with tularemia by PCR.“ J. Clin. Microbiol. 35 (1997) 1045-1048. 33. Johansson A., Berglund L., Eriksson U., Göransson I., Wollin R., Forsman M., Tärnvik A., Sjöstedt A.: „Comparative Analysis of PCR versus Culture for Diagnosis of Ulceroglandular Tularemia.“ J. Clin. Microbiol. 38 (2000) 22-26. 34. Karhukorpi E.K., Karhukorpi J.: „Rapid laboratory diagnosis of ulceroglandular tularemia with polymerase chain reaction.“ Scand. J. Infect. Dis. 33 (2001) 383-385. 35. Posthaus H., Welle M., Mörner T., Nicolet J., Kuhnert P.: „Tularemia in a common marmoset (Callithrix jacchus) diagnosed by 16S rRNA sequencing.“ Vet. Microbiol. 61 (1998) 145-150. 36. Grunow R., Splettstößer W., McDonald S., Otterbein C., O’Brien T., Morgan C., Aldrich J., Hofer E., Finke E.-J., Meyer H.: „Detection of Francisella tularensis in Biological Specimens Using a Capture Enzyme-Linked Immunosorbent Assay, an Immunochromatographic Handheld Assay, and a PCR.“ Clin. Diagn. Lab. Immunol. 7 (2000) 86-90. |
|
Anschrift des
Verfassers: |