|
Kongressbericht ICAAC 2002 |
|
|
|
|
H. Burgmann |
|
Beim ICAAC 2002 in San Diego wurden einige wissenschaftliche Arbeiten zum Thema Telithromycin, einem Vertreter der Ketolide, präsentiert. Folgende Themen wurden abgehandelt:
|
| Weltweite
Resistenzdaten
In den 90er
Jahren wurde mittels des SENTRY-Surveillance-Programmes eine deutliche
Zunahme von Resistenzen der Respirationstraktkeime in Asien registriert.
So produzierten 17% von Moraxella catarrhalis und Haemophilus
influenzae ß-Laktamasen, 20% der S. pneumoniae
waren Pen G-resistent (MIC 1999 wurde PROTEKT (Prospective Resistant Organism Tracking And Epidemiology for the Ketolide Telithromycin) als globales Surveillance-Programm für Respirationstraktinfektionserreger (RTI) ins Leben gerufen. Die Analyse
von 3.362 Isolaten von S. pneumoniae zwischen 1999/2000 (PROTEKT
Global) ergab eine Pen G-Resistenzrate (MIC Wie oben angeführt,
entpuppte sich Japan als Hochrisikoland für resistente RTI-Keime.
Im Winter 2000/2001 waren 30,9% der Pneumokokken resistent gegen
Pen G und 77,2% gegen Erythromycin (Iinuma et al.) [1]. Für
S. pyogenes betrug die Erythromycin-Resistenzrate 5%, 8,8%
von Die Makrolid-Resistenz kann nun grob gesprochen in 2 Arten unterschieden werden: Target-site-Resistenz: Dabei kommt es zur Methylierung der 23S rRNA durch die rRNA-Methylase erm(B)- oder erm(A)-Subklasse erm(TR). Diese Methylierung bedingt eine verminderte Bindung der Makrolide und wird als MLSB-Phänotyp bezeichnet. Efflux-Resistenz: Dieser Resistenzmechanismus wird durch das mef(A)-Gen hervorgerufen und resultiert in einem relativ geringen Resistenzlevel mit MIC von 1-8 mg/L und einer erhaltenen Empfindlichkeit gegen Clindamycin. Brown S. et al. präsentierten Resistenzdaten von S. pyogenes der USA während des Winters 2000/2001 [2]. 5,5% von S. pyogenes waren Ery-resistent, allerdings mit einem deutlichen Nord-Süd-Gefälle. So lag die Resistenzrate im NW bei 8,2%, im SW bei 3,8%, und war > 10% in 10 Staaten. Städte waren die Brennpunkte der Resistenz mit beispielsweise 33,3% Resistenzrate in Stamford. 49,8% waren vom mef(A)-, 41,2% erm(TR)- und 5,7% vom erm(B)-Resistenztyp. Ery A-resistente S. pyogenes waren in 96,7% und 96,3% resistent gegen Clarithromycin und Azithromycin. Telithromycin zeigte ausgezeichnete Wirksamkeit bei diesen Keimen. Farrell et al. präsentierten Resistenzdaten von S. pneumoniae und S. pyogenes bei pädiatrischen Patienten [3, 4]. Betreffend S. pneumoniae fanden sich weltweit folgende Resistenzraten: intermediate Penicillin-resistent 18%, Penicillin-resistent 24,8% und Makrolid-resistent 35,9%. Allerdings ist eine große geographische Streubreite zu verzeichnen: 0% in den Niederlanden und Belgien bzw. > 60% in Südkorea. 52,1% der Makrolid-resistenten Pneumokokken waren coresistent gegen Pen G, und der Großteil der multiresistenten Keime wurde bei Kindern < 2 Jahre isoliert. Telithromycin zeigte hervorragende Aktivität gegen Keime mit mef(A) und/oder erm(B). Bezüglich S. pyogenes war die Ery A-Resistenzrate weltweit 10,2% mit der höchsten Rate in Italien (36,7%) und Polen (37,5%). Kein Ery A-resistenter Keim war auf Clarithromycin oder Azithromycin empfindlich. Alle Keime mit erm(A) und mef(A) waren auf Telithromycin empfindlich, während 85,7% mit erm(B) nicht Telithromycin-empfindlich waren. In einer weiteren
Präsentation im Rahmen der PROTEKT-Studie wurde die Resistenzrate
von H. influenzae untersucht. 15-25% der isolierten |
| Klinische
Studien zu Telithromycin
Betreffend die
klinische Effektivität wurden einige interessante Studien vorgestellt.
Tellier G. et al. verglichen die Sicherheit und Effektivität
von Die Studie schloss, dass 1-mal 800 mg Telithromycin für 5 bzw. 7 Tage gleich effektiv ist wie 2-mal tgl. Clarithromycin für 10 Tage. Im Sinne der Kostenreduktion ist die 5-Tage-Telithromycinbehandlung eine interessante Therapieoption. In einer weiteren Studie von Pullman et al. wurde die klinische und bakteriologische Effektivität von Telithromycin bei Patienten mit CAP, verursacht durch Erythromycin-resistente Stämme, untersucht [6]. Sowohl bei Einfach- als auch bei Mischinfektionen war Telithromycin bei 88,9% der Patienten mit Erythromycin-resistenten S. pneumoniae-Infektionen klinisch sowie bakteriologisch effektiv. P. Iannini et al. verglichen Telithromycin 1-mal tgl. 800 mg bei CAP, der akuten Exazerbation der chronischen Bronchitis und bei der akuten Sinusitis mit 2-mal tgl. Amoxicillin/Clavulansäure (875/125 mg) [7]. Insgesamt wurden in die Studie um die 24.000 Personen inkludiert. Die meisten Nebenwirkungen waren geringgradig und betrafen den Gastrointestinaltrakt. Die Effektivität von 1-mal tgl. 800 mg Telithromycin war vergleichbar zur 2-mal tgl. Gabe von Amoxicillin/Clavulansäure. Singer et al. behandelten in ihrer Publikation die Auswirkung der steigenden Chinolon-Resistenz auf die Behandlung der CAP, im Speziellen auf die Hospitalisierungsrate [8]. Sie verwendeten für ihre Berechnungen zwei Ausgangsannahmen:
Als Grundlage für die Resistenzdaten der Pneumokokken dient die PROTEKT-Studie 1999/2000. Weitere zugrunde liegende Annahmen der Berechnung:
3 Therapieschemata wurden hinsichtlich der Effektivität und Hospitalisierungsrate evaluiert: Primär-/Sekundärtherapie
Bei einer Chinolon-Resistenz von 1,5% finden sich nun folgende Hospitalisierungsraten:
Bei einer angenommenen Chinolon-Resistenz von 15,7% (Hongkong) finden sich folgende Hospitalisierungsraten:
Die Autoren folgerten aus ihren Berechnungen, dass bei steigender Chinolon-Resistenz die Hospitalisierungsrate bei den vorliegenden Daten um 1/3 ansteigt. Eine effektive Primärtherapie wie beispielsweise mit Telithromycin wäre hoch effektiv, um dieser steigenden Hospitalisierungsrate und den daraus folgenden zusätzlichen Krankenhauskosten gegenzusteuern. |
| Pharmakokinetik
und Pharmakodynamik von Telithromycin
Ein weiterer Themenschwerpunkt am ICAAC war die Pharmakokinetik und Pharmakodynamik von Telithromycin. Montay et al. zeigten, dass Coadministration von Telithromycin und Digoxin zu einer erhöhten Bioavailability von Digoxin von ungefähr 36% führte [9]. Die Tal-Plasmakonzentrationen blieben allerdings im therapeutischen Bereich, und es wurden keine Zeichen der Digoxin-Toxizität beobachtet. Laut Bhargava et al. resultiert die gleichzeitige Gabe von Telithromycin und Theophyllin in einer 17,3% Erhöhung der AUC von Theophyllin [10]. Ursächlich dafür scheint der gleiche Abbauweg beider Substanzen über den Cytochrom-P450-Weg zu sein. Es konnten keine Intoxikationen nachgewiesen werden. Ketokonazol und im geringeren Grade Itrakonazol führen bei gleichzeitiger Applikation zu erhöhten Telithromycinkonzentrationen, in beiden Fällen war die Gabe sicher und wurde gut vertragen. |
| Satellitensymposium
zum Thema: Ökologische Auswirkungen der Resistenz In einem Satellitensymposium
wurden die ökonomischen Auswirkungen der zunehmenden Resistenz
diskutiert. Die Ausbreitung von Resistenzen stellt beispielsweise
die derzeitigen Empfehlungen für die empirische Therapie von
RTI in Frage und hat auch ökonomische Auswirkungen. Um diesen
Einfluss auf die zukünftige Therapie zu minimieren, müssen
Schritte unternommen werden, diese Mechanismen zu kontrollieren.
In einem WHO-Bericht wurde der weit reichende und oft inadäquate
Gebrauch von antimikrobiellen Substanzen als Hauptursache für
die Entstehung von Resistenzen erkannt. Der Zusammenhang zwischen
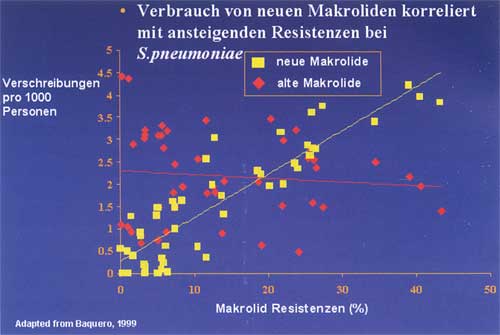
Makrolidverbrauch und Resistenzentstehung konnte beispielsweise
in Spanien gezeigt werden (Abb. 1).
Weitere Kofaktoren für die Resistenzentwicklung sind neben Patienten-bezogenen Faktoren wie Selbstmedikation, geringe Compliance und Fehlinformation auch inkorrekte Diagnose (Virusinfektion), inadäquate Antibiotikaauswahl bzw. inadäquate Dosierung. Eine wirksame Strategie im Kampf gegen resistente Erreger ist die Entwicklung neuer antimikrobieller Substanzen. Telithromycin ist ein Vertreter einer neuen Substanzgruppe, der Ketolide. Das Wirkspektrum umfasst die üblichen Respirationstraktpathogene. Telithromycin unterliegt nicht den Mechanismen der Makrolid-Lincosamid-Streptogramin-Resistenz und ist auch wirksam gegen Makrolid-resistente Bakterien. Die ökonomische Auswirkung der klinischen Konsequenz der antimikrobiellen Resistenz ist bemerkenswert. Neben der Notwendigkeit von zusätzlichen diagnostischen Untersuchungen und Therapien muss auch das zusätzliche Leid der Patienten gesehen werden. |
|
| Anschrift
des Verfassers: A.o. Univ.-Prof. Dr. Heinz Burgmann Univ.-Klinik für Innere Medizin I, Klin. Abt. für Infektionen und Chemotherapie A-1090 Wien, Währinger Gürtel 18-20 E-Mail: heinz.burgmann@akh-wien.ac.at |