| Fosfomycin im schwer erreichbaren
Kompartiment |
|
M. Bauer 1,
R. Gattringer 2, Ch. Joukhadar 1,2
1 Univ.-Klinik für Klinische Pharmakologie, Abteilung für
Klinische Pharmakokinetik, Medizinische Universität Wien
(Vorstand: Univ.-Prof. Dr. M. Müller)
2 Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
(Vorstand: Univ.-Prof. DDr. W. Graninger) |
|
|
Zusammenfassung
Durch den Einsatz
der minimal-invasiven Mikrodialysetechnik konnte in rezenten
Studien zur Pharmakokinetik von Fosfomycin eine ausgezeichnete
Penetration in gesunden Probanden und in Patienten nachgewiesen
werden. Bei gesunden Probanden waren die Fosfomycin-Konzentrationen
im Muskel- und Fettgewebe nach ca. 20 Min. identisch mit den
korrespondierenden Plasma-Konzentrationen. Weiters wurde Dosislinearität
gezeigt. Beim septischen Intensivpatienten und bei Patienten
mit komplizierten Weichteilinfektionen, wie beim diabetischen
Fuß-Syndrom, erreicht Fosfomycin im infizierten und gesunden
Gewebe therapeutische Konzentrationen. In einer Studie zur Liquorpharmakokinetik
von Fosfomycin (i.v.) bei ZNS-Shuntinfektionen wurden therapeutische
Konzentrationen über den gesamten Behandlungszeitraum erreicht,
obwohl die Integrität der Liquor-Blut-Schranke durch die
erfolgreiche antimikrobielle Therapie verbessert wurde.
|
Key-words:
Fosfomycin, penetration, pharmacokinetik, human |
|
Summary
By the use
of the minimal invasive microdialysis technique it was demonstrated
in recent studies that fosfomycin penetrates excellently in
soft tissues in healthy volunteers and patients. In healthy
volunteers the concentrations of fosfomycin in skeletal muscle
and subcutaneous adipose tissue were almost identical with plasma
after an equilibration period of approximately 20 minutes. In
addition, a linear pharmacokinetik behavior was shown for fosfomycin.
Effective concentrations of fosfomycin were also detected in
patients with sepsis and patients with diabetic-foot-syndrome,
presenting tissue concentration-versus-time profiles almost
similar to healthy unaffected tissue. In another study, the
fosfomycin concentrations in the cerebrospinal fluid in patients
with catheter associated ventriculitis were shown to reach therapeutically
active concentrations throughout the dosing interval, though
the capillary integrity of the cerebrospinal fluid-blood barrier
has improved by successful antimicrobial treatment.
|
Einleitung
Die einzigartigen
pharmakologischen Eigenschaften von Fosfomycin wie das geringe
Molekulargewicht, die fehlende Plasmaproteinbindung, die ausgezeichnete
Gewebepenetration, das geringe Verteilungsvolumen, die Hydrophilie,
aber auch die gute Verträglichkeit haben aus einer bisher
wenig beachteten Substanz eine interessante Therapieoption bei
schweren Weichteil- und ZNS-Infektionen gemacht. Anhand von
rezenten pharmakokinetischen und pharmakodynamischen Studien
soll die Bedeutung von Fosfomycin gezeigt werden.
|
| Mikrodialyse
- eine Technik zur Bestimmung der pharmakokinetischen Eigenschaften
von Antiinfektiva Die
Mikrodialyse ist eine minimal-invasive Methode zur Messung vonArzneistoffkonzentrationen
im extrazellulären Raum von verschiedenen Geweben. Hierfür
werden Mikrodialyse-Sonden, welche in Aufbau und Funktion einer
Blutkapillare sehr ähnlich sind in das zu untersuchende
Gewebe implantiert (Abbildung 1). Diese
Mikrodialyse-Sonden bestehen aus einem dünnen Röhrchen,
umgeben von einer semipermeablen Membran, die für die meisten
Arzneistoffe durchlässig ist. Die Mikrodialyse-Sonde wird
mit sehr geringer Flussgeschwindigkeit mit physiologischer Kochsalzlösung
gespült, sodass Moleküle, die aus dem interstitiellen
Raum durch die semipermeable Membran diffundieren, in die Spüllösung
gelangen und von dieser mitgerissen werden. Nach wenigen Minuten
stellt sich ein Konzentrationsgleichgewicht ein. Die SpüIflüssigkeit
wird nun "Dialysat" genannt und kann in bestimmten
Intervallen gesammelt und analysiert werden. Die Konzentration
der Arzneistoffmoleküle im Dialysat steht in einem vorbestimmten
Verhältnis zum Wert der Konzentration im Gewebe. Die Interpretation
von Mikrodialysedaten hat entscheidend zum Gesamtverständnis
der Gewebspenetrationund Wirkung von Arzneistoffen im Zielgewebe
beigetragen. Diese Methode erlaubt die genaue Ermittlung des
Konzentrations-Zeit-Profils eines Arzneistoffes im Gewebe und
liefert daher wichtige Daten für Dosisempfehlungen.
Abbildung 1: Setzen einer Mikrodialyse-Sonde
|
|
| Gesunde
Probandenpopulation Bis
vor wenigen Jahren lagen für Fosfomycin keine systematischen
Untersuchungen zur Gewebekinetik von Fosfomycin an einer gesunden
Population vor. Aus diesem Grunde wurde von Frossard und Mitarbeitern
im Jahr 2000 die erste klinische Studie an gesunden Probanden
mit dem Ziel durchgeführt, systematisch das pharmakokinetische
Profil von Fosfomycin in verschiedenen Kompartimenten zu testen.
Zu diesem Zweck wurde die oben beschriebene Mikrodialyse eingesetzt.
In dieser
Studie konnte gezeigt werden, dass es zu einer vollständigen
Äquilibrierung (Ausgleich der Konzentrationen) von Fosfomycin
zwischen den einzelnen Kompartimenten kommt. Die Konzentrationen
von ungebundenem, also mikrobiologisch aktivem Fosfomycin im
Plasma waren nach einer kurzen Äquilibrierungsphase von
ca. 20 Min. identisch mit dem Konzentrations-Verlauf im Muskel-
und Fettgewebe. Dasselbe wurde auch für die 8 g-Dosierung
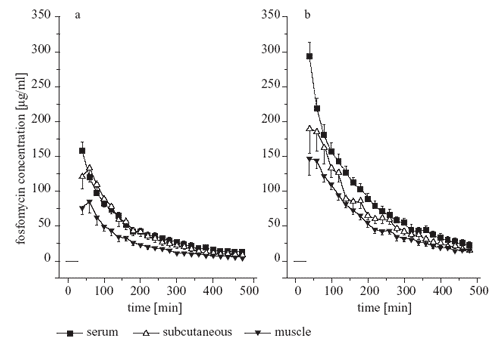
festgestellt. Nach Betrachtung der pharmakokinetischen Parameter
wie Cmax, Fläche unter der Kurve
(AUC), zeigt sich auch, dass eine lineare Pharmakokinetik besteht.
Dies bedeutet, dass es bei einer Verdoppelung der Dosis (von
4 g auf 8 g) zu einer Verdoppelung der Spitzenkonzentration
(Cmax) und der AUC kommt. Die Halbwertszeit
im Serum und im interstitiellen Gewebe betrug jeweils ca. 2-3
Stunden und entspricht den bisher bekannten Daten an einer gesunden
Population (Abbildung 2).
Abbildung 2: Das Zeit-Konzentrations-Profil von
Fosfomycin im Serum (volle Kästchen), im Skelettmuskel
(volle Dreiecke) und im Unterhaut-Fettgewebe (leere Dreiecke)
nach Gabe von 4 g (a) und 8 g (b)
Fosfomycin bei gesunden Probanden. Die schwarze Linie
gibt die Infusionsdauer an [2].
|
In einem
etablierten pharmakokinetisch-pharmakodynamischen Modell (PK-PD)
versucht man, die Wachstumshemmung definierter Bakterienstämme
im interstitiellen Gewebe zu simulieren. Das PK-PD-Modell setzt
sich aus zwei Arbeitsschritten zusammen. Zuerst wird das pharmakokinetische
Profil der Testsubstanz z.B. im Plasma und im Interstitium bestimmt.
Hierauf werden definierte Bakterienstämme in einer definierten
Inokulumzahl denjenigen Antibiotikakonzentrationen ausgesetzt,
die zuvor in den einzelnen Kompartimenten bestimmt wurden. So
lassen sich Bakterienwachstums-Hemmkurven über die Zeit
simulieren und die In vivo-Situation nachvollziehen.
Durch Einsatz dieses PK-PD-Modells konnten die Autoren dieser
Studie zeigen, dass nach Verabreichung von 4 g und 8 g einer
einzelnen Dosis von Fosfomycin ausreichend hohe Konzentrationen
im Serum und Interstitium von Fett- und Muskelgewebe erreicht
werden, sodass viele klinisch relevante Keime hier sehr wirkungsvoll
bereits nach einer Einmalgabe abgetötet werden (Abbildung
3).
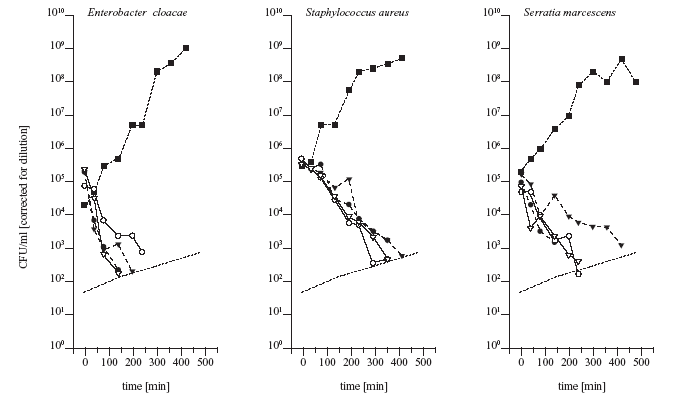
Abbildung 3: Die PK-PD-Simulation zeigte Wachstums-Hemmkurven
für klinisch relevante Bakterien, wie Enterobacter
coli, Staphylococcus aureus und Serratia
marcescens
|
Die PK-PD-Simulation
zeigte Wachstums-Hemmkurven für klinisch relevante Bakterien,
wie Enterobacter coli, Staphylococcus aureus
und Serratia marcescens. In allen drei Simulationen
konnte gezeigt werden, dass die Verabreichung von sowohl 4 g
(volle Dreiecke) als auch 8 g (leere Kreise) Fosfomycin eine
sehr effektive Wachstumshemmung dieser drei Bakterien bewirkt.
Die vollen Symbole mit gestrichelter Linie stellen die Wachsfums-Hemmkurven
für die Fosfomycin-Konzentration im Serum nach Infusion
von 4 g (volle Dreiecke mit gestrichelter Linie) und 8 g (volle
Kreise mit gestrichelter Linie) dar, die leeren Symbole stehen
für die Wachstums-Hemmkurven von Fosfomycin in der interstitiellen
Flüssigkeit des subkutanen Fettgewebes nach Infusion von
4 g (leere Dreiecke mit gestrichelter Linie) und 8 g (leere
Kreise mit gestrichelter Linie). Die CFU-Daten sind verdünnungskorrigiert,
das Detektionslimit über die Zeit ist die gestrichelte
Linie [1].
Zusammenfassend
konnte in dieser Studie gezeigt werden, dass Fosfomycin sehr
hohe und effektive Konzentrationen im Weichteilgewebe erreicht.
Diese Konzentrationen sind nach einer kurzen Äquilibrierungszeit
praktisch identisch mit dem Plasmakompartiment und sind effektiv,
um klinisch relevante Bakterienstämme vollständig
zu eradizieren. Die Autoren folgerten, dass sich Fosfomycin
zur Therapie der Weichteilinfektion aus pharmakokinetischer
Sicht gut eignet. |
| Der
kritisch kranke Patient Die
antimikrobielle Therapie des kritisch kranken und septischen
Patienten ist nach wie vor eine große Herausforderung
für den klinisch tätigen Arzt. Die Gabe des Antibiotikums
erfolgt in der initialen Phase meist empirisch und wird dann
nachVorliegen des Antibiogramms entsprechend modifiziert. Die
Wahl des geeigneten Antibiotikums zu Beginn der antimikrobiellen
Therapie ist gerade bei dieser septischen Population eminent
wichtig, da eine spätere Umstellungn und Adjustierung eines
geeigneten Präparates das Überleben und die Behandlungsdauer
des Patienten signifikant beeinflusst. Fosfomycin wurde aufgrund
seiner hervorragenden pharmakokinetischen Eigenschaften seit
Jahren bei der septischen Weichteilinfektion eingesetzt. Durch
Einsatz der Mikrodialyse konnte auch bei kritisch kranken Patienten
mit Sepsis gezeigt werden, dass Fosfomycin ähnliche Penetrationseigenschaften
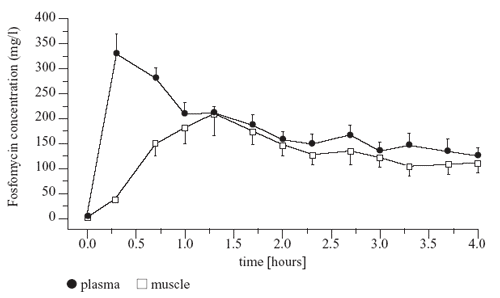
wie bei gesunden Probanden aufweist. Auffällig war, dass
der Konzentrationsausgleich zwischen Plasma und Interstitium
im Vergleich zu einer gesunden Population um 30-40 Min. verlängert
ist. Die Ursache: Sepsis-Patienten haben ein deutlich erhöhtes
extrazelluläres Volumen durch kreislaufstützende Infusionen.
Da sich Fosfomycin als hydrophile Substanz ausschließlich
im Extrazellularraum verteilt, ist die Zeit zur vollständigen
Äquilibrierung mit dem Extrazellularraum verlängert.
Außerdem sind die Konzentrationen in der interstitiellen
Flüssigkeit in Relation zu einer gesunden Population erniedrigt.
Auch dies ist durch die Erhöhung des extrazellulären
Volumens einer septisch kranken Intensivpopulation erklärbar
(Abbildung 4).
Abbildung 4: Konzentrationsverlauf von Fosfomycin
im Plasma und Skelettmuskel bei septischen Patienten (n
= 9) nach i.v. Verabreichung von 8 g Fosfomycin über
ca. 20 Min. Das Konzentrationsgleichgewicht in Interstitium
(Quadrate) und Plasma (Kreise) stellte sich nach 80 Min.
ein [2].
|
Zusammenfassend
konnte gezeigt werden, dass Fosfomycin auch bei septischen Patienten
ausreichend hohe Konzentrationen im Weichteilgewebe erreicht,
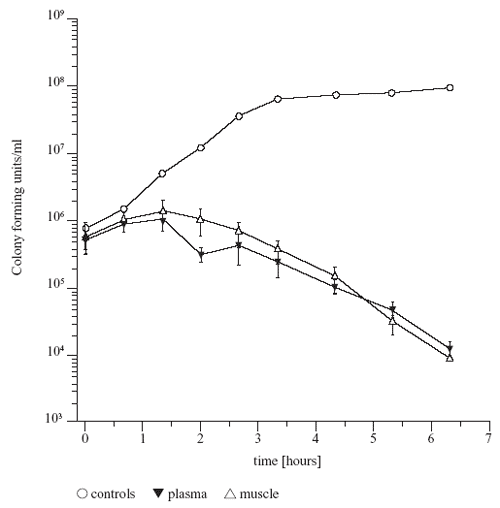
um klinisch relevante Bakterien zu eradizieren (Abbildung 5).
Abbildung 5: Wachstums-Hemmkurve für Strep.
pyogenes-Stämme nach PK-PD-Simulation. Fosfomycin-Konzentrationen
im Plasma (schwarze Dreiecke mit Spitze nach unten) und
Muskulatur (leere Dreiecke mit Spitze nach oben), simuliert
über einen Zeitraum von mehr als 6 Stunden. Als Kontrolle
dient eine Bakterienwachstumskurve ohne Fosfomycin (Kreise)
[2].
|
|
| Der
diabetische Fuß Bei
der Infektion des diabetischen Fuß-Syndroms wird der Äuilibrationsprozess
vom Plasma in das Gewebe maßgeblich von der Durchblutung
des betroffenen Areals beeinflusst. Für Fluorchinolone
konnte eine deutliche Verzögerung dieses Äuilibrationsprozesses
nachgewiesen werden. In früheren Studien wurde der Einfluss
der Mikrozirkulation im inflammierten Bereich als prädominierender
Faktor für den Konzentrationsaustausch definiert. Basierend
auf diesen Ergebnissen wurde im Jahr 2003 eine Studie von Legat
und Mitarbeitern an einer Patientenpopulation mit Zellulitis
und/oder diabetischem Fuß-Syndrom durchgeführt. Dabei
wurde die Penetration von Fosfomycin im inflammierten mit gesundem
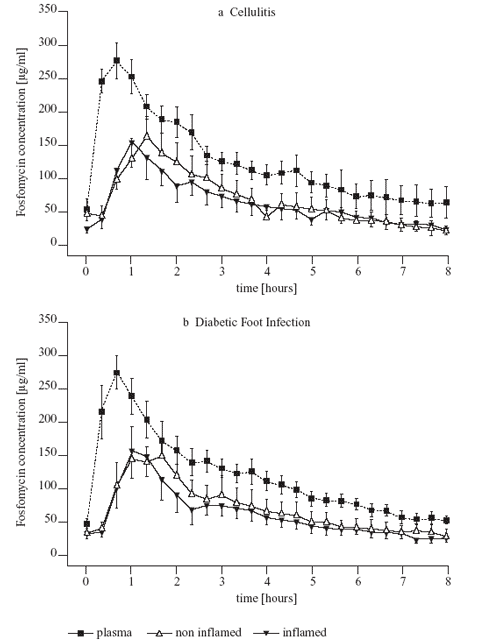
Gewebe verglichen. Das überraschende Ergebnis dieser Studie
war, dass es zwischen dem infizierten und dem gesunden Gewebe
keinen Konzentrationsunterschied über den gesamten Beobachtungszeitraum
von 8 Stunden gab [4]. Im Gegensatz zu den Fluorchinolonen,
die häufig zur Therapie von Weichteilinfektionen eingesetzt
werden, weist Fosfomycin ein besonders günstiges Penetrationsverhalten
in das entzündete Gewebe auf (Abb. 6).
Abbildung 6: Zeit-Konzentrations-Verlauf von
Fosfomycin im Plasma bzw. im nicht entzündeten und
entzündeten Weichteilgewebe bei Patienten mit Zellulitis
(a) und diabetischem Fuß-Syndrom
(b)
|
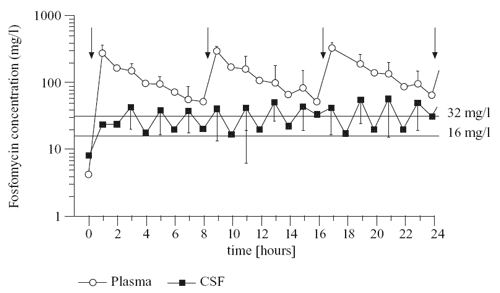
Abbildung
7: Zeit-Konzentrations-Profil im Plasma (Kreise)
und Liquor (Quadrate) nach 3 x 8 g Fosfomycin/Tag (n =
6). Die horizontalen Linien zeigen den therapeutischen
Bereich [3].
|
|
| Der
neurologische Intensivpatient Schwere
Hirninfektionen erfordern die unmittelbare und sofortige Verabreichung
von Antibiotika, die effektiv den pathogenen Keim erfassen.
Therapieversager haben meist die folgenden Ursachen: die Wahl
des falschen Antibiotikums, eine unzureichende Penetration in
das ZNS oder die Entwicklung von Resistenzen während der
antibiotischen Therapie. In der Therapie der Shunt-Ventrikulitis
wurde die direkte intrathekale oder intraventrikuläre Gabe
von Antiinfektiva propagiert, um das eingeschränkte Penetrationsverhalten
von Antiinfektiva zu umgehen. Fosfomycin hingegen erreicht aufgrund
seiner pharmakokinetischen Eigenschaften auch bei intravenöser
Gabe ausreichend hohe Konzentrationen in der zerebrospinalen
Flüssigkeit und im Hirngewebe. Pfausler und Mitarbeiter
untersuchten im Jahre 2004 die Konzentrationen von Fosfomycin
im Liquor bei Patienten mit Shunt-Ventrikulitis. Die Konzentration
von Fosfomycin im Liquor wurde sowohl nach einmaliger Gabe als
auch im Steady-state (nach 2 - 3 Tagen) bestimmt. Die Ventrikulitis
wurde mittels Keimnachweis und Laborparameter (Leukozyten, Fibrinogen,
C-reaktives Protein, Zellzahl im Liquor, Liquor-Protein, Verhältnis
von Liquor-Glukose zu Plasma-Glukose) dokumentiert. Die Patienten
erhielten täglich 3 x 8 g Fosfomycin über 8 - 10 Tage.
Fosfomycin wurde in dieser Studie von allen Patienten sehr gut
toleriert. Kombinationspartner von Fosfomycin waren Betalaktame,
Aminoglykoside und Clindamycin.
Die Konzentrationen
im Steady-state waren geringfügig (um 18% - 40%) höher
als nach der ersten Applikation, was auf eine längere Halbwertszeit
von Fosfomycin im Liquor (3 - 4 Stunden) zurückzuführen
ist. Bei allen Patienten wurden therapeutisch wirksame Fosfomycin-
Konzentrationen im Liquor und im Plasma nachgewiesen. Die Konzentrationen
im Liquor betrugen etwa 25% der Plasmakonzentrationen (16 bis
50 mg/l). Unter der Kombinationstherapie mit Fosfomycin kam
es innerhalb von 4 - 7 Tagen zur klinischen Konsolidierung.
Es ist bekannt, dass mit dem Heilungsprozess eine verminderte
Permeabilität der Blut-Hirn-Schranke eintritt und daher
die Konzentrationen von Antibiotika abnehmen. Fosfomycin zeigte
dieses Verhalten auch nach 10-tägiger Behandlungsdauer
nicht. Die Liquor-Konzentrationen von Fosfomycin verringern
sich mit fortschreitender Wiederherstellung der Blut-Hirn-Schranke
nicht und bleiben im therapeutischen Bereich.
|
Literatur:
| 1.
Frossard M., Joukhadar C., Erovic B.M., Dittrich P., Mrass
PE., Van Houte M., Burgmann H., Georgopoulos A., Muller
M.: "Distribution and antimicrobial activity of fosfomycin
in the interstitial fluid of human soft tissues." Antimicrob.
Agents Chemother. 44 (10) (2000) 2728-32. |
| 2.
Joukhadar C., Klein N., Dithich P., Zeitlinger M., Geppert
A., Skhirtladze K., Frossard M., Heinz G., Muller M.: "Target
site penetration of fosfomycin in critically ill patients."
J. Antimicrob. Chemother. 51 (5) Epub 2003 Mar 28 (2003)
1247-52. |
| 3.
Pfausler B., Spiss H., Dittrich P., Zeitlinger M., Schmutzhard
E., Joukhadar C.: "Concentrations of fosfomycin in
the cerebrospinal fluid of neurointensive care patients
with ventriculostomy-associated ventriculitis." J.
Antimicrob. Chemother. 53 (5): Epub 2004 Mar 31 (2004 May)
848-52. |
| 4.
Legat F.J., Maier A., Dittrich P., Zenahlik P., Kern T.,
Nuhsbaumer S., Frossard M., Salmhofer W., Kerl H., Muller
M.: "Penetration of fosfomycin into inflammatory lesions
in patients with cellulitis or diabetic foot syndrome."
Antimicrob. Agents Chemother. 47 (1) (2003 Jan) 371-4. |
Anschrift
des Verfassers:
Univ.-Prof. Dr. Christian Joukhadar
Univ.-Klinik für Klinische Pharmakologie,
Abteilung für Klinische Pharmakokinetik
A-1090 Wien, Währinger Gürtel 18-20
E-Mail:
christian.joukhadar@meduniwien.ac.at
|
|
|