| Fosfomycin - ein Literaturüberblick
|
|
H. Schiel 1,
D. Steinort 2, W. Graninger 1
1 Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
(Vorstand: Univ.-Prof. DDr. W. Graninger)
2 Sandoz GmbH, Wien |
|
Schlüsselwörter:
Fosfomycin, MRSA, multiresistente Pseudomonas aeruginosa,
Enterokokken, Pharmakokinetik, Mikrodialyse, Synergismus, Weichteilinfektionen,
diabetisches Fuß-Syndrom, Spondylodiszitis, Osteomyelitis,
ZNS-Infektionen, Zystische Fibrose |
|
Zusammenfassung
Fosfomycin
ist der einzige Vertreter der Epoxid-Antibiotikagruppe und wirkt
bakterizid gegen zahlreiche Gram-positive und Gram-negative
Bakterien sowie verschiedene Anaerobier. Kreuzresistenzen und
-allergien mit anderen Antibiotika wurden aufgrund der andersartigen
Struktur und Wirkungsweise bisher nicht beschrieben. Da Fosfomycin
praktisch nicht an Proteine gebunden wird und ein extrem niedriges
Molekulargewicht besitzt, penetriert es ausgezeichnet in das
Gewebe. In Weichteilen, Muskulatur, Wundsekreten, Liquor, ZNS,
Knochen, Herz, Augen und Lungen wurden hohe Konzentrationen
nachgewiesen, die deutlich über den MHK-Werten der wichtigsten
Erreger lagen.
Fosfomycin
greift bereits in einem frühen Stadium in den Aufbau der
Bakterienwand ein. Durch diese Wirkweise lässt sich die
ausgezeichnete synergistische Wirkung mit anderen Antibiotika
wie Betalaktamen, die ebenfalls an der Bakterienwand angreifen,
erklären. Bei anderen Antibiotika kann der synergistische
Effekt - zumindest teilweise - auf eine Fosfomycin-bedingte
Permeabilitätssteigerung der Bakterienwand zurückgeführt
werden. Vor allem bei der Therapie von Problemkeimen wie MRSA
und multiresistenten Pseudomonas aeruginosa-Stämmen
erweist sich Fosfomycin als sinnvoller Kombinationspartner.
Obwohl Fosfomycin in Österreich bereits 1981 in die antimikrobielle
Therapie eingeführt wurde, ist bis heute kein nennenswerter
Aktivitätsverlust zu beobachten.
Fosfomycin
wird sehr erfolgreich bei abszedierenden, postoperativen und
posttraumatischen Weichteilinfektionen, insbesondere beim diabetischen
Fuß eingesetzt. Weitere wichtige Einsatzgebiete sind Spondylodiszitis,
Osteomyelitis, ZNS-Infektionen und rezidivierende Infekte bei
zystischer Fibrose.
|
Key-words:
Fosfomycin, methicillin-resistant Staphylococcus
aureus, Pseudomonas aeruginosa, enterococci, pharmacokinetics,
microdialysis, synergy, soft tissue infections, diabetic foot
infection, spondylodiscitis, osteomyelitis, cystic fibrosis, liquor,
meningitis |
|
Summary
Fosfomycin
remains the single representative of the epoxide family of antimicrobial
drugs, and acts bactericidal against various gram-positive,
gram-negative, and anaerobic pathogens. Because of its unique
chemical structure and mode of performance, neither cross-resistance
with other chemotherapeutics, nor relevant allergic events have
been observed. Fosfomycin has an extremely low molecular weight,
and shows almost no binding to plasma proteins. Thus, the drug
easily penetrates and accumulates in soft tissue, muscles, bone,
heart, eyes, lungs, wound fluids, and liquor at gradients well
above the minimal inhibitory concentrations of common bacteria.
Fosfomycin
blocks the very early steps of bacterial cell wall synthesis.This
explains its remarkable synergistic killing characteristics
when applied in combination with other antimicrobials that inhibit
wall-assembling enzymes, like beta-lactam compounds. Also, fosfomycin
enhances the permeability of the bacterial cellwall for other
antibiotics. Fosfomycin has emerged as an indispensable adjunct
when targeting methicillin-resistant Staphylococcus aureus,
and multi-drug resistant Pseudomonas strains. Although
the drug has been approved in 1981 in Austria for treating a
broad range of infections, surveillance studies failed to demonstrate
a significant loss of antimicrobial activity over time. Fosfomycin
offers a reasonable treatment option in abscessing, postoperative,
posttraumatic, as well as CNS infections. Recent clinical data
highlight its high efficacy and tolerability in diabetic foot
infections with osteomyelitis, spondylodiscitis, and recurrent
pneumonia in cystic fibrosis.
|
Einleitung
Fosfomycin
ist ein natürlich vorkommendes Antibiotikum, das von Streptomyces-Pilzen
synthetisiert wird. Die Entdeckung erfolgte im Rahmen einer
Untersuchungsreihe in diversen Pilzkulturen im Jahr 1969. Fosfomycin
(CAS Nr. 23155-02-4) ist ein kleines, wasserlösliches Molekül
mit einem niedrigen Molekulargewicht von 138.1 und einer eher
ungewöhnlich einfachen Struktur (L-cis-1,2-Epoxypropylphosphorsäure).
Es besitzt eine für die antibakterielle Wirksamkeit verantwortliche
Epoxygruppe und ein direkt an Kohlenstoff gebundenes Phosphoratom
(Abbildung 1).
Abbildung 1: Fosfomycin - chemische Formel
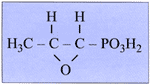
|
Durch seinen
chemisch einzigartigen Aufbau gilt Fosfomycin als einziger Vertreter
der Epoxid-Antibiotikagruppe. Parallelresistenzen und -allergien,
wie sie üblicherweise bei bekannten, großen Antibiotikagruppen
auftreten, wurden bisher nicht beschrieben und sind aufgrund
der andersartigen Struktur und Wirkungsweise auch nicht zu erwarten.
Heute wird Fosfomycin synthetisch hergestellt.
Parenteral
verabreicht wird das Di-Natrium-Salz des Fosfomycin, das im
folgenden Text genauer beleuchtet wird. Orale Formen des Fosfomycin
sind nicht Gegenstand dieser Abhandlung und werden, soweit sie
nicht in Bezug zur parenteralen Form stehen, im Folgenden auch
nicht abgehandelt. |
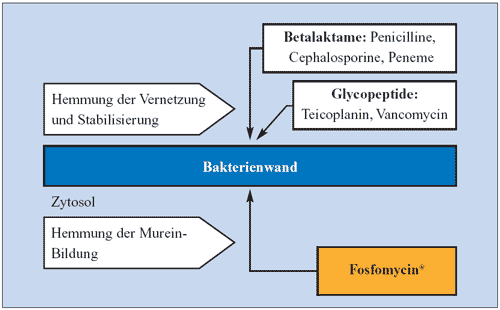
| Wirkmechanismus
Die Wirkung
von Fosfomycin beruht auf einer Störung der Zellwand- bzw.
Mureinsynthese bei wachsenden Bakterien durch Hemmung einer
frühen Vorstufe des Mureins (Kahan FM,1974). Durch diese
Wirkweise lässt sich die ausgezeichnete synergistische
Wirkung mit anderen Antibiotika, die ebenfalls an der Bakterienwand
angreifen, erklären. Im Gegensatz zu anderen typischen
Wandsynthese-Hemmstoffen, wie den Betalaktam-Antibiotika, greift
Fosfomycin bereits in einem frühen Stadium als Antimetabolit
des Phosphoenolpyruvats in den Aufbau der Bakterienwand ein.
Es hemmt durch kovalente Bindung das Enzym UPD-N-Acetylglucosaminenolpyruvyl-Transferase,
das einen der ersten Schritte bei der Wandsynthese, die Bildung
des Zellwandbausteins Acetylmuraminsäure katalysiert. Wie
bei den anderen Wandsynthese-Hemmstoffen ist die Wirkung von
Fosfomycin bakterizid. Der Angriffspunkt von Fosfomycin befindet
sich innerhalb der Bakterienwand. Daher besteht natürlich
die Notwendigkeit, dass Fosfomycin in das Bakterium eindringt.
Als hydrophiles Molekül kann Fosfomycin jedoch nicht passiv
durch die Bakterienwand diffundieren, sondern ist auf einen
aktiven Transportmechanismus angewiesen. Dabei wird entweder
das L-alpha-Glycerophosphat-Transportsystem oder, bei Vorhandensein
von Glukose-6-Phoshat, das Hexose-Phosphat-Transportsystem verwendet.
Fosfomycin wirkt spezifisch an Bakterienwänden und interferiert
nicht mit dem Wandaufbau menschlicher Zellen.
Während
Fosfomycin durch die erwähnten Mechanismen die Bildung
von Murein verhindert, hemmen Betalaktam-Antibiotika bakterielle
Enzyme (Trans- bzw. Carboxypeptidasen), die für die Vernetzung
der Mureinpräkursoren und damit für die Stabilisierung
der Mureinzellwand verantwortlich sind. Auch Glykopeptid-Antibiotika
greifen in die Zellwandsynthese ein und hemmen die Synthese
und Vernetzung des Mureingerüsts; jedoch im Gegensatz zu
den Betalaktam-Antibiotika durch Bindung an das Substrat, die
D-Alanyl-D-Alanin-Reste der Mureinbausteine (Abbildung 2).
Abbildung 2: Synergistische Wirkung bei der Bakterienwandsynthese
|
Neben seiner
antimikrobiellen Wirkung scheint Fosfomycin die Nephro- und
Ototoxizität von Aminoglykosiden zu reduzieren. Es wird
angenommen, dass Fosfomycin einen protektiven Effekt auf die
lysosomale Membranintegrität ausübt (Mirakhur A, 2003).
|
| Antimikrobielle
Wirkung Fosfomycin
wirkt nach Penetration der Bakterienwand bakterizid gegen zahlreiche
Gram-positive und Gram-negative Bakterien sowie verschiedene
Anaerobier. Dazu gehören unter anderen Staphylococcus
aureus, Streptococcus pneumoniae, Neisseria
meningitidis, Haemophilus influenzae, Escherichia
coli, Klebsiella pneumoniae, Serratia marcescens,
Proteus mirabilis und Pseudomonas aeruginosa
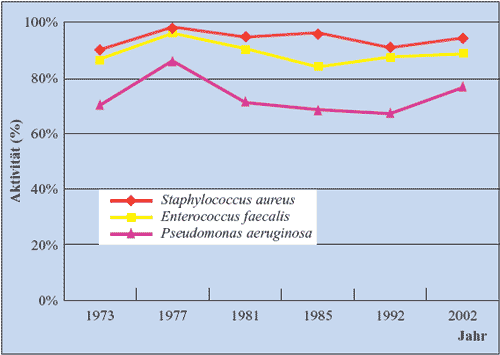
(Tabelle 1). Die Wirksamkeit von Fosfomycin hat sich über
die Jahre (1973 -2002) nicht wesentlich verändert (Abbildung
3). (Gobernado M, 2003; Greenwood D, 1987; Neu HC, 1990; Vömel
W 1982).
Tabelle 1: Antimikrobielles Spektrum von Fosfomycin
(Gobernado M, 2003)
MHK
 16 mg/l
16 mg/l |
MHK
16 - 64 mg/l |
|
| Staphylococcus
aureus |
Staphylococcus
haemolyticus |
| Staphylococcus
epidermidis |
Staphylococcus
auricularis |
| Streptococcus
pyogenes |
Staphylococcus
hominis |
| Streptococcus
viridans |
Streptococcus
agalactiae |
| Streptococcus
pneumoniae |
Stomatococcus
mucilaginosus |
| Enterococcus
faecalis |
Corynebacterium
spp. |
| Enterococcus
faecium |
Listeria
monocytogenes |
| Bacillus
anthracis |
Neisseria
meningitidis |
| Actinomyces
spp. |
Klebsiella
oxytoca |
| Neisseria
gonorrhoeae |
Enterobacter
spp. |
| Haemophilus
influenzae |
Providencia
rettgeri |
| Escherichia
coli |
Morganella
morganii |
| Klebsiella
pneumoniae |
Vibrio
spp. |
| Serratia
marcescens |
Pseudomonas
aeruginosa |
| Citrobacter
spp. |
Bartonella
spp. |
| Proteus
mirabilis |
Treponema
pallidum |
| Proteus
vulgaris |
Leptospira
spp. |
| Salmonella
spp. |
Clostridium
perfringens |
| Shigella
spp. |
Prevotella
spp. |
| Aeromonas
hydrophila |
|
| Campylobacter
jejuni |
|
| Yersinia
enterocolitica |
|
| Peptococcus
spp. |
|
| Peptostreptococcus
spp. |
|
| Fusobacterium
spp. |
|
| Veillonella
spp. |
|
|
|
Abbildung
3: Aktivität von Fosfomycin (%) gegen wichtige
Krankenhauserreger (1973 - 2002, Valencia) (Gobernado
M, 2003)
|
Fosfomycin
gehört zu den Antibiotika mit schlechter Korrelation zwischen
In vitro- und In vivo-Testergebnissen. Der
Grund dafür besteht in einer gewissen Abhängigkeit
der Aktivität von Nährböden und Testtechniken
(Simon C, 1991). Die Präsenz von Glukose-6-Phosphat ist
ein wichtiger Faktor für das Eindringen von Fosfomycin
in das Bakterium. Der Agardiffusionstest wurde entsprechend
standardisiert, für die MHK-Bestimmung steht neuerdings
auch der E-Test zur Verfügung (Andrews JM, 1983; Fromtling
RA, 1987; Grimm H,1979).
Resistenzentwicklung
Nur wenige
Pathogene erwerben ihre Fosfomycin-Resistenz durch Übertragung
von Plasmiden. In den meisten Fällen handelt es sich um
eine Alteration der genetisch determinierten Transportmechanismen.
Durch Variation dieser Systeme wird das Eindringen von Fosfomycin
in das Bakterieninnere und damit die Hemmung der Mureinsynthese
unterbunden (Arca P, 1991). Manche Bakterien können auch
direkt gegen das intrazellulär befindliche Fosfomycin gerichtete
Enzyme entwickeln. Die Modifikation und Inaktivierung von Fosfomycin
scheint durch Glutathione-S-Transferase mediiert zu werden (Llaneza
J, 1985; Arca P, 1990).
Generell
hat Fosfomycin, wahrscheinlich infolge des gezielten Einsatzes,
über die Jahre relativ wenig Wirkung eingebüßt
(Tabelle 2) (Gobernado M, 2003).
Tabelle 2: Veränderungen der Aktivität
von Fosfomycin (%) gegen diverse Pathogene (Krankenhaus
La Fe, Valencia) (Gobernado M, 2003)
| |
1973 |
1977 |
1981 |
1985 |
1992 |
2002 |
|
| S.
aureus |
88 |
97 |
94 |
96 |
91 |
94 |
| E.
faecalis |
90 |
96 |
90 |
84 |
87 |
89 |
| E.
coli |
84 |
96 |
95 |
98 |
98 |
99 |
| Klebsiella
spp. |
79 |
80 |
86 |
90 |
85 |
87 |
| Enterobacter
spp. |
44 |
76 |
75 |
77 |
70 |
68 |
| S.
marcescens |
97 |
99 |
88 |
85 |
85 |
87 |
| Salmonella
spp. |
99 |
99 |
96 |
97 |
99 |
99 |
| P.
mirabilis |
82 |
71 |
79 |
86 |
86 |
87 |
| M.
morganii |
40 |
33 |
42 |
45 |
36 |
37 |
| P.
aeroginosa |
71 |
86 |
73 |
69 |
68 |
77 |
|
|
Intrazelluläre
Wirkung
Fosfomycin
kann in humane Leukozyten penetrieren und innerhalb dieser Zellen
seine bakterizide Wirkung entfalten. Diese Eigenschaft ist von
Bedeutung, da virulente Keime nach Phagozytose in neutrophilen
Leukozyten weiter überleben können und die intrazelluläre
Lage Schutz vor der antimikrobiellen Wirkung einiger Antibiotika,
wie Betalaktamen oder Glykopeptiden, bietet. Das erklärt
möglicherweise, warum Antibiotika mit gutem Penetrationsvermögen
in Leukozyten (z.B. Clindamycin, Rifampicin, Fosfomycin) bei
rezidivierenden bzw. persistierenden Staphylokokken-Infekten
Betalaktam-Antibiotika oft überlegen sind. Die Unterschiede
zwischen der extrazellulären und intrazellulären Aktivität
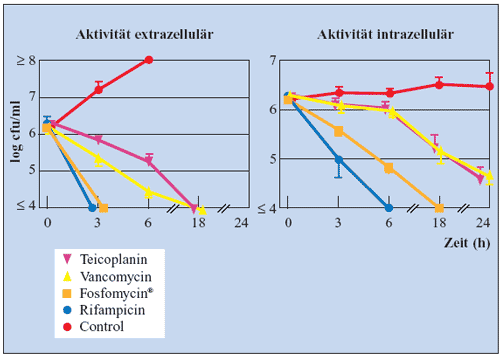
werden durch die Ergebnisse einer Studie an Staphylokokken deutlich:
Fosfomycin und Rifampicin wirken sowohl inner- als auch außerhalb
der Leukozyten, die Effektivität von Glykopeptiden (Vancomycin,
Teicoplanin) erwies sich dagegen intrazellulär als signifikant
(p<0,001) herabgesetzt (Abbildung 4) (Trautmann M, 1992).
Im Gegensatz zu Rifampicin zeigt Fosfomycin keinen negativen
Einfluss auf Chemotaxis und Phagozytose (Höger PH, 1987).
Abbildung 4: Unterschiede in der extra- und intrazellulären
Wirkung gegen Staphylococcus aureus-Stämme
(Trautmann M et al., 1992)
|
Einfluss
von Sauerstoffpartialdruck und pH
Der Sauerstoffpartialdruck
kann durch Veränderungen der MHK im aeroben und anaeroben
Milieu auf die Wirksamkeit von Antibiotika Einfluss nehmen.
Laut den Resultaten einer Untersuchung, bei der die Wirkung
von Fosfomycin gegen verschiedene Pathogene unter aeroben und
anaeroben Bedingungen getestet wurde, sinken die MHK50-Werte
im anaeroben Milieu. Dieser Effekt war bei Koagulase-negativen
Staphylokokken am stärksten ausgeprägt (Faktor 20),
bei MRSA und Enterokokken wurde eine 50%ige Reduktion der MHK-Werte
beschrieben, was natürlich eine entsprechend bessere Wirkung
von Fosfomycin impliziert (Hamilton-Miller J,1992; Inouye S,
1989; Grif K, 2001). Der pH-Wert am Wirkort kann die Effektivität
einer antimikrobiellen Chemotherapie beeinflussen. Fosfomycin
weist bei Staphylococcus aureus-Stämmen ein breites
pH-Optimum von 6,0 bis 8,0 auf (Haag R, 1984).
Effektivität
und synergistische Wirkung
Durch den
unterschiedlichen Angriffspunkt an der Bakterienwand wirkt Fosfomycin
mit einer großenAnzahl Antibiotika synergistisch bzw.
additiv. Vor allem bei der Therapie von Problemkeimen wie MRSA,
Enterokokken und multiresistenten Pseudomonas aeruginosa-Stämmen
erweist sich Fosfomycin als sinnvoller Kombinationspartner.
Der Synergismus wurde in einer großen Anzahl von Studien
untersucht (Tabelle 3).
Tabelle 3: Therapierelevante Interaktionen zwischen
Fosfomycin und anderen Antibiotika (Gobernado M, 2003;
Zeitlinger MA, 2003; Grif K, 2001; Chavanet P, 1996; Guggenbichler
JP, 1987)
| |
Kombinationspartner |
Pathogene |
Kombinationseffekt |
|
| Penicilline |
|
|
|
| |
Benzylpenicillin |
N.
meningitidis
S. pneumoniae |
S
S |
| |
Ampicillin |
E.
coli |
S |
| |
Amoxicillin |
S.
pneumoniae |
S |
| |
Piperacillin-Tazobactam |
P.
aeruginosa
S. marcescens
S. aureus |
S
S
S |
|
| Cephalosporine |
|
|
|
| |
Cefazolin |
S.
aureus |
S |
| |
Cefamandol |
S.
aureus |
S |
| |
Cefotaxim |
S.
aureus
S. epidermidis
S. pneumoniae |
S
S
S |
| |
Ceftazidim |
P.
aeruginosa |
S-A-I |
| |
Cefepim |
P.
aeruginosa |
S |
| |
Cefpirom |
S.
aureus
P. aeruginosa |
S
S |
|
| Monobactame |
|
|
|
| |
Aztreonam |
P.
aeruginosa |
S |
|
| Carbapeneme |
|
|
|
| |
Meropenem |
S.
aureus
S.
epidermidis
P. aeruginosa |
S
I
S |
| |
Imipenem |
S.
aureus
S. epidermidis
K. pneumoniae
P. aeruginosa |
S-A-I
S
S
S-A-I |
|
| Lincosamide |
|
|
|
| |
Clindamycin |
S.
aureus |
S |
|
| Aminoglykoside |
|
|
|
| |
Gentamicin |
S.
aureus
E. faecalis
P.
aeruginosa
S. marcescens
|
A-S-I
A-S
S-A
A-S |
| |
Amikacin |
S.
aureus |
A-S-I |
|
| Chinolone |
|
|
|
| |
Ciprofloxacin |
S.
aureus
S.
epidermidis
E. faecalis
P. aeruginosa |
S
S
S
S-A-I |
| |
Levofloxacin |
P.
aeruginosa |
S-A |
| |
Moxifloxacin |
S.
aureus
S.
epidermidis |
S
S |
|
| Glykopeptide |
|
|
|
| |
Vancomycin |
S.
aureus
S.
epidermidis |
A-S-I
A-I |
| |
Teicoplanin |
S.
aureus
E. faecalis |
S
S |
|
| Steroid-Antibiotika |
|
|
|
| |
Fusidinsäure |
S.
aureus
S.
epidermidis |
A-I
S-A |
|
| Andere |
|
|
|
| |
Linezolid |
S.
aureus
S.
epidermidis |
S
S |
| |
Rifampicin |
S.
aureus
S.
epidermidis
E. faecalis |
AT-I-S
S
S |
|
| S=
synergistisch, A = additiv, I = indifferent, AT =
antagonistisch |
|
Staphylokokken
Infolge seines einzigartigen Wirkmechanismus ist Fosfomycin
sowohl bei Methicillin-empfindlichen als auch bei Methicillin-resistenten
Staphylococcus aureus-SIämmen erfolgreich einsetzbar.
Bei MRSA eignen sich weder Penicilline noch Cephalosporine oder
Peneme. Häufig zeigen diese Pathogene sogar weitere Multiresistenzen
gegen andere Antibiotika-Gruppen, wodurch die Therapieoptionen
noch weiter limitiert sind. Eine mögliche Alternative zu
diesen Antibiotika ist Fosfomycin. Durch seine hohe bakterizide
Aktivität gegen Staphylokokken, seine gute Penetrationsfühigkeit
und die synergistische Wirkung mit anderen Antibiotika ist Fosfomycin
ein viel versprechendes Therapeutikum bei Infektionen mit MRSA.
Fosfomycin
ist gegen Methicillin-empfindliche StaphyIococcus aureus-Stämme
sehr gut wirksam. (Hara T, 2003; Grif K, 2001; Iwantscheff A,1988;
Graninger W, 1984). Das gilt auch für Methicillin-resistente
Isolate. In einer Wiener Studie erwiesen sich 90% der Methicillin-resistenten
Staphylococcus aureus-Stämme als empfindlich gegen
Fosfomycin (Graninger W, 1984).
In einer
rezenten Untersuchung an MRSA aus verschiedenen deutschen Großräumen
zeigten nur zwischen 1 % und 6,25 % der Stämme Resistenzen
gegen Fosfomycin (Scholz H, 2003). Auch in einer Studie aus
Spanien waren lediglich 1,2 % der MRSA-Stämme gegen Fosfomycin
resistent (Del Valle O, 1999).
Zahlreiche
Untersuchungen belegenden synergistischen Effekt mit Betalaktam-Antibiotika
(Chin NX, 1986; Neu HC, 1990). In einer 2001 in Innsbruck durchgeführten
Untersuchung erwiesen sich Kombinationen von Fosfomycin mit
Cefazolin, Meropenem, Moxifloxacin, Linezolid oder Rifampicin
gegen Staphylococcus epidermidis- und Staphylococcus
aureus-Stämme als synergistisch wirksam. Die Kombination
von Meropenem plus Fosfomycin war in vitro signifikant
wirksamer als Fosfomycin alleine, obwohl dieser Stamm gegen
Meropenem in Monotherapie als unempfindlich gilt. Auch die antimikrobielle
Wirksamkeit von Linezolid plus Fosfomycin war deutlich höher
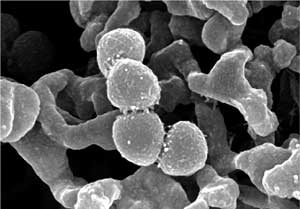
als der antibiotische Effekt der Einzelsubstanzen (Abbildung
5a, 5b und 6) (Grif K, 2001).
Abbildung 5a: Glykopeptid-resistenter Staph.
aureus nach 18 Stunden
mit Linezolid alleine (1,0 mg/T), 20.000-fache Vergrößerung
|
Abbildung 5b: Derselbe Stamm nach 18 Stunden
Inkubation mit Linezolid
(0,25 mg/T) PLUS Fosfomycin (2 mg/T) zeigt typische "Kohlkopf"-Formen
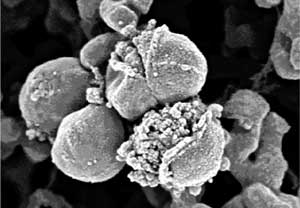
|
| Abbildung
6: Wirksamkeit von Linezolid (8 mg/l) und Fosfomycin
(40 mg/l), als Kombinations- und als Monotherapien gegen
MRSA DSM 46320 (Grif K et al., 2001)
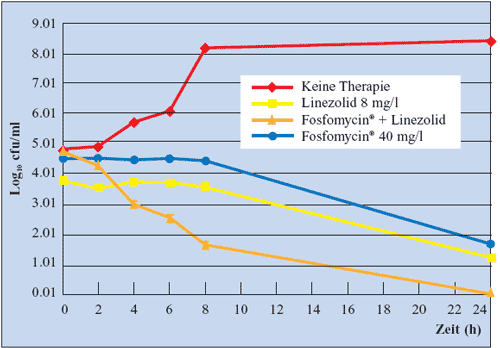
|
Fosfomycin
zeigte auch eine synergistische Wirkung mit Rifampicin oder
Ciprofloxacin gegen Koagulase-negative Staphylokokken und MRSA
(Hamilton-Miller JM, 1992; Ullmann U, 1987). Die Kombination
von Fosfomycin mit einem Cephalosporin der 4. Generation - Cefpirom
- ergab in einer In-vivo-/In-vitro-Studie innerhalb
von 5 Stunden eine komplette Eradikation von Staphylococcus
aureus-Stämmen (Abbildung 7) (Zeitlinger MA, 2003).
Abbildung 7: Synergistische Wirkung von Cefpirom
und Fosfomycin gegen Staphylococcus aureus-Stämme
(Zeitlinger MA et al., 2003)
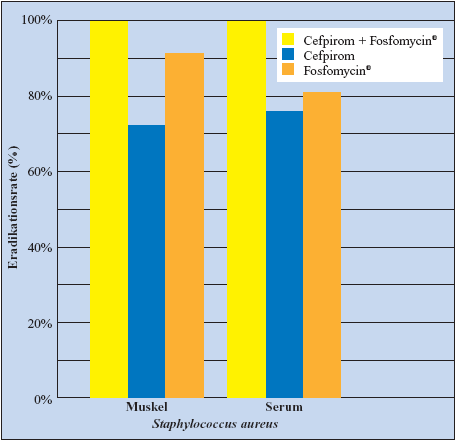
|
Pseudomonas
aeruginosa
Fosfomycin ist gegenüber 70 % der Pseudomonas aeruginosa-Stämme
wirksam. Für die Kombination von Fosfomycin mit Piperacillin,
Ceftazidim, Aztreonam und Imipenem wurde in bis zu 61 %, mit
Meropenem sogar in 86 % der Fälle eine synergistische Wirkung
gegen Pseudomonas aeruginosa-Stämme nachgewiesen
(Chin NX, 1986; Bauernfeind A, 1995). Der Vorteil einer gemeinsamen
Applikation von Fosfomycin und Ciprofloxacin konnte in mehreren
Untersuchungen bewiesen werden. Synergie wurde je nach Studie
in 78 %, 60 % bzw. 15 %, eine additive Wirkung in 22 %, 40 %
bzw. 80 % der Fälle gefunden (Ullmann U, 1987; Figueredo
VM, 1988; Tessier F, 1997).
Vor allem
bei der Behandlung von multiresistenten Pseudomonas aeruginosa-Stämmen
hat sich eine zusätzliche Gabe von Fosfomycin bewährt.
In einer 2002 publizierten Studie wird den Kombinationen von
Fosfomycin mit Aztreonam, Cefepim, Ceftazidim, Gentamicin, Imipenem,
Levofloxacin, Meropenem oder Piperacillin eine effektive synergistische
Wirkung gegen Pseudomonas aeruginosa bescheinigt. Als
wirksamste Kombinationspartner erwiesen sich Meropenem, Aztreonam
und Cefepim (Abbildung 8) (Okazaki M, 2002). In einer In
vivo-/In vitro-Studie erwies sich auch die Gabe von Fosfomycin
plus Cefpirom als effektiv (Abbildung 9) (Zeitlinger MA, 2003).
Abbildung 8: Effektivität verschiedener
Kombinationen von Fosfomycin mit anderen Antibiotika gegen
30 Pseudomonas aeruginosa-Stämme, inklusive
multirestistente Isolate (Okazaki M et al., 2002)
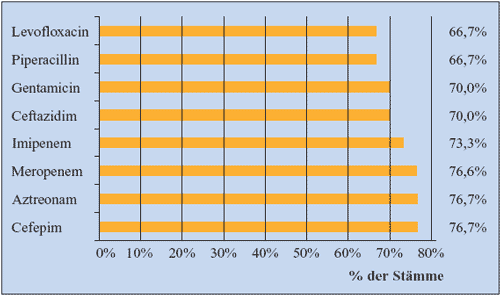
|
Abbildung
9: Synergistische Wirkung von Cefpirom und Fosfomycin
gegen Pseudomonas aeruginosa-Stämme (Zeitlinger
MA et al., 2003)
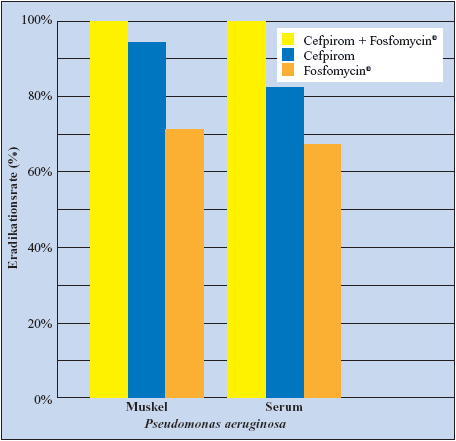
|
Eine interessante
Untersuchung an in einem Biofilm wachsenden Pseudomonas
aeruginosa zeigte eine deutlich synergistische Wirkung
von Fosfomycin mit Ofloxacin. Da in Bakterien, die mit der Kombination
behandelt wurden, deutlich höhere Ofloxacin-Konzentrationen
nachweisbar waren als in jenen, auf die nur Ofloxacin ohne Fosfomycin
einwirkte, scheint der synergistische Effekt - zumindest teilweise
- auf einer Fosfomycin-bedingten Permeabilitätssteigerung
der Bakterienwand für Ofloxacin zu beruhen (Kumon H, 1995;
Monden K, 2002).
Enterobacteriaceae
Für die Kombination von Fosfomycin mit Ampicillin sowie
Cefotaxim wurde vor allem bei vielen Proteus vulgaris-,
Enterobacter- und Providencia rettgeri-Stämmen
eine synergistische Wirkung gefunden (Chin NX, 1986).
Pneumokokken
Penicillin-resistente Pneumokokken stellen weltweit ein Problem
dar. Die Kombinationstherapie von Amoxicillin und Fosfomycin
erwies sich der Monotherapie mit einer der beiden Substanzen
deutlich überlegen (Chavanet P, 1996). Das gilt auch für
die Kombination von Fosfomycin mit Cefotaxim (Barakett V, 1993).
Enterokokken
Fosfomycin ist auch eine effektive Alternative bei Vancomycin-resistenten
Enterokokken. In einer Studie aus Innsbruck waren verschiedene
Vancomycin-resistente Enterokokken (E. faecium, E. faecalis,
E. gallinarum, E. casseliflavus) zu 94 % bis 97 % gegen
Fosfomycin empfindlich (Allerberger F,1999). Fosfomycin zeigte
auch eine synergistische Wirkung mit Rifampicin oder Ciprofloxacin
gegen Enterokokken (Hamilton-Miller JM, 1992). In einer 2000
publizierten Studie wurde die Aktivität von Fosfomycin
alleine und in Kombination mit Ampicillin, Gentamicin, Moxifloxacin,
Vancomycin und Teicoplanin gegenVancomycin-empfindliche und
Vancomycin-resistente E. faecalis- und E. faecium-Stämme
getestet. Am wirksamsten erwies sich, unabhängig vom Resistenzmuster
der einzelnen Stämme, die Kombination von Fosfomycin mit
Teicoplanin oder Ampicillin (Abbildung 10) (Georgopoulos A,
2000).
Abbildung 10: Aktivität von Fosfomycin plus
Teicoplanin gegen Vancomycin-empfindliche und Vancomycin-resistente
E. faecalis und E. faecium
(Georgopoulos A et al., 2000)
|
Helicobacter
pylori
Eine rezente, 2005 publizierte In vitro-Untersuchung
zeigte, dass Fosfomycin auch gegen Helicobacter pylori
wirksam ist und in Kombination mit Amoxicillin, Metronidazol
oder Clarithromycin gegen diesen Erreger eine partielle Synergie
besteht. Da einige Helicobacter pylori-Stämme
inzwischen Resistenzen gegen verschiedene Antibiotika entwickelt
haben, könnte eine Kombinationstherapie mit Fosfomycin
daher eine viel versprechende Alternative zu den üblichen
Therapieschemata darstellen (Blacky A, 2005).
|
| Pharmakokinetik
Die Eliminationshalbwertszeit
des üblicherweise verwendeten Dinatriumsalzes liegt bei
1,5 - 2 Stunden. Fosfomycin wird in der Leber nicht metabolisiert
und besitzt keinen enterohepatischen Kreislauf. Deshalb ist
bei Leberinsuffizienz keine Kumulation zu erwarten. Fosfomycin
wird nach intravenöser Gabe unverändert, das heißt
in der biologisch aktiven Form zu etwa 93 % renal aktiv eliminiert,
wobei 50 % bis 60 % davon innerhalb der ersten drei bis vier
Stunden ausgeschieden werden. Daher ist bei eingeschränkter
Nierenfunktion die Halbwertszeit deutlich verlängert und
eine Dosisadaptation nötig. Bei Dialysepatienten muss die
gute Dialysierbarkeit von Fosfomycin berücksichtigt werden;
innerhalb einer sechsstündigen Dialyse werden etwa 80 %
der Dosis entfernt (Bergan T, 1990; Bergan T, 1993 ; Fachinformation
2005).
Penetration
ins Gewebe
Fosfomycin
wird praktisch nicht an Proteine gebunden und besitzt ein extrem
niedriges Molekulargewicht. Dies sind wichtige Voraussetzungen
für eine gute Gewebepenetration. Nach intravenöser
Infusion unter Annahme eines offenen Zweikompartmentmodells
wird das Verteilungsvolumen von Fosfomycin mit zwischen 17,6
und 26,8 Liter angegeben. Da dieses Volumen deutlich größer
als das Blutvolumen ist, darf eine signifikante Verteilung von
Fosfomycin in das Gewebe angenommen werden. Im Liquor, Auge,
Knochen, Wundsekret, in der Muskulatur und Lunge wurden inzwischen
entsprechend hohe Konzentrationen nachgewiesen (Foltz EL, 1969;
Plaue R, 1980; Vömel W, 1981).
Weichteile
Von allen Antibiotika gibt es für Fosfomycin eine der umfassendsten
Dokumentationen über die Penetration in Weichteile.
In einer
Studie erhielten freiwillige Probanden eine Kurzinfusion mit
4 g bzw. 8 g Fosfomycin. Anschließend wurden die Serumspiegel
und mittels Mikrodialysetechnik auch die Fosfomycinkonzentrationen
im Weichteilgewebe gemessen. In Folge wurden in einem In
vivo- Pharmakokinetik- / In vitro-Pharmakodynamik-Modell
Kulturen relevanter Erreger mit Fosfomycin in genau jenen Konzentrationen,
die im Mikrodialysat auffindbar waren, behandelt. Die Gewebsspiegel
lagen weit über den MHK-Werten der wichtigsten Pathogene
(Tabelle 4), die getesteten Isolate (Staphylococcus aureus,
Enterobacter cloacae, Serratia marcescens) wurden problemlos
eliminiert (Frossard M, 2000). Diese Resultate konnten durch
klinische Studien an Patienten mit schweren Weichteilinfektionen
nachvollzogen werden. Auch bei septischen Patienten überschritten
nach intravenöser Gabe von 8 g die mittleren Fosfomycinkonzentrationen
im Plasma und im Interstitium während des Beobachtungszeitraumes
von 4 Stunden die MHK-Werte von Streptococcus pyogenes,
Staphylococcus aureus und Pseudomonas aeruginosa
(Joukhadar C, 2003).
Tabelle 4: Konzentrationen (mg/l) von Fosfomycin
in Serum, Muskel und Subkutis zum Maximalzeitpunkt (Cmax)
und nach 8 Stunden (C8) nach intravenöser
Kurzinfusion von 4 g und 8 g (Frossard M et al., 2000)
|
| intravenöse
Kurzinfusion 4 g |
|
|
|
Cmax |
97
± 13 |
144
± 19 |
202
± 20 |
C8 |
10,7
± 1,9 |
4,8
± 0,9 |
2,7
± 1,5 |
|
| intravenöse
Kurzinfusion 8 g |
|
|
|
Cmax |
156
± 16 |
208
± 30 |
395
± 46 |
C8 |
22,1
± 3,6 |
13,7
± 3,7 |
9,8
± 2,3 |
|
|
Bei Phlegmone
und diabetischem Fußsyndrom wurden die Konzentrationen
im Plasma und mittels Mikrodialyse die Fosfomycinspiegel im
Zielgewebe gemessen. Die mittleren Fosfomycinkonzentrationen
im Weichteilgewebe lagen bei 22 - 25 mg/l, also weit über
den MHK der wichtigsten Erreger. Die Werte waren bei entzündlichem
und nicht-entzündlichem Gewebe vergleichbar (Legat FJ,
2003).
Liquor
Die meisten Antibiotika treten unter normalen Bedingungen, d.h.
bei intakten Meningen, nur zu einem sehr geringen Teil aus dem
Blut in den Liquor über. Nach Gabe von Penicillinen oder
Cephalosporinen findet man im Liquor meist unter 1 % bis 2 %
der Wirkstoffkonzentrationen im Serum. Fosfomycin hat durch
das extrem kleine Molekül und das Fehlen einer Eiweißbindung
auch hier eine Sonderstellung. In einer Studie an Unfallpatienten,
die sich einer Spinalanästhesie unterziehen mussten konnte
gezeigt werden, dass klinisch relevante Mengen von Fosfomycin
auch durch intakte Meningen penetrieren. Die Fosfomycinliquorkurve
steigt nach einmaliger, intravenöser Gabe von 70 mg/kg
langsam über 4 Stunden an, bleibt für weitere 2,5
Stunden in einem relativ hohen Konzentrationsniveau und fällt
dann über weitere 6 Stunden langsam ab (Oellers B, 1981).
Die gute Penetrationsfähigkeit von Fosfomycin bei größtenteils
intakter Blut-Hirn-Schranke konnte auch in einer Studie an 39
Patienten mit bestehenden Liquordrainagen bestätigt werden.
Die maximalen Fosfomycinkonzentrationen im Liquor lagen 3 -
6 Stunden nach Infusion von 5 g Fosfomycin bei 9 mg/l bis 10
mg/l, 2 - 3 Stunden nach Gabe von 10 g bei14 mg/l bis 17 mg/l
(Pfeifer G, 1985). Bei entzündeten Hirnhäuten steigen
die Penetrationsrate und damit die Fosfomycinliquorkonzentrationen
deutlich an. Während nach Infusion von 15 g ohne Meningitis
Liquorkonzentrationen zwischen 6,48 mg/l und 8,98 mg/l gemessen
wurden, waren bei Entzündungen der Hirnhäute Spiegel
von 20,28 mg/l bis 39,80 mg/l nachweisbar - also Konzentrationen,
die eine Aktivität gegen die wichtigsten Pathogene garantieren
(Friedrich H, 1987). In einer anderen Untersuchung konnten diese
Angaben bestätigt werden, nach 5 Tagen Sättigungsphase
wurde aber sogar über Liquorspiegel von bis zu 150 mg/l
berichtet - d.h. bis zu 300 % Anstieg im Vergleich zu Fosfomycinkonzentrationen
bei nicht entzündeten Meningen (Kuhnen E, 1987). Während
einer Therapie mit dreimal täglich 8 g Fosfomycin lagen
unter Steady-state-Bedingungen bei Intensivpatienten mit Ventrikulitis
die Fosfomycinkonzentrationen im Liquor zu 98 % der Beobachtungszeit
über einer MHK von 8 mg/l, zu 92 % über 16 mg/l und
zu 61 % über 32 mg/l (Abbildung 11) (Pfausler B, 2004).
In Hirnabszessen und in deren Kapseln waren Konzentrationen
von 171 mg/l und 112 mg/l nachweisbar (Tritthart H, 1987).
Abbildung 11: Konzentrationen von Fosfomycin
in Plasma und Liquor nach mehreren Applikationen von 8
g als Kurzinfusion über 30 Minuten bei Patienten
auf einer Neurointensivstation. Vergleich mit MHK-Werten
von 16 mg/l und 32 mg/l (Pfausler B et al., 2004)
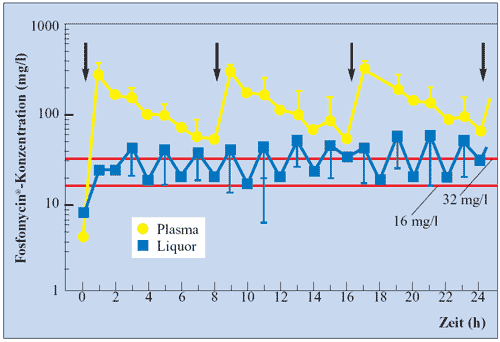
|
Knochen
Fosfomycin penetriert sehr gut in das Knochengewebe. Sowohl
in der Spongiosa als auch in der Kortikalis konnten nach intravenöser
Gabe von 5 g oder 10 g Fosfomycin weit über der MHK der
wichtigsten Bakterien liegende Gewebskonzentrationen messen
werden (Abbildung 12, 13) (Wittmann DH, 1980; Meißner
A, 1989). Mit diesen Gewebskonzentrationen werden die wichtigsten
Erreger erfasst (Abbildung 14) (Plaue R, 1980).
Abbildung 12: Konzentrationen von Fosfomycin
in Plasma, Spongiosa und Corticalis nach intravenöser
Kurzinfusion von 5 g (Wittmann DH, 1980)
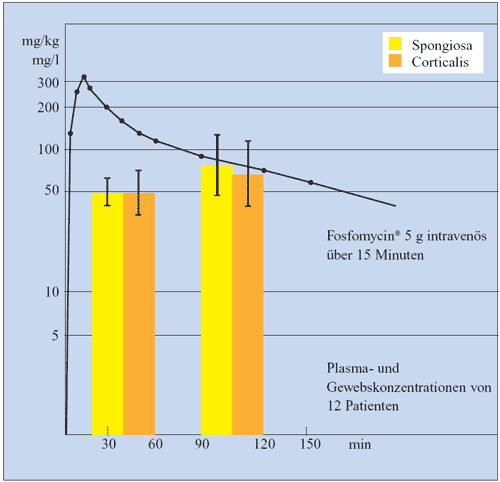
|
Abbildung
13: Konzentrationen (ø) von Fosfomycin
in Spongiosa, Corticalis und Sequester nach intravenöser
Applikation von 10 g (Meißner A et al., 1989)
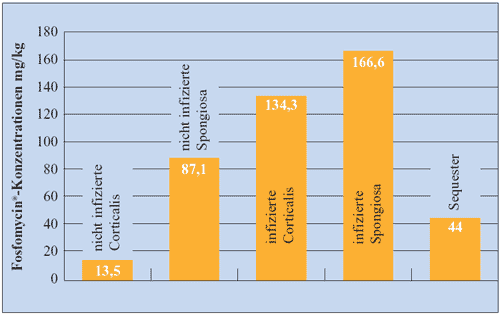
|
Abbildung
14: Antimikrobielle Aktivität von Fosfomycin
in Spongiosa und Corticalis nach intravenöser Applikation
von 70 mg/kg KG (Plaue R et al., 1980)
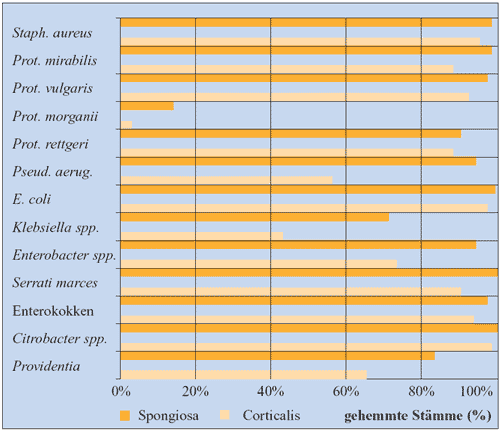
|
Es wird
auch eine Interaktion zwischen Fosfomycin und dem Hydroxylapatit
des Knochens vermutet. Möglicherweise wird Fosfomycin aus
der interstitiellen Flüssigkeit an die Knochengrenzfläche
adsorbiert. Der so entstehende Konzentrationsverlust in der
interstitiellen Flüssigkeit wird natürlich ausgeglichen,
solange ein Konzentrationsgefälle von intravasal nach extravasal
besteht. Kommt es durch die renale Elimination schließlich
zu einer Umkehr der Gegebenheiten, wird Fosfomycin verzögert
aus dem Knochen abgegeben. Dadurch werden im Knochengewebe noch
für längere Zeit antimikrobiell wirksame Konzentrationen
aufrechterhalten, was die ausgezeichneten klinischen Erfolge
bei ossären Infektionen erklären könnte (Haag
R, 1989; Wittmann DH, 1980; Bauernfeind A, 1983).
Lunge
In einer Studie erhielten Patienten, bei denen eine Lungenoperation
durchgeführt werden musste, 5 g Fosfomycin zu einem definierten
Zeipunkt in Form einer intravenösen Kurzinfusion verabreicht.
Da die Zeitintervalle zwischen der Infusion und der Probenentnahme
bei den einzelnen Individuen unterschiedlich lang gewählt
wurden, konnte aus der Gesamtheit der Daten der Verlauf der
Serum- und Gewebskonzentrationen ermittelt werden (Abb. 15).
Bereits nach 80 Min. wurden die höchsten Konzentrationen
im Lungengewebe nachgewiesen (Adam D, 1981).
Abbildung 15: Konzentrationen von Fosfomycin
in Serum und Lungengewebe nach intravenöser Kurzinfusion
von 5 g (Adam D et al., 1981)
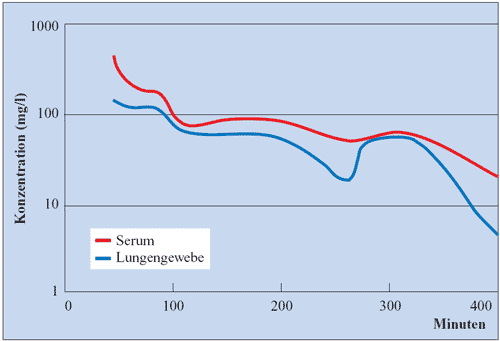
|
Augen
Nach einer intravenösen Infusion von 4 g bzw. 8 g konnten
etwa zwei Stunden nach der Applikation im Kammerwasser die höchsten
Konzentrationen (28,3 mg/l bzw. 52 mg/l) gemessen werden. Diese
Fosfomycinspiegel übersteigen deutlich die Konzentrationen,
die nötig sind um klinisch relevante Erreger zu eliminieren.
Im Rahmen dieser Studie wurde auch beobachtet, dass bei Patienten
mit entzündeten Augen wesentlich höhere Fosfomycinspiegel
gemessen werden konnten (Philipp W, 1986). Zu ähnlichen
Ergebnissen führte eine andere Untersuchung an Patienten,
die sich einer Kataraktoperation unterzogen. Nach intravenöser
Applikation von 4 g Fosfomycin wurden zu unterschiedlichen Zeiten
die Kammerwasserspiegel untersucht. Bereits nach einer Stunde
konnten Konzentrationen von 11,46 ± 2,12 mg/l, nach zwei
Stunden Spitzenwerte von 14,63 ± 5,54 mg/l gemessen werden.
Die Fosfomycinspiegel im Kammerwasser blieben auch 6 und 12
Stunden nach Applikation noch deutlich erhöht. Fosfomycin
ist daher laut Aussage der Autoren für die Therapie intraokulärer
bakterieller Infektionen geeignet (Forestier F, 1996). Nach
intravenöser Infusion von 8 g waren Maximalkonzentrationen
von 35 - 60 mg/l im Kammerwasser nachweisbar (Radda TM, 1985).
Herz
Entsprechend den ermutigenden Ergebnissen bei experimenteller
Endokarditis wurde Fosfomycin inzwischen erfolgreich bei MSSA-bedingter
Endokarditis eingesetzt (Aoyagi S,1994; Rodriguez A,1987; Rodriguez
A, 1985). Auch nach Herzoperationen kann es durch Staphylococcus
aureus und Staphylococcus epidermidis, seltener
durch Escherichia coli und Klebsiella pneumoniae
zu Infektionen wie Endokarditis oder Mediastinitis kommen. Fosfomycin
(5 g i.v.) penetriert ausgezeichnet in das Klappengewebe, die
Muskulatur und ins umgebende Fettgewebe. Insbesondere im Myokard
wurden sehr hohe Werte gefunden (Tabelle 5) (Achatzy R,1987).
In einer anderen Studie konnten die Resultate weitgehend bestätigt
werden. Beide Studien kamen auch zum Ergebnis, dass ein kardiogener
Bypass keinen Einfluss auf die Kinetik oder die Gewebspenetration
hat (Hirt SW, 1990). Vor allem bei Patienten mit Betalaktam-Allergie
ist Fosfomycin, eventuell in Kombination mit einem Chinolon,
eine interessante Alternative (Lebreton P, 1989).
Tabelle 5: Konzentrationen (mcg/ml, mcg/g) von
Fosfomycin in Plasma, Klappengewebe und Myokard nach intravenöser
Kurzinfusion von 5 g (Achatzky R et al., 1987)
| |
0
- 60 Minuten |
60
- 120 Minuten |
120
- 180 Minuten |
|
| Patienten
mit KHK |
|
|
|
| Plasma |
195,74
± 82,3 |
128,6
± 41,61 |
138
± 12,31 |
| Myokard
+ Subkutis |
98
± 52,49 |
26 |
32,5 |
|
| Patienten
mit Klappendefekten |
|
|
|
| Plasma |
156,13
± 61,56 |
132,12
± 36,48 |
|
| Herzklappe |
87,52
± 56 |
80,1
± 51,7 |
|
| Myokard |
178 |
95,62
± 60,15 |
92,43
± 51,49 |
|
|
|
| Klinische
Anwendung
Weichteilinfektionen
Durch die
hervorragende Gewebegängigkeit von Fosfomycin übersteigen
die am Wirkort gefundenen Konzentrationen die MHK-Werte der
häufigsten Erreger. Diese Tatsache konnte, wie bereits
zuvor dargestellt, durch Mikrodialysetechniken an Patienten
mit Phlegmone, diabetischem Fuß-Syndrom bzw. Sepsis direkt
im infizierten Gewebe bewiesen werden. Die Penetration wird
durch die Entzündung nicht beeinflusst (Legat FJ, 2003;
Joukhadar C, 2003; Müller M, 2000).
Nekrotisierende
Weichteilinfektionen sind in der Regel aggressiv verlaufende
Krankheiten mit einer relativ hohen Mortalität. In einer
prospektiven Untersuchung an 42 Patienten wurde im Rahmen eines
multimodalen Therapiemanagements (Intensivtherapie, rasches
chirurgisches Debridement, antimikrobielle Chemotherapie, optional
hyperbarer Sauerstoff) eine antibiotische Initialtherapie mit
Fosfomycin (2 x 8 g/Tag) und Meropenem (3 x 1-2 g/Tag) verabreicht.
DieseAntibiotikakombination erwies sich bei lebensbedrohlichen,
nekrotisierenden Weichteilinfektionen als effiziente antimikrobielle
Therapie mit einem sehr günstigen Nebenwirkungsprofil (Maier
A, 2000).
Bei posttraumatischen
und postoperativen Weichteilinfekten hat sich eine Kombinationstherapie
von Fosfomycin (2 x 8 g/Tag) mit Clindamycin oder einem Betalaktam-Antibiotikum
über mindestens 6 Tage ebenfalls bewährt. Auch in
dieser retrospektiven Untersuchung an 53 Patienten waren Staplrylococcus
aureus-Stämme die häufigsten Erreger, deutlich
seltener wurden Escherichia coli. Klebsiellen
und Staphylococcus epidermidis nachgewiesen (Wildling
E, 1992).
Diabetischer
Fuß
Beim diabetischen
Fuß müssen Infektionen als schwerwiegendes Risiko
eingestuft werden, bei bis zu 50 % der Betroffenen ist eine
inadäquateTherapie die unmittelbare Ursache für die
Amputation. In der Regel sind Staphylokokken und Streptokokken
Gruppe A für oberflächliche Infektionen verantwortlich,
bei tiefergreifenden Infektionen mit Knochenbeteiligung muss
neben Gram-positiven Staphylokokken, Streptokokken und Enterokokken
auch mit Gram-negativen Enterobakterien, bei nekrotisierenden
Prozessen auch mit anaeroben Keimen gerechnet werden. Fosfomycin
ist infolge seines Spektrums, seiner hohen Penetrationsrate
in das betroffene Gewebe und seiner pH-unabhängigen Wirksamkeit
gut zur Behandlung dieser Infektionen geeignet. Außerdem
wird seine Wirkung gegen Staphylococcus aureus durch
ein anaerobes Milieu eher gesteigert.
In einer
multizentrischen Pilotstudie an Patienten mit diabetischem Fuß-Syndrom
erwies sich Fosfomycin in Kombination mit Amoxicillin/Clavulansäure
bei Vorfußphlegmone und zusammen mit Meropenem bei akuten
septischen Zustandsbildern als ausgezeichnet wirksam. Vor allem
bei schweren, tiefen und phlegmonösen Infektionen sollte
Fosfomycin in hoher Dosis in Kombination mit Amoxicillin/Clavulansäure
oder einem Cephalosporin der dritten Generation, bei lebensbedrohlichen
Infektionen mit septischer Streuung zusammen mit Meropenem und
eventuell einem Aminoglykosid verabreicht werden. Bei Patienten
mit Penicillin- bzw. Cephalosporin-Allergie empfiehlt sich die
Gabe von Aztreonam oder einem Chinolon in Kombination mit Fosfomycin
oder Clindamycin (Graninger W, 2000).
Bei schweren
Infektionen und Komplikationen wird beim diabetischen Fuß-Syndrom
in vielen Fällen eine Amputation unumgänglich. In
einer klinischen Studie konnte neulich gezeigt werden, dass
durch die antimikrobielle Therapie mit Fosfomycin eine deutliche
Senkung der Amputationsrate möglich ist. 52 Patienten mit
schwerer Infektion und drohender Amputation wurden mit Fosfomycinin
einer Tagesdosis von 8 g bis 24 g, in 82,7 % der Fälle
in Form einer Kombinationstherapie mit einem anderen Antibiotikum
(meist einem Betalaktam) über 14,4 ± 8,3 Tage behandelt.
Obwohl 42,4 % der Teilnehmer bereits erfolglos mit anderen Antibiotika
vorbehandelt worden waren, konnte durch die Verabreichung von
Fosfomycin bei 92,3 % der Patienten eine Amputation vermieden
werden (Stengel D, 2005).
Spondylodiszitis
Für
die antimikrobielle Therapie der hämatogenen Spondylodiszitis
existiert bis heute kein Goldstandard. In einer rezenten, 2005
publizierten Studie an 40 Patienten konnte in 68 % der Fälle
Staphylococcus aureus als Erreger identifiziert werden
und zu je 10 % Streptococcus spp. und Escherichia
coli. Staphylococcus epidermidis war zu 6 %, Salmonellen
und Enterococcus spp. zu je 3 % beteiligt. Die häufigsten
Komplikationen waren Epiduralabszesse (28 %), Psoasabszesse
(18 %), Abszesse in anderen Lokalisationen (20 %), Pleuraempyem
(8 %), Sepsis (8 %) und eine inkomplette Querschnittsymptomatik
(5 %). Mit 3 x 8 g Fosfomycin pro Tag, meist in Kombination
mit einem Cephalosporin der zweiten Generation über eine
Dauer von durchschnittlich 24 Tagen konnte bei 87,5 % der Patienten
ein klinischer Erfolg verzeichnet werden (Stöckl B, 2005).
Auch bei der Therapie von 34 Patienten nach Bandscheibenoperationen
konnten alle Studienteilnehmer nach der Behandlung mit 2 x 8
g Fosfomycin in Kombination mit Ceftriaxon, Clindamycin oder
Amoxicillin/Clavulansäure als klinisch geheilt eingestuft
werden (Wurm G, 2000).
Osteomyelitis/Osteitis
Durch die
Zunahme von Unfüllen und dem stetigen Anstieg von Operationen
mit Implantation eines künstlichen Gelenksersatzes ist
auch die Häufigkeit von sekundären Gelenks- undKnocheninfektionen
im Steigen begriffen. Nach einer offenen Fraktur ist in 12,8
% eine sekundäre Osteitis zu erwarten, bei geschlossenen
Frakturen beträgt die Inzidenz noch immer 3,9 %. Die Wahrscheinlichkeit
ist hoch, dass die Knocheninfektion zu einem langwierigen, manchmal
auch lebenslang bestehenden Problem wird und abgesehen von der
Beeinträchtigung der Lebensqualität auch entsprechend
hohe Kosten verursacht. Neben der operativen Sanierung entscheidet
vor allem die Wahl der richtigen antimikrobiellen Chemotherapie
über den Ausgang der Erkrankung. Fosfomycin ist für
den Einsatz in dieser Indikation sehr gut geeignet.
Die häufigsten
Erreger einer hämatogenen Osteomyelitis sind Staphylococcus
aureus und andere Gram-positive Kokken. Bei postoperativer
oder posttraumatischer Osteomyelitis gehören zum Spektrum
der zu erwartenden Pathogene auch Gram-negative Keime und Anaerobier.
Ein spezielles Problem bei der Behandlung von Knocheninfekten
besteht in der Tatsache, dass auch nach symptomfreien Jahren
ein Rezidiv wieder auftreten kann. Neben der chirurgischen Intervention
spielt hier eine möglichst gezielte antimikrobielle Chemotherapie
eine wichtige Rolle. Die Therapie der Wahl bei Osteomyelitis
sind Betalaktam-Antibiotika, möglichst in Kombination mit
Fosfomycin, dadurch einen synergistischen Effekt die intrazelluläre
Wirkung und die gute Gewebspenetration eine zusätzliche
Wirkverstärkung erwartet werden darf. Laut pharmakokinetischen
Untersuchungen darf man davon ausgehen, dass nach i.v. Gabe
von Fosfomycin in üblicher Dosierung die Gewebskonzentrationen
deutlich über den MHK-Werten der klinisch relevanten Pathogene
liegen (Wittmann DH, 1980; Meißner A, 1989).
Möglicherweise
ist auch die strukturelle Ähnlichkeit zwischen Fosfomycin
und Hydroxylapatit dafür verantwortlich, dass die Konzentrationen
von Fosfomycin im Knochen höher sind als bei anderen Antibiotika
(Wittmann DH, 1980).
Bei akuter
hämatogener Osteomyelitis sollte die intravenöse Behandlung
über 5 - 14 Tage erfolgen, gefolgt von 2 - 4 Wochen oraler
Therapie. Bei chronischen Verlaufsformen ist eine bis zu 6 Wochen
lange parenterale Therapie notwendig, auch die anschließende
orale Behandlung muss oft wesentlich länger (6 - 12 Monate)
andauern (Janata O, 2000).
In einer
prospektiven klinischen Studie an 60 Patienten mit posttraumatischer
Osteomyelitis wurden nach einer präoperativen Initialdosis
von 10 g dreimal 5 g Fosfomycin pro Tag verabreicht, bis die
Entzündungsparameter zumindest drei Tage lang nachweislich
zurückgegangen waren. Die durchschnittliche Behandlung
dauerte 13,9 Tage (5 - 28 Tage). Die Patienten waren schon zuvor
mit bis zu 12 Antibiotika (Ø 3,1) behandelt worden. Die
gemessenen Knochenkonzentrationen lagen weit über den MHK-Werten
der nachgewiesenen Pathogene. Bei einer Kontrolluntersuchung
nach 7 - 53 Monaten (Ø 37 Monaten) wurde in nur 26,4
% ein unbefriedigendes Therapieergebnis gefunden (Meißner
A, 1989).
Die rezidivierende
posttraumatische oder postoperative Osteitis ist eine Krankheit
mit oft unbefriedigenden therapeutischen Resultaten. In einer
Studie an 55 Patienten wurde neben der operativen Sanierung
eine antibiotische Behandlung mit 2- 3 x 5 g Fosfomycin durchgeführt.
Die durchschnittliche Krankheitsdauer dieser Patienten betrug
zum Zeitpunkt der Inklusion in die Studie bereits durchschnittlich
3,3 Jahre, alle waren bereits mehrfach erfolglos vorbehandelt.
Nach zweiwöchiger Therapie waren bei 89 % der Patienten
die Kulturen steril. Innerhalb eines Beobachtungszeitraumes
von 1,5 Jahren entwickelte sich bei nur 12,7 % der mit Fosfomycin
behandelten Patienten ein Rezidiv, im Vergleich dazu lag die
Rezidivrate bei Patienten mit Behandlungsschemata ohne Fosfomycin
doppelt so hoch, bei 24 % (Roth B, 1987).
Fosfomycin
eignet sich auch sehr gut zur Initialtherapie bei pädiatrischen
Knochen- und Gelenksinfektionen. In einer prospektiven Studie
an 23 Kindern wurde die Behandlung mit Cefotaxim (100 mg/kg/Tag)
in Kombination mit Fosfomycin (100 mg/kg/Tag) begonnen. Alle
Kinder konnten nach einer etwa 15-tägigen parenteralen
Behandlung als klinisch geheilt bezeichnet werden (Badelon O,
1988). In einer Vergleichsstudie an 103 Kindern mit akuter hämatogener
Osteomyelitis benötigten Kinder, die mit Fosfomycin als
Monotherapie oder in einer Kombinationstherapie behandelt wurden,
die parenterale Antibiotikatherapie über einen signifikant
kürzeren Zeitraum. Auch in dieser rezenten Untersuchung
war Staphylococcus aureus das am häufigsten isolierte
Pathogen, gefolgt von Koagulase-negativen Staphylokokken (Corti
N, 2003). Laut einer 2004 erschienenen Publikation könnte
auch mit Fosfomycin bzw. Vancomycin angereichertes Hydroxylapatit
eine interessante Möglichkeit zur adjuvanten Lokaltherapie
bieten (Buranapanitkit B, 2004).
ZNS-Infektionen
Fosfomycin
ist für die Behandlung von Infekten des zentralen Nervensystems
gut geeignet, da es gegen die wichtigsten Erreger wirksam ist,
mit anderen hier einsetzbaren Antibiotika deutliche Synergien
zeigt und, sowohl bei inflammierten als auch bei mäßig
entzündeten Meningen, sehr gut die Blut-Hirn-Schranke passieren
kann. Dadurch werden im ZNS für einen ausreichend langen
Zeitraum die nötigen Konzentrationen für eine verlässliche
Eradikation erreicht (Pfeifer G, 1985; Friedrich H, 1987). Es
konnte auch bewiesen werden, dass unter Steady-state-Bedingungen
(3 x 8 g Fosfomycin/Tag) die MHK-Werte der wichtigsten Erreger
lange genug und hoch genug überschritten werden, um eine
verlässliche Wirkung zu ermöglichen (Pfausler B, 2004).
Im Gegensatz zu vielen anderen Antibiotika gelangt Fosfomycin
sogar bei intakten Hirnhäuten - wenn auch in einem geringeren
Umfang als bei inflammierten Meningen - in relevanten Mengen
durch die Blut-Hirn-Schranke (Oellers B, 1981).
Die Behandlungsstrategie
bei intrakraniellen und spinalen Abszessbildungen wird mitunter
kontroversiell diskutiert. Zur Auswahl stehen die neurochirurgische
Intervention, eine externe Drainage und/oder eine antimikrobielle
Chemotherapie. Die Applikation von zweimal täglich 8 g
Fosfomycin, meist in Kombination mit einem Cephalosporin der
3. bzw. 4.Generation und/oder Metronidazol, hat sich bei diesen
Indikationen bewährt (Tritthart H, 1987). Auch in einer
retrospektiven Untersuchung von Patienten mit posttraumatischen
intrakraniellen Abszessen und Empyemen wurde Fosfomycin mit
Erfolg eingesetzt (Trummer M, 1999).
Infektionen
von Liquorableitungssystemen stellen eine gefürchtete Komplikation
dar. Die Behandlung ist schwierig, da es sich bei den Erregern
einer Shunt-Infektion meist um nosokomiale Pathogene handelt
und manche Erreger, wie Koagulase-positive und -negative Staphylokokken
sowie Enterokokken, nur eine geringe entzündliche Veränderung
der Blut-Hirn-Schranke bewirken. Aus diesem Grund ist die Penetration
vieler Antibiotika (vor allem von Betalaktamen, Vancomycin,
Aminoglykosiden) deutlich geringer als bei Infektionen mit akuter
Meningitis. Fosfomycin ist eines der wenigen Antibiotika, die
auch bei intakten Meningen in einer ausreichend antimikrobiell
wirksamen Menge in das ZNS penetrieren. Als Dosis von Fosfomycin
werden 200 mg/kg KG, als Kombinationspartner ein Cephalosporin
der dritten Generation, bzw. Vancomycin, Imipenem/Cilastatin
oder eventuell Rifampicin empfohlen (Guggenbichler JP, 1996;
Guggenbichler JP, 1998).
Zystische
Fibrose
Die meisten
Patienten mit zystischer Fibrose werden von Pseudomonas
aeruginosa-Stämmen kolonisiert, was sich negativ auf
die Prognose auswirkt. Dieser Erreger ist zu einem großen
Teil für Morbidität und Mortalität der Patienten
mit zystischer Fibrose verantwortlich. Die Behandlung wird noch
durch die Tatsache erschwert, dass die meisten dieser Pseudomonas
aeruginosa-Stämme bereits gegen eine Reihe von Antibiotika
Resistenzen entwickelt haben.
Fosfomycin
penetriert nicht nur sehr gut in das Lungengewebe, es sind infolge
seines speziellen Wirkmechanismus auch keine Kreuzresistenzen
mit anderen Antibiotika, die bereits zur Therapie dieser bakteriellen
Infekte verwendet wurden, zu befürchten. Bei zystischer
Fibrose bietet sich vor allem eine Kombination mit Meropenem
oder Ciprofloxacin an. Die Kombination von Ciprofloxacin (oral)
und Fosfomycin (i.v.) zeigte gegen Pseudomonas aeruginosa
in 60 % der Fälle eine synergistische, in 40 % eine additive
Wirkung (Figueredo VM, 1988). Da es sich bei den Infektionen
im Rahmen der zystischen Fibrose um rezidivierende Exazerbationen
handelt, ist der klinische Erfolg einer antimikrobiellen Therapie
mitunter schwer abschätzbar und wird von einer Reihe anderer
Faktoren mitentschieden. In einer Studie an 86 Patienten mit
zystischer Fibrose fiel jedoch auf, dass die Patienten subjektiv
eine deutliche Besserung durch die Gabe von Fosfomycin spürten
(Meyer H, 1987). Bei 15 an zystischer Fibrose leidenden Patienten
wurden im Rahmen einer Studie 30 Exazerbationen mit Fosfomycin
in Kombination mit verschiedenen anderen Antibiotika behandelt.
Eine Behandlung dauerte im Durchschnitt 16,6 Tage, pro Patienten
erfolgten etwa 2 Therapiezyklen. Durch diese Therapie konnte
eine signifikante (p < 0,001) Besserung der FEV1-Werte
erreicht werden (Mirakhur A, 2003).
Pleuraempyem,
Lungenabszess
Fosfomycin
ist für die Behandlung komplizierter Lungeninfektionen
sehr gut geeignet, da es in hohen Konzentrationen in das Lungengewebe
penetriert (Adam D, 1981).
In einer
Studie wurde Patienten mit bisher erfolglos behandelten Pneumonien
und Lungenabszessen Fosfomycin in Kombination mit einem Cephalosporin
verabreicht. Mit dieser Therapie konnte eine Heilungsrate von
70 % erreicht werden (Shimada K, 1994).
|
| Dosierung
Im Allgemeinen
gelten folgende Dosierungsrichtlinien: Frühgeborene und
Säuglinge bis 1 Jahr (bis 10 kg) erhalten täglich
100 - 200 mg/kg Körpergewicht, im Ausnahmefall ist eine
Tagesdosis von 400 mg/kg möglich. Kinder von 1 bis 12 Jahren
(10 - 38 kg) bekommen 4 bis 8 g/Tag, Erwachsene bis 16 g/Tag.
Aufgrund der hervorragenden Verträglichkeit und der minimalen
Toxizität ist bei schweren Infektionen eine kurzfristige
Erhöhung der Dosis möglich. Es hat sich bei der Therapie
von schweren Infektionen bei Erwachsenen auch eine Tagesdosis
von 24 g (täglich 3-mal 8 g) bewährt.
Bei Niereninsuffizienz
ist die Dosierung entsprechend zu reduzieren. Eine Kreatinin-Clearance
von bis zu 60 ml/min macht noch keine Anpassung erforderlich.
Bei einer Reduktion der glomerulären Filtrationsrate auf
40 ml/min und darunter ist eine Dosisreduktion angezeigt (Tabelle
6) (Fachinformation, 2005).
Dinatrium-Fosfomycin
soll als Kurzzeitinfusion (4 g über etwa 30 Minuten, 8
g über etwa 60 Minuten) verabreicht werden. Die Tagesdosis
richtet sich nach dem klinischen Zustand des Patienten bzw.
der Empfindlichkeit der Erreger und wird auf 2 oder 3 gleiche
Gaben aufgeteilt, die in 8-oder 12-stündigen Intervallen
infundiert werden.
Tabelle 6: Dosierungsempfehlungen bei eingeschränkter
Nierenfunktion
glomeruläre
Filtrationsrate |
Anteil
der Normdosis |
40
- 20 ml/min |
20
- 10 ml/min |
unter
120 ml/min |
|
80
- 60 % |
60
- 40 % |
40
- 10 % |
|
|
|
| Toxizität
und Verträglichkeit Fosfomycin
wird als beinahe atoxisch beschrieben. Für das Dinatrium-Salz
wurden bei Mäusen i.v. LD50-Werte
von 1,1 g/kg Körpergewicht beschrieben, der i.v. LD50-Wert
liegt bei Hunden sogar bei 3 g/kg (Fromtling RA,1987).
Nebenwirkungen
und Vorsichtsmaßnahmen
Fosfomycin
gilt im Allgemeinen als sehr gut verträglich. Selten werden
allergische Reaktionen in Form von Hautausschlägen beschrieben,
mitunter kommt es zum Auftreten von gastrointestinalen Beschwerden
(wie Geschmacksirritationen, Übelkeit, Diarrhö), Kopfschmerzen,
Appetitverlust, Dyspnoe, Sehstörungen und Thrombophlebitis.
Es kann zu einer vorübergehenden Erhöhung der alkalischen
Phosphatase und der Transaminasen kommen. Eine Venenreizung
ist bei i.v.-Gabe möglich, bei intramuskulärer Verabreichung
kann es zu lokalen Schmerzen kommen.
Da mit einem
Gramm Fosfomycin (entspricht 1,32 g Dinatrium-Fosfomycin) 14,5
mmol Natrium zugeführt werden, sollte vor allem bei höheren
Dosierungen, insbesondere bei Patienten mit Herzinsuffizienz,
Ödemneigung und sekundärem Hyperaldosteronismus, auf
die starke Natriumbelastung geachtet und die Seruelektrolyte
entsprechend kontrolliert werden. Dabei kann sekundär auch
die Kaliumausscheidung erhöht und eine Kaliumsubstitution
nötig sein (Fachinformation, 2005; Simon C, 1997).
Schwangerschaft
und Stillperiode
Bisher wurden
auch bei Langzeitstudien an Kaninchen und Mäusen keine
Hinweise auf eine teratogene Wirkung gefunden, bzw. gibt es
auch keine Berichte, die auf teratogene Effekte beim Menschen
rückschließen lassen (Fromtling RA, 1987). Aus Gründen
der Vorsicht gibt es aber die Empfehlung, Fosfomycin in der
Schwangerschaft nur bei vitaler Indikation einzusetzen. Nach
Verabreichung von Fosfomycin wurden auch geringe Mengen in der
Muttermilch gefunden (Fachinformation, 2005). |
Literatur:
| Achatzy
R, Daschner F, Pittlik N, Bartels F. Penetration of Fosfomycin
into heart valves, subcutaneous and muscle tissue of patients
undergoing open heart surgery. New aspects for treatment
with fosfomycin 1987, ed. Guggenbichler JP, Springer Verlag
Wien. |
| Adam
D, Ritscher R. Konzentrationen von Fosfomycin in Serum und
Lungengewebe. Münch Med Wschr 1981;123 (21): 893-5. |
| Allerberger
F, Klare I. In-vitro activity of fosfomycin against vancomycin-resistant
enterococci. J Antimicrob Chemother 1999; 43:211-7. |
Andrews
JM, Baquero E, Beltran JM, Canton E, Crokaert F, Gobernado
M et al. International collaborative study on standardization
of bacterial sensitivity to fosfomycin. J Antimicrob Chemother
1983 ;12:357-61. |
| Aoyagi
S, Kawara T, Mizoguchi T, Ando E, Yanai T, Yamamoto E et
al. Methicillin-resistant Staphylococcus aureus endocarditis
following patch closure of a ventricular septal defect:
report of a case. Surg Today 1994;24:644-7. |
| Arca
P, Hardisson C, Suarez JE. Purification of a glutathione
S-transferase that mediates fosfomycin resistance in bacteria.
Antimicrob Agents Chemother 1990;34:844-8. |
| Arca
P, Reguera G, Hardisson C. Plasmid-encoded fosfomycin resistance
in bacteria isolated from the urinary tract in a multicentre
survey. J Antimicrob Chemother 1997;40:393-9. |
| Badelon
O, Bingen E, Sauzeau C, Lambert-Zechovsky N, de Ribier A,
Bensahel H. Choice of first-line antibiotic therapy in the
treatment of bone and joint infections in children. Pathol
Biol (Paris) 1988;36:746-9. |
| Barakett
V, Lesage D, Delisle F, Burghoffer B, Richard G, Vergez
P et al. Synergy of cefotaxime and fosfomycin against penicillin-resistant
pneumococci. J Antimicrob Chemother 1993;31:105-9. |
Bauernfeind
A, Wittmann DH. Retention von Fosfomycin im anorganischen
Knochen-Hydroxylapatit. 1983;In: Spitzy KH, Adam D (Hrsg.)
Fosfomycin - ein neuartiges Antibiotikum. Pmi-pharm &
medical inform VerlagsGmbH, Frankfurt-Zürich: 134-8. |
| Bauernfeind
A. Perspectives of antibiotic therapy in cystic fibrosis
by meropenem and combinations of meropenem with other antibiotics.
9th annual North American Cystic Fibrosis Conference. Dallas,
October 12-15, 1995. Pediatr Pulmonol 1995; 12 (Suppl):
Abstract 241. |
| Bergan
T, Thorsteinsson SB, Albini E. Pharmacokinetic profile of
fosfomycin trometamol. Chemotherapy 1993; 39:297-301. |
| Bergan
T. Pharmacokinetic comparison between fosfomycin and other
phosphonic acid derivatives. Chemotherapy 1990; 36 Suppl
1:0-18. |
| Blacky
A, Makristathis A, Apfalter P, Willinger B, Rotter ML, Hirschl
AM. In vitro activity of fosfomycin alone and in combination
with amoxicillin, clarithromycin and metronidazole against
Helicobacter pylori compared with combined clarithromycin
and metronidazole. J Clin Microbiol Infect Dis 2005; published
online: 16 April 2005. |
| Buranapanitkit
B, Srinilta V, Ingviga N, Oungbho K, Geater A, Ovatlarnporn
C. The efficacy of a hydroxyapatite composite as a biodegradable
antibiotic delivery system. Clin Orthop 2004; 244-52. |
| Chavanet
P, Peyrard N, Pechinot A, Buisson M, Duong M, Neuwirth C
et al. In vivo activity and pharmacodynamics of amoxicillin
in combination with fosfomycin in fibrin clots infected
with highly penicillin-resistant Streptococcus pneumoniae.
Antimicrob Agents Chemother 1996; 40:2062-66. |
| Chin
NX, Neu NM, Neu HC. Synergy of fosfomycin with betalactam
antibiotics against staphylococci and aerobic gram-negative
bacilli. Drugs Exp Clin Res 1986;12:943-7. |
| Corti
N, Sennhauser FH, Stauffer UG, Nadal D. Fosfomycin for the
initial treatment of acute haematogenous osteomyelitis.
Arch Dis Child 2003;88:512-6. |
| Del
Valle O, Trincado P, Martin MT, Gomez E, Cano A, Vindel
A. The prevalence of methicillin-resistant Staphylococcus
aureus phagotype 95 in the Hospitales Vall d'Hebron of Barcelona.
Enferm Infecc Microbiol Clin 1999;17:498-505. |
| Fachinformation
Fosfomycin "Sandoz", 1 g i.v.-Trockensubstanz
zur Infusionsbereitung, Zulassungsnummer: 17.307. Austria
Codex 2005 |
| Figueredo
VM, Neu HC. Synergy of ciprofloxacin with fosfomycin in
vitro against Pseudomonas isolates from patients with cystic
fibrosis. J Antimicrob Chemother 1988;22:41-50. |
| Foltz
EL, Wallick H, Rosenblum C. Pharmacodynamics of phosphonomycin
after oral administration in man. Antimicrob Agents Chemother
1969; 322-6. |
| Forestier
F, Salvanet-Bouccara A, Leveques D, Junes P, Rakotondrainy
C, Dublanchet A et al.Ocular penetration kinetics of fosfomycin
administered as a one-hour infusion. Eur J Ophthalmol 1996;6:137-42. |
| Friedrich
H, Engel E, Potel J. Fosfomycinspiegel im Liquor bei Patienten
mit und ohneMeningitis. Immun Infekt 1987;15:98-102. |
| Fromtling
RA. Fosfomycin (MK-0955): an overview. Drugs of Today 1987;
23:151-6. |
| Frossard
M, Joukhadar C, Erovic BM, Dittrich P, Mrass PE, Van Houte
M et al. Distribution and antimicrobial activity of fosfomycin
in the interstitial fluid of human soft tissues. Antimicrob
Agents Chemother 2000;44:2728-32. |
| Georgopoulos
A, Bezecny P, Buxbaum A, Graninger W. Aktivität von
Fosfomycin in Kombination mit Ampicillin, Gentamicin, Moxifloxacin,
Vancomycin und Teicoplanin gegenüber Enterokokken mittels
Bioscreen-C-Analyzer. Antibiotika Monitor 2000; XVI, 5/6:
80-84. |
| Gobernado
M. Fosfomycin. Rev Esp Quimioter 2003;16:15-40. |
| Graninger
W, Leitha T, Havel M, Georgopoulos A. In vitro activity
of fosfomycin against methicillin-susceptible and methicillin-resistant
Staphylococcus aureus. Infection 1984;12:293-5. |
| Graninger
W. Die Infektion beim diabetischenFuß. Antibiotika
Monitor 2000; XVI:12-6. |
| Greenwood
D, Coyle S, Andrew J. The trometamol salt of fosfomycin:
microbiological evaluation. Eur Urol 1987;13 Suppl 1:69-75. |
| Grif
K, Dierich MP, Pfaller K, Miglioli PA, Allerberger F. In
vitro activity of fosfomycin in combination with various
antistaphylococcal substances. J Antimicrob Chemother 2001;48:209-17. |
| Grimm
H. In vitro investigations with fosfomycin on Mueller-Hinton
agar with and without glucose-6-phosphate. Infection 1979;7:256-9. |
| Guggenbichler
JP, Menardi G, Hager J. Antimicrobial therapy of bacterial
meningitis in premature- and newborn infants and shunt infections.
In: New aspects for treatment with fosfomycin, 1987, ed.
Guggenbichler JP, Springer Verlag Wien: 41-57. |
| Guggenbichler
JP, Bonatti H, Rottensteiner F. Resistance of intracellular
killing of Staphylococci by macrophages as new pathophysiologic
concept of acute hematogenous osteomyelitis in children
and therapeutic consequences. In: New aspects for treatment
with Fosfomycin. Springer Verlag Wien-NewYork 1987. |
| Guggenbichler
JP, Böswald M. Infektionen von Liquordrainagen. Antibiotika
Monitor 1996;tom XII (6): 154-6. |
| Guggenbichler
JP. Die Behandlung von Infektionen von Ventrikel-Ableitungssystemen.Workshop
ZNS-Infektionen, österr. Gesellschaft für Chemotherapie
und Universitätsklinik für Neurochirurgie, Graz,
1998. |
| Haag
R, Hölzelberger R, Rienhoff E, Bartels F, Meissner
A. Experimentelle Untersuchungen und Überlegungen zur
Verteilung und zur verzögerten Freisetzung von Fosfomycin
aus Knochengewebe. Z antimikrob antineoplast Chemother 1989;7:3-10. |
| Haag
R. Vergleichende therapeutische Wirksamkeit bei experimentellen
Staphylococcus aureus-Infektionen und Einfluss von pH-Wert
und Sauerstoff auf die In-vitro-Empfindlichkeit gegenüber
Fosfomycin. Berichtsband der Fosfomycin Arbeitstagung, Hinterzarten
1984; pmi-Verlag Frankfurt/Main: 37-40. |
Hamilton-Miller
JM. In vitro activity of fosfomycin against 'problem'
gram-positive cocci. Microbios 1992;71:95-103. |
| Hara
T, Araake M, Tsuruoka T, Watabe H. [Antimicrobial activity
of fosfomycin against beta-lactamase-producing methicillin-sensitive
Staphylococcus aureus and methicillin-sensitive coagulase-negative
staphylococci]. Jpn J Antibiot 2003;56:142-7. |
| Hirt
SW, Alken A, Muller H, Haverich A,Vomel W. Perioperative
preventive antibiotic treatment with fosfomycin in heart
surgery: serum kinetics in extracorporeal circulation and
determination of concentration in heart valve tissue. Z
Kardiol 1990:79:615-20. |
| Höger
PH. Influence of intracellularly active antibiotics (Fosfomycin,
Rifampicin, Sulfamethoxazole, Trimethoprim) on normal neutrophil
function in vitro. In: New aspects for treatment with Fosfomycin,
1987; ed: Guggenbichler JP, Springer Verlag: 19-33. |
| Inouye
S, Watanabe T, Tsuruoka T, Kitasato I. An increase in the
antimicrobial activity in vitro of fosfomycin under anaerobic
conditions. J Antimicrob Chemother 1989;24:657-66. |
| Iwantscheff
A. In vitro activity of fosfomycin against different Staphylococcus
species. J Antimicrob Chemother 1988;21:379-81. |
| Janata
O. Knocheninfektionen - Übersicht. Symposium: Gram-positive
Infektionen - eine Herausforderung für Mikobiologie
und Klinik, Linz 4.-5. Juli 2000. |
| Joukhadar
C, Klein N, Dittrich P, Zeitlinger M, Geppert A, Skhirtladze
K et al. Target site penetration of fosfomycin in critically
ill patients. J Antimicrob Chemother 2003;51:1247-52. |
| Kahan
FM, Kahan JS, Cassidy PJ, Kropp H. The mechanism of action
of fosfomycin (phosphonomycin). Ann N Y Acad Sci 1974;235:364-86. |
| Kuhnen
E, Pfeifer G, Frenkel C. Penetration of fosfomycin into
cerebrospinal fluid across non-inflamed and inflamed meninges.
Infection 1987;15:422-4. |
| Kumon
H, Ono N, Iida M, Nickel JC. Combination effect of fosfomycin
and ofloxacin against Pseudomonas aeruginosa growing in
a biofilm. Antimicrob Agents Chemother 1995; 39:1038-44. |
Lebreton
P, Vergnaud M, Zerr C, Nigam M, Kaladji C, Quesnel J.
Antibiotic prophylaxis using a combination of pefloxacin
and fosfomycin in heart surgery with CEC (extracorporeal
circulation) in patients allergic to betalactams. Cah
Anesthesiol 1989;37:77-87. |
| Legat
FJ, Maier A, Dittrich P, Zenahlik P, Kern T, Nuhsbaumer
S et al. Penetration of fosfomycin into inflammatory lesions
in patients with cellulitis or diabetic foot syndrome. Antimicrob
Agents Chemother 2003;47 :371-4. |
| Llaneza
J, Villar CJ, Salas JA, Suarez JE, Mendoza MC, Hardisson
C. Plasmid-mediated fosfomycin resistance is due to enzymatic
modification of the antibiotic. Antimicrob Agents Chemother
1985;28:163-4. |
| Maier
A, Legat E, Dittrich P, Schintler M, Tomaselli F, Koch H,
Müller M, Smolle-Jüttner FM. Interstitieller Konzentrationsverlauf
von Fosfomycin bei Patienten mit schwererWeichteilinfektion
- erste Mikrodialyse-Ergebnisse. Antibiotika Monitor 2000;
XVI:8-11. |
| Maier
A. Multimodale Therapie bei nekrotisierenden Weichteilinfektionen.
Symposium: Gram-positive Infektionen - eine Herausforderung
für Mikrobiologie und Klinik, Linz 4.-5. Juli 2000. |
| Meißner
A, Haag R, Rahmanzadeh R. Adjuvant fosfomycin medication
in chronic osteomyelitis. Infection 1989;17:146-51. |
| Meyer
H. Fosfomycin in cystic fibrosis. In: New aspects for treatment
with fosfomycin,1987, ed. Guggenbichler JP, Springer Verlag
Wien: 110-8. |
| Mirakhur
A, Gallagher MJ, Ledson MJ, Hart CA, Walshaw MJ. Fosfomycin
therapy for multiresistant Pseudomonas aeruginosa in cystic
fibrosis. J Cyst Fibros 2003;2:19-24. |
| Monden
K, Ando E, Iida M, Kumon H. Role of fosfomycin in a synergistic
combination with ofloxacin against Pseudomonas aeruginosa
growing in a biofilm. J Infect Chemother 2002;8:218-26. |
| Müller
M. Messung der Penetration von Antibiotika in das Weichteilgewebe
mittels Mikrodialyse - Ergebnisse mit Fosfomycin. Symposium:
Gram-positive Infektionen - eine Herausforderung für
Mikrobiologie und Klinik, Linz 4.-5. Juli 2000. |
| Neu
HC. Fosfomycin trometamol - management of lower urinary
tract infections. Chemotherapy 1990;36 Suppl 1:53-55. |
| Oellers
B, Bethke RO, Fabricius K, Müller O, Untersuchungen
zur Liquorgängigkeit von Fosfomycin. Therapiewoche
1981;31:5855-7. |
| Okazaki
M, Suzuki K, Asano N, Araki K, Shukuya N, Egami T et al.
Effectiveness of fosfomycin combined with other antimicrobial
agents against multidrug-resistant Pseudomonas aeruginosa
isolates using the efficacy time index assay. J Infect Chemother
2002;8:37-42. |
Pfausler
B, Spiss H, Dittrich P, Zeitlinger M, Schmutzhard E, Joukhadar
C. Concentrations of fosfomycin in the cerebrospinal fluid
of neurointensive care patients with ventriculostomy-associated
ventriculitis. J Antimicrob Chemother 2004;53:848-52. |
| Pfeifer
G et al. Pharmacokinetic aspects of cerebrospinal fluid
penetration of Fosfomycin. Int J Clin Pharm Res 1985; V(3):
171-4. |
| Philipp
W, Kofler J. [Studies of the penetrating ability of fosfomycin
into the aqueous humor and vitreous body of the eye]. Klin
Monatsbl Augenheilkd 1986;189:240-2. |
| Plaue
R, Müller O, Fabricius K, Oellers B. Untersuchungen
über die Diffusionsrate von Fosfomycin in verschiedene
menschliche Gewebe. Therapiewoche 1980;30:8329-33. |
Radda
TM, Gnad HD, Paroussis P. Fosfomycin levels in human aqueous
humor after intravenous administration. Arzneimittelforschung
1985;35:1329-31. |
| Rodriguez
A, Vicente MV, Olay T. Single- and combination-antibiotic
therapy for experimental endocarditis caused by methicillin-resistant
Staphylococcus aureus. Antimicrob Agents Chemother 1987;31:1444-5. |
| Rodriguez
A, Vicente MV, Olay T. Experimental endocarditis and fosfomycin.
Drugs Exp Clin Res 1985;11:55-62. |
| Roth
B, Mattarelli G, Bartels F. Fosfomycin in the treatment
of chronic osteitis. In: New aspects for treatment with
fosfomycin, 1987, ed. Guggenbichler JP, Springer Verlag
Wien:67-72. |
| Scholz
H, Mehl M, Seifert H, Grabein B. In-vitro-Aktivität
von Fosfomycin und 4 weiteren Antibiotika gegen Methicillin-resistente
Staphylococcus aureus (MRSA)-Isolate aus drei Regionen Deutschlands.
7. Kongress für Infektionskrankheiten und Tropenmedizin,
2003, Berlin. |
| Shimada
K, Kudoh S, Hayashi I, Shishido H, Fukuchi Y, Suzuki H et
al. [Clinical usefulness of the combined empirical therapy
with flomoxef and fosfomycin for intractable respiratory
tract infections. With a background of increasing MRSA incidence].
Jpn J Antibiot 1994;47:1299-304. |
Simon
C, Stille W. Antibiotika-Therapie in Klinik und Praxis.
9. Auflage 1997 Schattauer Verlag. |
| Stengel
D, Görzer E, Schintler M, Legat FJ, Amann W, Pieber
T, Ekkernkamp A, Graninger W. Second-line treatment of limb-threatening
diabetic foot infections with intravenous fosfomycin. Journal
of Chemotherapy 2005; in print. |
| Stöckl
B, Schmutzhard E. Antimikrobielle Therapie der Spondylodiszitis
- Überlegungen zur Optimierung. Chemotherapie Journal
2005;14:11-15. |
| Tessier
F, Quentin C. In vitro activity of fosfomycin combined with
ceftazidime, imipenem, amikacin, and ciprofloxacin against
Pseudomonas aeruginosa. Eur J Clin Microbiol Infect Dis
1997;16:159-62. |
| Trautmann
M, Meincke C, Vogt K, Ruhnke M, Lajous-Petter AM. Intracellular
bactericidal activity of fosfomycin against staphylococci:
a comparison with other antibiotics. Infection 1992;20:350-4. |
| Tritthart
H. Fosfomycin in cerebral and spinal abscesses. In: New
aspects for treatment with fosfomycin, 1987, ed. Guggenbichler
JP, Springer Verlag Wien: 58-66. |
| Trummer
M, Eustacchio S, Unger F. Prognose und Therapie posttraumatischer
intrakranieller Abszesse und Empyeme. Acta Chir Austriaca
1999; l:32-5. |
| Ullmann
U. Synergism between ciprofloxacin and fosfomycin in vitro.
Infection 1987;15:264. |
| Vömel
W, Abshagen U, Betzien G, Haag R, Hoffmann R. Zur Humanpharmakokinetik
und antibakteriellen In-vitro-Aktivität von Fosfomycin.
Der Krankenhausarzt 1981;54:771-90. |
| Vömel
W. Bakteriologische und pharmakokinetische Grundlagen der
klinischen Anwendung von Fosfomycin. in: Linzenmeier G.(Hrsgb.)
Aktuelle Aspekte zur bakteriologischen Resistenzbestimmung
und Resistenzsituation. 1982 Vieweg Verlag. |
| Wildling
E, et al. Fosfomycin, eine therapeutische Alternative bei
schwer zu behandelnden Infektionen. Antibiotika Monitor
1992: tomVIII (4):87-92. |
| Wittmann
DH. Chemotherapeutic principles of difficult-to-treat infections
in surgery: II. Bone and joint infections. Infection 1980;
8 (6): 330-3. |
| Wurm
G. Postoperative Spondylodiszitis. Symposium: Gram-positive
Infektionen - eine Herausforderung für Mikrobiologie
und Klinik, Linz 4.-5. Juli 2000. |
| Zeitlinger
MA, Marsik C, Georgopoulos A, Muller M, Heinz G, Joukhadar
C. Target site bacterial killing of cefpirome and fosfomycin
in critically ill patients. Int J Antimicrob Agents 2003;21:562-7. |
Anschrift
des Verfassers:
Univ.-Prof.
DDr. Wolfgang Graninger
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail:
wolfgang.graninger@meduniwien.ac.at
|
|
|