| Infektiologie des Kindesalters - Allgemeine Aspekte und Besonderheiten |
|
|
|
J.P. Guggenbichler |
| Einleitung
Im Kindesalter besteht für das diagnostische und therapeutische Vorgehen bei Infektionen eine Vielzahl von Besonderheiten. Diese erfordern eine unterschiedliche Vorgangsweise als bei der Behandlung von Infektionen im Erwachsenenalter. |
| Wann
antimikrobielle Therapie beginnen?
Dass am Anfang einer jeden antimikrobiellen Therapie eine korrekte Diagnose stehen muss, ist eine Forderung, die für ältere Kinder und Jugendliche sicher nach wie vor Gültigkeit hat. Leider ist sie aber, vor allem im frühen Kindesalter, nur schwer zu erfüllen. In der Regel wesentlich stürmischer verlaufende Infektionen im Kindesalter bedürfen meist einer sofortigen korrekten Behandlung, um bleibende Schäden vom Patienten abzuwehren. Zum Beispiel verschlechtert eine nur um wenige Stunden verzögerte Behandlung einer eitrigen Meningitis sowohl die Überlebenschancen als auch die Chance auf eine Restitutio ad integrum wesentlich. Die klinische und mikrobiologische Diagnostik sowie die Diagnosesicherung stellen daher im Kindesalter besondere Herausforderungen auch bezüglich eines Zeitfaktors dar. Auch akute Harnwegsinfektionen, die im frühen Säuglingsalter besonders schwer unter Entgleisungen des Wasser-, Elektrolyt- und Säure-Basen-Haushaltes verlaufen können, müssen ohne Verzögerung behandelt werden. Die akute Pyelonephritis im Kindesalter wird heute als eine Notfallsituation betrachtet, in der es ebenso wie bei der eitrigen Meningitis gilt, eine Eradizierung der Erreger so rasch wie möglich zu erreichen. Dadurch kann die Bildung von Nierennarben verhindert werden, die erst Jahrzehnte später z.B. während einer Schwangerschaft zu schwer wiegenden Folgen wie Eklampsie, Neigung zu Frühgeburtlichkeit, lebenslanger Hypertonie bzw. einer Einschränkung der Nierenfunktion bis hin zur pyelonephritischen Schrumpfniere führen können. Bereits der geringste Verdacht auf eine Infektion erfordert bei Patienten mit eingeschränkter körpereigener Abwehr den sofortigen Beginn einer effektiven antimikrobiellen Behandlung. Einige Beispiele für eingeschränkte körpereigene Abwehr:
Die antimikrobielle Behandlung erfolgt nach Abnahme entsprechender Kulturen aus Blut, Harn, Liquor und anderen relevanten Entzündungsherden noch vor dem Vorliegen einer mikrobiologischen Bestätigung oder Resistenzprüfung. Die Erstauswahl des Antibiotikums muss auf das gehäufte Auftreten multiresistenter Keime im Krankenhaus insbesondere auf Intensivstationen abgestimmt werden und die lokalen bzw. regionalen Verhältnisse berücksichtigen. Das macht die Erstauswahl des Antibiotikums schwierig. Die Indikation für eine antimikrobielle Behandlung, im Kindesalter in erster Linie auf dem klinischen Erscheinungsbild beruhend, ist entscheidend. Sie kann durch Laborparameter (Blutbild, CRP, Procalcitonin etc.) und die mikrobiologische Diagnostik unterstützt oder modifiziert werden. Der optimale Zeitpunkt für den Beginn einer antibiotischen Therapie ist schwierig zu bestimmen und bedarf großer klinischer Erfahrung. Diese beruht im Wesentlichen auf einer sorgfältigen Beobachtung des Krankheitsverlaufes mit mehrmaligen klinischen Untersuchungen des Patienten in kurzen Abständen. Gründe für den Beginn einer antimikrobiellen Therapie:
Entscheidende Hinweise für den richtigen Zeitpunkt einer antimikrobiellen Therapie:
Eine prophylaktische Verabreichung eines Antibiotikums vor Auftreten der bakteriellen Superinfektion zur Verhinderung derselben ist noch im Stadium des Virusinfektes nicht sinnvoll. Es treten dabei die bei Erwachsenen bekannten Probleme auf, wie Verschleierung der Infektion, Selektion resistenter Keime unter der Therapie sowie eine inkomplette Ausheilung des Infektionsprozesses. Eine stabile körpereigene Flora, welche die Schleimhäute besiedelt, stellt einen wesentlichen Bestandteil der körpereigenen Abwehr dar, wie immer wieder beobachtet werden kann. Eine Destabilisierung dieser körpereigenen Flora durch Antibiotika erleichtert pathogenen Mikroorganismen, sich auf den Schleimhäuten auszubreiten. Keinesfalls jedoch sollte die Angst vor solchen möglichen negativen Antibiotika-Einflüssen dazu führen, medizinisch indizierte antimikrobielle Therapien zu unterlassen. |
| Pharmakokinetische
Besonderheiten
Im Neugeborenen- und Säuglingsalter gibt es Besonderheiten, wie geänderte Bioverfügbarkeit, Pharmakokinetik, Pharmakodynamik und ein unterschiedliches Gefährdungspotential durch antimikrobielle Substanzen, die bei einer antimikrobiellen Behandlung unbedingt zu berücksichtigen sind. Für den therapeutischen Erfolg einer Antibiotikatherapie ist entscheidend, dass biologisch wirksame Konzentrationen am Infektionsort, d.h. im Gewebe, in Körperhöhlen und Körperflüssigkeiten, über eine ausreichend lange Zeit aufrechterhalten werden. Eine wichtige Orientierungsgröße für die Anwendung antimikrobieller Substanzen ist die Bioverfügbarkeit eines Medikamentes. Im Folgenden soll auf einzelne, für die
antimikrobielle Therapie im Kindesalter grundlegende pharmakologische
Aspekte eingegangen werden:
Bioverfügbarkeit Die Mehrzahl der Patienten erhält eine orale Therapie, bei der Resorption und Bioverfügbarkeit des Präparates wesentlich zum therapeutischen Erfolg beitragen. Pharmakologische Untersuchungen im Rahmen der Zulassung von Medikamenten werden an gesunden, nüchternen Jugendlichen und Erwachsenen durchgeführt. Die Verabreichung erfolgt an Säuglinge und Kleinkinder mit verschiedenen Grundkrankheiten oft ohne ausreichende Rücksicht auf den Füllungszustand des Magens. Nur selten stehen pharmakokinetische Daten von Kindern, fast nie von Säuglingen und Kleinkindern zur Verfügung. Die Bioverfügbarkeit von Antibiotika wurde
durch pharmakokinetische Untersuchungen in verschiedenen Lebensaltern
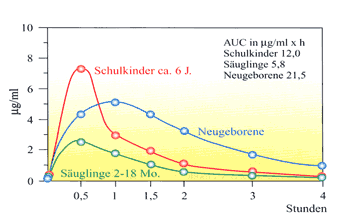
bestimmt (Abb. 1).
Kinder im Alter von ca. 6 Jahren resorbieren Oralpenicillin sehr gut, die maximale Serumkonzentration wird bereits nach 30 Minuten erreicht, die Ausscheidung erfolgt mit einer Halbwertszeit von ca. 50 Minuten. Die Bioverfügbarkeit ist etwa gleich gut wie bei Jugendlichen und Erwachsenen. Es zeigt sich, dass entsprechend der Fläche unter der Kurve und der im Harn wiederentdeckten Wirkstoffmenge Neugeborene eine deutlich größere Wirkstoffmenge resorbieren als ältere Kinder. Dies beruht einerseits auf einer höheren Membranpermeabilität bei Früh- und Neugeborenen mit besserer Penetration des Wirkstoffes im Darm, anderseits auf einer durch die Unreife der Nieren verzögerten renalen Elimination. Aufgrund des bei Neugeborenen größeren Verteilungsvolumens (ca. 40%) als bei 6-jährigen Kindern (26%) kommt es trotz der größeren resorbierten Wirkstoffmenge zu niedrigeren Serum-Spitzenkonzentrationen. Die Bioverfügbarkeit ist neben der Membranpermeabilität wesentlich vom Ausmaß der resorbierenden Oberfläche und der Intensität der Peristaltik abhängig: Da Oralpenicilline und Amoxicillin nur im Duodenum und in den obersten 25-30 cm des Jejunums resorbiert werden, ist eine um das 3-4fache beschleunigte Passagezeit bei Säuglingen für eine substantielle Verminderung der Resorptionsmenge verantwortlich. Dadurch besteht nach dem ersten Lebensmonat eine wesentliche Einschränkung der Bioverfügbarkeit z.B. für Penicillin V und auch für andere Antibiotika, wie z.B. Azidocillin. Bestimmungen der 2-Stunden-Serumkonzentrationen nach Verabreichung von 17,5 mg/kg KG Amoxicillin + Clavulansäure sowie Sulbactam + Ampicillin als Einzeldosis ergaben, dass bei Säuglingen im Vergleich zu Schulkindern nur ein Drittel der 2-Stunden-Serumkonzentrationen erreicht werden, d.h. 2 µg/ml vs. 6 µg/ml von Amoxicillin/Clavulansäure bzw. 1,3 µg/ml vs. 5 µg/ml bei Sulbactam/Ampicillin. Bei 3 von 12 Säuglingen im Alter zwischen 9 und 15 Monaten konnten nach Gabe von Sul-bactam/Ampicillin keineWirkstoffkonzentrationen nachgewiesen werden (Nachweisgrenze von 0,25 µg/ml). Anders als die Oralpenicilline werden Cephalexin, aber auch Cefaclor, Cefadroxil und Loracarbef im gesamten Intestinaltrakt resorbiert. Es bestehen daher keine Resorptionseinbußen im Säuglingsalter. Die oralen Cephalosporine der 3. Generation wie Cefixim, Ceftibuten, Cefpodoxim-Proxetil, Cefetamet-Pivotil weisen keine vollständige Bioverfügbarkeit (50 bis 75%) auf. Von einer verminderten Bioverfügbarkeit veresterter Substanzen wegen der im Säuglingsalter verminderten Ausstattung an intestinalen Hydrolasen wird in Literaturangaben gesprochen. Für „Prodrugs“, z.B. Cefpodoxim-Proxetil, konnte jedoch keine Resorptionseinbuße im frühen Säuglingsalter nachgewiesen werden. Eine gute Bioverfügbarkeit zeigen generell Makrolidantibiotika, vor allem die neueren Makrolide wie Roxithromycin und Clarithromycin. Im Gegensatz zu b-Laktamantibiotika, die sehr rasch über die Blutbahn in das interstitielle Kompartiment verteilt werden, füllen Makrolidantibiotika nach der Resorption in den kleinen Kreislauf zuerst das interstitielle und intrazelluläre Kompartiment der Lunge auf, und erst der nicht gewebegebundene „Überlauf“ ist im Blut nachweisbar. Nahezu 100% Bioverfügbarkeit besitzt das Trimethoprim. Resorptionseinbußen durch Nahrungsmittel und veränderte Resorption und Elimination bei verschiedenen Grundkrankheiten Nahrungsmittel mit einem hohen Gehalt an Kalzium,
insbesondere Milch und Milchprodukte, führen zu substantiellen
Resorptionseinbußen von verschiedenen b-Laktamantibiotika
insbesondere von Penicillin V, das als Salz im sauren Milieu des
Magens in Penicillin V und K dissoziiert. Wenn gleichzeitig Milch
mit dem Antibiotikum verabreicht wird, rekombiniert sich Penicillin
V mit dem im Überschuss vorhandenen Kalzium und führt
zu einem unlöslichen, unresorbierbaren Kalziumsalz (Abb. 2).
Allerdings werden keineswegs alle Antibiotika in ihrer Bioverfügbarkeit
beeinträchtigt: Das Benzathinsalz des Penicillin V (Ospen®)
wird unabhängig vom Füllungszustand des Magens resorbiert.
Cephalosporine werden, da im gesamten Dünndarm resorbiert,
praktisch in ihrer Bioverfügbarkeit nicht verändert. Die
meisten Makrolidantibiotika zeigen sogar höhere Wirkstoffkonzentrationen,
wenn sie gleichzeitig mit Nahrungsmitteln verabreicht werden. Azithromycin
wird jedoch durch gleichzeitige Verabreichung von Nahrung massiv
in seiner Bioverfügbarkeit beeinträchtigt.
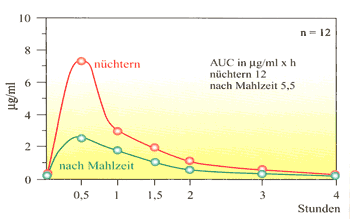
Insgesamt ist es von großer Bedeutung, diese resorptionsmindernden Faktoren zu berücksichtigen, da bei oraler Verabreichung einerseits die nicht resorbierte Wirkstoffmenge am Infektionsort fehlt, andererseits im Intestinaltrakt zu Störungen (z.B. osmotischen Durchfällen) führt. Durchfall (akut und chronisch) als häufige Begleiterkrankung bei verschiedenen Infekten, führt wie auch hohes Fieber (> 39,5°C) zu einer verminderten Bioverfügbarkeit (- 40% Serumspitzenkonzentration, - 25% AUC). Bei Mukoviszidose führt eine beschleunigte renale Elimination z.B. von b-Laktamantibiotika der Penicillinreihe zu niedrigen Serum- und Gewebskonzentrationen mit ungenügenden therapeutischen Ergebnissen. Aminoglykoside werden bei Patienten mit Mukoviszidose neben der normalen glomerulären Filtration auch tubulär sezerniert, d.h. es entsteht ein zusätzlicher Ausscheidungsweg von Aminoglykosiden und damit ebenfalls eine beschleunigte renale Elimination. Verlängerung der Halbwertszeit Die Unreife der Niere im Neugeborenenalter und im ersten Trimenon bzw. eine gleichzeitig bestehende Dehydratation führen zu einer verzögerten renalen Clearance und dadurch zu einer Verlängerung der Halbwertszeit. Dosierung nach Körpergewicht, Wahl der
Tagesdosis und Verabreichungsweise In Europa werden im Gegensatz zu Dosierungsrichtlinien in den USA etwa 3fach höhere Tagesdosen verabreicht. Zum Beispiel beträgt die Therapieempfehlung für Europa bei Amoxicillin 60 mg/kg KG, die für Cefaclor 50 mg/kg KG. Beide Medikamente werden in den USA mit 20 mg/kg KG dosiert. Die Vorteile einer höheren Gesamt-Tagesdosis bestehen in einer effizienten Eradikation der Keime und dadurch auch in einer Verhinderung bzw. Verzögerung der Resistenzentwicklung, wie sie durch subinhibitorische Konzentrationen induziert wird. Die korrekte Wahl der Tagesdosis und der Dosierungsintervalle hängt vom pharmakokinetischen Profil der Substanz (Bioverfügbarkeit, Wirkstoffkonzentration am Infektionsort, Eliminationsgeschwindigkeit) und der antimikrobiellen Wirksamkeit (MHK-Wert) ab. Diese Parameter werden unter Pharmakodynamik subsumiert. Die Verabreichungsweise, d.h. die Zahl der Gaben pro Tag, welche die Compliance beeinflusst, sowie die galenische Zubereitung und der Geschmack eines Präparates sind weitere wichtige Aspekte einer antimikrobiellen Therapie im Kindesalter. Untersuchungen zeigen, dass eine 3x tägliche Verabreichung von weniger als 75% der Patienten eingehalten wird. Eine 2x tägliche Verabreichung hingegen wird von mehr als 90% der Patienten korrekt eingehalten. Zwischen einer 1x täglichen und einer 2x täglichen Verabreichung besteht kein Unterschied in der Compliance. Dosisanpassung bei Leberfunktionsstörungen Dosisanpassung bei Nierenfunktionsstörungen
Unterschiedliche Eiweißbindung Welche klinische Relevanz die Verabreichung von Präparaten mit unterschiedlicher Eiweißbindung hat, ist umstritten bzw. bisher weitgehend unklar. Als günstig zu bewerten ist die Transportfunktion und Depotfunktion, d.h. in einem proteinreichen Exsudat sind bei Präparaten mit hoher Eiweißbindung ungleich höhere Konzentrationen zu beobachten als bei Präparaten mit geringer Eiweißbindung. Eigene experimentelle Untersuchungen in einem Modell mit infizierten Fibrinklumpen weisen darauf hin, dass trotz hoher Gesamt-Wirkstoffkonzentrationen nur der freie, d.h. ungebundene Wirkstoff antimikrobielle Wirksamkeit besitzt. Daher sind bei Substanzen mit geringer Eiweißbindung trotz niedrigerer Gesamt-Wirkstoffkonzentrationen am Infektionsort vielfach höhere freie Wirkstoffkonzentrationen zu beobachten. Die verminderte Zahl von Bindungsstellen an Albumin kann im Neugeborenenalter zu Problemen führen. Antibiotika verdrängen das Bilirubin aus Albumin-Bindungsstellen und freies, nicht eiweißgebundenes Bilirubin, das die Blut-Hirn-Schranke leichter durchdringt, führt dadurch zu einer erhöhten Gefahr eines Kernikterus. Bedeutung der Gewebekonzentration Der Wert einer hohen Gewebekonzentration einer Wirksubstanz ist differenziert zu sehen und im Zusammenhang mit den jeweiligen Keimen zu beurteilen. Bei der Testung der Gewebsproben wird die gesamte Wirkstoffkonzentration, die im Blutkompartiment (5%) im interstitiellen Flüssigkeitskompartiment (35%) und intrazellulär (60%) vorliegt, gemessen. Die Wirkstoffkonzentrationen verteilen sich jedoch nicht gleichmäßig in den einzelnen Kompartimenten. Hohe Gewebskonzentrationen bedeuten daher, dass sich der weitaus größte Teil der Wirkstoffkonzentration intrazellulär befindet. Dies bedeutet gleichzeitig, dass je nach Abnahmezeit im steady state im Blutkompartiment und im interstitiellen Flüssigkeitskompartiment geringe Wirkstoffkonzentrationen vorhanden sind. Bei Substanzen, die sich weitgehend im interstitiellen Flüssigkeitskompartiment verteilen, sind daher trotz niedrigerer Gesamt-Wirkstoff-konzentrationen deutlich höhere Wirkstoffkonzentrationen in der interstitiellen Flüssigkeit zu finden als bei Präparaten mit hohen Gewebespiegeln. Für die Klinik heißt dies nun, dass bei Infektionen mit intrazellulär residierenden Keimen wie Mykoplasmen, Chlamydien, Legionellen, aber auch Listerien, Borrelien und Leptospiren hohe intrazelluläre Wirkstoffkonzentrationen günstig sind. Die meisten schweren Infektionen durch Streptokokken, Pneumokokken, H. influenzae spielen sich jedoch im interstitiellen Flüssigkeitskompartiment, in Körperhöhlen oder in Exsudaten ab. Dabei sind hohe intrazelluläre Wirkstoffkonzentrationen therapeutisch eher nachteilig bzw. unnötig. Granulozyten und alveoläre Makrophagen können aktiv Wirkstoffkonzentrationen, z.B. von Makrolidantibiotika, an den Infektionsort transportieren und bei Zerfall freisetzen. Dies ist ein interessantes theoretisches Modell, das aber mengenmäßig eher zu vernachlässigen ist. Wesentlich bei der Betrachtung der Gewebegängigkeit von Präparaten ist, dass eine „balancierte Kinetik“ besteht, d.h., dass in allen Kompartimenten (Blut-, interstitielles Flüssigkeitskompartiment und, wenn bei intrazellulären Keimen nötig, auch im intrazellulären Kompartiment und in der Epithelial Lining Fluid, ELF) therapeutisch ausreichende Wirkstoffkonzentrationen vorhanden sind. Bei den Makrolidantibiotika ist dies für Clarithromycin, Josamycin und Roxithromycin gegeben, nicht jedoch für Azithromycin, bei dem sehr niedrige Serumkonzentrationen hohen Gewebskonzentrationen gegenüberstehen. Wie lange therapieren? Die Therapiedauer muss sich daher nach der Korrektur der ursprünglichen Pathologie richten und weniger nach der Dauer bis zur Eradikation der Keime. Die Funktion der Eustachischen Tube ist im Rahmen eines Virusinfektes der oberen Luftwege für ca. 10-14 Tage gestört. Bei einer Behandlungsdauer von 5 Tagen besteht für weitere 7 Tage nach Therapieende eine funktionelle Störung der Tubenbelüftung sowie persistierendes Sekret in der Paukenhöhle, was die Wiederbesiedelung der Paukenhöhle durch Keimaszension aus dem Nasen-Rachenraum begünstigt. Bei der Otitis media konnte bei einzelnen Studien eine Überlegenheit einer 10-tägigen Behandlungsdauer über eine 5-tägige Therapiedauer beobachtet werden. Sie manifestierte sich jedoch nicht im unmittelbaren Behandlungsergebnis nach Therapieende. Deutliche Unterschiede bis 50% zugunsten der längeren Behandlung traten zwischen dem 35. und 48. Tag nach Therapieende in der Zahl der Rezidive zwischen einer 5- und 10-tägigen Behandlungsdauer zugunsten der längeren Behandlung zutage. Bei Patienten mit einer Streptokokkentonsillitis kann die Behandlung mit einem Oralpenicillin bei gleicher mikrobiologischer Eradikationsrate nicht auf 5 Tage reduziert werden, wie es durch verschiedene Oralcephalosporine (z.B. Cefadroxil oder Cefpodoxim-Proxetil) bereits dokumentiert ist. Bei Harnwegsinfektionen muss sich die Therapiedauer nach der restharnfreien Entleerung richten. Solange die Patienten nach einer akuten Harnwegsinfektion nicht restharnfrei entleeren, besteht ein hohes Risiko einer Reinfektion. |
| Definition
und Grundbegriffe
Infektion bezeichnet den Zustand, in dem sich ein pathogener Mikroorganismus (Bakterien, Viren, Pilze, Parasiten) im Körper in erster Linie auf Haut und Schleimhäuten festsetzt und sich vermehrt. Keime können aber auch direkt in tiefere Gewebsschichten eindringen, z.B. bei Verletzung, einem penetrierenden Trauma oder bei Störung der Barrierefunktion der Haut und Schleimhaut. In die Blutbahn eingedrungene Keime können sich in verschiedenen Geweben, wie den Meningen, der Lunge oder im Harntrakt (Säuglinge < 3 Monate), festsetzen und zu lokalen Infektionen führen. Gelegentlich spielt auch eine lokale Durchblutungsstörung, wie z.B. eine Osteomyelitis nach einem stumpfen Trauma der betroffenen Extremität, eine Rolle. Infektionskrankheit liegt dann vor, wenn der Organismus mit subjektiven und objektiven Krankheitssymptomen reagiert. Bei intakten körpereigenen Abwehrmechanismen kann eine Infektion ohne klinische Symptome bestehen; diese wird als inapparente oder subklinisch verlaufende Infektion (stille Feiung) bezeichnet. Die Kolonisation von Haut und Schleimhäuten ist ein physiologisches Phänomen, das im Gegensatz zur Infektion steht. Haut und Schleimhäute sind mit einer Vielzahl von apathogenen Bakterien besiedelt. Zur körpereigenen Abwehr trägt eine stabile körpereigene Flora im Rachen, im Intestinaltrakt und auf der Haut wesentlich bei, indem sie in Konkurrenz mit pathogenen Keimen um Nahrungsstoffe steht. Verschiedene Keime bilden Pyocine oder freie Fettsäuren, die ein Milieu (pH-Wert) bilden, welches das Anwachsen fremder Keime verhindert. Probiotika, d.h. apathogene Keime wie Lactobacillus spp. sollen durch Konkurrenz die Adhärenz pathogener Mikroorganismen verhindern. Sie waren jedoch in eigenen Untersuchungen in einem Modellversuch an Gefrierschnitten menschlichen Dünndarms nicht imstande, die Adhärenz pathogener Mikroorganismen wie EHEC oder Salmonella enteritidis zu verhindern. Zwischen Infektion, Erkrankung und asymptomatischem Trägerstatus besteht eine fließende Grenze. Die körpereigene Abwehr steht in einem biologischen Gleichgewicht mit der Virulenz der Erreger, d.h. der Fähigkeit eines Keimes, sich im Körper anzusiedeln und zu vermehren, sowie der Ausprägung der pathogenetischen Fähigkeiten, wie Toxinbildung und Gewebeinvasion. Bei hoher Virulenz des Erregers bedarf es einer starken körpereigenen Abwehr, um den Erreger abzuwehren, bei verminderter körpereigener Abwehr können bereits Keime mit geringer Virulenz oder apathogene Keime, z.B. Keime der körpereigenen Flora, zur Erkrankung führen. Auch das klinische Bild hängt von der Effizienz der körpereigenen Abwehr ab: Bei einem Patienten kann zum Beispiel eine Infektion mit Meningokokken zu einer Meningitis, einer Meningoencephalitis, einer Meningitis mit Sepsis und einer Sepsis ohne Meningitis führen. Er kann aber auch nur an einer Pharyngitis – die sich üblicherweise einer mikrobiologischen Diagnose entzieht – an einer eitrigen Rhinitis, Urethritis oder Cervicitis erkranken. Bei vielen Virusinfektionen, wie z.B. Masern, Varicellen, Hepatitis A und B, sind die Patienten bereits Tage vor dem Auftreten der klinischen Symptome ansteckend. Ist der Patient nach der Ansteckung aber vor Auftreten der klinischen Symptome bereits infektiös, bezeichnet man dies als die Latenzzeit. Den Zeitraum zwischen Ansteckung und Auftreten einer Infektionskrankheit bezeichnet man als Inkubationszeit. Mit der klinischen Heilung erwirbt der Patient einen mehr oder weniger langdauernden Schutz vor einer Neuinfektion. Für eine Reihe von viralen Mikroorganismen besteht ein lebenslanger Infektionsschutz, für andere Virusinfektionen ist die Dauer der Schutzwirkung jedoch bemerkenswert gering: Bei Respiratory Syncytial (RS)-Viren und Rotaviren hält der Schutz nur wenige Monate an. Reinfektionen verlaufen jedoch weniger akut als die Erstinfektion. Bei einem Rezidiv einer Harnwegsinfektion verläuft die Reinfektion klinisch umso weniger akut, je kürzer das Intervall zwischen Infektion und Reinfektion ist. Kein lebenslanger Infektionsschutz besteht bei
Pertussis. Beim Erwachsenen können Infektionen jedoch ohne
die typischen Hustenanfälle Dass ein lebenslanger Infektionsschutz auch nach einer Maserninfektion besteht, kann heute nicht mehr mit Sicherheit angenommen werden. Nachdem serologisch gesicherte Zweiterkrankungen im Jugend- und Erwachsenenalter beobachtet wurden, liegt der Schluss nahe, dass durch eine Wildvirus-Boosterung der Infektionsschutz bei älteren Kindern und Erwachsenen laufend wieder aufgefrischt wurde. Heute, wo Personen keine Boosterung durch erkrankte Kinder erfahren, könnte sich der Infektionsschutz nach Jahrzehnten wiederum abschwächen. Einerseits müsste man diesem Phänomen im Rahmen des Impfplanes für Erwachsene Rechnung tragen. Anderseits besteht aber die Chance, das Masernvirus als ausschließlich humanpathogenes Virus durch eine weltweite Impfkampagne vollständig zu eliminieren. Bei Patienten nach antineoplastischer Therapie bzw. nach Knochenmarktransplantation besteht eine besondere Situation. Bei diesen Patienten ist bei Erreichen der Remission eine Wiederauffrischungsimpfung zuerst mit Tot- bzw. Toxoidimpfstoffen, nach voller Wiederherstellung der humoralen und zellulären körpereigenen Abwehr nach 15 Monaten auch mit attenuierten Lebendimpfstoffen indiziert. Von Erregerpersistenz spricht man, wenn die Keime nach klinischer Besserung oder Heilung überleben. Die Persistenz eines Mikroorganismus im Körper eines asymptomatischen Trägers ist jedoch nicht harmlos, da diese zur Weiterverbreitung eines Keimes beitragen kann. Beispielsweise können Meningokokken bei einer Person lediglich als Besiedler des Nasen-Rachenraums vorliegen, bei einer anderen Person mit einer Verminderung der körpereigenen Abwehr jedoch zur Erkrankung führen. Auf 1 Patienten mit einer invasiven Meningokokkeninfektion kommen mindestens 10 asymptomatische Träger. Ein asymptomatischer Trägerstatus kann auch zum Schaden des individuellen Patienten beitragen. Wir haben beobachtet, dass Säuglinge in einer Kinderkrippe über Wochen mit H. influenzae-Kapseltyp b besiedelt waren und erst im Rahmen eines Virusinfektes an einer invasiven Infektion mit diesem Erreger klinisch erkrankten. |
| Virulenzfaktoren
Die Erforschung pathogenetischer Mechanismen, die den verschiedenen Infektionen zugrunde liegen, hat zu neuen therapeutischen und prophylaktischen Ansätzen bei einzelnen Infektionskrankheiten geführt. Zwei Kategorien von Virulenzfaktoren können grob unterschieden werden:
Besiedlung der Haut bzw. Schleimhäute
Die Bedeutung der Adhärenz wurde von Smith und Liggood im Zusammenhang mit der Bildung von Enterotoxinen am Beispiel von enterotoxischen E. coli untersucht. Virulenzfaktoren wie ST- (hitzestabiles Enterotoxin) und LT- (hitzelabiles En-terotoxin) Enterotoxin bzw. das für die Adhärenz verantwortliche Colonisationsfaktor-Antigen (CFA), werden durch Plasmide codiert. Wenn gentechnologisch diese Plasmide aus dem Zytoplasma entfernt werden, verliert der Keim die pathogene Eigenschaft im Tiermodell. Beide Faktoren sind gleichwertig in ihrer Bedeutung für die Pathogenität von enterotoxischen E. coli (ETEC). Dasselbe Prinzip gilt auch für die Pathogenität von enterohämorrhagischen E. coli (EHEC) und von zahlreichen anderen Keimen (z.B. Meningokokken, Salmonellen, Gonokokken etc.), dass nämlich Toxinbildung nur in Verbindung mit der Fähigkeit zur spezifischen Adhärenz an Schleimhäuten zu Erkrankung führt. Nicht haftende Stämme sind generell apathogen! Die Adhärenz auf Seiten des Keimes wird durch Fimbrien oder Pili ermöglicht (Abb. 4).
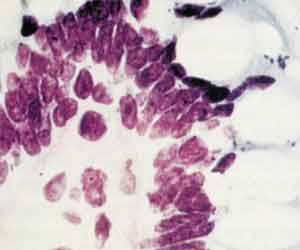
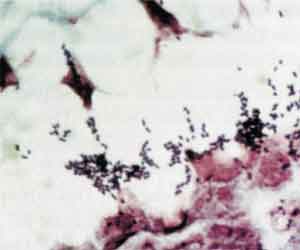
Fimbrien sind artspezifisch in erster Linie für gramnegative Enterobakterien, aber meist Serotyp-übergreifend. Adhärenzstrukturen bestimmter pathogener Keime sind spezifisch für Rezeptoren, z.B. beim Menschen. Andere Keime haften nur an Epithelzellen bestimmter Tierarten: E. coli K88 haften nur an Epithelzellen von Jungferkeln, K99 an Kälbern. Entge-gen der Literatur haben wir jedoch Keime gefunden, die sowohl an Haftstrukturen von Tieren als auch von Menschen adhärieren, wie z.B. O78, der sowohl humanpathogen als auch tierpathogen ist. EHEC sowie Salmonella enteritidis infizieren überwiegend Epithelzellen des terminalen Ileums. Die Keime haften in 10fach niedrigeren Konzentrationen in anderen Etagen des Intestinaltraktes, z.B. im Jejunum, aber auch im Colon. Bisher verwendete Modelle zur Untersuchung der Adhärenz von Keimen stützten sich auf Gewebskulturzellen von immortalisierten Tumorzellen unterschiedlichen Reifegrades. In diesen Modellen war es nicht möglich, diese pathogenetisch relevanten Besonderheiten der Adhärenz zu erfassen. Erst die Untersuchung der Adhärenz an Gefrierschnitten menschlichen Materials ergab eine weiterführende Einsicht (Abb. 5, 6).
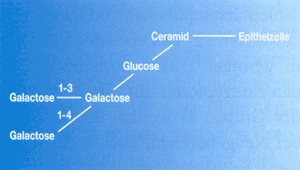
Die Rezeptoren für die Adhärenz von Keimen am Wirtsorganismus bestehen in erster Linie aus Makromolekülen, meist Glykoproteinen an der äußeren Zellmembran, die zur spezifischen Bindung an die Fimbrien der Keime befähigt sind. Fimbrien haften an diesen Kohlenhydratstrukturen, z.B. Tetrasacchariden der Globoserie, mit 3 Molekülen Galaktose (Abb. 7).
Untersuchungen zeigen, dass die Rezeptordichte auf bestimmten Schleimhäuten und in bestimmten Lebensabschnitten unterschiedlich ist. Auch bestehen individuelle Unterschiede der Rezeptordichte, die insofern klinische Relevanz erlangen, als Patienten mit einer hohen Rezeptordichte häufiger an Infektionen erkranken. Patienten mit rezidivierenden Streptokokkeninfektionen (> 3 bewiesene Streptokokkeninfektionen im Jahr) weisen statistisch im Vergleich (Matched-pairs-Technik) eine 5fach höhere Rezeptordichte für Streptokokken an Wangenschleimhautepithelzellen auf. Eine höhere Rezeptordichte an Uroepithelien spielt auch bei rezidivierenden Harnwegsinfektionen eine pathogenetische Rolle. Die Adhärenz von Keimen, z.B. an Uroepithelien, kann in einem In-vitro-Modell untersucht werden. An aus dem Morgenharn gesunder Probanden gewonnener Uroepithelzellen haften normalerweise ca. 4-7 CFU E. coli/Epithelzelle. Bei Patienten mit rezidivierenden Harnwegsinfektionen ohne Abflussbehinderung haften ca. 6-8fach mehr Keime pro Uroepithelzelle. Patienten mit urodynamischen Problemen wie vesikoureteralem Reflux, die trotz einer Antibiotikaprophylaxe häufige Rezidive aufweisen, haben ca. 5fach mehr auf Uroepithelzellen haftende Keime, während auf Uroepithelzellen von Patienten mit Reflux, aber ohne Rezidivneigung, eine „normale“ Adhärenz zu beobachten ist, ähnlich den Keimzahlen auf Epithelzellen von gesunden Probanden. Adhärenzrezeptoren für Streptokokken der Gruppe A sind an Wangenschleimhautepithelien von Kindern in den ersten 12-18 Lebensmonaten nur in geringer Dichte vorhanden, Adhärenzrezeptoren für Streptokokken der Gruppe B werden überwiegend bei Neugeborenen, aber auch in der Genitalschleimhaut präpubertärer Mädchen, kaum jedoch an Wangenschleimhautepithelien von Säuglingen nach dem ersten Trimenon gefunden. Adhärenzrezeptoren für Mycoplasma pneumoniae an terminalen Bronchiolen treten erst ab dem 3. Lebensjahr auf. Deshalb erkranken Patienten erst ab dem Alter von 3-3 1/2 Jahren an einer Mykoplasmen-Pneumonie. Infektionen bei jüngeren Kindern verlaufen klinisch unter dem Bild einer Pharyngitis, Laryngitis oder Bronchitis. Auch andere, für die enge Bindung an die Zelle verantwortliche Haftstrukturen sind neben den Fimbrien, die den Initialkontakt des Keimes mit der Wirtszelle vermitteln, erforscht worden. Es sind dies z.B. die M-Proteine, welche die Penetration eines Keimes in die Epithelzelle und die Motilität vermitteln. Andere Faktoren sind für die Ausbreitung von Keimen auf Schleimhäuten verantwortlich und ermöglichen Keimen, die schützende Schleimschicht zu durchdringen. Zahlreiche pathogene Keime, z.B. Salmonella spp., bilden Invasine, die an Integrinen an basolateralen Oberflächen von intestinalen Epithelzellen binden und so die Invasion der Schleimhaut ermöglichen. Andere Haftstrukturen bestehen für grampositive Kokken: Es sind dies nichtfibrilläre Adhäsine, z.B. das Protein F von Streptococcus pyogenes, mit dem der Keim an Fibronektin der Mundhöhlenschleimhaut adhäriert. Die Fibrillen, haarähnliche Strukturen, scheinen nicht für die Adhärenz verantwortlich zu sein. Die Toxin-Bildung wird häufig durch Plasmide vermittelt. Plasmide sind extrachromosomale DNA-Strukturen in der Bakterienzelle, in denen bestimmte Eigenschaften codiert sind, z.B. die Bildung von Proteinen (Toxinen). Da Plasmide von einem Serotyp auf einen anderen, z.B. durch Sexpili, übertragen werden können, sind diese Virulenzfaktoren nicht an bestimmte Serotypen gebunden. So ist die Bildung von Verotoxin, verantwortlich für das hämolytisch urämische Syndrom bei EHEC, nur zu 50% mit dem Stamm O 157 assoziiert. Auch andere E. coli-Stämme wie O 55 und O 126 können die Bildung von Verotoxin übernehmen. Zu den weiteren pathogenetischen Faktoren von Keimen gehören z.B. Siderophore, die bakteriellen Mikroorganismen Eisenquellen erschließen, welche diese zum besseren Wachstum und zur Bildung von Virulenzfaktoren benötigen. Manche Keime, wie z.B. H. influenzae oder S. pneumoniae, bilden eine Polysaccharid-Schleimkapsel. Bekapselte Stämme von H. influenzae und Pneumokokken sind für invasive Infektionen wie Meningitis, Epiglottitis, Sepsis und Bakteriämie verantwortlich. Durch die Polysaccharidkapsel können sich die Keime gegen Phagozytose schützen, was ihnen einen Überlebensvorteil bietet. Den Wirtsorganismus schädigende Virulenzfaktoren Von diesen Exotoxinen gehen eine Reihe von toxischen Wirkungen aus:
Ein Zytotoxin, das Diphtherietoxin hemmt z.B. die Proteinsynthese der Zelle, indem es die ADP-Phosphoribosylgruppe von NAD abtrennt und so den Elongationsfaktor, den Wachstumsfaktor der Zelle ausschaltet. Bereits ein einziges Molekül des Diphtherietoxins kann eine Zelle zerstören; deshalb gehört dieses Toxin zu den toxischsten Produkten in der Natur. Die Zerstörung von Zellmembranen kann von Exotoxinen bewirkt werden: Das Toxin wird in die Zellmembran eingebaut und eröffnet dort Kanäle, durch die vitale Zellbestandteile verloren gehen. Das alpha-Hämolysin von E. coli öffnet z.B. Kalziumkanäle der glatten Muskulatur der Blase und der Ureteren. Es kommt durch den Kalziumverlust initial zu heftigen Kontraktionen der glatten Muskelzelle – klinisch als Tenesmen der Blasenmuskulatur erkennbar. In weiterer Folge führt das alpha-Hämolysin durch Lähmung der glatten Muskelzelle zur Ureteratonie und Detrusorschwäche mit inkompletter Entleerung der Blase und Restharnbildung. In der Schwangerschaft führt dieses Toxin bei Harnwegsinfektionen durch E. coli zu vorzeitigen Kontraktionen des Uterus, wodurch eine erhebliche Zunahme des Risikos einer Frühgeburt entsteht. Ein anderer Mechanismus der Membranschädigung ist die Bildung von Phospholipasen der Zellmembran, die eine Zelllyse bewirken. Da die meisten Zellen Phospholipide in der Zellmembran enthalten, wirken diese Phospholipasen auf zahlreiche Zellen zytotoxisch. Am besten bekannt sind Hämolysine. Bei Harnwegsinfektionen besteht ein weiterer pathogenetischer Faktor darin, dass vorübergehend Hormonrezeptoren blockiert werden. Aldosteronrezeptoren können durch Coli-Toxine blockiert werden, was zu einem vorübergehenden Pseudohypoaldosteronismus mit Hyponatriämie und Hyperkaliämie führt. Auch die ADH-Rezeptoren können durch Coli-Toxine blockiert werden, wodurch es zu einem Pseudodiabetes insipidus oder zu einer distalen/proximalen tubulären Azidose kommen kann. Superantigene führen über einen weiteren Mechanismus zu toxischen Reaktionen: Sie binden in kleinen Mengen an „major histocompatibility complex II“ (MHCII) und an T-Zellrezeptoren und führen zu einer überschießenden Ausschüttung von Interleukin II und Zytokinen mit Gewebsschädigung, Kreislaufzusammenbruch bis hin zum Multiorganversagen. Nahrungsmittelintoxikationen, z.B. durch Staphylokokken-Enterotoxine, sind bekannte weitere Toxinwirkungen. Sie führen im Darm zu einer profusen Flüssigkeits- und Elektrolytsekretion. Ein ähnlicher Mechanismus ist auch beim Cholera-Toxin und beim E. coli hitzelabilen Enterotoxin (LT) beschrieben, das zur maximalen Steigerung normaler Sekretionsmechanismen in den Lieberkühn´schen Krypten ohne Entzündungsreaktion führt. Innerhalb von wenigen Stunden kann ein Patient dadurch bis zu 12-14% des Körpergewichtes verlieren. Schwerste Zeichen der Dehydratation, Azidose und Kreislaufzusammenbruch sind die Folge. Hydrolytische Enzyme, die Gewebe auflösen und so das Vordringen und die Ausbreitung von Bakterien begünstigen, können von bestimmten pathogenen Bakterien produziert werden (z.B. Streptokinase und Streptodornase der Streptokokken, Hyaluronidase der Staphylokokken). Der pathologische Effekt, der von diesen Keimen ausgeht, ist oft schwer von der Gewebszerstörung durch Phagozyten zu unterscheiden. Manche Bakterien provozieren autoimmunologische Phänomene: Bakterielle Proteine, z.B. so genannte „Heat-shock-Proteine“, besitzen Epitope, die einen ausreichend großen Unterschied zu Wirtszellen aufweisen, um eine Immunantwort auszulösen, aber doch ähnlich genug sind, dass Antikörper und T-Lymphozyten auch körpereigenes Gewebe angreifen. Funktionelle Störungen körpereigener Funktionen, z.B. durch physiologische Flora, die plötzlich an normalerweise sterilen Stellen auftritt (Fehlbesiedlung), stellen einen wesentlichen, vielfach unterbewerteten Pathomechanismus dar. Dieser Mechanismus spielt bei akuten, besonders aber protrahierten Durchfallerkrankungen eine besondere Rolle. Der Dünndarm ist vom Ligamentum Treitz bis 30 cm vor der Bauhin´schen Klappe steril. Im Rahmen von Virusinfekten oder bei gestörter Peristaltik durch Überlastung des Darmes mit Nahrung (Toleranzüberschreitung) kommt es zur Fehlbesiedlung oberer Dünndarmabschnitte mit normaler (physiologischer) Flora. Diese Flora führt dann zu funktionellen Störungen der Verdauung und Resorption: Normale Flora in Konzentrationen von 3-5 log 10 an normalerweise sterilen Darmabschnitten führt
Überwucherung des Nahrungsbreies mit normaler Flora kann zur Bildung biogener Amine führen, z.B. von Putrescin, Cadaverin etc., die die Resorption von Wasser beeinträchtigen. Ursachen für eine Fehlbesiedlung sind im Wesentlichen gestörte Peristaltik und besondere Adhärenz dieser Mikroorganismen bei Besiedlung von höher liegenden Darmabschnitten. Der Mechanismus der Fehlbesiedlung kann auch bei intensivgepflegten, künstlich beatmeten Patienten entstehen, postoperativ, nach Polytrauma oder bei eingeschränkter körpereigener Abwehr, wenn es zu einer Überwucherung oberer Dünndarmabschnitte mit gramnegativen Enterobakterien kommt. Die mikrobielle Translokation aus dem Intestinaltrakt stellt einen weiteren wesentlichen Pathomechanismus nosokomialer Infektionen (Sepsis, Pneumonie, Harnwegsinfektionen, Durchfallerkrankungen) und des Multiorganversagens bei intensivgepflegten Patienten dar. Bei Störung der intestinalen Epithelzellbarriere, z.B. verursacht durch Minderperfusion bei eingeschränkter Kreislaufsituation wegen großer Blut- und Flüssigkeitsverluste, oder aufgrund verminderter körpereigener Abwehr oder ausgelöst durch Hypoperistaltik, können lebende Mikroorganismen die Epithelzellbarriere überwinden und in Mesenteriallymphknoten und in weiterer Folge in die Blutbahn eindringen. Aber nicht nur lebende, sondern auch abgestorbene Mikroorganismen oder bakterielle Abbauprodukte, wie Bestandteile der Zellwand, penetrieren die Epithelzell-barriere und führen zu Aktivierung von Zytokinen, Leukotrienen und der Komplementkaskade, die zusammen wiederum ihrerseits die Epithelzellbarriere schädigen. Dieses Geschehen wird als Systemic Inflammatory Response Syndrom (SIRS) bezeichnet. In der weiteren Folge kommt es zur Sepsis bzw. Multiorganversagen. Auch anatomische Lücken sowie eine Änderung der bakteriellen Flora begünstigen die mikrobielle Translokation. Die Probleme bei der nosokomialen Sepsis bestehen einerseits in der hohen Morbidität durch das Auftreten multiresistenter Mikroorganismen, die den Einsatz von Breitspektrum-Antibiotika nötig macht, sowie anderseits in einer Letalität von bis zu 50%. Die Antwort auf die neuen Erkenntnisse der Pathomechanismen von SIRS, Sepsis und Multiorganversagen sind therapeutische Optionen in Richtung von Maßnahmen zur Blockierung der bakteriellen Translokation. Als eine einfache und effiziente therapeutische Maßnahme hat sich der frühzeitige Beginn einer enteralen Ernährung in Form von Sondennahrung mit Zugabe von Omega-3-Fettsäuren erwiesen. Damit kann einerseits der Protein-Kalorien-Malnutrition entgegengewirkt und der anabole Stoffwechselstatus gestoppt werden, anderseits eine mechanische „Waschfunktion“ oberer Dünndarmabschnitte zur Verhinderung der bakteriellen Translokation erreicht werden. Mit der Zugabe von Arginin und Glutamin zur Sondennahrung wird dem Körper bei der Reparatur der geschädigten Schleimhaut geholfen. Als sehr effiziente Maßnahme zur Verhinderung der bakteriellen Translokation hat sich im Tiermodell (IL-6-knock-out-Mäuse) die Zugabe von Galacturoniden als Rezeptoranaloga zur Blockierung der Anlagerung von Keimen am Darmepithel erwiesen. Diese sauren Di- und Tri-Galakturonide, die in sehr ähnlicher Weise auch in der Muttermilch vorkommen, blockieren bereits in Konzentrationen von 0,1% die Adhärenz zahlreicher pathogener Mikroorganismen an der Schleimhaut. Klinische Studien, die einen Rückgang der nosokomialen Sepsis und des Multiorganversagens durch eine „antimikrobielle“ Sondennahrung zeigen sollen, werden gegenwärtig durchgeführt. Die Blockierung von Effektormolekülen wie z.B. die Verabreichung von monoklonalen Antikörpern gegen TNF, wasserlöslichen TNF-Rezep-toren, IL-1-Rezeptor-Antagonisten, hat hingegen zu keinen sichtbaren therapeutischen Verbesserungen geführt. Pathomechanismen bei viralen Infektionen Mikroskopische Befunde am Epithel sind spärlich: gesehen werden verklumpte Flimmerhärchen bzw. entblößte Zelloberflächen mit zahlreichen adhärierenden Keimen. Eine Entzündungsreaktion geht von geschädigten Zellen des Epithels aus. Diese sezernieren Entzündungsmediatoren, wie Bradykinin, Histamin, Serotonin, Leukotriene und Prostaglandine, die zugleich auch potente vasoaktive Stoffe darstellen. Ein wichtiger Bestandteil der Entzündungsreaktion ist die Erweiterung der Arteriolen durch eine verringerte Aktivität sympathischer, vasokonstriktorischer Nerven im Bereich der Arteriolen und Vasokonstriktion des venösen Abflusses. Dadurch resultiert eine Schwellung venöser Sinusoide, die eine Anschwellung der Nasenschleimhaut bedingt. Außerdem führen diese Mediatorsubstanzen initial zu einem profusen wässrigen Sekret, das innerhalb von 2-3 Tagen durch vermehrte Aktivität der Becherzellen in ein dickes, zähes Sekret übergeht. Dies beruht auf einer durch die Virusinfektion bedingten Verminderung nasaler Enzyme, die das Bradykinin spalten. Das Bradykinin fördert aber auch die Transsudation durch eine Schrankenstörung der Epithelzellbarriere. Gleichzeitig fördern diese Mediatorsubstanzen auch die Entwicklung einer Hyperplasie der Schleimhaut. Die submuköse Schwellung der Nasenschleimhaut führt zu einer Obstruktion physiologischer Öffnungen, die den Abfluss der Nasennebenhöhlen über die mittlere Nasenmuschel beeinträchtigt. Alle diese Faktoren begünstigen durch die profunde Störung der mukoziliären Clearance eine bakterielle Besiedelung und Infektion. Virusinfektionen, z.B. Infektionen mit Herpesviren, Cytomegalieviren, führen zu zytotoxischen Reaktionen auf Epithelzellen der Schleimhäute, der Leberzellen, der Nervenzellen im Gehirn etc. Virusinfektionen von Organtransplantaten, z.B. durch Zytomegalieviren, führen durch Bildung von antigenen Strukturen im Transplantat zur Transplantatabstoßung. |
| Faktoren
der körpereigenen Abwehr
Bereits lange vor der Geburt ist der Körper im Mutterleib dem kontinuierlichen Angriff bakterieller und viraler Mikroorganismen sowie Pilzen ausgesetzt. Zur Abwehr dieser ständigen Bedrohung haben sich phylogenetisch eine Vielzahl von höchst erfolgreichen Abwehrmechanismen entwickelt. Spezifische Abwehr-Mechanismen
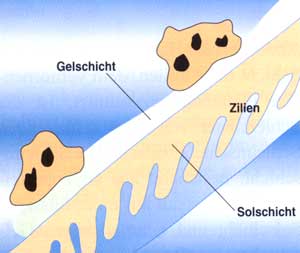
Eine spezifische Immunität wird nach dem Erstkontakt des Organismus mit einem Krankheitserreger erworben. Die aktive Immunität entwickelt sich innerhalb weniger Tage bis Wochen, hält aber, je nach Erreger, über Monate bis Jahre an und zeigt den so genannten Memory-Effekt, der zu einer raschen Neubildung und intensiven Auffrischung von Abwehrmechanismen bei erneutem Kontakt führt. Die Stimulation der aktiven Immunität ist auch durch die meist parenterale Verabreichung von lebenden, mitigierten oder abgetöteten Mikroorganismen bzw. deren Exotoxinen in Form der Impfung möglich. Eine passive Übertragung von Antikörpern der IgG-Klasse erfolgt diaplazentar in den letzten Wochen der Schwangerschaft und spielt beim Neugeborenen eine wichtige Rolle: Diese Übertragung begründet vor allem die humorale Immunität. Durch die Muttermilch werden Antikörper, aber auch aktivierte T-Lymphozyten übertragen. Die parenterale Verabreichung von Immunglobulinen verleiht dem Patienten einen vorübergehenden Schutz, der einige Wochen anhält. Es sind zahlreiche angeborene und erworbene Defekte dieser Abwehrmechanismen beschrieben. Defekte der spezifischen Abwehr führen zu häufigen und oft schweren bis lebensbedrohenden Infektionen. Sie sind für rezidivierende Infekte, d.h. das häufig kranke Kind, jedoch nur in > 2% der Patienten verantwortlich. Defekte der spezifischen körpereigenen Abwehr sind durch Infekte in verschiedenen Organsystemen mit zum Teil unüblichen Keimen, protrahiertem Verlauf und nahezu obligat durch Gedeihstörung gekennzeichnet. Von besonderer Bedeutung für rezidivierende Infekte im Kindesalter ist die unspezifische Mukosa-assoziierte Immunität, das Mukosa-assoziierte Lymphatische Gewebe (MALT) und die erst kürzlich entdeckte angeborene Abwehr. Unspezifische Abwehr Mechanische Barriere- und Klärfunktion Anders als die Haut, die sich mit einer Schicht
toter Zellen, dem verhornenden Plattenepithel schützt, ist
die Schleimhaut von einer schützenden Schleimschicht bedeckt.
Die Schleimschicht, bestehend aus Glykoproteinen, ist aufgebaut
aus einer flüssigen Solschicht und einer viskösen Gelschicht,
in der Mikroorganismen gefangen werden. Das Flimmerepithel und die
darauf wie ein Teppich liegende Schleimschicht transportieren ständig
die abgelagerten Staub-Partikelchen, Viren, Bakterien, Pilze und
Antigene (z.B. Allergene) nach außen. Die Flimmerhaare (Zilien)
schlagen mit einer Frequenz von ca. 3-5 Schlägen pro Sekunde
und bewegen die Schleimschicht in einer Minute ca.
Zwei Schutzmechanismen der Nase bzw. der oberen Bronchialschleimhaut kennt jeder: Physikalische und chemische Reize der sensorischen Nerven der Nase lösen eine heftige wässrige Sekretion aus. Reizende Stoffe werden auf diese Art von der Nasenschleimhaut gespült. Wenn Schleimhautepithelzellen mit bakteriellen oder viralen Mikroorganismen besiedelt sind, kommt es zu einer Abstoßung der gesamten Zelle inklusive der anhaftenden Organismen. Durch den Niesreflex oder Hustenreflex werden reizende Stoffe, Bakterien und Epithelzellen ausgeschleudert. Eine reguläre Belüftung der Schleimhäute und ein ungehinderter Sekretfluss sind daher notwendigerweise wesentliche Faktoren der unspezifischen Abwehr. Durch eine Vergrößerung der Rachenmandeln kann es zu einer gestörten Belüftung der Nasenschleimhaut mit einer persistierenden chronischen Infektion der Nasenschleimhäute und der angrenzenden Strukturen (Nasennebenhöhlen) kommen. In ähnlicher Weise wie bei der mukoziliären Clearance der Atemwegsschleimhaut ist eine reguläre Peristaltik des Intestinaltrakts zur Verhinderung von Stase und damit der Fehlbesiedlung oberer normaler steriler Dünndarmabschnitte wesentlich. Im Harntrakt ist die restharnfreie Entleerung zur Verhinderung von Infektionsrezidiven von entscheidender Bedeutung. Sie ist bei vesikoureteralem Reflux, aber auch bei Detrusorschwäche bzw. Harnröhrenklappen oder Engstellen beeinträchtigt. An der Oberfläche wirksame antimikrobielle
Substanzen Auch intestinale Enzyme, wie Pankreasenzyme und Gallensäuren, besitzen antimikrobielle Wirksamkeit. Von Gallensäuren wissen wir, dass sie die äußerste Hülle der Rotaviren angreifen, dadurch sind diese Mikroorganismen nicht mehr imstande, an der Schleimhaut zu adhärieren und sind dadurch im Stuhl weniger infektiös als im Nasensekret. Voll infektionstüchtige Rotaviren werden überwiegend im Nasen-Rachen-Sekret ausgeschieden und als Tröpfcheninfektion weiterverbreitet. Der Schleim enthält auch Sekretions-IgA, das vorwiegend gegen Oberflächenstrukturen von Keimen gerichtet ist und ebenso die Adhärenz von Keimen an Epithelzellen blockiert. Die Mukosaimmunität INF-beta, TNF-alpha oder NO (Stickstoff-Monoxyd), die durch die Epithelzelle gebildet werden, kommen dabei als bakterizide Substanzen in Frage. Svenson konnte in Uroepithelzellen und in Bronchialepithelzellen die Induktion von Zytokinen nach Bindung von MR(p)-Fimbrien an den Glykolipidrezeptor zeigen. Dies veranlasst die Epithelzelle zur Bildung von IL-6 und IL-8. Verstärkt wird die von der E. coli-Adhärenz induzierte Epithelzellaktivierung durch lokal sezernierte Prostaglandine. Im flüchtigen Radikal NO kann die bakteriotoxische Eigenschaft vermutet werden. Sie ist in Makrophagen und Monozyten bereits als humoraler Abwehrmechanismus gegenüber intrazellulär gelegenen Bakterien und Tumorzellen nachgewiesen worden. Im Tiermodell wurde bei alveolären Makrophagen NO im Zusammenhang mit der natürlichen Abwehrfunktion gegenüber Klebsiellen in der Lunge nachgewiesen. Auch bei Infektion mit Salmonella typhimurium konnte die antimikrobielle Bedeutung des von Epithelzellen gebildeten NO gezeigt werden. Weitere antimikrobielle Peptide sind ebenfalls in Betracht zu ziehen. Defensine sind kleinmolekulare Proteine mit einem Molekulargewicht von ca. 5.000 Dalton, die aus 38-42 Aminosäuren zusammengesetzt sind. Sie bohren Poren in die Zellwand und lösen damit eine Kolliquationsnekrose aus. Die Exkretion von beta-Defensin aus Epithelzellen der Trachea und Bronchien nach Adhärenz bakterieller Mikroorganismen bzw. Kontakt mit LPS konnte nachgewiesen werden. beta-Defensin besitzt antimikrobielle Aktivität gegen ein breites Spektrum bakterieller und viraler Mikroorganismen sowie Pilze. Die Wirksamkeit besteht aber nur gegen ein kleines Inokulum (< 2-3 Keime/Epithelzelle). Alle diese Untersuchungen zeigen, dass Mukosazellen neben ihrer Barrierefunktion auch antibakterielle Fähigkeiten besitzen, ähnlich den alveolären Makrophagen. Diese Schutzfunktion wird als unspezifische Mukosaimmunität bezeichnet. Mukosaepithelzellen der „inneren“ Grenzfläche sind an der Kontrolle der bakteriellen Besiedlung beteiligt. Dieses Prinzip eignet sich aber in erster Linie zur Regulierung der Besiedlung durch schwach virulente Erreger und niedrige Keimzahlen, die kommensal im Oropharynx bzw. bei Tröpfcheninfektion, im Gastrointestinaltrakt und im Urogenitaltrakt vorkommen. Zur Abwehr hochvirulenter Pathogene sind unspezifisch gerichtete Defensine wahrscheinlich zu schwach. Die natürliche, angeborene Immunität Mikrobielle Strukturen, die durch das natürliche Immunsystem erkannt werden, haben ein generelles Molekülmuster, das keine Variabilität im Rahmen der Antigenvariabilität aufweist. Diese Strukturen bestehen überwiegend aus Kohlenhydraten, die essentiell für pathogene mikrobielle Zellfunktionen sind und sich absolut von den Kohlenhydraten in der Zellwand von Eukaryonten unterscheiden. Sie werden als pathogen assoziierte Molekularmuster (PAMPs - pathogen associated molecular patterns) bezeichnet und umfassen die Lipopolysaccharide gramnegativer Bakterien und Lipoteichonsäure grampositiver Keime oder die doppelsträngige RNA vieler RNA-Viren. Der infizierte Wirtsorganismus verfügt über Abwehrzellen, die eine Reihe von Rezeptormolekülen besitzen. Diese erkennen die PAMPs und leiten daraufhin eine rasche Abwehrreaktion des spezifischen Immunsystems ein. Die Erkennungsmoleküle weisen eine breite Spezifität auf, sind im Bronchialtrakt und Gastrointestinaltrakt positioniert und werden als Pattern recognition receptors (PRR) bezeichnet (Medzhitov). Das Mannose-bindende Lectin (MBL) ist ein spezielles, besonders vielseitiges Molekül der natürlichen Abwehr. Es weist funktionelle Analogie zu IgM, IgG und C1q auf und wirkt als Art Universalantikörper, induziert als Opsonin die Phagozytose und stimuliert den klassischen Weg der Komplementaktivierung. Das natürliche und angeborene Abwehrsystem ist zusammen mit den unspezifischen mechanischen Klärfunktionen sehr effizient und vernichtet wahrscheinlich die Mehr-heit der Infektionserreger an der Epitheloberfläche, bevor das spezifische Immunsystem auf den Plan gerufen wird. Häufig wird eine intakte Flora als wesentlicher Bestandteil der körpereigenen Abwehr in ihrer Bedeutung unterschätzt. Keime, die an Oberflächen haften, sind in permanenter Kompetition um Nahrungsstoffe. Zahlreiche Bakterien sind auch imstande, Bakteriozine und Pyocine zu bilden, die das Wachstum anderer Keimspezies unterdrücken. Eine stabile Flora unterdrückt z.B. das Anwachsen potentiell pathogener Mikroorganismen. Bei Destabilisierung der Flora durch Antibiotika können fremde Keime leichter Schleimhäute kolonisieren. Beispiel ist die Infektion/Besiedlung des Intestinaltraktes mit Salmonella enteritidis. Untersuchungen konnten zeigen, dass mehr als 106 Keime von Salmonella enteritidis nötig sind, um eine Infektion hervorzurufen. Wenn man unspezifisch die Intestinalflora z.B. durch parenterale Gabe eines Aminoglykosids stört, sind bereits 1.000 Keime für eine Infektion ausreichend. Klinische Relevanz bei der unkritischen Gabe eines Antibiotikums bei der Behandlung eines Virusinfektes: Durch die Gabe eines Antibiotikums kann oft die bakterielle Superinfektion nicht verhindert werden. Die Infektion findet dann möglicherweise 1-2 Tage später mit einem auf das verabreichte Antibiotikum resistenten Keim statt. Die Gabe des Antibiotikums kann den klinischen Krankheitsverlauf verschleiern und evtl. zu einer chronisch schwelenden Infektion Anlass geben. Ob die Verabreichung von Probiotika, d.h. apathogenen Bakterienkulturen, imstande ist, eine Besiedelung des Intestinaltraktes mit pathogenen Mikroorganismen zu verhindern, ist nicht zweifelsfrei belegt. Lactobacillus acidophilus zeigt eine langsame Proliferation über 48 Stunden, benötigt ein spezielles Nährmedium und proliferiert am besten bei Zimmertemperatur. Um die entsprechenden Plätze an der Darmschleimhaut zu besetzen, sind unphysiologisch große Mengen nötig. In eigenen Untersuchungen konnten wir feststellen, dass die Besiedelung des terminalen Ileums mit Lactobacillus acidophilus nicht imstande ist, die gleichzeitige oder nachfolgende Besiedelung mit EHEC, ETEC und Salmonella enteritidis zu verhindern (Abb. 9).
Störung der unspezifischen Abwehr Durch Viren (vor allem durch RS-Viren) infizierte Epithelzellen sind leichter bakteriell besiedelbar. Durch eine vermehrte Expression von Adhärenzstrukturen an der Oberfläche von Epithelzellen beobachten wir als weiteres Phänomen, dass diese Epithelzellen mit 50-100fach höheren Keimzahlen besiedelt werden als nicht virusinfizierte Epithelzellen. Die gesteigerte Besiedelbarkeit von Schleimhäuten normalisiert sich erst allmählich über 4-6 Wochen (Abb. 10).
Der Pathomechanismus von Virusinfekten führt über Mediatoren (Interleukine, LT, PAF, Thromboxan) zu einer Zunahme des arteriellen Zuflusses in die Submukosa und zum Verschluss des venösen Abflusses. Die Folge ist die Schwellung des submukösen Venenplexus. Das bekannte klinische Korrelat für diese pathophysiologischen Vorgänge ist die beim Schnupfen verstopfte Nase, der Verschluss des Eingangs in die Kieferhöhle/Siebbeinzelle, der Verschluss der Eustachischen Tube oder des Ductus lacrimalis. Sekret kann nicht abfließen – liegen gebliebenes Sekret bzw. ein Sekretstau wird bakteriell superinfiziert. Die mukoziliäre Clearance der Schleimhaut der Eustachischen Tube ist durch eine Virusinfek-tion für 10-14 Tage gestört. Funktionelle Störungen der Zilienmotilität (immotiles Zilien-Syndrom) können angeboren sein. Die Bildung eines zähflüssigen Schleimes (z.B. bei Mukoviszidose), sowie die Störung der Belüftung der Nasen-Rachen-Schleimhaut (z.B. durch vergrößerte, obstruktive Rachenmandeln) führen zur gesteigerten bakteriellen Besiedelung der Schleimhäute des Respirationstraktes. Die Verlegung des nasalen Ausgangs des Ductus nasolacrimalis entweder durch eine hyperplastische Schleimhaut oder eine anatomische Fehlbildung, wie einem knöchernen Sporn, führt zu Abflussbehinderung der Tränen und einer Infektion des Tränensackes. Weitere anatomische Veränderungen im Respirationstrakt, wie eine Deviation der Nasenscheidewand oder ein zu langer Processus uncinatus, führen zur Abflussbehinderung des Sekretes aus der Kieferhöhle und den Siebbeinzellen. Dies alles sind Ursachen für chronische und/oder rezidivierende Infektionen. Eine nicht restharnfreie Entleerung der Blase im Rahmen eines vesiko-ureteralen Refluxes, einer hinteren Harnröhrenklappe oder einer Detrusorschwäche führt zu rezidivierenden Harnwegsinfektionen. Experimentelle Untersuchungen in der Klinik sprechen dafür, dass für rezidivierende Infekte auch eine angeborene Störung der Mukosaimmunität und/oder eine verzögerte, verminderte oder fehlende Bildung von lokalen antimikrobiellen Substanzen in Oberflächensekreten wie beta-Defensin verantwortlich ist. Patienten mit vollkommenem Fehlen der Mukosaimmunität, z.B. Fehlen der Bildung von beta-Defensin, wurden beobachtet und mit dem Auftreten z.B. rezidivierender Harnwegsinfektionen trotz normaler Abflussverhältnisse korreliert. Ob eine zeitlich verzögerte Bildung von beta-Defensin zu einer verminderten Mukosaimmunität führt, wird gegenwärtig untersucht: Da beta-Defensin nur gegen ein kleines Inokulum wirkt, kann eine Proliferation von Keimen an Epithelzellen dieses sensible System überfordern. Das häufig kranke Kind
Selten sind Störungen der spezifischen Abwehr, z.B. eine angeborene Agammaglobulinämie, eine transitorische Hypogammaglobulinämie, ein selektiver IgA-Mangel, die Ursache für akute oder rezidivierende Atemwegsinfektionen. IgA-Proteasen, die von der Mehrzahl bakterieller Mikroorganismen auch in unseren Breiten gebildet werden, führen bei dieser hohen Besiedlungsrate zudem zur Ausschaltung der lokalen Immunität (IgA-Proteasen-Bildung durch H. influenzae 80%, Pneumokokken 100%, M. catarrhalis und Staphylokokken 30%). Diagnostische Hinweise Die Dokumentation der humoralen Immunität durch Bestimmung der Serum-Antikörper einschließlich der IgG-Subklassen, des Sekretions-IgA und des IgE-Spiegels ist auch dann indiziert, wenn klinisch bereits der Verdacht auf ein Antikörpermangelsyndrom erhärtet oder ausgeräumt werden kann. Bei rezidivierenden Infektionen der oberen Luftwege (chronische Sinusitis, Otitis media) ergibt die Darstellung der Strukturen des Mittelgesichtes durch ein CT mit besonderer Signalgebung (Knochenfenster) wesentliche Hinweise z.B. auf eine Abflussbehinderung aus den Kieferhöhlen, eine Belüftungsstörung der Mastoidzellen oder des Vorliegen eines Cholesteatoms. Therapeutische Hinweise Bei einer angeborenen Immundefizienz sowie bei einer transitorischen Hypogammaglobulinämie bzw. bei einem IgG-Subklassendefekt (IgG2- oder IgG4-Mangel), kann als passive Immunprophylaxe versuchsweise Immunglobulin 3- bis 4-wöchentlich über 6 Monate gegeben werden. Danach sollte ein Auslassversuch über wiederum 6 Monate mit Registrierung aller Infektionen vorgenommen werden. Das weitere Vorgehen ist dann von dem Ergebnis abhängig zu machen. Gegen die meisten Atemwegsinfektionen gibt es keine Impfungen. Impfung schützt nur gegen eine Infektion mit Influenza-Viren der Typen A und B. Die Hib-Impfung verhindert die Epiglottitis. Für die Vermeidung von Komplikationen bei Atemwegsinfektionen ist die Hib-Impfung jedoch nur in einem kleinen Prozentsatz wirksam, da Infektionen der Luftwege meist durch nicht bekapselte Stämme von H. influenzae verursacht werden. Die Verabreichung von Bakterienlysaten ist nach wie vor nicht allgemein akzeptiert. Der klinische Effekt der oralen Verabreichung von abgetöteten bakteriellen Mikroorganismen (Luivac, Broncho-Vaxom) als eine Art orale/lokale Immunisierung ist jedoch in klinischen Untersuchungen, die nach GCP-Standards durchgeführt wurden, bei mehreren 1.000 Patienten bewiesen. Es ist gegenüber einer Placebogabe bei mehr als 50% der Patienten ein statistisch signifikanter Rückgang der Zahl und Schwere von Infekten zu verzeichnen. Eigene Untersuchungen ergaben, dass durch die orale Verabreichung dieser Präparate Sekretions-IgA-Antikörper gegen Oberflächenstrukturen von Keimen im Speichel und im Nasensekret induziert werden, welche die Adhärenz von Keimen an Epithelzellen und die Besiedelbarkeit von Schleimhäuten blockieren. Es gibt Hinweise darauf, dass die Verabreichung von Bakterienlysaten auch zur Verbesserung der Mukosaimmunität der Schleimhaut führt, indem die Bildung von beta-Defensin aus Epithelzellen induziert wird. In den Bakterienlysaten sind auch Kohlenhydratstrukturen (PAMPs) aus der Zellwand bakterieller Mikroorganismen enthalten, die im Rahmen der natürlichen angeborenen Immunität die spezifische Abwehrfunktion stimulieren. Die Wirkung weiterer Immunstimulanzien pflanzlicher Herkunft ist sowohl experimentell als auch durch klinische Studien nicht ausreichend geklärt. Die Behandlung anatomischer Defekte erfolgt chirurgisch durch Korrektur des Defektes. |
| Fieber
- Pathogenese und Behandlung
Fieber ist eine zentral ausgelöste Erhöhung der Körpertemperatur bzw. eine Temperaturregulationsstörung, die meist als Begleitsymptom einer Reihe von Infektionskrankheiten auftritt, aber auch durch mangelnde Flüssigkeitszufuhr als Durstfieber entstehen kann. Beim Säugling und Kleinkind spricht man von Fieber, wenn die Temperatur anhaltend über 38,5°C, beim älteren Kind und Erwachsenen > 38°C liegt. Darunter liegende Werte werden jeweils als subfebrile Temperatur bezeichnet. Ein zirkadianer Rhythmus kennzeichnet die Regeltemperatur, die üblicherweise in den frühen Abendstunden am höchsten ist. Bei Fieber ist der zirkadiane Rhythmus meist aufgehoben, er kann aber auch verstärkt sein, d.h. bei einer Fieberkontinua ist die Körpertemperatur am späten Nachmittag und frühen Abend am höchsten. Das Thermoregulationszentrum im Hypothalamus spielt eine zentrale Rolle in der Temperaturregulation. Zellen des Immunsystems können Zytokine freisetzen, die zu einer Erhöhung der Regeltemperatur führen. Auch Pyrogene der Zellwand bakterieller Mikroorganismen wie Peptidoglykane führen zu einer plötzlichen Temperaturerhöhung. Muskelzittern, Schüttelfrost, Vasokonstriktion, Piloerektion sind mit dem Anstieg der Körpertemperatur verbunden. Im Anschluss an Infektionen der Luftwege bzw. nach Abklingen einer Epstein-Barr-Virusinfektion wird die postinfektiöse Hyperthermie (+ 0,5°C Regeltemperatur) beobachtet. Sie besteht in einer monatelang andauernden Hyperthermie, die jedoch einen zirkadianen Rhythmus aufweist. Gegen infektiöses Fieber sprechen die fehlenden Akut-Phase-Proteine und die normale Blutsenkungsgeschwindigkeit. Beim zerebralen Fieber, z.B. nach Hirnblutungen oder Encephalitis, ist die Ursache weniger eine vermehrte Wärmebildung als eine zentrale Fehlsteuerung und eine dadurch verminderte Wärmeabgabe. Auch das Durstfieber beruht auf einer verminderten Wärmeabgabe und ist dadurch gekennzeichnet, dass das Fiebermaximum in die frühen Morgenstunden fällt, wenn die letzte Wasserzufuhr lange Zeit zurückliegt. Bei Früh- und Neugeborenen kann eine ungenügende Wärmegeneration durch Einschränkung der Kreislaufsituation im septischen Schock anstelle des Fiebers zu Hypothermie führen. Früh- und Neugeborene mit Fieber oder Untertemperatur sind grundsätzlich stationär einzuweisen, da eine Temperaturerhöhung in diesem Lebensalter ein Alarmzeichen einer gravierenden Infektion ist. Bei fehlenden lokalen Entzündungszeichen ist an eine early oder late onset Sepsis, Meningitis oder Harnwegsinfektion zu denken. Eine rektale/axilläre Temperaturdifferenz von > 1°C beobachtet man bei Entzündungsherden im Abdomen, die den Verdacht auf eine akute Appendizitis nahelegen.
Positive Aspekte des Fiebers Eine moderate Erhöhung der Körpertemperatur z.B. bis 39°C steigert die Phagozytose, Lymphozytentransformation und Interferonbildung. Im Tiermodell wird diese Erhöhung der Körpertemperatur mit einer besseren Überlebensrate assoziiert. Negative Aspekte des Fiebers Bei hohem Fieber kommt es zu weiteren neurologischen Manifestationen wie Irritabilität, Delirien und Halluzinationen. Hyperpyrexie über 42°C führt zu Hirnschädigung bzw. verstärkt eine bereits bestehende Schädigung des Gehirns, z.B. im Rahmen einer Meningitis. Fieber – insbesondere der rasche Fieberanstieg – kann zu Fieberkrämpfen führen. 2-4% aller Kinder zwischen dem 9. Lebensmonat und dem 5. Lebensjahr erleiden mindestens eine Episode eines Fieberkrampfes. Krampfanfälle, die länger als 20 Minuten dauern, fokal beginnen und sekundär generalisieren, mit postiktaler Bewusstseinstrübung oder Lähmung einhergehen, die bei Patienten jünger als 6 Monate oder älter als 3 1/2 Jahre sowie bei nicht wesentlich erhöhter Körpertemperatur auftreten, werden als komplizierte Fieberkrämpfe bezeichnet und bedürfen einer sorgfältigen Behandlung und weiteren Abklärung mit bildgebenden Verfahren. Bei pathologischem EEG-Befund spricht man von Krampfanfall (epileptischem Anfall), ausgelöst durch Fieber. Bei fokalen Anfällen ist an eine Herpesenzephalitis zu denken, und wenn diese nicht mit Sicherheit ausgeschlossen werden kann, ist eine Behandlung mit Acyclovir (45 mg/kg KG in 3 Dosen) einzuleiten. Bei Säuglingen und Kleinkindern unter 18 Monaten sollte auch ohne meningeale Reizerscheinungen eine Lumbalpunktion durchgeführt werden. Ein EEG ist in jedem Fall indiziert. Fiebertherapie Fieber als Manifestation schwerer bakterieller
Infektionen Schwere bakterielle Infektionen wie Sepsis, bakterielle Meningitis, Pyelonephritis, Pneumonie bzw. Osteomyelitis und septische Arthritis gehen mit septischen Temperaturen, einer Einschränkung der Kreislaufsituation, toxischem Ikterus, Verbrauchskoagulopathie und Hyperpyrexie einher und weisen insbesondere bei immunsupprimierten Patienten sowie Früh- und Neugeborenen eine signifikante Mortalität auf. Für den Kinderarzt ist Fieber eines der häufigsten Symptome.
Alter < 3 Monate Bei Neugeborenen und Säuglingen < 1 Monat kann es sich um eine schwere lebensbedrohliche bakterielle oder virale Infektion handeln, aber auch eine „late onset“ Sepsis/Meningitis durch Streptokokken der Gruppe B. Eine E. coli-, Listerien- und Herpes simplex-Infektion führt in dieser Altersgruppe ebenso zu hohem Fieber. Differentialdiagnostisch kommen in diesem Alter bei Fieber ohne fokale Entzündungszeichen in Frage:
Alter > 3 Monate bis 2. Lebensjahr
Auch verschiedene Intoxikationen, z.B. Botulismus, verlaufen mit dem Leitsymptom Fieber. Alter > 2 Jahre Fieber mit lokalen Infektionszeichen Fieber bei immuninkompetenten Patienten Bei Asplenie bzw. nach Milzexstirpation sind Streptokokken und Pneumokokken für foudroyante Krankheitsbilder mit hoher Letalität verantwortlich. Bei Agammaglobulinämie sind zahlreiche verschiedene Keime, in erster Linie aber Pneumokokken, H. influenzae, Meningokokken, Staphylokokken, aber auch multiresistente Hospitalkeime und Pilze zu beobachten. Bei Einschränkung der zellulären Abwehr kommen Pilzinfektionen, Infektionen mit Pneumocystis carinii, Bacillus Calmette Guérin oder persistierende Virusinfektionen (Adenoviren, CMV) in Frage. Bei Patienten mit kongenitalen Herzfehlern ist das Risiko einer Endokarditis durch Staphylokokken, Streptococcus viridans und Enterokokken gegeben; Patienten mit liegendem Fremdkörper (zentralvenöse Katheter, liegende Ableitungssysteme) erleiden Infektionen durch Staphylokokken, seltener Enterokokken und kaum durch gramnegative Erreger oder Pilze. Bei neutropenischen Patienten mit Leukämie oder unter antineoplastischer Behandlung sind Keime der Darmflora bzw. multiresistente nosokomiale Keime (Klebsiella pneumoniae, Enterobacter cloacae oder P. aeruginosa) zu isolieren. Diagnostische und therapeutische Hinweise Kulturen von Blut, Harn müssen vor Beginn einer antibiotischen Behandlung abgenommen werden. Die kalkulierte Antibiotikatherapie bei einem schwer kranken Patienten mit Hyperpyrexie bzw. bei Patienten mit eingeschränkter körpereigener Abwehr besteht aus einem Cephalosporin der 3. Generation (z.B. Cefotaxim) und einem Aminoglykosid. Anstelle dieser Kombinationstherapie kann man auch Imipenem/Cilastatin oder Meropenem als Monotherapie verabreichen. Patienten mit einer Gesamtleukozytenzahl über 25.000 oder unter 2.500 und einem CRP-Wert > 100 mg/l gehören bei schweren bakteriellen Infektionen zur höchsten Risikogruppe. Fieber unklarer Genese (FUO)
Deshalb ist eine frühzeitige Diagnose so wichtig, die auf klinischen Verdachtsmomenten beruht und innerhalb von 3-4 Tagen die Diagnose nahe legt. Sie besteht – neben dem unklaren Fieber – in einer generalisierten Lymphadenopathie, wobei die Kieferwinkellymphknoten stärker betroffen sind. Weiterhin fallen besonders Lacklippen, eine Himbeerzunge und ein Enanthem ins Auge. Hautmanifestationen bestehen in einem scarlatiniformen Exanthem am Stamm und einem Palmarerythem. Das Blutbild zeigt eine Leukozytose mit Linksverschiebung, eine Thrombozytose, ein erhöhtes CRP und eine beschleunigte Senkungsgeschwindigkeit. Der Rachenabstrich auf Streptokokken ist negativ, der AST normal. Hautabschilferungen der Finger und Zehen treten erst nach 2-3 Wochen auf. Auch die systemische Form der juvenilen rheumatoiden Arthritis (Morbus Still) manifestiert sich mit einer Kontinua oder remittierendem Fieber über Wochen ohne lokale Entzündungsreaktion. Unter den hereditären Erkrankungen mit Fieber sind die anhidrotische ektodermale Dysplasie, die Dysautonomia Riley Day und der Diabetes insipidus, deren Gemeinsamkeit eine Schwierigkeit der Temperaturregulation durch Probleme der Flüssigkeitsbilanzierung ist, sowie das hereditäre Mittelmeerfieber zu nennen. Entzündliche Darmerkrankungen wie der M. Crohn manifestieren sich mit protrahiertem Fieber, allerdings auch mit schweren lokalen Entzündungsreaktionen wie Bauchschmerzen und Durchfall mit blutigen Stühlen.
Praktisches Vorgehen bei FUO
Die laborchemische Abklärung muss sorgfältig geplant werden. Ein ungezielter serologischer Rundumschlag ist, wie auch eine längere stationäre Aufnahme, teuer, und die Möglichkeit einer spezifischen Diagnose ist gering. Wertvolle Hinweise kann aber bereits das Blutbild mit Differentialblutbild und die BKS liefern:
Blutkulturen (aerobe und anaerobe) müssen mehrfach angelegt werden, um eine Endokarditis oder einen tief sitzenden Abszess zu diagnostizieren. Je nach Anamnese und Verdachtsdiagnose ist auch eine Isolierung auf Spezialnährmedien notwendig. Anlegen von Harnkulturen, Aspirationsmaterial aus der Lunge durch broncho-alveoläre Lavage bringt repräsentative Proben, die mit entsprechenden Färbungen (Gram, Ziehl-Nielsen) rasch beurteilt werden können. Tuberkulin-Hauttestung (nach Mendel-Mantoux) in einer Verdünnung von 1:10 muss routinemäßig durchgeführt werden. Um eine Anergie auszuschließen, kann die Tuberkulintestung auch in Form des Multitest Mérieux mit 5 weiteren Antigenen einschließlich Candida albicans durchgeführt werden. Serologische Tests werden entsprechend einer Verdachtsdiagnose, die sich aus der Anamnese, der physikalischen Untersuchung und dem Verlauf ergibt, durchgeführt. Röntgenuntersuchungen der Lunge in 2 Ebenen und der Nasennebenhöhlen sind indiziert. Mit szintigraphischen Untersuchungen mit Gallium, das Leukozyten markiert, oder Technetiumphosphat, das Osteoklasten markiert, kann man einen okkulten Infektionsherd sichtbar machen. Mit der Sonographie können Abszesse im Bauchraum (Douglas, subphrenisch) nachgewiesen werden. Die Diagnostik des FUO ist schwierig und bedarf der gründlichen, meist stationären Abklärung. Vermieden werden sollte vor allem eine zu schnelle empirische Antibiotikabehandlung, da diese einen Infektionsherd verschleiern kann und den Zeitraum bis zur Stellung einer spezifischen Diagnose verzögert. Die Behandlung erfolgt entsprechend der spezifischen ätiologischen Diagnose. |
| Probleme
der mikrobiologischen Diagnostik
Eine Reihe von Bedingungen sind zu erfüllen, um aussagekräftige Befunde bei einer mikrobiologischen Untersuchung zu erhalten. Diese sind in bestimmten Lebensabschnitten im Kindesalter jedoch schwerer als bei Erwachsenen zu erreichen. Möglichst gezielt mit einem Schmalspektrum-Antibiotikum zu behandeln lautet einer der Grundsätze einer antimikrobiellen Therapie. Voraussetzung dafür ist ein Keimnachweis und das Ergebnis der Resistenzprüfung. Probleme bei der Gewinnung von Proben Sputum Gelenksflüssigkeit Probenvolumina Bei älteren Kindern und Jugendlichen ist die Ausbeute u.U. mit 10-20% positiven Befunden gering. Untersuchungen haben gezeigt, dass sogar bei Früh- und Neugeborenen, bei denen die Keimzahlen höher sind als im Erwachsenenalter, trotz optimaler Bedingungen bei Probengewinnung und Kultur nur bei 25% der Patienten mit Verdacht auf Sepsis ein Keim isoliert werden kann. Es ist daher notwendig, bei dringendem Verdacht mehrere Kulturen im Abstand von 20 Minuten zu entnehmen. Die Blutmenge beträgt bei Neugeborenen 0,5-1 ml, bei älteren Kindern bis 5 ml. Meist wird routinemäßig je eine Blutkulturflasche für Aerobier und eine für Anaerobier beimpft. Bei intraabdominalen Infektionsherden und Verdacht auf Endokarditis muss auf jeden Fall eine aerobe und anaerobe Blutkultur angelegt werden. Es ist wichtig, dass Blutkulturflaschen nicht gekühlt werden dürfen, sondern – notfalls bei Zimmertemperatur – bebrütet werden, da vor allem Pneumokokken, Meningokokken und H. influenzae rasch absterben. Wichtig ist bei bestimmten Indikationen z.B. Kathetersepsis eine quantitative Blutkultur und der Vergleich der Keimzahlen zwischen der durch den kontaminierten Katheter abgenommenen Kultur und einer aus einer peripheren Vene abgenommenen Kultur. Eine Verbesserung der Ergebnisse der Blutkulturen ist mit der Methode der Signalflasche (aufgesetzte Agarplatte) möglich. Die Ausbeute an positiven Befunden ist höher, das Ergebnis liegt 6-8 h früher vor. Kontamination der Proben mit Standortflora Besondere Schwierigkeiten treten bei der Gewinnung von Harnproben auf. Die Gewinnung eines Mittelstrahlharns ist meist erst nach dem 3. Lebensjahr möglich. Der Beutelurin ist immer mit einer gewissen Keimmenge kontaminiert und muss sofort bearbeitet werden, um repräsentative Ergebnisse zu erbringen. Ein Versand eines Beutelurins ist nicht möglich, da sich die Kontaminationskeime bis zur quantitativen Keimzahlbestimmung um das 100-1.000fache vermehrt haben und so einen falsch positiven Befund vortäuschen können. Die Gewinnung des Harns durch Katheterisierung ist wegen des Risikos der Keimverschleppung, die suprapubische Blasenpunktion wegen der Belastung des Patienten nur in Ausnahmen durchzuführen. Wenn in einer Harnprobe mehrere verschiedene Keime isoliert werden, weist dies, mit Ausnahme beim Patienten mit einer neurogenen Blasenentleerungsstörung, auf eine Kontamination hin und ist nicht verwertbar. Ein Ausweg aus diesem Dilemma bietet der Uricult. Dieser kann sofort angelegt werden und gibt einen verlässlichen Hinweis auf die Keimzahl. Nach 8-12 Stunden Bebrütung kann der Uricult zur Identifizierung des Leitkeims und zur Empfindlichkeitsprüfung in ein mikrobiologisches Labor übersandt werden. Kontakt des Probenmaterials (z.B. Blutkulturen)
mit Antibiotika oder Desinfektionsmitteln Zeitspanne bis zur Bearbeitung der Proben Interpretation der Ergebnisse Das Gleiche gilt auch für die Interpretation von Liquorkulturen. Der Nachweis von S. aureus, S. epidermidis oder Enterokokken ist nur bei Vorliegen eines Ventrikel-Ableitungssystems als relevant zu bewerten. Dann aber ist dieser Befund auch ohne deutliche Pleozytose als pathologisch zu bewerten. Schwierig gestaltet sich die Interpretation von Tracheal-Absaugsekreten bei intubierten Patienten. Der Nachweis von Pseudomonas aeruginosa beweist keineswegs das Vorliegen einer Infektion. Es ist möglich, dass auch Frühgeborene unter künstlicher Beatmung mit eingeschränkter körpereigener Abwehr durch P. aeruginosa nur besiedelt sind und zu diesem Zeitpunkt keiner spezifischen Behandlung bedürfen. Die Indikation für eine Behandlung hängt dabei vom klinischen Bild, dem Blutbild, der Blutgasanalyse, dem Röntgenbild bzw. einer Synopsis dieser Befunde ab. Auch bei Patienten mit Mukoviszidose hängt die Interpretation des Sputumbefundes und die Entscheidung für eine antimikrobielle Behandlung von der Klinik ab. Bei diesem Krankheitsbild ist es nötig, quantitative Sputumkulturen anzulegen. Nur dadurch kann man einen evtl. Behandlungserfolg durch einen Rückgang der Keimzahlen im Sputum feststellen. Bei Sputumkulturen besteht noch eine Besonderheit. Während bei bakteriellen Infektionen üblicherweise ein Keim als Ursache in Frage kommt, sind es bei der Mukoviszidose mehrere Keime. So können 3-4 verschiedene Arten von P. aeruginosa mit unterschiedlichen API-Identifizierungen und unterschiedlicher antimikrobieller Empfindlichkeit vorhanden sein. Wenn die Resistenzprüfung auf P. aeruginosa nur mit Testung einer Kolonie durchgeführt wird, kann die Wahl des Antibiotikums nur für einen Teil der Keime relevant sein. Zeitdauer bis zum Vorliegen der Ergebnisse Neue Methoden zur beschleunigten Resistenzprüfung (Vitek-System u.a.) können nach Isolierung des Keimes die Resistenzprüfung auf 4 Stunden verkürzen, werden jedoch bisher noch nicht zur Routine eingesetzt. Alle diese Systeme bedürfen jedoch einer Reinkultur, die 8-24 Stunden benö-tigt. Die Zeitersparnis ist somit nicht gravierend. Schnelltests für eine limitierte Zahl bakterieller und viraler Mikroorganismen stehen seit Jahren zur Verfügung. Der Beginn der Schnelldiagnostik erfolgte durch Nachweis bakterieller Oberflächenantigene gegen Meningokokken, Pneumokokken, H. influenzae und der Streptokokken der Gruppe B mittels Counterimmunelektrophorese aus dem Liquor. Die Sensitivität und Spezifität ist hoch, es bedarf jedoch einer besonderen apparativen Ausstattung. Eine Vereinfachung dieser Methode erfolgte durch die Entwicklung von Latextests, wobei die spezifischen Antikörper auf Latexkügelchen aufgebracht wurden, die bei Vorliegen entsprechender bakterieller Antigene verklumpen und eine Trübung der Lösung bedingen. Ein weiterer wertvoller Schnelltest zur Diagnose einer Tonsillitis ist der Streptokokken-A-Schnelltest, der innerhalb von 5 Minuten ein Ergebnis mit einer Sensitivität und Spezifität von 95% erbringt. Schnelltests zur Virusdiagnostik sind der Rotavirus-Schnelltest und der RS-Schnelltest, die ebenso verlässliche Ergebnisse bringen und die Entscheidung für eine antimikrobielle Therapie zumindest erleichtern. Identifizierung von Keimen durch PCR ist noch zu teuer und bringt keinen wesentlichen Zeitvorsprung, zumal auch keine Empfindlichkeitsprüfung erfolgt. Wenn sich die Entscheidung für eine antimikrobielle Behandlung nicht auf ein Ergebnis der mikrobiologischen Testung und Resistenzprüfung stützen kann, muss man eine kalkulierte, empirische Behandlung beginnen. |
| Resistenzentwicklung
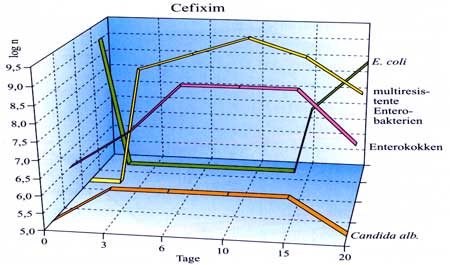
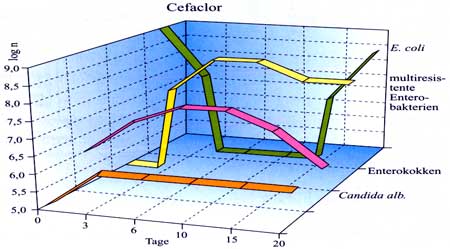
Einleitung Dazu einige Beispiele:
Noch immer besteht in Deutschland und in den skandinavischen Ländern ein wesentlicher Unterschied zwischen der Resistenzentwicklung im Krankenhaus und der im ambulanten Bereich. In Zentraleuropa spielen gegenwärtig beta-Laktamase-bildende, Amoxicillin-unempfindliche H. influenzae und Penicillin-resistente Pneumokokken zum Glück eine untergeordnete Rolle. Streptokokken sind immer, Pneumokokken und H. influenzae in mehr als 95% auf Penicillin bzw. Aminopenicilline empfindlich. Makrolidantibiotika haben im Spektrum gegenwärtig weitgehend die Leitkeime von Infektionen der oberen und unteren Luftwege. Makrolid-resistente Streptococcus pneumoniae und Streptococcus pyogenes nehmen jedoch deutlich zu. In den USA, Südamerika, Südafrika, Südostasien, aber auch in Spanien und Frankreich sind resistente Mikroorganismen, z.B. Leitkeime für Infekte der Luftwege, bereits in den ambulanten Bereich vorgedrungen und sind Ursache für zahlreiche Therapieversager. Bei Patienten, die aus dem Urlaub aus diesen Ländern zurückkommen, ist das zu berücksichtigen. Keime, die bei primären Harnwegsinfektionen isoliert werden, sind weitgehend auf TMP, aber auch auf Aminopenicilline empfindlich. In der anhaltenden Bedrohung durch Infektionskrankheiten ist daher Antibiotikaresistenz ein Schlüsselelement. Die Resistenzentwicklung wird als Konsequenz einer breiten Anwendung jeder Substanzklasse gesehen und unterminiert deren therapeutischen Wert. Weitere Faktoren, die zur Resistenzentwicklung beitragen, sind inadäquate Hygienemaßnahmen bei der Infektionskontrolle im Krankenhaus. Sie begünstigen die Verbreitung dieser multiresistenten Keime. Auch soziologische und bevölkerungskinetische Phänomene wie Urbanisierung und Überbevölkerung begünstigen die Resistenzentwicklung. Der breite Gebrauch und die unkritische Verschreibung von Antibiotika ist Hauptursache für die Entwicklung neuer Resistenzen und macht dadurch die Entwicklung immer neuer Antibiotika notwendig. Diese Spirale dreht sich immer schneller, und es ist in der nahen Zukunft zu erwarten, dass alle bisher zur Verfügung stehenden Präparate wie beta-Laktamantibiotika, Makrolide, Azole und Chinolone in gleichem Maße vulnerabel für die Entwicklung von Resistenzen sind. Das Gleiche gilt auch für antivirale Substanzen, z.B. gegen HIV. Um der rasanten Entwicklung der Resistenz von Mikroorganismen entgegenzutreten, müssen zunächst Ursprung und Mechanismen der Resistenzentwicklung aufgeklärt werden. Weltweit stellt diese Fragestellung eine wissenschaftliche Herausforderung dar, der durch Anstrengungen im Bereich der Epidemiologie, Mikrobiologie, Molekularbiologie und Biochemie begegnet wird. Resistenzmechanismen
Ursprung multipel resistenter Keime Antibiotika wirken nicht nur auf die ätiologisch bedeutsamen Erreger, zu deren Bekämpfung sie eingesetzt werden, sondern auch auf Keime der physiologischen Flora wie Stuhlflora, Flora der Mundhöhle, des Nasen-Rachenraums und der Haut. Daraus resultieren die sog. biologischen Nebenwirkungen wie Selektionsdruck, Erregerwechsel und Wiederbesiedlung von Körperoberflächen mit resistenten Keimen und in letzter Konsequenz die Selektion multipel resistenter Hospitalkeime. Erst in den letzten Jahren wurde deutlich erkannt, dass schwere nosokomiale Infektionen, z.B. beim immunsupprimierten Patienten, als vorwiegend endogene Infektionen aus dem Reservoir der patienteneigenen Flora hervorgehen. Die dabei isolierten Erreger zeichnen sich oft durch ausgeprägte Antibiotikaresistenzen aus, insbesondere wenn Patienten mit mehreren Breitspektrum-Antibiotika vorbehandelt wurden. Aktuelle Untersuchungen haben gezeigt, dass diese apathogenen, aber multiresistenten Keime Resistenzmechanismen auf potentiell pathogene Keime übertragen können. So kann z.B. ein makrolidresistenter Streptococcus mitis/sanguis in Gegenwart von subinhibitorischen Konzentrationen verschiedener Antibiotika die Resistenzmechanismen auf Streptococcus pyogenes übertragen. Obwohl die körpereigene Flora, z.B. die Stuhlflora, mit über 100 Keimarten und Keimzahlen von 109 bis 1012 Keimen/g Faeces, das größte Keimreservoir des Körpers darstellt, wurden die Veränderungen der Darmflora durch Chemotherapie erst spät Gegenstand kontrollierter wissenschaftlicher Untersuchungen. Der dominante Keim der Stuhlflora wird oft als Erreger von Re- bzw. Superinfektionen bei immunsupprimierten Patienten oder bei Patienten mit rezidivierenden Harnwegsinfektionen unter prophylaktischer Gabe von Antibiotika beobachtet. Die Verabreichung von Antibiotika, die zu hohen intraluminalen Wirkstoffkonzentrationen im Darm führen, verursachen eine massive Selektionierung multiresistenter Hospitalkeime. Bei intravenös verabreichten Breitspektrum-Antibiotika ist die hohe biliäre Ausscheidung und beta-Laktamasestabilität (z.B. Ceftriaxon), bei auch oral verabreichten Antibiotika die unvollständige Resorption und Bioverfügbarkeit (z.B. Cefixim und Cefaclor) verantwortlich. Einfluss von Antibiotika auf die körpereigene
Flora Die folgenden Abbildungen zeigen die qualitative und quantitative Veränderung der Stuhlflora unter dem Einfluss der verschiedenen Antibiotika. Cefixim, ein Cephalosporin der 3. Generation
mit breitem Wirkspektrum insbesondere gegen gramnegative Enterobakterien,
wird nur zu 50% absorbiert, 50% der verabreichten Wirkstoffmenge
bleiben unabsorbiert im Darm liegen. Bei einer Dosierung von 8-10
mg/kg KG resultieren Konzentrationen von ca. 100 µg/g Stuhl.
Die Coliflora wird innerhalb von 2 Tagen vollständig eradiziert.
Die Lücke wird durch Überwucherung mit Enterokokken in
Konzentrationen von 10
Ca. 7 Tage nach Absetzen des Antibiotikums kommt es zum Wiederauftreten der Coliflora und über 2-6 Wochen zur Verdrängung der Enterokokken, Candida albicans und auch der multiresistenten Enterobakterien. Eine ähnliche Veränderung der Stuhlflora wurde auch nach Gabe von Cefaclor beobachtet, das zu 85% enteral resorbiert wird. Die nicht absorbierten 15% der Wirksubstanz führen zu einer profunden Veränderung der Stuhlflora (Abb. 12).
Cefpodoximproxetil besitzt als Prodrug im Intestinaltrakt keine antimikrobielle Wirksamkeit, sondern wird erst nach Durchtritt durch die Darmwand aktiviert. Da dieses Präparat auch zu mehr als 90% renal ausgeschieden wird, sind keine antimikrobiellen Wirkstoffkonzentrationen im Stuhl nachzuweisen. Dies ist die Erklärung für die bemerkenswert geringe Veränderung der Intestinalflora nach Gabe dieses Präparates. Cefalexin wird vollständig im Dünndarm resorbiert und hat deshalb keine Änderung der Intestinalflora zur Folge (Abb. 13).
Auch nach Gabe von Cefadroxil wurde keine Beeinflussung der Stuhlflora beobachtet, da auch dieses Präparat vollständig aus dem Intestinaltrakt resorbiert wird. Durch Penicillin wird die Coliflora nicht verändert, deshalb erfolgt auch keine Überwucherung der Intestinalflora mit Enterokokken, Candida albicans oder multiresistenten Enterobakterien (Abb. 14).
Auch Makrolidantibiotika besitzen keine Wirksamkeit auf E. coli, und damit ist keine Änderung der Zusammensetzung und des Resistenzmusters der Darmflora zu beobachten (Abb. 15).
Klinische Konsequenzen aus diesen Untersuchungen resultieren in Reinfektionen mit einem entsprechend der verabreichten Substanz selektierten teil- oder multiresistenten Stamm. Ein Rezidiv eines Harnwegsinfektes, z.B. nach Gabe von Cefixim, erfolgt regelmäßig durch einen multiresistenten Enterobacter cloacae, der nur auf Carbapeneme empfindlich ist. Einfluss der Pharmakokinetik auf die Entwicklung
resistenter Mikroorganismen Baquero kreierte für dieses Phänomen den Begriff des „Selektiven Fensters“ und beschreibt damit den Zeitraum, in dem die Konzentration eines Antibiotikums zwischen MHK und MAK liegt. Wenn dieser Konzentrationsbereich, in dem die bakterizide/bakteriostatische Wirksamkeit nicht mehr ausreicht, der Wirkstoff jedoch trotzdem einen Einfluss auf den Stoffwechsel des Mikroorganismus hat, groß genug ist, haben Antibiotika die Fähigkeit, Resistenzen zu induzieren (Abb. 16).
In weiteren Untersuchungen konnte auch die Übertragung dieses Resistenzmechanismus von apathogenen Streptokokken (Streptococcus salivarius, Streptococcus mitis) auf Streptococcus pyogenes unter subinhibitorischen Konzentrationen beobachtet werden. Der Einfluss der Pharmakokinetik auf Veränderungen der körpereigenen Rachenflora wurde durch den Vergleich von Makrolidantibiotika mit unterschiedlicher Eliminationshalbwertszeit mittels E-Teststreifen bei 180 Patienten untersucht. Ergebnisse der Untersuchungen der Rachenflora 7 der 60 mit Azithromycin behandelten Patienten erlitten innerhalb der Beobachtungsphase eine Reinfektion, wobei neben viralen Infektionen auch bakterielle Infektionen mit makrolidresistenten Keimen (Strep. pneumoniae, Strep. pyogenes, Pseudomonas aeruginosa) gesehen wurden.
Die Beobachtung der ausgeprägten Veränderung der Zusammensetzung und des Resistenzverhaltens der Rachenflora bei Patienten nach Behandlung mit Azithromycin lässt sich durch die extrem lange Gewebeelimination und durch das Auftreten von subinhibitorischen Konzentrationen über mehrere Wochen erklären. Unter diesem Einfluss erklärt sich auch die nachhaltige Störung der Rachenflora und die Besiedelung des Rachenraums durch gramnegative Enterobacteriaceae. Darüber hinaus bietet eine gestörte Rachenflora nicht mehr den notwendigen Schutz gegen das Eindringen von pathogenen Keimen, sodass auch die hohe Reinfektionsrate in der Azithromycin-Gruppe auf diesen Effekt zurückgeführt werden muss. Bei Gabe der anderen Makrolidantibiotika wurde dieses Phänomen nicht beobachtet. Bei 60 Patienten, die Clarithromycin erhielten, wurde nur bei einem Patienten ein Rezidiv einer Sinusitis mit einem makrolidresistenten S. aureus, bei 36 Patienten unter Erythromycin-, Josamycin- oder Roxithromycintherapie wurde bei keinem Patienten ein Rezidiv beobachet. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Literatur beim Verfasser |
| Anschrift
des Verfassers: Univ.-Prof. Dr. J. Peter Guggenbichler Klinik mit Poliklinik der Universität Erlangen-Nürnberg D-91054 Erlangen, Loschgestraße 15 E-Mail: prof.guggenbichler@iname.com |