| Makrolid-Resistenz
bei Streptococcus pyogenes in Österreich: Prävalenz, Phänotypen und Resistenz-Gene |
|
C. Jebelean und H. Mittermayer Einsender und beteiligte Laboratorien |
|
| Schlüsselwörter:
S. pyogenes, Makrolide, Resistenz-Gene, Josamycin |
Zusammenfassung Wir haben die Erythromycin- und Tetrazyklin-Resistenz bei S. pyogenes ab 1994 in Linz periodisch untersucht. In den Jahren 1999 und 2000 weiteten wir diese Untersuchung auf verschiedene Regionen in ganz Österreich aus. Dabei haben wir auch die Phänotypen der Makrolid-Resistenz und die genetischen Determinanten dieser Resistenz bei S. pyogenes näher charakterisiert. Ergebnisse: Bei den Untersuchungen der Stämme aus unserem Einzugsgebiet in Linz fanden wir eine Prävalenz der Erythromycin-Resistenz in den Jahren 1994, 1995, 1996, 1997 und 1998 von 18%, 9%, 12%, 19% und 14% und eine Prävalenz der Tetrazyklin-Resistenz von 8%, 14%, 12%, 5% und 14%. Bei den Untersuchungen an Stämmen, die in den Jahren 1999 und 2000 aus verschiedenen Regionen Österreichs eingesandt wurden, stellten wir eine Prävalenz der Erythromycin-Resistenz von insgesamt 11% und eine Prävalenz der Tetrazyklin-Resistenz von 24% fest. Die Prävalenz der Erythromycin-Resistenz zeigte große regionale Unterschiede: Wir fanden eine hohe Makrolid-Resistenz in Graz (23%), Salzburg (17%) und Feldkirch (17%) und eine niedrige Makrolid-Resistenz in Innsbruck (9%), Linz (7%) und Wien (6%). Bei den 41 Erythromycin-resistenten Stämmen aus der letzten Untersuchung, die wir phänotypisch und genetisch untersucht haben, fanden wir folgende Phänotypen und Gene: einen Stamm mit einem MLSB-Phänotyp und einer Kombination von erm + mef-Genen; 29 Stämme wiesen einen M-Phänotyp und mef-Gene auf; 2 Stämme hatten einen MLSB-Phänotyp und erm-Gene, und bei 9 Stämmen ließen sich ein induzierbarer MLSB-Phänotyp und ermTR-Gene nachweisen. |
Key-words: S. pyogenes, macrolides, resistance genes, Josamycin |
Summary We investigated the erythromycin and tetracycline resistance of S. pyogenes strains isolated in Linz since 1994. During 1999 and 2000 we collected strains from different regions of Austria and investigated the erythromycin and tetracycline resistance. We also determined the phenotype and the genetic determinants of macrolide resistance of the S. pyogenes strains. In the S. pyogenes strains isolated in Linz in 1994, 1995, 1996, 1997 and 1998, we found an erythromycin resistance prevalence of 18%, 9%, 12%, 19% and 14%, respectively, as well as a tetracycline resistance prevalence of 8%, 14%, 12%, 5% and 14%, respectively. The last investigation of strains collected from various regions of Austria in 1999 and 2000 yielded an overall tetracycline resistance prevalence of 24% and an erythromycin resistance prevalence of 11%, respectively. The erythromycin resistance prevalence showed significant variations among the different regions: it was high in Graz (23%), Salzburg (17%) and Feldkirch (17%) and was low in Innsbruck (9%), Linz (7%) and Vienna (6%). In the 41 erythromycin-resistant strains from the last investigation we were able to detect the following phenotypes and genes: 29 strains with M/mef; 2 strains with MLSB/erm; 9 strains with inducible MLSB/ermTR and 1 strain with a MLSB phenotype and a combination of erm + mef genes. |
Einleitung Makrolid-Antibiotika sind eine wichtige therapeutische Alternative in der Therapie der Streptokokkeninfektionen bei Patienten mit einer Allergie gegen Penicillin und andere Betalactam-Antibiotika. Berichte aus mehreren Ländern Europas zeigten in den letzten Jahren einen Anstieg der Makrolid-Resistenz bei den S. pyogenes-Stämmen. Die Makrolid-Resistenz bei Streptokokken beruht hauptsächlich auf zwei Mechanismen: 1. Enzymatische Veränderung des
Angriffspunkts an den Ribosomen, die von einem erm-Gen kodiert
wird. 2. Transport des Makrolids aus
der Zelle, welcher von einem mef-Gen gesteuert wird. |
Material und Methoden Wir haben die Makrolid-Resistenz
der S. pyogenes-Stämme untersucht, die beginnend im Jahr
1994 bis Anfang des Jahres 2000 in unserem Labor in Linz isoliert
wurden.
Diese Bakterien wurden anschließend mit einer Agardilutions-Methode auf Antibiotika-Empfindlichkeit getestet: Davon 244 Stämme auf Clindamycin-, Erythromycin- und Josamycin-, Tetrazyklin-Empfindlichkeit und 145 Stämme auf Clindamycin-, Erythromycin-, Clarithromycin-, Roxithromycin-, Azithromycin- und Josamycin-, Tetrazyklin-Empfindlichkeit. Bei der Agardilutions-Methode nach
NCCLS erfolgt die Testung auf Mueller-Hinton-Agar mit 5% Schafblut-Zusatz,
der mit ansteigenden Konzentrationen der gewählten Antibiotika versetzt
wurde. Der Nachweis des MLSB
oder M-Phänotyps erfolgte mittels Doppel-Blättchen-Test.
Dabei wurden Erythromycin (15 µg)- und Clindamycin (2 µg)-Testblättchen
20 mm voneinander entfernt auf einem mit Streptokokken beimpften
Mueller-Hinton-Blutagar platziert. Die Ablesung der Platten erfolgte
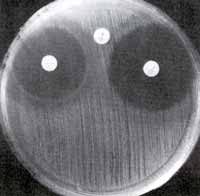
nach 24-48 Stunden Inkubation. Das induzierbare Resistenzmuster
zeigt eine Abflachung des Clindamycin-Hemmhofes in der Nähe des
Erythromycin-Blättchens (Abbildungen 1, 2 und 3). Mit einer PCR-Methode
[5] wurden die für die Makrolid-Resistenz verantwortlichen erm-,
ermTR- und mef-Gene nachgewiesen.
|
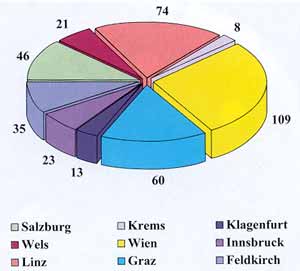
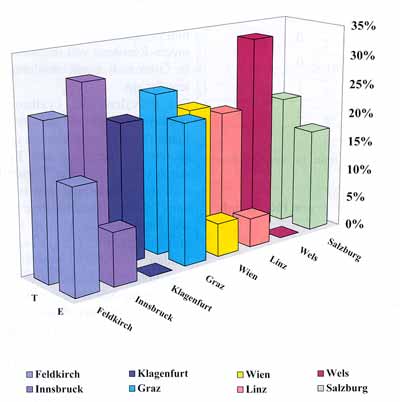
Ergebnisse Prävalenz der Erythromycin- und Tetrazyklin-Resistenz Einzugsgebiet Linz
Einzugsgebiet österreichweit
Graz, Salzburg und Feldkirch wiesen
eine Prävalenz der Makrolid-Resistenz von 23%, 17% und 17% auf,
im Vergleich zu Innsbruck, Linz und Wien, wo wir eine Prävalenz
von 9%, 7% und 6% fanden.
Phänotypen und Makrolid-Resistenz-Gene Bei den 44 Erythromycin-resistenten
Stämmen aus Linz, die wir phänotypisch und genetisch untersucht
haben, fanden wir folgende Phänotypen/Gene: 34 Stämme mit M/mef;
5 mit MLSB/erm; 2 mit induzierbaren
MLSB/ermTR; 2 mit einer Kombination
von erm + mef und 1 Stamm mit einer Kombination von
ermTR + mef-Genen (Tabelle 4).
Vergleich der Wirksamkeit mehrerer Makrolide bei 145 S. pyogenes-Stämmen Die Erythromycin-resistenten Stämme
aus dieser Untersuchung waren gleichzeitig resistent gegenüber Azithromycin,
Clarithromycin und Roxithromycin (mit Ausnahme eines Stammes, der
eine minimale Hemmkonzentration von 0,25 µg/ml gegen Clarithromycin
aufwies). Die MHK gegenüber Josamycin war bei 14 aus den 16 Erythromycin-resistenten
Stämmen < 0,25 µg/ml. Nur 2 Stämme mit konstitutiver MLSB-Resistenz
zeigten eine MHK von > 8 µg/ml (Tabelle 7).
In Tabelle 8 sind die Grenzwerte,
die für die Beurteilung der Wirksamkeit der untersuchten Antibiotika
angewendet wurden, aufgelistet. Bei insgesamt 37 Erythromycin-resistenten
Stämmen, 25 mit mef-Gen, 9 mit ermTR-Gen, 2 mit erm-Gen
und 1 Stamm mit erm + mef + ermTR-Genen, die
auch auf Josamycin-Empfindlichkeit untersucht wurden, zeigten 35
Stämme eine MHK von < 0,5 µg/ml, waren also Josamycin-empfindlich.
Nur jene zwei Stämme, die ein erm-Gen beherbergten, zeigten
eine MHK von > 8 µg/ml und waren somit Josamycin-resistent.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Diskussion In der Untersuchung an Stämmen,
die in ganz Österreich gesammelt worden waren, ergab sich für Linz
eine Prävalenz der Erythromycin-Resistenz von 7% und eine Prävalenz
der Tetrazyklin-Resistenz von 16%. Bei allen Stämmen, die wir im
Jahr 1999 in Linz isoliert hatten (85 Stämme, 8 Erythromycin-resistente,
12 Tetrazyklin-resistente), betrug die Prävalenz der Makrolid-Resistenz
9,4% und die der Tetrazyklin-Resistenz 14%. |
Schlussfolgerung Wir haben bei S. pyogenes
österreichweit eine Prävalenz der Erythromycin-Resistenz von insgesamt
11% und der Tetrazyklin-Resistenz von 24% gefunden. Die Prävalenz
der Makrolid-Resistenz zeigt große Unterschiede in verschiedenen
Regionen Österreichs. Der Mechanismus der Makrolid-Resistenz beruht
bei S. pyogenes-Stämmen aus Österreich überwiegend auf mef-Genen. |
| Literatur:
1. Scott R.J., Naidoo J., Lightfoot N.F., George R.C.: „A community outbreak of group A beta haemolytic streptococci with transferable resistance to erythromycin.“ Epidemiol. Infect. 102 (1989) 85-91. 2. Seppälä H., Nissinen A., Yu Q., Huovinen P.: „Three different phenotypes of erythromycin-resistant S. pyogenes in Finland.“ J.A.C. 32 (1993) 885-891. 3. Sutcliffe J., Tait-Kamradt A., Wondrack L.: „Streptococcus pneumoniae and Streptococcus pyogenes resistant to macrolides but sensitive to clindamycin: a common resistance pattern mediated by an efflux system“ A.A.C. 40 (1996) 1817-1824. 4. Seppälä H., Skurnik M., Soini H., Roberts M.C., Huovinen P.: „A novel erythromycin re- sistance methylase gene (ermTR) in Streptococcus pyogenes.“ A.A.C. 42 (1998) 257-262. 5. Sutcliffe J., Grebe T., Tait-Kamradt A., Wondrack L.: „Detection of Erythromycin-Resistant Determinants by PCR.“ A.A.C. 40 (1996) 2562-2566. 6. Jebelean C., Watschinger R., Haditsch M., Binder L., Mittermayer H.: „Erythromycin resistance of Streptococcus pyogenes strains from Upper Austria.“ ICC 1997, Sydney, Australien. 7. Jebelean C., Kriebernegg I., Feierl G., Bocksrucker A., Watschinger R., Haditsch M., Binder L., Mittermayer H.: „Prevalence, phenotypes and genetics of macrolide-resistant S. pyogenes in Austria.“ ECCMID 2000, Stockholm. 8. Kataja J., Huovinen P., Muotiala A., Vuopio-Varkila J., Efstratiou A., Hallas G., The Finnish Study Group for Antimicrobial Resistance, Seppälä H.: „Clonal spread of group A Streptococcus with the new type of erythromycin-resistance.“ J. Infect. Dis. 177 (1998) 786-789. 9. Perez-Trallero E., Marimon J.M., Montes J.M., Orden B., de Pablos M.: „Clonal differences among erythromycin-resistant Streptococcus pyogenes in Spain.“ Emerg. Infect. Dis. 3 (1999) 235-240. 10. Cornaglia G., Ligozzi M., Mazzariol A., Masala L., Lo Cascio G., Orefici G., The Italian Surveillance Group for Antimicrobial Resistance, Fontana R.: „Resistance of Streptococcus pyogenes to erythromycin and related antibiotics in Italy.“ Clin. Infect. Dis. 27 (1998) 87-92. 11. Arvand M., Hoeck M., Hahn H., Wagner J.: „Antimicrobial resistance in Streptococcus pyogenes isolates in Berlin.“ J.A.C. 46 (2000) 621-624. 12. Bingen E., Fitoussi F., Doit C., Cohen R., Tanna A., George I., Loukil C., Brahimi L., Le Thomas I., Deforche D.: „Resistance to macrolides in Streptococcus pyogenes in France in Pediatric Patients.“ A.A.C. 44 (2000) 1453-1457. 13. Descheemaeker P., Chapelle S., Lammens C., Hauchecorne M., Wijdooghe M., Vandamme P., Ieven M., Goossens H.: „Macrolide resistance and erythromycin resistance determinants among Belgian Streptococcus pyogenes and Streptococcus pneumoniae isolates.“ J.A.C. 45 (2000) 167-173. 14. Seppälä H., Klaukka T., Lehtonen R., Nenonen E., Huovinen P.: „Erythromycin resistance of group A streptococci from throat samples is related to age.“ Pediatr. Infect. Dis. J. 16 (1997) 651-656. 15. Kriebernegg I., Feierl G., Grisold A., Marth E.: „In-vitro Susceptibility of group A Beta-haemolytic Streptococci (GABHS) to Penicillin, Erythromycin, Clarithromycin and Azithromycin in Styria, Austria.“ ZBl. Bakteriol 287 (1998) 33-39. 16. Giovanetti E., Montanari M.P., Mingoia M., Varaldo P.E.: „Phenotypes and genotypes of erythromycin-resistant Streptococcus pyogenes strains in Italy and heterogeneity of inducibly resistant strains.“ A.A.C. 43 (1999) 1935-1940. 17. Jebelean C., Allerberger F., Feierl G., Bocksrucker A., Watschinger R., Haditsch M., Mittermayer H.: „Antibiotic Susceptibility of Pneumococci Varies in Different Regions of Austria.“ ECCMID, 2000, Stockholm. 18. Kataja J., Huovinen P., Skurnik M., The Finnish Study Group for Antimicrobial Resistance, Seppälä H.: „Erythromycin resistance genes in group A streptococci in Finland.“ A.A.C. 43 (1999) 48-52. |
| Anschrift
des Verfassers: Dr. med. Crista Jebelean Institut für Hygiene, Mikrobiologie und Tropenmedizin, Krankenhaus der Elisabethinen Linz A-4010 Linz, Fadingerstr. 1 |