| Fremdkörper-assoziierte
Infektionen in der Intensivmedizin - Therapie und Prävention |
| J.P. Guggenbichler
Univ.-Klinik für Kinder und Jugendliche der Universität
Erlangen/Nürnberg
(Vorstand: Univ.-Prof. Dr. W. Rascher) |
Schlüsselwörter:
Therapie Fremdkörper-assoziierter Infektionen, Prophylaxe
Fremdkörper-assoziierter Infektionen, Imprägnierung
mit Antibiotika, oligodynamische Wirkung von Silberionen, aktiviertes
Nanosilber |
|
Zusammenfassung
Katheter-assoziierte
Infektionen haben einen wesentlichen Einfluss auf das Leben
und das Wohlbefinden von intensiv gepflegten Patienten.
Die Behandlung
Katheter-assoziierter Infektionen durch S. epidermidis
unter Belassung des Katheters ist schwierig und mit hohem Risiko
verbunden, bei Infektionen durch S. aureus und Gram-negative
Mikroorganismen praktisch unmöglich. Daher besteht die
dringende Notwendigkeit für präventive Maßnahmen:
Eine Ausstattung der Katheter-Oberfläche mit Antibiotika
und Desinfektionsmittel weist beträchtliche Probleme bezüglich
Wirksamkeitsspektrum, Dauer der Wirksamkeit und klinischer Wirksamkeit
auf.
Die oligodynamische
Aktivität von Silberionen bietet eine sehr gute Möglichkeit,
diese Probleme zu lösen. Verschiedene Technologien, insbesondere
die Beschichtung von Oberflächen, führten jedoch nicht
zum erwarteten Resultat. Eine neue Technologie beschreibt die
Imprägnierung des gesamten Kunststoffes mit Billionen von
Nanopartikeln von Silber ,
was in einer Oberfläche von metallischem Silber von 2.000
cm² pro g Polyurethan (PU) resultiert und aufgrund dieser
großen Oberfläche zur Freisetzung bakterizider Konzentrationen
von Silberionen aus dem Katheter führt. ,
was in einer Oberfläche von metallischem Silber von 2.000
cm² pro g Polyurethan (PU) resultiert und aufgrund dieser
großen Oberfläche zur Freisetzung bakterizider Konzentrationen
von Silberionen aus dem Katheter führt.
Zentrale
Venenkatheter wurden mit dieser Technologie gefertigt und zeigten
eine gute antimikrobielle Wirksamkeit und Biokompatibilität.
Günstige Resultate wurden in experimentellen und in prospektiven,
randomisierten, klinischen Studien mit dem Katheter der ersten
Generation erhoben. Bei 660 Patienten konnte eine Reduktion
Katheter-assoziierter Sepsis um 66% beobachtet werden. Im Rahmen
einer Postmarketingstudie konnten die guten Studien-Resultate
bestätigt werden.
In einer
weiteren Studie mit einem optimierten Katheter mit einer Oberfläche
von 2.000 cm² Silber zeigte sich eine verbesserte antimikrobielle Wirksamkeit. Bei
204 Patienten mit einer durchschnittlichen Liegedauer von 9,2
Tagen wurde eine einzige Katheter-assoziierte Sepsis (0,51/1.000
Kathetertage) beobachtet. Die Rate an bakteriell kolonisierten
Kathetern betrug < 10%. Der Katheter zeigte eine sehr gute
Bioverträglichkeit.
zeigte sich eine verbesserte antimikrobielle Wirksamkeit. Bei
204 Patienten mit einer durchschnittlichen Liegedauer von 9,2
Tagen wurde eine einzige Katheter-assoziierte Sepsis (0,51/1.000
Kathetertage) beobachtet. Die Rate an bakteriell kolonisierten
Kathetern betrug < 10%. Der Katheter zeigte eine sehr gute
Bioverträglichkeit.
Durch die
Aktivierung von Silber-Nanopartikeln konnte bei gleich guter
Biokompatibilität eine weitere wesentliche Steigerung der
antimikrobiellen Wirksamkeit erzielt werden. Die Dauer der antimikrobiellen
Wirksamkeit beträgt > 370 Tage.
Die Technologie,
den gesamten Kunststoff mit Nanopartikeln von aktiviertem Silber auszustatten und dadurch bakterizide Konzentrationen von Silberionen
für einen langen Zeitraum gleichmäßig freizusetzen,
kann auch bei zahlreichen anderen Medizinprodukten wie Sheldon-,
Hickman-, urologischen Kathetern, externen und internen Ventrikeldrainagen
und endotrachealen Tuben eingesetzt werden.
auszustatten und dadurch bakterizide Konzentrationen von Silberionen
für einen langen Zeitraum gleichmäßig freizusetzen,
kann auch bei zahlreichen anderen Medizinprodukten wie Sheldon-,
Hickman-, urologischen Kathetern, externen und internen Ventrikeldrainagen
und endotrachealen Tuben eingesetzt werden.
Diese Entwicklung
kann zu einer wesentlichen Kostendämpfung im Gesundheitswesen
beitragen. Dies ist besonders im Lichte der Einführung
Diagnose-gestützter Abrechnungssysteme, bei denen Komplikationen
nicht mehr gesondert erstattungsfähig sind, von Bedeutung.
|
Key-words:
Therapy
of catheter related infections, prophylaxis of catheter related
infections, material modification with antibiotics, oligodynamic
activity of silver ion, activated nanosilver |
|
Summary
Catheter
related infections pose a substantial burden on patients lives
and well-being. There are reports on mortality of these patients
up to 30% in addition to a substantial prolongation of hospital
stay. The estimated cost of therapy of a BSI is approximately
10,000 Euro per patient. Conservative treatment and eradication
of S. epidermidis colonizing a catheter surface is
difficult and with substantial risk to the life of the patient,
the eradication of S. aureus and gram-negative enterobacteria
as well as Candida is impossible.
There is
a definitive need for antimicrobially active medical devices
for prophylaxis. Endowment of catheters with antibiotics and
disinfectants have substantial limitations regarding spectrum
of activity, duration of activity and clinical efficacy. Large
prospective randomised studies on silver sulfadiazine/chlorhexidine
surface-impregnated catheters show a favourable trend but no
statistical significant prevention.
The oligodynamic
activity of silver has the greatest potential for prevention
of catheter related infections. Various technologies in particular
surface coating of these medical devices have been advocated
previously with limited success. A new technology with impregnation
of the entire catheter matrix with an increasing surface of
silver resulting
eventually in a surface of 2,000 cm²/g polyurethane (PU)
has been developed. resulting
eventually in a surface of 2,000 cm²/g polyurethane (PU)
has been developed.
Central
venous catheters manufactured according to this technology have
been investigated with good results of antimicrobial activity
and biocompatibility. Favourable results in controlled prospective,
randomised studies have been obtained in 860 patients (reduction
of BSI of 66%). The catheter manufactured according to an improved
technology has been investigated in 204 patients with a mean
duration of catheter placement of 9.2 days. One catheter related
BSI (0.51/1,000 catheter days) was diagnosed. The rate of catheter
colonization was < 10%. The catheter was well tolerated.
Favourable results in a postmarketing surveillance with 3,000
patients were documented.
A further
improvement with increased antimicrobial activity was achieved
by activation of silver nanoparticles. The superior results
of in vitro tests and excellent biocompatibility let
us expect an additional improvement of preventive measures.
The duration
of antimicrobial activity lasts at least 370 days. The concept
of impregnation of a polymer matrix, silicone and also ceramics
can be extended to various other clinical applications e.g.
Sheldon, Hickman, Port catheters as well as urologic catheters
and external
ventricular drainage systems. Substantial savings in the cost
of patient care through prevention of complications can be expected
which is
of particular importance with the disease oriented (DRG) remuneration
system.
|
Einleitung
Eine nosokomiale
Sepsis ist eine komplexe Erkrankung mit einer unakzeptabel hohen
Letalität. Die Gesamtletalität an Sepsis auf einer
Intensivstation beträgt ca. 20% [1]. Die 30-Tage-Letalität,
definiert bei einem Krankheitsbild mit Sepsis, septischem Schock
und Organ-Dysfunktion beträgt 30-50% [2]. Trotz zahlreicher
Fortschritte im Bereich der Sepsistherapie und der Verfügbarkeit
neuer Antibiotika hat sich die Letalität an Sepsis in den
letzten 25 Jahren nicht wesentlich gebessert. Dies ist einerseits
darauf zurückzuführen, dass immer kleinere Frühgeborene
und immer ältere Patienten mit schweren Grundkrankheiten
und ausgedehnteren chirurgischen Eingriffen behandelt werden.
Anderseits ist es die zunehmende Resistenz bakterieller Mikroorganismen,
die zu diesen Problemen beiträgt. Die Lösung dieses
Problems in Form einer Reduktion der Inzidenz und Letalität
kann nur durch eine multifaktorielle Betrachtungsweise in multidisziplinären
Arbeitsgruppen angegangen werden:
Optimierte
antimikrobielle Behandlung
durch
sorgfältige klinische Überwachung und rechtzeitigen
Beginn einer wirksamen antimikrobiellen Therapie, oftmals einer
Kombinationstherapie, die die gegenwärtige Resistenzsituation
auf Intensivstationen mit multiresistenten Mikroorganismen wie
MRSA berücksichtigt [3, 4, 5]. Ein bisher weitgehend unberücksichtigtes
Phänomen besteht darin, dass bei synergistisch wirkenden
Kombinationen von Antibiotika von einer zeitversetzten Gabe
der Kombinationspartner eine verbesserte antimikrobielle Wirkung
im Gegensatz zu gleichzeitiger Gabe zu erwarten ist [6, 7].
Verbesserung
der Beatmungsparameter
durch
Absenkung des inspiratorischen Beatmungsdrucks und des PEEPS.
Zu hohe Druckwerte führen innerhalb von Tagen zum Untergang
von Lungengewebe. Eine Optimierung der Beatmungsparameter führt
auch zu einer Verminderung Beatmungs-assoziierter Pneumonien
[8, 9].
Verbesserung
der Kreislaufsituation und der Sauerstoffutilisation
durch
Optimierung der Verabreichung vasoaktiver Substanzen. Es ist
heute allgemein akzeptiert, dass Dopamin und Dobutrex zwar zu
einer Steigerung des Blutdruckes führen – die Mikrozirkulation
durch diese Präparate jedoch oft negativ beeinflusst wird
[10, 11].
Verbesserung der Gerinnungsparameter und der Mikrozirkulation
durch verschiedene Medikamente wie Drotrecogin. Eine Verschlechterung
der Gerinnungswerte mit Verbrauchskoagulopathie kann durch Gabe
von aktiviertem Protein C verbessert werden. Klinische Studien
zeigen eine Reduktion der Letalität im Rahmen einer Sepsis
von 31% auf 25%. Andere Medikamente wie AT III, Heparin müssen
ebenso in diese Untersuchungen einbezogen werden [12].
Bestimmung des Einsatzes und die Optimierung der Verabreichung
von antiinflammatorischen Medikamenten
Die antiinflammatorische Wirkung von verschiedenen Medikamenten
einschließlich Kortikosteroiden und deren Beeinflussung
der Wirksamkeit von proinflammatorischen Zytokinen muss noch
besser verstanden werden. Bisherige Untersuchungen mit verschiedenen
Präparaten, die zu einer Modifikation verschiedener Einzelbestandteile
der Entzündungskaskade führten, wie Verabreichung
von monoklonalen Antikörpern gegen TNF alpha, TNF-alpha-Rezeptor-Analoga
brachten enttäuschende Ergebnisse [13, 14, 15].
Blutzuckerkontrolle
Enge Blutzuckerkontrolle und Einstellung sowie Optimierung der
enteralen und parenteralen Ernährung:
Verbesserung der zeitlichen Abstimmung bezüglich des Beginns
einer parenteralen Ernährung mit Aminosäuren und Fettlösungen
ist dringend nötig [16, 17]. Es ist bekannt, dass der frühzeitige
Beginn einer enteralen Sondenernährung nach einem großen
chirurgischen Eingriff die bakterielle Translokation aus dem
Intestinaltrakt verhindert. Die Verabreichung von sauren Galakturoniden
als Rezeptor-Analoga zur Verhinderung der Adhärenz bakterieller
Mikroorganismen an Intestinalmukosa wurde in experimentellen
Untersuchungen und Tierversuchen bestätigt [18]. Ob durch
Zugabe dieser sauren Galakturonide dieser Effekt noch verstärkt
werden kann, wird gegenwärtig in einer klinischen Studie
geprüft. Über sehr gute Erfahrungen und die Ergebnisse
einer Pilotuntersuchung mit diesem Konzept bei Patienten nach
Knochenmarktransplantation wird im nächsten Heft berichtet
[19].
Ich
möchte mich in diesem Beitrag auf die Behandlung und die
Prävention Fremdkörper-assoziierter nosokomialer Infektionen
konzentrieren, die wahrscheinlich den größten Beitrag
zur Reduktion nosokomialer Todesfälle bringen könnten
[20].
|
| Therapeutische
Maßnahmen bei Verdacht auf eine Fremdkörper-assoziierte
Infektionen Die
Frage nach der Erhaltungsmöglichkeit infizierter zentralvenöser
Verweilkatheter wurde in den letzten Jahren bei Säuglingen
und Kleinkindern insbesondere mit langzeitimplantierten Kathetern
vom Hickman-Typ in vermehrtem Maße gestellt. Die Elimination
von Mikroorganismen wie Coagulase-negativen Staphylokokken von
Kunststoffoberflächen galt lange Zeit wegen der Biofilmbildung
– und der dadurch behinderten Penetration von Wirkstoff
durch den Biofilm – als praktisch unmöglich und in
der klinischen Praxis kaum realisierbar. Daher bestand die einzige
Behandlungsmöglichkeit einer Katheter-assoziierten Infektion
in der Entfernung des Fremdmaterials.
In
vitro-Untersuchungen haben gezeigt, dass zur Eradikation
von Mikroorganismen, die eine Kunststoffoberfläche kolonisieren,
50- bis 100fach höhere Wirkstoffkonzentrationen erforderlich
sind, als man nach der traditionellen Empfindlichkeitsprüfung
durch die Bestimmung der MHK erwarten würde. Bei Untersuchungen
von S. epidermidis hat sich gezeigt, dass trotz Biofilmbildung
Wirkstoffkonzentrationen bestimmter Antibiotika, die 50- bis
100fach über dem MHK-Wert liegen, über 24 Stunden
zu einer nachhaltigen Keimelimination führen können.
Durch die Verabreichung eines Antibiotikums als Bolusdosis oder
als Kurzinfusion über 30-60 Minuten hingegen ist keine
antimikrobielle Wirksamkeit zu erreichen (Abbildungen 1, 2,
3) [21].
Abbildung
1: Absterbekinetik von Staph. epidermidis
KH 11 und V2 in Kathetern unter kontrollierter Perfusion
mit verschiedenen Antibiotika
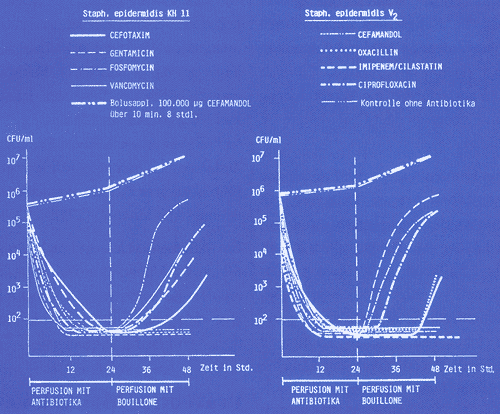
Abbildung
2: Absterbekinetik von Staph. aureus
ATCC 25923 in Kathetern unter kontrollierter Perfusion
mit verschiedenen Antibiotika
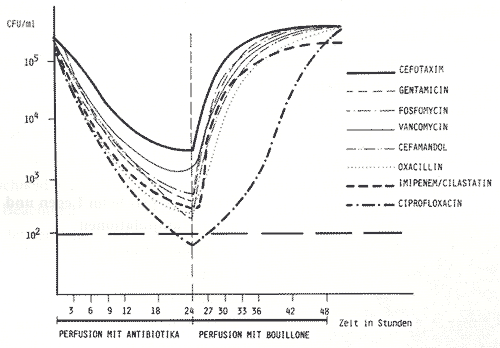
Abbildung
3: Rasterelektronenmikroskopische Untersuchung
eines mit Staphylococcus aureus ATCC 25923 besiedelten
Polyvinylkatheters nach 48-stündiger Perfusion mit
Imipenem/Cilastatin und Fosfomycin: Unvollständige
Keimelemination
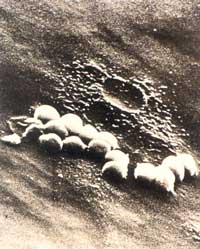
|
Bei S.
aureus konnte durch keine der geprüften Wirkstoffgruppen
eine Sanierung des kontaminierten Katheters erzielt werden.
Auch E.
coli, P. aeruginosa und C. albicans konnten
nicht mit Antibiotika von der Katheteroberfläche entfernt
werden.
Diese Untersuchungen
ermutigten jedoch, bei einer milden Verlaufsform einer Katheter-assoziierten
Infektion klinische Untersuchungen durchzuführen. Es hat
sich gezeigt, dass man in besonders gelagerten Fällen,
wenn ein Katheter nicht oder nur unter besonders erschwerten
Bedingungen ausgetauscht werden kann, einen kontaminierten Katheter
„retten“ kann. Durch eine Änderung der Verabreichungsweise
der Antibiotika – z.B. 1/3 der Tagesdosis als Dauerperfusion
über eine Motorspritze und Verabreichung von 2/3 der Tagesdosis
als Bolusapplikation in 8-stündlichen Intervallen –
konnte bei einer klinischen Pilotstudie bei 9 von 10 Katheterinfektionen
mit S. epidermidis der Katheter erhalten werden. Beim
Nachweis von S. aureus konnte nur sporadisch und bei
Gram-negativen Erregern und C. albicans in keinem Fall
der Katheter erhalten werden [22].
Als Vorgehen
bietet sich vor allem bei tunneliertem Langzeitkatheter und
milder klinischer Symptomatik an, den Katheter unter antibiotischer
Therapie und sorgfältiger klinischer Beobachtung zu belassen,
bis die Diagnose mikrobiologisch gesichert ist.
Bei einer
schweren klinischen Symptomatik oder Persistenz der klinischen
Symptome >3 Tage sowie bei Auftreten von Komplikationen,
wie septischen Thromboemboli, Verdacht auf Endokarditis (Ausschluss
mit TEE), Herdnephritis, ist eine sofortige Entfernung des Katheters
und der Beginn einer antimikrobiellen Behandlung indiziert.
Wenn nötig, erfolgt die Insertion eines neuen Katheters
auf der kontralateralen Seite. Das sog. „Umfädeln“
des Katheters über einen Führungsdraht birgt das Risiko
in sich, dass bei einer Kontamination des Innenlumens der neue
Katheter sofort erneut besiedelt ist. Dieses Vorgehen ist auch
bei Vorliegen einer lokalen Infektion indiziert. Auch bei Isolierung
von S. aureus, Enterokokken, Gram-negativen Mikroorganismen
oder C. albicans ist eine sofortige Entfernung des
Katheters und eine entsprechende antimikrobielle Behandlung
indiziert. Bei Vorliegen einer Klappenerkrankung ist auch bei
milder klinischer Symptomatik das Risiko, einen Katheter unter
antibiotischer Therapie zu erhalten, zu groß. Ein ähnliches
Vorgehen wird auch bei nichttunnelierten Kurzzeit- oder Sheldon-Kathetern
empfohlen.
Insgesamt
ist jedoch diese Vorgehensweise mit einem erheblichen Risiko
und hohen Kosten verbunden, und man wird dies nur dann ins
Auge fassen, wenn ein zentralvenöser Zugang unbedingt erforderlich
ist und eine Neuanlage problematisch erscheint.
Die Wahl
eines Antibiotikums erfolgt nach Resistenzprüfung oder
empirisch. Dies ist jedoch bei der gegenwärtig zunehmenden
Resistenzproblematik auf Intensivstationen u.U. schwierig geworden.
Zur Behandlung von Infektionen mit Coagulase-negativen Staphylokokken
bietet sich Oxacillin, Cefazolin, Cefotiam, vorzugsweise in
Kombination mit Vancomycin oder Fosfomycin an. Zur Behandlung
einer S. aureus-Infektion ist zusätzlich zur obligaten
Entfernung des Katheters eine Therapie mit Cefotiam, Oxacillin,
bei MRSA ist nur Vancomycin, Fosfomycin, Linezolid oder Quinupristin/Dalfopristin
indiziert; üblicherweise erfolgt eine Kombination zweier
Antibiotika. Die Behandlung einer Infektion durch Enterobacteriaceae
erfolgt mit einem Cephalosporin der III. Generation oder einem
Carbapenem in Kombination mit einem Aminoglykosid. Die Behandlung
einer Enterokokkeninfektion erfolgt mit Ampicillin + einem Aminoglykosid.
Candida albicans erfordert die Verabreichung von Fluconazol
oder Caspofungin i.v. [23, 24, 25].
Die Empfehlungen
zur Freispülung von thrombosierten Kathetern mit einer
verdünnten Heparin-Antibiotika-Lösung werden vor allem
in der Kinderheilkunde sehr skeptisch betrachtet. Vor allem
bei kleinen Frühgeborenen kann es durch das Heparin zu
lebensbedrohlichen Blutungen kommen. Bei allen Patienten kann
die Ablösung von Thromben zu septischen Thromboembolien
führen [26].
Maßnahmen
zur intermittierenden Stilllegung einzelner Lumina bzw. des
gesamten Katheters bestehen in der Antibiotika-Lock-Technik,
wobei der Katheter bis zur Spitze mit einer konzentrierten Antibiotikalösung
über mindestens 12 Stunden bis mehrere Tage gefüllt
wird. Diese Methode zeigt bisweilen Erfolg, der jedoch kurzlebig
ist. Bei der Elimination von Mikroorganismen bleiben Reste der
Zellwand am Katheter haften und führen zu einer raschen
Wiederbesiedelung (Abbildung 4) [27].
Ein Alkohol-Lock
wird nicht empfohlen, da Alkohol den Weichmacher aus dem Katheter
ausspült. Weichmacher sind potenziell toxisch, der Katheter
wird steif und brüchig.
Abbildung
4: Rasterelektronenmikroskopische Untersuchung
eines mit Staphylococcus aureus ATCC 25923 besiedelten
Polyvinylkatheters nach 96-stündiger Perfusion mit
Imipenem/Cilastatin und Fosfomycin und anschließender
24-stündiger Perfusion mit "Bouillon":
Vollständige Keimelemination, als Residuen Matrixteile

|
|
| Präventive
Maßnahmen für Katheter-assoziierte Infektionen
Präventiven
Maßnahmen zur Verhinderung der Besiedelung von implantierbaren
Biomaterialien und einer Katheter-assoziierten BSI kommt wegen
der unakzeptabel hohen Letalität und der sozioökologischen
Konsequenzen eine vordringliche Bedeutung zu [28].
Strikte
Asepsis beim Legen und bei allen Manipulationen
Es ist
unbestritten, dass sorgfältiges Einhalten steriler, aseptischer
Kautelen beim Legen des Katheters und bei allen weiteren Manipulationen
eine entscheidende Rolle bei der Eindämmung dieser schweren
Infektionen spielt und auch erfolgreich ist [29]. Ein steriler
Mantel, Handschuhe, Maske, Haube, ein großes Lochtuch,
das die Einstichstelle und den Sonographiekopf weiträumig
abdeckt, die Desinfektion der Einstichstelle mit Desinfektionsmittel
unter Beachtung der Einwirkzeit sind Bedingung beim Legen des
Katheters. Alkoholische Desinfektionsmittel sind zu bevorzugen,
eine systemische Antibiotikatherapie ist beim Legen eines Katheters
nicht indiziert. Ein zwar kostenintensiver, aber überaus
nutzbringender Faktor ist ausreichendes Pflegepersonal auf einer
Intensivstation. Bei einer verminderten Personaldecke ist die
Rate an Katheter-assoziierten Infektionen um ein Vielfaches
höher [30, 31, 32, 33].
Die Versorgung
der Einstichstelle erfolgt mit einem Wasserdampf-durchlässigen
Transparentverband oder einer sterilen Gaze, die eine tägliche
Inspektion der Einstichstelle ermöglichen. Bei Durchfeuchtung
und Blutung ist ein sofortiger Verbandwechsel vorzunehmen, transparente
Verbände müssen nach 7 Tagen gewechselt werden [34,
35].
Ausbildung
des Pflegepersonals
Sherertz
konnte zeigen, dass eine 1-tägige Ausbildung des Pflegepersonals
in Hygienemaßnahmen mit Verdeutlichung des Problems die
Infektionsrate von 4,51 auf 2,9 Infektionen pro 1.000 Kathetertage
senkte [36]. Zuschneid beobachtete, dass die strenge Beachtung
der Empfehlungen in den letzten Jahren bei 84 teilnehmenden
Intensivstationen sowohl nach mikrobiologischen als auch klinischen
Kriterien zu einer Reduktion Katheter-assoziierter Infektionen
von 2,1 auf 1,5 BSI/1.000 Kathetertage in Deutschland geführt
hat [37]. Ausbildungsmaßnahmen bedürfen jedoch einer
regelmäßigen Auffrischung und Kontrolle.
Eine wichtige
Maßnahme ist die tägliche Überprüfung der
Indikation für den zentralvenösen Zugang. Ein routinemäßiger
Wechsel des Katheters im 4-Tages-Intervall ist nicht nötig,
wenn der Katheter aber unter eingeschränkt aseptischen
Notfallbedingungen gelegt wurde, ist ein möglichst baldiger
Wechsel indiziert.
Es scheint
aber, dass das Potenzial durch konservative Maßnahmen
bei problembewussten Intensivstationen ausgeschöpft ist
und nur ein beschränkter Teil der Patienten gegenwärtig
in den Genuss dieser Reduktion kommt. Außerdem sind die
Kosten für das Gesundheitssystem durch Fremdkörper-assoziierte
Infektionen exorbitant.
|
| Prävention
durch Materialmodifikation Es
gilt daher, alle Möglichkeiten der Verhinderung nosokomialer
Infektionen auszuschöpfen. Das Anforderungsprofil für
eine Prävention von Katheter-assoziierten Infektionen bzw.
die antimikrobielle Ausstattung eines Katheters ist hoch:
Eine Reihe
von Materialmodifikationen wurde bisher beschrieben:
Materialauswahl
Bei der
Auswahl des Materials sind Polyurethankatheter den Kathetern
aus Polyvinylchlorid und Polyäthylen, die leichter einer
bakteriellen Besiedelung unterliegen, vorzuziehen. Gegenwärtig
sind jedoch praktisch alle Hersteller implantierbarer Kunststoffe
auf Polyurethan oder Silikon übergegangen. Von wesentlicher
Bedeutung ist eine glatte, hydrophile Oberfläche, wobei
der Wasserfilm an der Oberfläche die Adhärenz bakterieller
Mikroorganismen verhindert. Die Beschichtung der Katheter mit
Heparin, Hydrogelen, Phospholipiden und Hyaluronsäure zeigte
in vitro eine Verminderung der Adhärenz bakterieller
Mikroorganismen, in klinischen Untersuchungen konnte jedoch
keine Reduktion Katheter-assoziierter Infektionen bestätigt
werden [38, 39].
Oberflächenbeschichtung
mit Antibiotika und Desinfektionsmittel
Die Reduktion Katheter-assoziierter
Infektionen mit einem an der Oberfläche mit Silber-Sulfadiazin
und Chlorhexidine beschichteten Katheter wurde in 11 kontrollierten
prospektiven Studien untersucht und in einer Metaanalyse zusammengefasst
[40]. Bei 3 Studien konnte keine Verbesserung, bei weiteren
3 eine mäßige Reduktion dokumentiert werden. Die
Metaanalyse aus diesen Studien zeigt einen Trend zugunsten der
Silber-Sulfadiazin-beschichteten Katheter, jedoch keine statistisch
gesicherte Reduktion (Tabelle 1).
Tabelle
1: Resultate von 11 Studien mit einem Silber-Sulfadiazin-Chlorhexidin-beschichteten
Katheter
| Autor |
Katheter |
Patienten-
anzahl |
Liegedauer
in Tagen |
Infektionsrate
(%) |
|
Kontr.K. |
Antim.K. |
|
| Tennenberg |
Arrow |
283 |
5,3 |
6,2 |
3,6 |
| Maki |
A |
403 |
6,0 |
4,6 |
1,6 |
| Hannan |
A |
128 |
8,0 |
11,7 |
7,4 |
| Bach
1996 |
A |
117 |
7,7 |
2,6 |
0 |
| Heard |
A |
157 |
9,0 |
3,8 |
3,3 |
| Collin |
A |
139 |
7,3 |
2,9 |
1,0 |
| Ciresi |
A |
127 |
9,1 |
11,0 |
10,5 |
| Pemberton |
A |
40 |
11 |
7,5 |
6,3 |
| Ramsay |
A |
189 |
10,9 |
2,1 |
0,5 |
| Trazzera |
A |
99 |
6,7 |
5,1 |
3,3 |
| Karthaus |
A |
55 |
16 |
14,2 |
2,0 |
|
|
Die Wirkung
war umso besser, je kürzer die Liegedauer der Katheter
war. Eine Reduktion z.B. von 4,4 auf 1,0/1.000 Kathetertage
wurde bei einer Liegedauer von 6 Tagen beschrieben. Bei einer
Liegedauer von 9-11 Tagen wurde bei einer Inzidenz von bis zu
10,5 BSI/1.000 Kathetertage keine Reduktion von ZVK-assoziierten
BSI beobachtet.
Die Erklärung
für die unterschiedlichen Studienergebnisse mit dem Silber-Sulfadiazin
und Chlorhexidine-beschichteten Katheter sind offenkundig und
beruhen auf 3 Problemen:
a) Die
antimikrobielle Wirkung basiert neben der antimikrobiellen Wirkung
des Desinfektionsmittels Chlorhexidine auf dem Chemotherapeutikum
Sulfadiazine. Die Wirkung der Silberionen ist hierbei vernachlässigbar.
Bei Imprägnierung von Kunststoffen mit Antibiotika sind
wesentlich höhere antimikrobielle Wirkstoffkonzentrationen
für eine Eradikation von sessilen Keimen (= an Oberflächen
haftende Keime) erforderlich als in flüssigem Medium. Letztlich
kann es zur Entwicklung sog. „small colony variants“
kommen, die auf Antibiotika vollkommen unempfindlich sind [41].
b) Silber-Sulfadiazine,
aber auch Chlorhexidine werden innerhalb von 5-8 Tagen weitgehend
aus dem Kathetermaterial ausgewaschen und hinterlassen eine
raue Oberfläche.
c) Die
antimikrobielle Beschichtung besteht bisher nur an der Außenseite.
Ab dem 5. Tag geht jedoch die Infektion häufig vom Luer-Lock
aus und die Kontamination besteht vorwiegend an der Innenseite
des Katheters. Bei einer erst vor kurzem beschriebenen Verbesserung
des Katheters ist auch das Lumen mit Chlorhexidin beschichtet.
Darüber gibt es aber noch keine Studien.
Bei der
Datenlage ist es nicht logisch nachvollziehbar, den mit Silber-Sulfadiazin
und Chlorhexidine beschichteten Katheter, der seine Stärken
in den ersten 5 Tagen besitzt, bei Patienten zu empfehlen, bei
denen man erwarten kann, dass der Katheter länger als 5
Tage liegt, da man sich nur in den ersten Liegetagen von diesem
Katheter eine Wirkung erwarten kann. Zudem kann man häufig
nicht voraussehen, bei welchen Patienten eine längere Liegedauer
zu erwarten ist.
Eine erhebliche
Reduktion Katheter-assoziierter Infektionen wurde in prospektiven
randomisierten Studien auch durch einen außen und innen
mit Rifampin-Minocyclin imprägnierten Katheter erzielt.
Dabei konnte bei einer durchschnittlichen Liegedauer von 6-7
Tagen eine substanziell niedrigere Infektionsrate im Vergleich
zu einem Kontrollkatheter sowie auch zu einem Chlorhexidine-Silber-Sulfadiazin-Katheter
beobachtet werden [42].
Es gibt
jedoch eine Reihe von Vorbehalten gegen letztere Technologie:
Das antimikrobielle Wirkspektrum beider Antibiotika ist löchrig.
Ca. 35% der Coagulase-positiven und -negativen Stämme auf
Intensivstationen sind gegenwärtig auf Tetrazykline unempfindlich.
Das gilt mit steigender Tendenz auch für eine hohe Zahl
Gram-negativer Isolate. Bei Rifampin ist die schnelle Resistenzinduktion
gegen S. aureus ein bekanntes Problem. Im Tierversuch
wurden nach 7- bis 14-tägiger Implantation resistente S.
aureus-Stämme beobachtet, was das Potenzial für
eine Resistenzinduktion unterstreicht. Diese Stämme repräsentieren
Subpopulationen von S. aureus mit reduzierter Empfindlichkeit
gegen Tetrazykline und Rifampin. Bei Kontamination mit Minocyclin-empfindlichen,
Rifampin-resistenten Keimen bestand keine Schutzwirkung. Obwohl
gegenwärtig verfügbare Studien eine Reduktion Katheter-assoziierter
Infektionen versprechen, ist die Verwendung dieses Katheters
– wie auch von Antibiotika-imprägnierten Kathetern
zur externen Ventrikeldrainage (Bactiseal = Imprägnierung
mit Clindamycin und Rifampin) wegen der Selektion resistenter
Mikroorganismen und Pilze mit großer Vorsicht zu betrachten
[43].
Es besteht
allgemeines Einvernehmen, dass sich die Imprägnierung oder
Beschichtung von implantierbaren Biomaterialien mit Antibiotika,
die auch als Therapeutikum in Betracht kommen, verbietet. Bei
Versagen der Prophylaxe würden keine antimikrobiell wirksamen
Substanzen zur Therapie zur Verfügung stehen.
Anforderungsprofil
an einen antimikrobiell ausgestatteten Kunststoff
Das Anforderungsprofil
für eine Prävention von Katheter-assoziierten Infektionen
bzw. an die antimikrobielle Ausstattung eines Katheters
ist hoch:
| –
Breites antimikrobielles Wirkspektrum gegen multiresistente
Gram-positive und Gram-negative Infektionserreger und Pilze,
ohne eine Resistenzentwicklung zu begünstigen. Wirksamkeit
gegen sessile Keime sowie „small colony variants“ |
| –
Wirksamkeit sowohl an der Katheteraußenseite als auch
im Lumen und am Luer-Lock bei gleich bleibender antimikrobieller
Wirksamkeit über Monate |
| –
Keine Änderung der physikalischen Eigenschaften |
| –
Nachgewiesene Biokompatibilität einschließlich
guter Hämokompatibilität, vor allem aber keine
Thrombogenität und keine Zytotoxizität |
| –
Nachweis gesicherter Wirksamkeit in klinischen prospektiven,
randomisierten Doppelblind-Studien |
| –
Günstige Kosten-Nutzen-Relation |
Ausnützung
der oligodynamischen Wirkung von Silberionen
Die oligodynamische
Wirkung von Silberionen bietet sich zur antimikrobiellen Ausstattung
eines Katheters als Alternative gegenüber den bisherigen
Technologien der Beschichtung/Imprägnierung mit Antibiotika
und Antiseptika an [44, 45].
Silber
ist als antimikrobielle Substanz seit Jahrtausenden bekannt.
V. Nägeli bestimmte vor mehr als 100 Jahren die antimikrobielle
Wirksamkeit von Silber auf Algen mit 5 x 10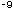 Mol/l. Die Wirksamkeit auf bakterielle Mikroorganismen und Pilze
ist um den Faktor 10 kleiner [46].
Mol/l. Die Wirksamkeit auf bakterielle Mikroorganismen und Pilze
ist um den Faktor 10 kleiner [46].
Silberionen
blockieren SH-Gruppen in Enzymsystemen, die den bakteriellen
Energiestoffwechsel aufrechterhalten. Außerdem blockieren
Silberionen die Atmungskette der Mikroorganismen und die Verlängerung
der DNS-Helix [47].
Entscheidend
für die antimikrobielle Wirksamkeit von Silberionen ist
jedoch die Technologie der Silberausstattung eines Kunststoffes,
wobei bakterizide Konzentrationen bei einem Katheter sowohl
an der Außenseite als auch intraluminal über einen
Zeitraum von Monaten freigesetzt werden müssen.
Unterschiedliche
Technologien
Die Beschichtung
eines Kunststoffkatheters außen und innen mit Silber ist
technisch nicht möglich, zudem werden nur unzureichende
bakterizide Konzentrationen von freien Silberionen von der Oberfläche
freigesetzt. Ein Silberkatheter, bei dem Silberionen durch Ionenimplantation
auf die Oberfläche des Katheters aufgebracht wurden, erwies
sich als thrombogen.
Die Einarbeitung
von Silbersalzen in den Kunststoff ist ebenso problematisch.
Bei gut wasserlöslichen Salzen besteht das Problem in einer
erhöhten Toxizität, bei schlecht wasserlöslichen
Salzen ist die Freisetzung von Silberionen zu gering. Deshalb
eignen sich Salze nur bedingt zum Einsatz in implantierbaren
Kunststoffen.
Bei einer
verbesserten Technologie werden die Hohlräume zwischen
den Polyurethanmolekülketten mit Milliarden von Nanopartikeln
von metallischem Silber durchsetzt. Mit steigender Oberfläche
von Silber-Nanopartikeln im Kunststoff auf >2.000 cm²/g
PU konnte die antimikrobielle Wirksamkeit kontinuierlich gesteigert
werden. Die nach dieser Technologie gefertigten Katheter sind
nicht thrombogen, nicht zytotoxisch und weisen eine sehr gute
Hämokompatibilität auf [48]. Die antimikrobielle Ausstattung
mit Nanosilber ist bei Polyurethan, Polyäthylen, -propylen,
Silikon, Methacrylat und Keramik (Titanoxyd) möglich (Abbildung
5).
Abbildung
5: Antimikrobielle Ausstattung von Kunststoffen
(PU) mit Silber -Nanopartikelchen
auf einem Barium-Sulfat-Träger -Nanopartikelchen
auf einem Barium-Sulfat-Träger
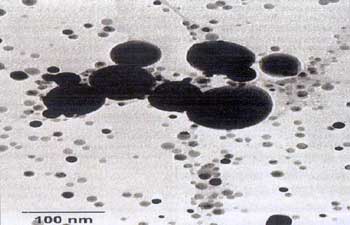
|
Weitere
Möglichkeiten und eine Verbesserung der Freisetzung von
aktivmikrobiell wirksamen Silberionen wurden in einer Kombination
von Nanosilber mit Platin beschrieben. Es ist bekannt, dass
ein edleres Metall, z.B. Platin, Ionen aus dem unedleren Silber
freisetzt. Als Katalysator wird noch Graphit beigemischt. Die
Problematik bei dieser sehr teuren Technologie liegt darin,
dass zwar ausreichend bakterizide Wirkstoffkonzentrationen freigesetzt
werden, der Katheter aber sehr steif und dadurch schlecht handhabbar
wird [49].
Eine weitere
Möglichkeit ist die Verwendung von Ionenaustauschern, z.B.
Zeolithen. Dabei handelt es sich um Magnesium-Aluminium-Silikate,
die mit Silbersalzen gefüllt sind und zur raschen Freisetzung
von Silberionen führen. Die Wirksamkeit ist aber weitgehend
auf 7 Tage begrenzt. Synthetische Zeolithe lassen sich zudem
in Kunststoffen schwer verarbeiten, natürliche Zeolithe
sind aufgrund von Unreinheiten für Medizinprodukte nicht
geeignet [50].
In einer
von uns entwickelten, nochmals entscheidend verbesserten Methode
kommt es im Prozess der Bildung von Nanosilber durch Zugabe
von Säuren und Elektrolyten auf den Silber-Nanopartikelchen
zur Bildung von schwer wasserlöslichen Silbersalzen, z.B.
von Silber-Orthophosphat, das wie eine Batterie mit dem Silber reagiert und effektiv Silberionen freisetzt. Die Wirkung ist
gegenüber dem reinen Silber
reagiert und effektiv Silberionen freisetzt. Die Wirkung ist
gegenüber dem reinen Silber wesentlich gesteigert, ohne in den toxischen Bereich zu gelangen.
Zu dem ist diese Technologie kostengünstig. Eine gleichmäßige
bakterizide Wirksamkeit wurde über 370 Tage dokumentiert.
Die aus dem Polyurethan freigesetzten Konzentrationen von Silberionen
liegen auch
wesentlich gesteigert, ohne in den toxischen Bereich zu gelangen.
Zu dem ist diese Technologie kostengünstig. Eine gleichmäßige
bakterizide Wirksamkeit wurde über 370 Tage dokumentiert.
Die aus dem Polyurethan freigesetzten Konzentrationen von Silberionen
liegen auch
für Langzeit-implantierte Hickman-Katheter um das ca. 1.000fache
unter dem für den Menschen toxischen Bereich. Zudem führen
die Konzentrationen zu keiner Resistenzinduktion. Die Katheter
sind sehr gut biokompatibel und erfüllen alle Anforderungen
des Medizinproduktegesetzes. Sie sind CE-gekennzeichnet, klinisch
geprüft und im Handel erhältlich.
Messung
der Silberfreisetzung
Vergleich
der Silberfreisetzung bei den einzelnen Technologien [51]. Die
Messung erfolgte mit einer voltametrischen Methode und mittels
Massenspektroskopie (Abbildung 6).
Abbildung
6: Messung der Freisetzung von Silberionen bei
den verschiedenen Technologien
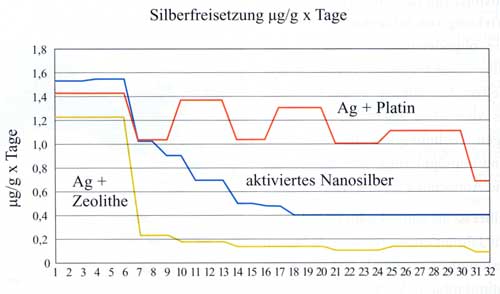
|
Gleiches
gilt für weitere Produkte (urologische Katheter, Ventrikelkatheter),
bei denen durch die Aktivierung von Ag Nanopartikelchen im Kunststoff eine sehr gute antimikrobielle
Wirksamkeit bei gleich bleibend guter Biokompatibilität
erreicht wurde.
Nanopartikelchen im Kunststoff eine sehr gute antimikrobielle
Wirksamkeit bei gleich bleibend guter Biokompatibilität
erreicht wurde.
Experimentelle Untersuchung der antimikrobiellen Wirksamkeit
Die antimikrobielle
Wirksamkeit wurde in experimentellen Untersuchungen mit der
Ausrollkultur-Methode und der Dow-Shaker-Methode initial, nach
6 und 12 Wochen kontinuierlicher Elution in phys. Kochsalzlösung
untersucht und zeigte die exzellente antimikrobielle Wirksamkeit
dieser Katheter [52].
Ausrollkultur
Bei der Ausrollkultur wird ein 5 cm langes Stück eines
Katheters in einer Keimsuspension mit 10 CFU/ml für 3-4 Stunden inkubiert und anschließend
über eine Agarplatte gerollt. Das Katheterstück wird
ohne abzuspülen in phys. Kochsalzlösung eingelegt
und in 3- bzw. 6-stündlichen Intervallen wiederum über
eine Agarplatte gerollt. Dabei zeigt sich, dass nach 6 Stunden
beim Katheter mit aktiviertem Nanosilber eine wesentliche Keimreduktion
erreicht wurde und der Katheter nach 12 Stunden keimfrei ist.
Im Vergleich dazu zeigen Katheter, die nur mit Nanosilber imprägniert
sind, erst nach 18 Stunden eine erkennbare Keimreduktion. Diese
Methode misst sowohl die Adhärenz und Biofilmbildung von
Mikroorganismen an einer antimikrobiellen Oberfläche als
auch die Bakterizidie dieser Oberfläche für adhärente
Keime.
CFU/ml für 3-4 Stunden inkubiert und anschließend
über eine Agarplatte gerollt. Das Katheterstück wird
ohne abzuspülen in phys. Kochsalzlösung eingelegt
und in 3- bzw. 6-stündlichen Intervallen wiederum über
eine Agarplatte gerollt. Dabei zeigt sich, dass nach 6 Stunden
beim Katheter mit aktiviertem Nanosilber eine wesentliche Keimreduktion
erreicht wurde und der Katheter nach 12 Stunden keimfrei ist.
Im Vergleich dazu zeigen Katheter, die nur mit Nanosilber imprägniert
sind, erst nach 18 Stunden eine erkennbare Keimreduktion. Diese
Methode misst sowohl die Adhärenz und Biofilmbildung von
Mikroorganismen an einer antimikrobiellen Oberfläche als
auch die Bakterizidie dieser Oberfläche für adhärente
Keime.
Dow-Shaker-Methode
Bei der Dow-Shaker-Methode wird ein Katheterstück mit der
Oberfläche von 5 cm² mit 10 Keimen (S. epidermidis) in 1 ml NaCl phys. inokuliert.
Es werden 6-stündlich Keimzahlbestimmungen durchgeführt,
indem die Menge einer kalibrierten Öse (0,02 ml) auf eine
Agarplatte aufgebracht wird. Die Kulturen werden 24 Stunden
bebrütet. Anschließend wird eine Keimzahlbestimmung
durchgeführt. Die Lösung ist bei Kathetern, die mit
aktiviertem Nanosilber ausgestattet sind, nach spätestens
12 Stunden steril. Bei Kathetern mit Nanosilber allein ist innerhalb
von 24 Stunden eine Keimreduktion von 10
Keimen (S. epidermidis) in 1 ml NaCl phys. inokuliert.
Es werden 6-stündlich Keimzahlbestimmungen durchgeführt,
indem die Menge einer kalibrierten Öse (0,02 ml) auf eine
Agarplatte aufgebracht wird. Die Kulturen werden 24 Stunden
bebrütet. Anschließend wird eine Keimzahlbestimmung
durchgeführt. Die Lösung ist bei Kathetern, die mit
aktiviertem Nanosilber ausgestattet sind, nach spätestens
12 Stunden steril. Bei Kathetern mit Nanosilber allein ist innerhalb
von 24 Stunden eine Keimreduktion von 10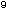 auf 10
auf 10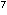 CFU/ml
festzustellen. Bei dieser Methode wird die antimikrobielle Aktivität
der aus der Oberfläche von 5 cm² eluierten Menge an
freien Silberionen gemessen (Abbildung 7a, b). CFU/ml
festzustellen. Bei dieser Methode wird die antimikrobielle Aktivität
der aus der Oberfläche von 5 cm² eluierten Menge an
freien Silberionen gemessen (Abbildung 7a, b).
Abbildung
7a, b: Antimikrobielle Wirksamkeit eines mit
aktiviertem Nanosilber ausgestatteten Katheters mit der
Ausrollmethode (a) und der Dow-Shaker-Methode (b) (Inokulumgröße
jeweils 10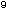 CFU/ml) [52]
CFU/ml) [52]
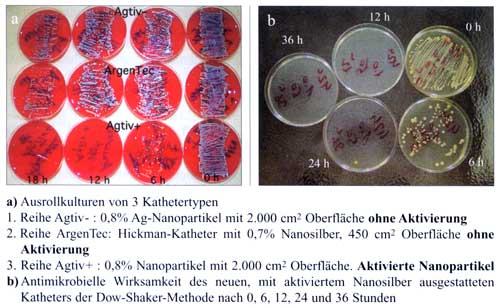
Abbildung
8: Ausrollkulturen Ventr. Kath. 10 CFU/ml, 4h Inkubation
CFU/ml, 4h Inkubation
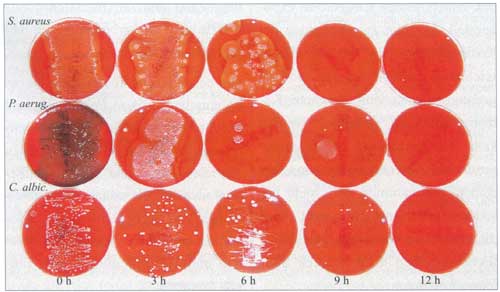
|
Die antimikrobielle
Wirksamkeit wurde gegen eine Reihe von bakteriellen Mikroorganismen
(ATCC-Referenzstämme, frische klinische Isolate) von S.
epidermidis, S. aureus, Enterokokken, E. coli,
P. aeruginosa, Klebsiella spp., Enterobacter
und Candida albicans und C. glabrata getestet.
Alle Mikroorganismen waren auf Silber empfindlich, die antimikrobielle
Wirksamkeit von aktiviertem Nanosilber war bei den einzelnen
Isolaten weitgehend gleich. Am schnellsten (3 h) wird E.
coli, gefolgt von P. aeruginosa und S. epidermidis
eliminiert. Alle anderen Keime werden gleichmäßig
nach 6-9 Stunden (Enterobacter spp.) vom Katheter eliminiert
[53].
Klinische Studien
Bezüglich
antimikrobiell ausgestatteter Katheter haben sich in den letzten
Jahren neue Entwicklungen und Verbesserungen ergeben, die durch
prospektive, kontrollierte und randomisierte Studien belegt
sind. In diesen Untersuchungen bei Kurzzeitkathetern konnte
mit Kathetern der ersten Generation (250 cm² Oberfläche
von Ag ) bei 426
Patienten eine Reduktion Katheter-assoziierter Infektionen um
60% und mit einer Oberfläche von 450 cm² bei 165 Patienten
um 72% erzielt werden [54, 55]. Eine Postmarketing-Surveillance
bei 3.500 Patienten ergab mit diesem Katheter keine dokumentierte
Katheter-assoziierte Infektion sowie keine weiteren Komplikationen
wie Thrombosen etc. ) bei 426
Patienten eine Reduktion Katheter-assoziierter Infektionen um
60% und mit einer Oberfläche von 450 cm² bei 165 Patienten
um 72% erzielt werden [54, 55]. Eine Postmarketing-Surveillance
bei 3.500 Patienten ergab mit diesem Katheter keine dokumentierte
Katheter-assoziierte Infektion sowie keine weiteren Komplikationen
wie Thrombosen etc.
Bei einer
Fallbeobachtungsstudie mit einem Katheter der zweiten Generation
mit 2.000 cm² Ag /g
PU wurde bei 204 Patienten mit einer durchschnittlichen Liegedauer
von 9,2 Tagen nach dem Score-System bei einem Patienten eine
Katheter-assoziierte Infektion und bei keinem Patienten ein
Verdacht auf eine Infektion beobachtet, was einer Inzidenz von
0,52/1.000 Kathetertage entspricht [56]. /g
PU wurde bei 204 Patienten mit einer durchschnittlichen Liegedauer
von 9,2 Tagen nach dem Score-System bei einem Patienten eine
Katheter-assoziierte Infektion und bei keinem Patienten ein
Verdacht auf eine Infektion beobachtet, was einer Inzidenz von
0,52/1.000 Kathetertage entspricht [56].
Der Katheter
der III. Generation mit aktiviertem Nanosilber wird gegenwärtig
in einer prospektiven randomisierten Doppelblind-Untersuchung
bei 750 Patienten untersucht. Es liegen sehr günstige vorläufige
Ergebnisse bei 350 Patienten vor.
In einer
klinischen Studie mit einem mit Nanosilber und Platin ausgestatteten
Katheter (VANTEX®) wurde in einer randomisierten klinischen
Studie bei 206 Patienten bei 4 Patienten mit dem Kontrollkatheter
und bei 1 Patienten mit einem Silberkatheter eine Katheter-assoziierte
Infektion beobachtet [49].
Eine randomisierte
klinische Untersuchung mit einem mit der Nanosilber-Technologie
der ersten Generation ausgestatteten Hickman-Katheter zeigte
bei 5.990 Kathetertagen keine BSI versus 3 BSI bei 5.071 Kathetertagen
mit dem Kontrollkatheter [57].
Es zeigt
sich, dass die Technologie, die gesamte Katheter-Matrix mit
Nanosilber-Partikeln auszustatten, wobei sowohl nach außen
als auch in jedes Lumen Silberionen freigesetzt werden, klinisch
hoch wirksam ist.
Unterstützende Technologien
Verbesserungen
aus klinischer Sicht kann man zusätzlich durch sog. „Kitpacking“
erreichen. Eine nahtlose Fixierung – der Katheter kann
an der Eintrittsstelle nicht mehr verrutschen – und die
Zugabe aller wichtigen Legehilfen (Mantel, großes Lochtuch,
EKG-Ableitung über den Führungsdraht) bringt eine
Erleichterung und mindert das Risiko der Kontamination [58].
Auch ein
Chlorhexidin-getränkter Schwamm an der Eintrittsstelle
kann Infektionen an der Eintrittsstelle verhindern.
|
| Schlussfolgerung
Neuere Technologien
zur antimikrobiellen Ausstattung der Kunststoffe wie die beschriebene
Verwendung von aktiviertem Nanosilber lassen, wie sowohl experimentelle
als auch klinische Studien belegen, eine nachhaltige Wirksamkeit
und weitere Reduktion der Katheter-assoziierten Infektionen
erwarten. Insbesondere die Ausstattung der gesamten Kunststoffmatrix
– nicht nur der Oberfläche – mit aktiviertem
Nanosilber hat einen bedeutenden Fortschritt auf diesem Gebiet
erbracht.
Entsprechend
den vorgestellten Daten ist es gerechtfertigt und notwendig,
antimikrobiell ausgestattete Katheter Patienten nicht vorzuenthalten,
da sich diese für den einzelnen Patienten als eine entscheidende
Maßnahme erweisen können. Der Nutzen, den man durch
ihren Einsatz erzielt, steigt mit zunehmender Liegedauer exponentiell
und trägt zur Dämpfung der Kostensituation im Gesundheitsbereich
auch dadurch bei, dass die Liegedauer entsprechend geeigneter
Katheter erheblich verlängert werden kann. Mit Einführung
des diagnosegestützten Abrechnungssystems, bei dem Komplikationen
nicht mehr gesondert erstattungsfähig sind, wird die Prävention
von nosokomialen Infektionen einen noch höheren Stellenwert
erlangen.
Der Einsatz
antimikrobiell ausgestatteter Kunststoffe hat noch weiter reichende
Konsequenzen: Einerseits erübrigen sich bei einer gesicherten
antimikrobiellen Ausstattung der Katheter Maßnahmen um
stillgelegte Lumina oder bei intermittierender Verwendung von
Kathetern. Eine zusätzliche Wirksamkeit und Sicherheit
ist durch die Versorgung der Eintrittsstelle mit einem Chlorhexidin-getränkten
Schwamm oder mit silberimprägnierten Kollagenmanschetten
sowie durch die nahtlose Fixierung möglich.
Antimikrobiell,
d.h. auf der Basis aktivierter Silber-Nanopartikel ausgestattete
Katheter können zur Einschränkung der Verwendung von
Antibiotika auf Intensivstationen beitragen. Sobald ein verlässliches
und kostengünstiges System allgemein akzeptiert ist, ist
auch das Vorgehen bei Patienten mit Fieber auf Intensivstationen
zu ändern. Bisher hat man bei Fieber als erste Maßnahme
den Katheter gezogen und ein Antibiotikum verabreicht. In Zukunft
wird man den Katheter belassen und dafür die Diagnostik
auf andere, nicht Katheter-assoziierte Infektionen intensivieren.
Dies unterstützt die frühzeitige Diagnose und gezielte
Behandlung einer anderen Infektionsquelle und dadurch die Verbesserung
der therapeutischen Ergebnisse.
Die beschriebene
Technologie ist bei Polyurethan, Silikon, Polyäthylen und
Polypropylen sowie in Knochenzement einsetzbar. Sie kann neben
zentralen Kurz- und Langzeitkathetern auch bei Blasenkathetern,
ableitenden Ventrikelsystemen, bei endotrachealen Tuben, Tenckhoff-Kathetern
und Thoraxdrainagen zum Einsatz kommen.
Nach der
vorliegenden Datenlage ist der Einsatz antimikrobiell ausgestatteter
Katheter in vielen Kliniken gerechtfertigt. In den USA zeichnet
sich die zunehmende Verwendung antimikrobiell ausgestatteter,
in erster Linie aber außen beschichteter Katheter ab und
umfasst bereits 60% der verwendeten Katheter. Der umfassend
antimikrobiell ausgestattete Katheter auf der Basis aktivierten
Nanosilbers ist derzeit noch auf den europäischen Markt
beschränkt. |
Literatur:
1.
Hoyert D.L., Arias E., Smitz B.L., Murphy S.L., Kochanek
K.D.: „National Vital Statistics Reports 21. Sept.
2001.“
[http://www.cdc.gov/nchs/data/nvsr/nvsr49/nvsr49_08.pdf]. |
| 2.
Angus D.C., Linde-Zwirble W.T., Lidicker J., Clermont G.,
Carcillo J., Pinsky M.R.: „Epidemiology of severe
sepsis in the United Sates: analysis of incidence, outcome,
and associated costs of care.“ Crit. Care Med. 29
(2001) 1303-1310. |
| 3.
Vincent J.L., Bihari D., Suter P.M.: „The prevalence
of nosocomial infection in Europe: the result of the EPIC
Study.“ JAMA 274 (1995) 639-644. |
| 4.
Edmond M.B., Wallace S.E., McClish, Pfaller M.A., Jones
R.N., Wenzel R.P:. „Nosocomial bloodstream infections
in the United States hospitals. A three year analysis.“
Clin. Infect. Dis. 29 (1999) 239-244. |
| 5.
Luzzati R., Amalfitano G., Lazzarini L.: „Nosocomial
candidemia in non neutropenic patients in an Italian tertiary
care hospital.“ Europ. J. Clin. Microbiol. Infect.
Dis. 19 (2000) 602-607. |
| 6.
Guggenbichler J.P., Allerberger F., Dierich M.P., Schmitzberger
R., Semenitz E.: „Spaced administration of antibiotic
cominations to eliminate Pseudomonas from sputum in cystic
fibrosis.“ Lancet 2 (8613) (1988) 749-750. |
| 7.
Riedl M., Allerberger F., Guggenbichler J.P., Semenitz E.,
Dierich M.P.: „Behandlung von Sepsiserkrankungen im
Kindesalter mit zeitlich versetzter Gabe von Antibiotika-Kombinationen.“
Wien. Med. Wochenschr. 141 (1991) 172-178. |
| 8.
Amato M.B., Barbas C.S., Medeiros D.M., Magaldi R.B., Schettino
G.P., Lorenzi-Filho G., Kairalla R.A., Deheinzelin D., Munoz
C., Oliveira R., Takagaki T.Y., Carvalho C.R.: „Effect
of protective ventilation strategy on mortality in the acute
respiratory distress syndrome.“ N. Engl. J. Med. 338
(1998) 347-354. |
| 9.
The Acute Respiratory distress Syndrome Network: „Ventilation
with lower tidal volumes as compared with traditional tidal
vo-lumes for acute lung injury and the acute respiratory
distress syndrome.“ New Engl. J. Med. 342 (2000) 1301-1308. |
| 10.
Task force of the American College of Critical Care Medicine.
Society of Critical Care medicine: „Practice parameters
for hemodynamic support of sepsis in adult patients with
sepsis.“ Crit. Care Med. 27 (1999) 1301-1308. |
| 11.
Nguyen H.B., Rivers E.P., Havstad S., Knoblich B., Ressler
J.A., Muzzin A.M., Tomlanovich M.C.: „Critical care
in the emergency department: a physiologic assessment and
outcome evaluation.“ Acad. Emerg. Med. 7 (2000) 639-661. |
| 12.
Vincent J.L., Angus D.C., Artigas A., Kalil A., Basson B.R.,
Jamal H.H., Johnson G., Bernard G.R.: „Effects of
drotrecogin alfa (activated) on organ dysfunction in the
PROWESS trial.“ Crit. Care Med. 31 (2003) 834-840. |
| 13.
Neugebauer E., Rixen D., Daum M., Schäfer U.: „Thirty
years of anti mediator treatment in sepsis and septic shock
– what have we learned?“ Langenbecks Arch. Surg.
383 (1998) 26-34. |
| 14.
Bollaert P.E., Charpentier C., Levy B., Debouverie M., Audiber
G., Larcan A.: „Reversal of late septic shock with
supraphysiologic dosis of hydrocortisone.“ Crit. Care
Med. 26 (1998) 645-650. |
| 15.
Annane D., Sebille V., Charpentier C., Bollaert P.E., Francois
B., Korach J.M., Capellier G., Cohen Y., Azoulay E., Troche
G., Chaumet-Riffaut P., Bellissant E.: „Effect of
a treatment with low dosis of hydrocortisone and fludrocortisone
on mortality in patients with septic shock.“ JAMA
288 (2002) 862-971. |
| 16.
Van den Berghe G., Wouters P., Weekers F., Verwaest Ch.,
Bowers C.Y., Veldhuis J.D.: „Intensive insulin therapy
in the critically ill patients.“ New Engl. J. Med.
345 (2001) 1359-1367. |
| 17.
Senkal M., Kemen M., Homann H.H.: „Modulation of postoperative
immune response by enteral nutrition with diet enriched
with arginine, RNA, omega-3-fatty acids in patients with
upper gastrointestinal cancer.“ Eur. J. Surg. 161
(1995) 115-122. |
| 18.
Kastner U., Glasl S., Lugauer S., Guggenbichler J.P.: „Sepsis
– Neue Erkenntnisse zur Pathogenese, Therapie und
Prävention.“ Antibiotika Monitor tom XVII/4 (2001)
66-80. |
| 19.
Kastner U., Guggenbichler J.P.: „Enterale Infektionsprophylaxe
in der pädiatrischen Stammzelltransplantation: Orale
Dekontamination versus antiadhäsive Prophylaxe.“
Antibiotika Monitor tom XX/4, in Druck. |
| 20.
Eggimann P., Harnart S., Constatin N.M., Touveneau S., Chevrolet
J.C., Pittet D.: „Impact of a prevention strategy
at vascular access care on incidence of infections aquired
in intensive care.“ Lancet 355 (2000) 1864-1868. |
| 21.
Guggenbichler J.P.: „Otitis media.“ Antibiotika
Monitor tom VII/4 (1991) 71-75. |
| 22.
Guggenbichler J.P., Berchtold D., Allerberger F., Bonatti
H., Hager J., Pfaller W., Dierich M.P.: „In vitro
and in vivo effect of antibiotics on catheters colonised
by staphylococci.“ Eur. J. Clin. Microbiol. Infect
Dis. 11 (1992) 408-415. |
| 23.
Salomao R., Rigato O., Pignatari A.C., Freudenberg M.A.,
Galanos.: „Bloodstream Infections: Epidemiology, Pathophysiology
and Therapeutic Perspectives.“ Infection 27 (1999)
7-13. |
| 24.
Christensen G.D., Bisno L., Parisi J.T., Mc Laughlin B.,
Hester M.G., Luther W.: „Nosocomial septicemia due
to multiply antibiotic resistant Staphylococcus epidermidis.“
Ann. Int. Med. 96 (1982) 1-10. |
| 25.
Girmenia C., Martino P.: „New antifungal drugs and
new clinical trials: interpreting results may be difficult.“
Curr. Opin. Oncol. 15/4 (2003) 283-288. |
| 26.
Smith S., Dawson S., Hennessy R., Andrew M.: „Maintenance
of the patency of indwelling central venous catheters: is
heparin necessary.“ Am. J. Ped. Hematol. Oncol. 13
(1991) 141 -143. |
| 27.
Empfehlung der Kommission für Krankenhaushygiene und
Infektionsprävention beim Robert-Koch-Institut: „Prävention
Gefäßkatheter-assoziierter Infektionen.“
Bundesgesundheitsblatt 11 (2002) 907-823. |
| 28.
Pearson M.L., Committee HICPAC: „Guideline for the
prevention of intravascular device related infections.“
Infect. Control Hosp. Epidemiol. 17 (1996) 438-487. |
| 29.
Raad I., Hohn D.C., Gilbreath B.J., Suleiman N., Hill L.A.,
Bruso P.A., Marts K., Mansfield P.F., Bodey G.P.: „Prevention
of central venous catheter-related infections by using maximal
sterile barrier precautions. During insertion.“ Infect
Contr. Hosp. Epidemiol. 15 (1994) 213-238. |
| 30.
Maki D.G., Alvarado C.J., Ringer M.: „A prospective
randomised trial of povidone iodine, alcohol and chlorhexidine
for prevention of infection with central venous and arterial
catheters.“ Lancet 338 (1991) 339-343. |
| 31.
Ljungman P., Hagglund H., Gjorkstrand B., Lonnqvist B.,
Ringden O.: „Preoperative teicoplanin for prevention
of gram-positive infections in neutropenic patients with
indwelling central venous catheters: a randomised controlled
study.“ Support Care Cancer 5 (1997) 485-488. |
| 32.
Fridkin S.K., Pear S.M., Williamson T.H., Galgiani J.N.,
Jarvis W.R.: „The role of understaffing in central
venous catheter associated bloodstream infections.“
Infect. Control Hosp. Epidemiol. 17 (1996) 150-158. |
| 33.
Bach A.: „Prevention of infections caused by central
venous catheters established and novel measures.“
Infection 27 Suppl. 1 (1999) 11-15. |
| 34.
Frey P., Christ A.: „Katheterversorgung mit transparenten
Folienverbänden.“ Teil I: Heilberufe 50 (1998)
32-34. |
| 35.
Frey P., Christ A.: „Katheterversorgung mit transparenten
Folienverbänden.“ Teil II: Heilberufe 50 (1998)
38-39. |
| 36.
Sherertz R.J., Ely E.W., Westbrook D.M., Gledhill K.S.,
Streed S.A., Kiger B.: „Education of physicians in
training can decrease the risk for vascular catheter infection.“
Ann. Intern. Med. 132 (2000) 641-648. |
37.
Zuschneid I., Schwab F., Geffers C., Ruden H., Gastmeier
P.: „Reducing central venous catheter-associated primary
blood-stream infections in intensive care units is
possible: data from the German nosocomial infection surveillance
system.“ Infect. Contr. Hosp. Epidemiol. 24 (7) (2003)
501-505. |
| 38.
Bylock A.: „Surface morphology of unused and used
Hydromer coated intravenous catheters.“ Scan. Electr.
Micr. (1986) 157-164. |
| 39.
Scherhag Seifert L.M.: „Evaluation of in vivo adsorption
of blood elements onto hydrogel coated silicone rubber by
scanning electron microscopy and fourier transform infrared
spectroscopy.“ J. Biomed. Mat. res. 19 (1985) 1043-1071. |
| 40.
Veenstra D.L., Saint S., Saha S., Lumley Th., Sullivan S.D.:
„Efficacy of antiseptic-impregnated central venous
catheters in preventing catheter-related bloodstream infection.“
JAMA 281 (1999) 261-267. |
| 41.
Goudie J.G., Goudie R.B.: Recurrent infection by a stable
dwarf colony variant of Staphylococcus aureus.“ J.
Clin. Pathol. 8 (1955) 284-289. |
| 42.
Darouich R.O., Raad I.I., Heard S.O., Thornby J.E., Wenker
O.C., Garbrielli A.: „A comparison of two antimicrobial
impregnated central venous catheters.“ New Engl. J.
Med. 340 (1999) 1-8. |
| 43.
Kojic E., Darouiche R.O.: „Candida infections of medical
devices.“ Clin. Microb. Rev. 17 (2004) 255-267. |
| 44.
Wuhrman K.G., Zobrist F.: „Untersuchungen über
die bakterizide Wirkung von Silber in Wasser.“ Mitteilungen
eidgen. Anst. f. Wasserversorgung. Schweiz Hydrol. 20 (1958)
218-255. |
| 45.
Chambers C.W., Proctor C.M., Kabler P.W.: „Bactericidal
effect of low concentrations of silver.“ J. A. Water
works ass. 54 (1962) 208-214. |
| 46.
Naegeli V.: „Die Wirksamkeit von Silber auf Algen.“
Deutsch. Schr. Schweiz Naturforsch. Ges. 33 (1893) 174-182. |
| 47.
Thurman R.B., Gerba C.H.P.: „The molecular mechanisms
of copper and silver ion disinfection of bacteria and viruses.“
Crit. Rev. Environmental Control 18 (1989) 295-315. |
| 48.
Guggenbichler J.P., Böswald M., Lugauer S., Krall T.H.:
„A new technology of microdispersed silver in polyurethane
induces antimicrobial activity in central venous catheters.“
Infection 27 Suppl. 1 (1999) 16-23. |
| 49.
Ranucci M., Isgro G., Giomarelli P.P. et al.: „Impact
of oligon central venous catheter colonization and catheter
related blood stream infection.“ Crit. Care Med. 31
(1) (2003) 52-59. |
| 50.
Vygon: „Produktinformation: Antimikrobieller Katheter
auf der Basis Zeolith.“ |
| 51.
Cichos Ch.: „Unpublizierte Ergebnisse.“ (2004). |
| 52.
Guggenbichler J.P.: „Central venous catheter associated
infections: Pathophysiology incidence Clinical diagnosis
and Prevention – a review.“ Mat. Wiss. und Werkstofftechnik
34, 12 (2003) 1145-1154. |
| 53.
Guggenbichler J.P.: „Unpublizierte Ergebnisse.“
(2004). |
| 54.
Guggenbichler J.P., Beer A., Böswald M., Braun G.G.,
Burgmann H., Lugauer S., Regenfus A., Baratto F., Carlon
R., Meggiolaro M., Stoiser B., Frass M., Giron G.P.: „Reduced
rates of catheter related bloodstream infections by use
of a silver impregnated central venous catheter: results
of an European multicenter study.“ ECCMID Stockholm
(2000). |
| 55.
Böswald M., Lugauer S., Bechert Th., Greil J., Regenfus
A., Guggenbichler J.P.: „Thrombogenicity testing of
central venous catheters in vitro.“ Infection 27 Suppl
1 (1999) 30-33. |
| 56.
Guggenbichler J.P., Juhl G. and the study group silver catheter:
„Clinical investigation with a new silver impregnated
central venous catheter.“ Hyg. Med. 28 (2003) 235-242. |
| 57.
Guggenbichler J.P., Carbon R., Lugauer S., Geitner U., Regenfus
A., Böswald M., Greil J., Bechert Th., Hümmer
P.: „Reduced incidence of catheter related infections
in long term i.v. catheters in children by use of a silver
impregnated catheter.“ ECCMID Stockholm (2000). |
| 58.
Statlock System: „Nahtlose Fixierung.“ Produktinformation
Medex Medical (2004). |
Anschrift
des Verfassers:
Univ.-Prof. Dr. J. Peter Guggenbichler
Klinik mit Poliklinik der Universität Erlangen-Nürnberg
D-91054 Erlangen, Loschgestraße 15
E-Mail: prof.guggenbichler@gmx.de
|
|
|