| Josamycin -
das bessere Makrolid? |
| A. Georgopoulos
1, A. Buxbaum 1,2
1 Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, AKH Wien
(Leiter: Univ.-Prof. DDr. W. Graninger)
2 Univ.-Klinik für Innere Medizin IV, Klin. Abt. für
Pulmologie, AKH Wien
(Vorstand: Univ.-Prof. Dr. L.H. Block) |
Schlüsselwörter:
Atemwegsinfektionen,
Josamycin, Streptokokken, Pneumokokken, Resistenzsituation |
|
Zusammenfassung
Josamycin ist
ein Antibiotikum aus der Makrolidgruppe und wird bei Infektionen
der Atemwege, des HNO-Traktes, des Urogenitalbereiches, von Haut-
und Weichteilen, im Dentalbereich und bei posttraumatischen und
postoperativen Infektionen erfolgreich eingesetzt. Im Gegensatz
zu herkömmlichen Makroliden basiert die Struktur von Josamycin
auf einem 16-gliedrigen Laktonring. Dieser Unterschied hat sich
als klinisch relevant erwiesen. Ein häufig bei Streptokokken
vorkommender Resistenzmechanismus ("M-Resistenz") beruht
auf einer Efflux-Pumpe, die Makrolide kontinuierlich aus dem Zellinneren
heraustransportiert. Dieser Resistenzmechanismus bewirkt eine
Resistenz gegen Erythromycin, Clarithromycin, Azithromycin und
Roxithromycin, ist aber gegen Josamycin wirkungslos. Außerdem
kommt es durch Josamycin seltener zu einer Resistenzinduktion
als durch andere Vertreter der Makrolidgruppe. Neue Daten zeigen
auch eine hervorragende Wirkung gegen Ureaplasma urealyticum
und Mycoplasma hominis. |
Key-words:
Infection
of the respiratory tract, josamycin, streptococci, pneumococci,
resistance |
|
Summary
Josamycin as
an antibiotic substance of the macrolid group is used with great
effect against infections of the respiratory tract, of the ear/nose/throat
region, against urogenital, dermatological and abdominal diseases,
in dentistry and against post-traumatic and postoperative infections.
In comparison with traditional macrolids josamycin has a 16-limbed
lacton-circle. This structural differenence results in clinical
relevance. Streptococci often manifest resistance mechanism (M-resistance)
based on an efflux-pump which transports continuously macrolids
out of the cell. This resistance mechanism effects resistential
reaction against erythromycin, clarithromycin, azithromycin and
roxithromycin but not against josamycin. Furthermore resistance
induction is not as often as in other substances of the macrolid
group. Excellent effect against Ureaplasma urealyticum
and Mycoplasma hominis could be demonstrated in recent
studies. |
Einleitung
Josamycin
ist ein oral verabreichbares Antibiotikum aus der Gruppe der
Makrolide, isoliert aus dem Kulturmedium von Streptomyces
narbonensis var. josamyceticus.
Die zu
der großen Gruppe der Makrolide gehörenden Antibiotika
unterscheiden sich trotz der gemeinsamen makrozyklischen Laktonstruktur
vielfach in ihrem molekularen Aufbau. Josamycin besitzt - im
Gegensatz zu den anderen im Handel befindlichen Makroliden -
einen 16-gliedrigen Laktonring und durch eine lineare Anordnung
von Aminozucker und Zucker, verestert mit einer aliphatischen
Carbonsäure, eine sehr lange Seitenkette.
Ein klinisch
besonders wichtiger Unterschied liegt im Aufbau des Laktonringes.
Während Erythromycin, Clarithromycin und Roxithromycin
einen 14-gliedrigen und Azithromycin einen 15-gliedrigen Laktonring
besitzen, hat der Laktonring von Josamycin 16 Glieder. Ein überaus
wichtiger Unterschied, denn dadurch sind Resistenzen, die auf
einem Makrolid-Efflux-Mechanismus beruhen, gegen Josamycin unwirksam.
Es ist
nicht überraschend, dass derartige strukturelle Charakteristika
nicht nur die physiko-chemischen Eigenschaften, sondern auch
das pharmakologische Verhalten beeinflussen (Abbildung 1) [1].
Es erscheint daher nötig, Josamycin als speziellen Vertreter
der Gruppe der
Makrolide differenzierter zu betrachten, um Besonderheiten bzw.
Vorteile für die Therapie besser ausschöpfen zu können.
Abbildung
1: Chemische Struktur
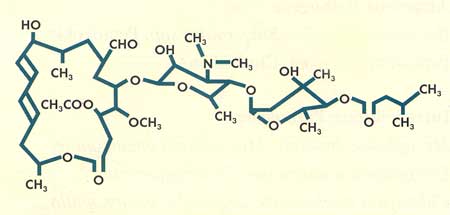
|
|
Pharmakokinetik
Josamycin
ist deutlich säurestabiler als Erythromycin und wird nach
oraler Applikation im Gastrointestinaltrakt fast vollständig
resorbiert, maximale Serumkonzentrationen können nach etwa
einer Stunde nachgewiesen werden [2]. Nahrungsaufnahme verzögert
zwar die Resorption, maximale Konzentrationen werden in diesem
Fall erst nach 2 Stunden gemessen. Signifikante Unterschiede
der Spitzenkonzentrationen zwischen nüchternen und nicht
nüchternen Probanden bestehen nicht. Gemessen wurden nach
oraler Einzelgabe (nüchtern) von 1 g nach einer Stunde
Plasmakonzentrationen von 2,4 bis 3 mcg/mL, nach Einzelgabe
von 1,5 g nach 1,5 Stunden 3,5 bis 7,2 mcg/mL (Mittelwert 5
mcg/mL) [3, 4, 5]. Die Plasmaspiegel steigen während längerer
Einnahme an und erreichen schließlich Steady-State-Bedingungen.
Bei Tagesdosen
von 1.500 mg werden nach 49 Stunden Serumkonzentrationen von
1,64 mcg/mL, bei 2.000 mg zum gleichen Zeitpunkt 2,3 mcg/mL
erreicht [6].
Entsprechend
dem Verteilungskoeffizienten ist Josamycin wesentlich lipophiler
(> 15fach) als Erythromycin. Die Bindung an Serumeiweiß
liegt mit 15% dagegen wesentlich niedriger als diejenige von
Erythromycin (80 - 90%).
Tabelle
1: Penetration von Josamycin in verschiedene
Gewebe (nach Periti P., 1989)
| |
Penetration |
Konzentrations-
verhältnis
Gewebe / Serum |
| Bronchialflüssigkeit |
| Röhrenknochen |
| Lunge |
| Mittelohr
(Exsudat) |
| Kieferknochen |
| Speichel |
| Tränenflüssigkeit |
| Tonsillen |
|
|
0,28
- 0,48 |
0,8 |
1,3
- 2,9 |
0,49
- 2,3 |
0,4 |
0,4 |
0,8 |
7
- 28 |
|
| ++
= ausgezeichnet |
+
= gut |
-
= schlecht |
|
|
Josamycin
penetriert daher hervorragend ins Gewebe (Tabelle 1) [4]. Das
errechnete Verteilungsvolumen beträgt cirka 300 L [3].
Die Gewebskonzentrationen liegen im Allgemeinen bei adäquater
Dosierung über den für die Wirksamkeit nötigen
Hemmkonzentrationen von 0,5 mcg/mL bei z.B. Mycoplasma pneumoniae,
Streptococcus pneumoniae, Streptococcus pyogenes,
Corynebacterium diphtheriae und Neisseria meningitidis
bzw. über 2 mcg/mL bei Staphylococcus aureus und
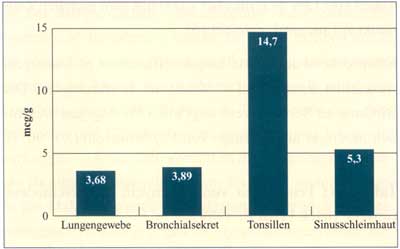
Bacteroides fragilis (Abbildung 2) [7, 8, 9]. Wie alle
Makrolid-Antibiotika penetriert Josamycin auch sehr gut in den
intrazellulären Raum, was für die Wirkung gegen in
der Zelle gelegene Pathogene, wie Mykoplasmen, Chlamydien oder
Legionellen, aber auch bei in Phagozyten eingeschlossenen Staphylokokken
sehr wichtig ist.
Abbildung
2: Josamycin-Konzentrationen im Gewebe (nach
Carlone N.A., 1982; Wildfeuer A., 1987)
|
Josamycin
wird in der Leber metabolisiert und primär biliär
eliminiert, weniger als 20% der eingenommenen Dosis gelangen
unverändert in den Urin. 4 Metaboliten wurden identifiziert,
nur der 15-hydroxylierte Metabolit ist antimikrobiell aktiv,
allerdings in einem geringeren Ausmaß als die Muttersubstanz.
Die Eliminationshalbwertszeitbeträgt 0,9 - 2,0 Stunden
[4, 6, 7, 10, 11, 12, 13, 14, 15, 16].
|
| Antimikrobielle
Aktivität
Wie alle Makrolide wirkt Josamycin unabhängig von der Zellwandsynthese
auch auf zellwandlose, nicht proliferierende Keime bakteriostatisch
durch Blockierung der Peptidyltransferase in der Proteinbiosynthese
infolge Bindung an die Fraktion 50S und 70S der Ribosomen der
Zielbakterien. Dieser Vorgang behindert durch Interferenz mit
der Fixierung des t-RNA-Aminosäurenkomplexes die Ablesung
der messenger-RNS und so in Folge auch die Funktion der Ribosomen.
Bei Konzentrationen über dem 2 - 4 fachen minimalen Hemmkonzentrationswert
(MHK) wirkt Josamycin auch bakterizid. Die Destabilisierung
des Ribosomen-Peptidyl-tRNA-Komplexes wird dabei von der Größe
des Makrolid-Moleküls beeinflusst.
Großmolekulare Makrolide mit einem 16-gliedrigen Laktonring,
sowie Lincosamine oder Streptogramin B destabilisieren den Ribosomen-Peptidyl-tRNA-Komplex
viel stärker als kleinere Moleküle. Aus diesem Grund
kommt es durch Josamycin deutlich seltener zu einer Resistenzinduktion
als durch andere Vertreter der Makrolide (Tabelle 2) [17].
Tabelle
2: In-vitro-Keimspektrum von Josamycin
In-vitro-Keimspektrum
von Josamycin
Gram-positive aerobe Pathogene
Staphylococcus aureus, Staphylococcus epidermidis,
Staphylococcus citreus, Streptococcus pneumoniae,
Streptococcus pyogenes, Corynebacterium diphtheriae
Listeria
monocytogenes
Gram-negative aerobe Pathogene
Bordetella pertussis, Haemophüus influenzae,
Neisseria meningitidis, Neisseria gonorrhoeae,
Treponema pallidum
Anaerobe Pathogene
Bacteroides fragüis, Bacteroides spp,
Peptokokken,
Peptostreptokokken, Clostridien
Intrazelluläre Pathogene
Mycoplasma hominis, Mycoplasma pneumoniae,
Ureaplasma urealyticum, Chlamydia psittaci,
Chlamydia trachomatis, Legionella pneumophüa,
Rickettsiaceae
|
|
Streptokokken
Seit einigen Jahren steigt die Resistenz von Streptokokken gegen
Makrolide weltweit an. Österreich und Deutschland sind
zwar noch nicht in dem Ausmaß wie andere Staaten (USA,
Südeuropa, Japan etc.) betroffen, es zeigt sich aber dennoch
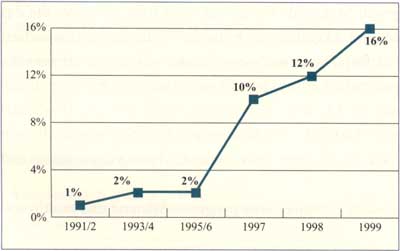
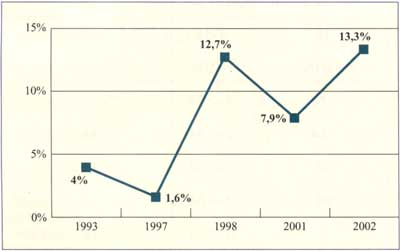
eine stetig steigende Tendenz (Abbildungen 3, 4). Allerdings
sind nicht alle Makrolide gleichmäßig betroffen -
durch die 16-gliedrige Struktur des Laktonringes gelten diese
Daten nicht für Josamycin (Abbildung 5, 6, 7) [18, 19,
20, 21].
Abbildung
3: Anstieg der Resistenzen gegen Erythromycin
bei Pneumokokken in Linz (nach Jebelean C. et al., 2001)
|
Abbildung
4: Anstieg der Makrolid-Resistenzen bei Streptococcus
pyogenes in Deutschland (nach Sauermann R. et al., 2003)
|
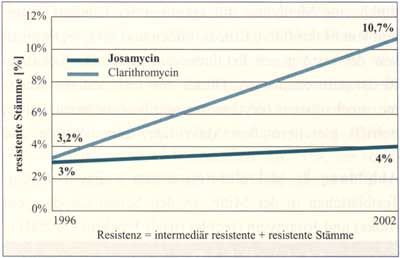
Abbildung
5: Anstieg resistenter Pneumokokken, Vergleich
1996 - 2002 (nach Buxbaum A., 2004, Georgopoulos A., 2004)
|
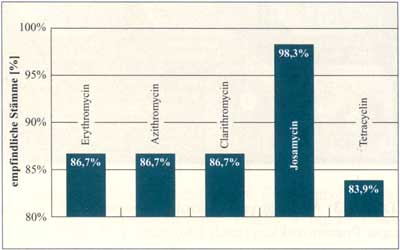
Abbildung
6: Aktivität gegen Streptococcus pyogenes,
540 Isolate (Bayern 1999 - 2000) (nach Sauermann R., 2003)
|
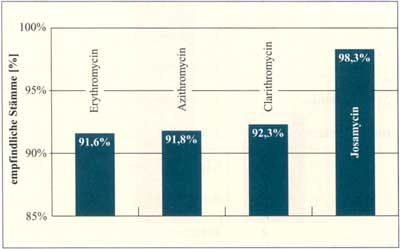
Abbildung
7: Aktivität gegen Pneumokokken, 598 Isolate
(Österreich 1999 - 2001) (nach Jebelean C., 2002)
|
Makrolide,
wie auch Lincosamine und Streptogramine, wirken durch Behinderung
der Proteinsynthese an bakteriellen Ribosomen. Eine Ribosomen-Alteration
durch eine Methylase mit verminderter Bindungsfähigkeit
von Makroliden, Lincosaminen und Streptograminen war der erste
gegen Erythromycin gerichtete, bekannte Resistenzmechanismus.
Dieser erm-Gen-codierte Resistenzmechanismus (erythromycine
ribosome methylation) betrifft gleichermaßen Makrolide,
Lincosamide und Streptogramin B ("MLSB-Resistenz").
Daher sollte bei diesem Typ die alleinige Testung von Erythromycin
ausreichend Auskunft über die zu erwartende Wirksamkeit
der gesamten Makrolid-Gruppe geben. Das gilt jedoch nur mit
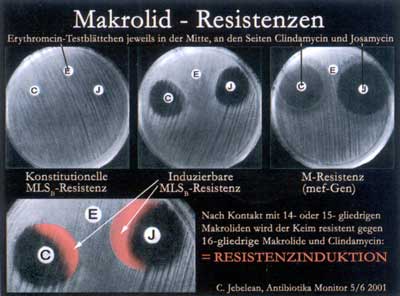
Einschränkungen, denn manche Erreger tragen induzierbare
MLSBi-Resistenzen, die zwar im Genotyp vorhanden, jedoch im
Phänotyp noch nicht ausgeprägt sind. Da Josamycin
wesentlich seltener Resistenzen induziert als herkömmliche
Makrolide, sind diese Pathogene, obwohl sie eine erm-Gen-codierte
MLSBi-Resistenz besitzen, empfindlich gegen Josamycin. Kommen
diese Erreger mit MLSBi-Resistenz in Kontakt mit herkömmlichen
Makroliden, wie Erythromycin, dann wird der Resistenzmechanismus
induziert und der resistente Phänotyp ausgebildet (MLSBc).
Gegen diese Erreger ist dann auch Josamycin unwirksam (Abbildung
8) [22].
Abbildung
8: Makrolid-Resistenzen - Erythromycin-Testblättchen
in der Mitte, an den Seiten Clindamycin (links) und Josamycin
(rechts) (nach Jebelean C., 2001)
|
Ein weiterer
Resistenzmechanismus ("M-Resistenz") gegen Makrolide
beruht auf einer Efflux-Pumpe, die das Makrolid kontinuierlich
aus dem Zellinneren transportiert [23, 24]. Dieser mef-Gen-codierte
Resistenzmechanismus (macrolide efflux) betrifft nur Makrolide
und unter ihnen
nur die 14- und 15-gliedrigen, nicht aber die 16-gliedrigen
Makrolide, wie Josamycin. Diese Stämme erscheinen daher
bei In-vitro-Tests immer Erythromycin-resistent und
zeigen eine Kreuzresistenz gegen Clarithromycin, Azithromycin
und Roxithromycin. Daher gibt die alleinige
Testung von Erythromycin hier keine ausreichende Auskunft über
eine Resistenz gegen Josamycin, denn auch bei Unempfindlichkeit
gegen Erythromycin wirkt Josamycin bei M-Resistenzen.
Bei Streptococcus
pneumoniae existieren noch andere Resistenzmechanismen
gegen Makrolide, wie Esterasen, Phosphorylasen und Mutationen
in den ribosomalen Proteinen L4 und L22 bzw. in der ribosomalen
23S rRNA, die aber wesentlich seltener sind [25].
Infolge
seiner Sonderstellung wirkt Josamycin daher bei einem nicht
unbeträchtlichen Teil jener Streptokokken, bei denen andere
Makrolide unwirksam sind (Tabelle 3) [26]. Der Unterschied zwischen
Josamycin und den anderen, herkömmlichen Makroliden ist
von der Inzidenz der einzelnen Resistenzmechanismen abhängig.
Je höher der Anteil der mef-Gen-codierten M-Resistenz
liegt, desto besser wirkt Josamycin, auch wenn andere Makrolide
versagen. Die Häufigkeit der Resistenzmechanismen wird
unterschiedlich angegeben und scheint geographischen Einflüssen
zu unterliegen. In einer rezenten Publikation aus Österreich
wird bei Erythromycin-resistenten Streptococcus pyogenes-Stämmen
der Anteil von M-Resistenzen mit 71%, bei resistenten Pneumokokken
mit 34% angegeben (Tabelle 4, 5) [18,22].
Tabelle
3: Aktivität von Makroliden gegen Erythromycin-resistente
Streptococcus pyogenes-Stämme und multiresistente
Pneumokokken (nach Klugmann K.P., 1998)
| Pathogen
(n) |
Makrolid |
MIC50
(mg/L) |
MIC90
(mg/L) |
Bereich |
Laktonring-Glieder |
| S.
pyogenes, |
| Erythromycin- |
| resistent
(40) |
| . |
| . |
|
| Erythromycin |
| Roxithromycin |
| Clarithromycin |
| Azithromycin |
| Josamycin |
|
|
|
2
- 8 |
4
- 8 |
16
- 32 |
4
- 16 |
<
0,06 |
|
|
| S.
pneumoniae, |
| multiresistent
(40) |
| . |
| . |
| . |
|
| Erythromycin |
| Roxithromycin |
| Clarithromycin |
| Azithromycin |
| Josamycin |
|
|
|
4
- > 64 |
2
- > 64 |
2
- > 64 |
2
- > 64 |
0,12
- 4 |
|
|
|
Tabelle
4: Inzidenz der Resistenzmechanismen von Streptokokken
- Erythromycin-resistente Streptokokken in Österreich
1999/2000 (nach Jebelean C., 2001)
| Pathogen |
erm* |
mef |
Kombination |
andere |
| S.
pyogenes |
| S.
agalactica |
| S.
pneumoniae |
| Vergrünende
S. |
|
|
|
|
|
| *erm
+ ermTR |
|
Tabelle
5: MHK - Grenzwerte für Streptococcus
pneumoniae (nach Jebelean C., 2002)
| |
empfindlich |
intermediär-
empfindlich |
resistent |
| Erythromycin |
| Roxithromycin |
| Clarithromycin |
| Azithromycin |
| Josamycin |
|
|
|
|
*
Grenzwerte des Comité de l'Antibiogramme de
la Société Francaise de Microbiologie
**NCCLS - Grenzwerte 01 / 2001 |
|
Staphylokokken
Wie bei anderen Pathogenen zeigt die Resistenzrate gegen Makrolide
auch bei Staphylokokken steigende Tendenz. Dem 16-gliedrigen
Josamycin kommt auch hier eine Sonderstellung zu. Laut Untersuchungen
scheint Josamycin den 14- und 15-gliedrigen Makroliden in der
In-vitro-Wirksamkeit gegen Erythromycin-resistente
Staphylococcus aureus-Stämme überlegen zu
sein (Abbildung 9, 10) [27, 28]. Nach Gabe von Josamycin bleibt
auch ein deutlicher postantibiotischer Effekt gegen intraleukozytäre
Staphylococcus aureus bestehen [29].
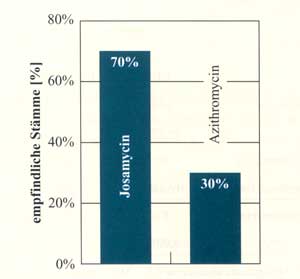
Abbildung
9: Empfindlichkeit von Erythromycin-resistenten
Staph. aureus-Stämmen (MHK 4 mg/L) (nach
Georgopoulos M., 1993)
|
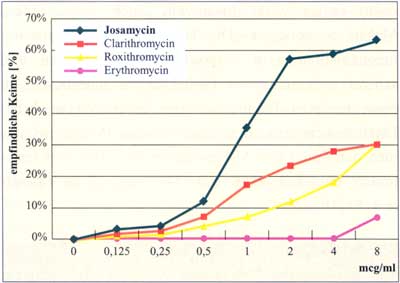
Abbildung
10: In-vitro-Aktivität gegen Erythromycin-resistente
Staphylokokken (MHK 4 mcg/ml) (nach Georgopoulos
A., 1993)
|
Intrazelluläre
Pathogene
Infolge seiner guten Penetrationsfähigkeit in das Zielgewebe
und in den Intrazellularraum wirkt Josamycin auch sehr gut gegen
intrazelluläre Pathogene, wie Mycoplasma hominis,
Mycoplasma pneumoniae, Ureaplasma urealyticum,
Chlamydia psittaci, Chlamydia trachomatis
und Legionellen. Die zur antimikrobiellen Wirksamkeit notwendigen
Konzentrationen werden von Josamycin problemlos erreicht (Tabelle
6a, 6b) [30, 31].
Die Wirksamkeit gegen Mycoplasma pneumoniae entspricht
laut Vergleichsstudien zumindest derjenigen von Erythromycin
[16, 32, 33]. Gegen Ureaplasma urealyticum ist Josamycin
deutlich wirksamer als Roxithromycin oder Azithromycin, insbesondere
bei kombinierten Infektionen durch Ureaplasma urealyticum
und Mycoplasma hominis (Tabelle 7) [34].
Tabelle
6a: Empfindlichkeit von 137 Mycoplasma pneumoniae-Isolaten
gegen Josamycin (nach Suzaki K., 1982)
Anzahl
empfindlicher Isolate |
MHK
(mcg/ml) |
%
empfindlicher
Isolate |
|
0,0031 |
0,0061 |
0,0122 |
0,024 |
Summe |
|
1,5% |
18,2% |
55,5% |
24,8% |
100% |
|
|
Tabelle
6b: Empfindlichkeit von 36 Legionella-Stämmen
gegen Makrolide (nach Bornstein N., 1985)
| Makrolid |
MHK |
| Josamycin |
| Erythromycin |
| Spiramycin |
|
0,06
- 0,25 mcg/ml |
0,12
- 0,5 mcg/ml |
1,0
- 5,0 mcg/ml |
|
|
Tabelle
7: In-vitro-Empfindlichkeit von Ureaplasma
urealyticum und Mycoplasma hominis gegen
Makrolide (nach Huang C., 2003)
| |
empfindlich |
intermediär
empfindlich |
resistent |
UU |
UU
+ MH |
UU |
UU
+ MH |
UU |
UU
+ MH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| UU
= Ureaplasma urealyticum
MH = Mycoplasma hominis |
|
|
| Klinischer
Einsatz
Josamycin wurde im Rahmen von Studien an über 35.000 Patienten
verabreicht. In erster Linie handelt es sich dabei um Studien
über Infektionen der oberen und unteren Atemwege und des
HNO-Traktes. Die klinischen Behandlungserfolge betragen durchschnittlich
etwa 97%. Aufgrund der hohen Erfolgsraten ist Josamycin ein
Antibiotikum der ersten Wahl bei HNO- und Atemwegsinfekten und
eignet sich zur empirischen Therapie, das heißt ohne vorherige
Bestimmung des Pathogens. Infolge der im Vergleich mit herkömmlichen
Makroliden überlegenen Wirksamkeit gegen Streptokokken
ist Josamycin vor allem bei Tonsillitis bzw. Pharyngitis ein
idealer Ersatz für Penicillin-Antibiotika.
Durch seine
gute Wirksamkeit gegen Staphylokokken kann Josamycin auch erfolgreich
gegen Infektionen von Haut und Weichteilen sowie bei schwereren
Formen von Akne eingesetzt werden. Die gute Penetration macht
Josamycin, vor allem bei Patienten mit Betalaktam-Allergien,
auch zu einem geeigneten Antibiotikum bei dentalen Eingriffen.
Josamycin
wurde in verschiedenen klinischen Studien bei Infektionen der
unteren und oberen Atemwege, des HNO-Traktes, bei Haut- und
Weichteilinfekten, sowie bei urologischen Indikationen erfolgreich
eingesetzt.
Atemwegsinfektionen
Josamycin erwies sich in verschiedenen Studien bei Atemwegsinfektionen
als sehr wirkungsvoll. Bei Infektionen der oberen Atemwege,
im Pharynx- und Tonsillen-Bereich sind die hohen Erfolgsraten
(zwischen 96,3% und 97,8% ) zu einem hohen Grad auf die verlässlichere
Wirksamkeit gegen Streptokokken zurückzuführen (Tabelle
8) [35]. Josamycin wurde auch erfolgreich bei akuten Exazerbationen
von chronischen Bronchitiden eingesetzt. Die klinische Erfolgsrate
der 14-tägigen Therapie lag im Durchschnitt bei 95,2% -
bei Patienten unter 65 Lebensjahren bei 96,3% und bei über
65-Jährigen bei 93,3% (Tabelle 9) [36]. Unter der Therapie
mit Josamycin konnte in 95,2% der Fälle eine Eradikation
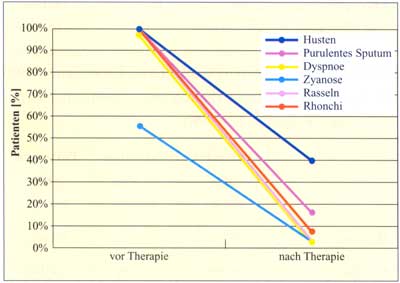
des Pathogens erreicht werden (Tabelle 10). Auch die Symptome
der chronischen Bronchitis wurden durch die Behandlung signifikant
gebessert (Abbildung 11).
Tabelle
8: Klinische Wirksamkeit von Josamycin bei Infektionen
der oberen und unteren Atemwege (nach Osono T., 1979)
| Diagnose |
Anzahl
Patienten |
Erfolgsrate |
| Laryngopharyngitis |
| Pharyngitis |
| Laryngitis |
| Tonsillitis |
| Obere
Atemwegsinfekte |
| Angina |
| Bronchitis |
| Pneumonie |
| Bronchopneumonie |
| Mykoplasmenpneumonie |
|
1.481 |
934 |
167 |
2.656 |
2.068 |
157 |
4.946 |
668 |
482 |
89 |
|
97,8% |
96,3% |
96,4% |
97,7% |
97,8% |
93,0% |
96,5% |
94,5% |
95,4% |
96,6% |
|
|
Tabelle
9: Klinische Wirksamkeit von Josamycin (1.500
mg/Tag) bei akuter Exazerbation einer chronischen Bronchitis
(nach Fraschini F., 1990)
|
Patienten
alle
n = 42 |
Patienten
< 65a
n = 27 |
Patienten
 65a
65a
n = 15 |
| Heilung |
| Besserung |
| Kein
Erfolg |
| Klinischer
Erfolg |
|
|
|
|
|
Tabelle
10: Eradikation der Erreger durch 14-tägige
Therapie mit Josamycin bzw. Clarithromycin bei akuter
Exazerbation einer chronischen Bronchitis (nach Fraschini
F., 1990)
|
Josamycin |
Clarithromycin |
| Anzahl
Patienten |
| Eradikation |
| Erregerpersistenz |
|
|
|
|
Abbildung
11: Besserung der Symptome bei akuter Exazerbation
einer chronischen Bronchitis durch Josamycin (1.500 mg/d)
(nach Franschini F., 1990)
|
Tabelle
11: Klinische Wirksamkeit von Josamycin bei unterschiedlichen
bronchopulmonalen Infekten (n=6.033) (nach Lozarno R.,
1991)
| |
Pneumonie |
Atypische
Pneumonie |
Akute
Bronchitis |
Chronische
Bronchitis |
| Anzahl
Patienten |
| Anzahl
Patienen (%) |
| Heilung |
| Besserung |
| Kein
Erfolg |
| Klinischer
Erfolg |
|
834 |
(14%) |
84,8% |
12,9% |
2,3% |
97,7% |
|
468 |
(8%) |
84,6% |
12,9% |
2,5% |
97,5% |
|
2.638 |
(44%) |
81,5% |
16,5% |
2,0% |
98,0% |
|
2.093 |
(35%) |
30,3% |
66,0% |
3,7% |
96,3% |
|
|
Tabelle
12: Klinische Wirksamkeit von Josamycin bei Infektionen
des HNO-Bereiches (nach Osono T., 1979)
| Diagnose |
Anzahl
Patienten |
Erfolgsrate |
| Sinusitis |
| Sinusitis
maxillaris |
| Otitis
media |
| Otitis
externa |
Furunculosis
des
äußeren Gehörganges |
|
|
92,1% |
100,0% |
92,2% |
96,9% |
97,4%
. |
|
|
Ein ähnlich
gutes Ergebnis konnte bei der Behandlung von 6.033 ambulanten
Patienten mit verschiedenen Atemwegsinfekten erzielt werden.
Die klinische Erfolgsrate von Josamycin lag je nach Art des
bronchopulmonalen Infektes zwischen 98,0% und 96,3% (Tabelle
11) [37]. Durch die breite Wirkung gegen atypische Erreger von
Atemwegsinfektionen ist Josamycin ohnehin ein Mittel der ersten
Wahl gegen Infektionen mit Chlamydien, Mykoplasmen und Legionellen.
HNO-Trakt-Infektionen
Der Einsatz von Josamycin bei Infektionen im Hals-Nasen-Ohrenbereich
wurde bei fast 2.000 Patienten in klinischen Studien dokumentiert.
Die klinischen Erfolgsraten lagen zwischen 92,1% und 100,0%.
Der gute Erfolg bei Infektionen des äußeren Gehörganges
ist wahrscheinlich auf die überlegene Wirksamkeit gegen
Staphylokokken zurückzuführen (Tabelle 12) [35].
Haut- und Weichteil-Infektionen
Durch seine überlegene Wirksamkeit gegen Staphylokokken,
die höhere Unempfindlichkeit gegen Resistenzmechanismen
von Streptokokken und seine gute Penetrationsfähigkeit
kann Josamycin auch erfolgreich gegen Infektionen im Haut- und
Weichteilbereich eingesetzt werden (Tabelle 13) [35]. Vor allem
bei Allergien gegen Penicilline bzw. Cephalosporine ist Josamycin
eine wirksame Alternative zu den Betalaktam-Antibiotika. Darüber
hinaus ist Josamycin hochwirksam gegen Propionibacterium
acnes und kann auch daher effizient zur Therapie von Akne
eingesetzt werden (Tabelle 14) [38].
Tabelle
13: Klinische Wirksamkeit von Josamycin bei Infektionen
von Haut- und Weichteilen (nach Osono T., 1979)
| Diagnose |
Anzahl
Patienten |
Erfolgsrate |
| Pyodermie |
| Follikulitis |
| Akne |
| Furunkel |
| Karbunkel |
| Flurunkulosis |
| Suppuratives
Atherom |
| Panaritium |
| Phlegmone |
| Abszess |
|
47 |
94 |
359 |
653 |
73 |
141 |
130 |
189 |
121 |
23 |
|
95,7% |
95,7% |
95,0% |
97,9% |
97,3% |
94,3% |
96,2% |
95,8% |
95,0% |
100,0% |
|
|
Tabelle
14: In-vitro-Aktivität von Makroliden
gegen Propionibacterium acnes (nach Yamaji E.,
1997)
|
Josamycin |
Erythromycin |
Roxithromycin |
|
|
|
|
|
Infektionen
im Urogenitalbereich
Bei urogenitalen Infektionen ist die hohe klinische Erfolgsrate
großteils auf die gute Wirksamkeit gegen intrazelluläre
Pathogene bzw. auf die überlegene Wirksamkeit gegen Ureaplasma
urealyticum und Mycoplasma hominis zurückzuführen.
Wie eine rezente Studie zeigt, ist Josamycin eines der wirksamsten
Antibiotika bei NGU (non-gonococcal Urethritis). Ureaplasma
ureaIyticum sind zu 96,67% empfindlich, auch bei Kombinationsinfektionen
von Ureaplasma urealyticum plus Mycoplasma hominis
sprechen 71,43% der Pathogene auf Josamycin an (Tabelle 15,
16). Im Gegensatz zu den anderen Makroliden hat die Resistenz
gegen Josamycin in den letzten Jahren nicht zugenommen, Josamycin
sollte daher bei Mykoplasmeninfektionen im Urogenitaltrakt als
Mittel der ersten Wahl eingesetzt werden [35, 39].
Tabelle
15: Wirksamkeit von verschiedenen Antibiotika
gegen Ureaplasma urealyticum und Kombinationsinfektionen
von Ureaplasma urealyticum plus Mycoplasma
hominis (nach Huang C., 2003)
| Josamycin |
>
Doxycyclin |
>
Minocyclin |
| |
>
Sparfloxacin |
>
Roxithromycin |
| |
>
Ofloxazin |
>
Azithromycin |
|
|
Tabelle
16: Klinische Wirksamkeit von Josamycin bei Infektionen
im Urogenitalbereich (nach Osono T., 1979)
| Diagnose |
Anzahl
Patienten |
Erfolgsrate |
| Urethritis |
| Zystitis |
| Epididymititis |
|
|
|
|
Infektionen
im Dentalbereich
Josamycin dringt sehr gut in das Zahngewebe bzw. dessen Umgebung
vor. In Zahngranulomen wurden nach Einnahme von nur 600 mg Josamycin
Konzentrationen von 2,39 mcg/ml, also über der MHK der
entsprechenden Pathogene gefunden [40]. Die klinischen Erfolgsraten
zeigen, dass Josamycin bei Infektionen im Zahnbereich erwartungsgemäß
sehr effektiv ist. In einer doppelblinden Studie wurde die Eradikationsrate
bei odontogenen Infekten für Josamycin mit 97,4% angegeben
(Tabelle 17) [41,35].
Tabelle
17: Klinische Wirksamkeit von Josamycin bei Infektionen
im Dentalbereich (nach Osono T., 1979)
| Diagnose |
Anzahl
Patienten |
Erfolgsrate |
| Peridontitis |
| Alveolitis |
| Pericoronitis |
| Sinusitis
maxillaris |
| Gnathitis |
| Alveolarabszess |
|
|
97,7% |
96,6% |
96,9% |
100,0% |
90,7% |
99,4% |
|
|
Posttraumatische und postoperative Infektionen
Durch das breite Spektrum, die gute Staphylokokken-Wirksamkeit
und die geringere Inzidenz von Resistenzen bei Streptokokken
kann Josamycin auch sehr erfolgreich bei posttraumatischen und
postoperativen Infektionen eingesetzt werden (Tabelle 18) [35].
Tabelle
18: Klinische Wirksamkeit von Josamycin bei posttraumatischen
und postoperativen Infektionen (nach Osono T., 1979)
| Diagnose |
Anzahl
Patienten |
Erfolgsrate |
| Postoperative
Infekte |
| Infekte
nach Verbrennungen |
| Wundinfektionen |
|
|
|
|
|
| Einsatz
in der Pädiatrie
In der Pädiatrie wurde Josamycin vor allem bei Infektionen
der Atemwege und des HNO-Bereiches erfolgreich geprüft.
In den einzelnen Indikationen sind die klinischen Erfolgsraten
von 2 großen multizentrischen Studien mit insgesamt fast
3.800 Patienten vergleichbar und bewegen sich zwischen 90,0%
und 100,0% (Tabelle 19, 20; Abbildung 12, 13) [14,42]. Josamycin
erwies sich im Rahmen dieser Studien sowohl bei Infekten der
unteren als auch der oberen Atemwege bzw. des HNO-Traktes als
sehr wirksam, bei Scharlach war die Anwendung in beiden Studien
ein jeweils 100%iger Erfolg.
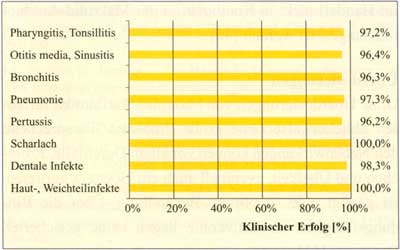
Tabelle
19: Klinische Wirksamkeit von Josamycin (Multizenterstudie,
1.908 Kinder Ø 5,27 Jahre) (nach PriviteraG., 1984)
| Infektion |
Patientenzahl
|
klinischer
Erfolg |
| Pharyngitis,
Tonsillitis |
| Otitis
media, Sinusitis |
| Bronchitis |
| Pneumonie |
| Pertussis |
| Scharlach |
| Dentale
Infekte |
| Haut-,
Weichteilinfekte |
|
1.158 |
193 |
328 |
37 |
104 |
19 |
27 |
14 |
|
97,2% |
96,4% |
96,3% |
97,3% |
96,2% |
100,0% |
98,3% |
100,0% |
|
|
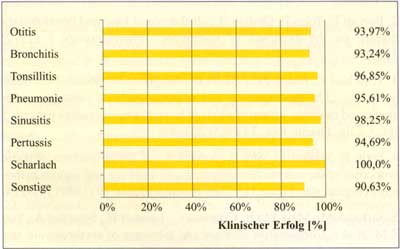
Tabelle
20: Klinische Wirksamkeit von Josamycin (Multizenterstudie,
1.887 Kinder Ø 4,3 Jahre) (nach Waßmer B.,
1985)
| Infektion |
Patientenzahl
|
klinischer
Erfolg |
| Otitis |
| Bronchitis |
| Tonsillitis |
| Pneumonie |
| Sinusitis |
| Pertussis |
| Scharlach |
| Sonstige |
|
813 |
340 |
254 |
114 |
114 |
113 |
11 |
128 |
|
93,97% |
93,24% |
96,85% |
95,61% |
98,25% |
94,69% |
100,00% |
90,63% |
|
|
Abbildung
12: Klinische Wirksamkeit von Josamycin in einer
Multizenterstudie an 1.908 pädiatrischen Patienten
(nach Privitera G., 1984)
|
Abbildung
13: Klinische Wirksamkeit von Josamycin in einer
Multizenterstudie an 1.887 pädiatrischen Patienten
(nach Waßmer B., 1985)
|
In kleineren
Studien an 241 bzw. 78 Kindern war der Einsatz von Josamycin
bei Atemwegsinfekten und Infektionen des HNO-Bereiches ebenfalls
sehr effizient. Die Erfolgsraten lagen in diesen Studien zwischen
93% und 98,4%, als Erreger konnten Streptokokken, Staphylokokken,
Haemophilus influenzae, Bordetella pertussis,
Mykoplasmen und Chlamydien identifiziert werden [43,44].
Auch in
einer rezenten Studie an 223 auswertbaren pädiatrischen
Patienten mit Tonsillitis war die Wirkung von Josamycin derjenigen
von Penicillin-Antibiotika durchwegs vergleichbar [45].
Bei dentalen
Infekten und Infektionen von Haut- und Weichteilen sind die
Patientenzahlen geringer, die Erfolgsraten (98,3%-100%) sprechen
aber für sich [35].
|
| Einsatz
in der Schwangerschaft
Josamycin wird in verschiedenen europäischen Staaten als
Mittel der Wahl zur Therapie der Toxoplasmose bei Schwangeren
empfohlen. Die Dosierung beträgt dabei 3-mal 1 g/Tag über
10 Tage. Nach je einer Pause von 10 Tagen sind eine zweite und
dritte Therapiefolge
anzuschließen. Im langjährigen Einsatz bei Graviden
wurde Josamycin bisher ohne nachteilige Wirkungen eingesetzt,
auch in Tierversuchen wurden in höchsten Dosen bis heute
keine teratogenen Effekte nachgewiesen. Prinzipiell sollte das
Antibiotikum dennoch zur Vorsicht im ersten Trimenon nur nach
strenger Indikationsstellung eingesetzt werden [46]. Josamycin
in einer Tagesdosis von 1,5 g hat sich auch als sehr effektiv
zur Behandlung von Chlamydien-Infektionen von Schwangeren erwiesen
[47]. |
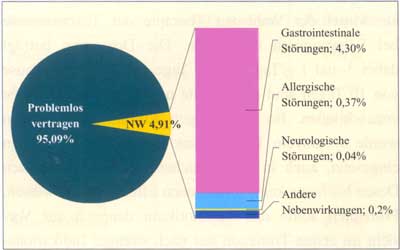
| Verträglichkeit
Die Klasse
der Makrolid-Antibiotika zeichnet sich generell durch eine sehr
gute Verträglichkeit aus. Das gilt auch für Josamycin.
Bei Erfassung der Daten von 27.090 im Rahmen von Studien behandelten
Patienten wurden Nebenwirkungen bei 4,91% der Teilnehmer registriert
(Abbildung 14) [35]. Bei einer etwas kleineren Studie an 1.887
Kindern (04,3 Jahre) kam es in 8,6% der Fälle zu größtenteils
problemlosen, unerwünschten
Ereignissen, das Absetzen der Medikation war aber nur in 1,32%
erforderlich (Abbildung 15) [42]. Die häufigsten Nebenwirkungen
sind gastrointestinale Beschwerden (Durchfall, Erbrechen, Übelkeit,
Appetitlosigkeit, Völlegefühl, Tenesmen, Magenschmerzen,
pelzige Zunge, Soor, ...). Wesentlich seltener sieht man allergische
Reaktionen. Neurologische Störungen (Schwindel, Kopfschmerzen)
kommen nur vereinzelt vor. Eventuell kann bei Früh- und
Neugeborenen bzw. bei längerfristiger Einnahme von Josamycin
ein reversibler Anstieg der Leberenzyme oder eine Cholestase
registriert werden [46].
Abbildung
14: Unerwünschte Wirkungen von Josamycin
(27.090 behandelte Patienten) (nach Osono T., 1979)
|
Abbildung
15: Unerwünschte Wirkungen von Josamycin
(Multizenterstudie, 1.887 Kinder Ø 4,3 Jahre) (nach
Waßmer B., 1985)
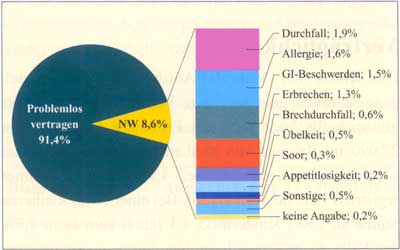
|
Interaktionen
Wie alle Makrolid-Antibiotika wird Josamycin durch das Cytochrom-P-450-System
in der Leber metabolisiert. Es kann daher zu einer Beeinflussung
der Konzentrationen
anderer Substanzen, die am gleichen Isoenzym metabolisiert werden,
kommen. Vorsicht ist geboten bei gleichzeitigem Einsatz von
Ergotamin-Präparaten, da speziell bei gestörter Leberfunktion
eine Kumulation mit ischämischen Reaktionen (Vasospasmus)
an den Extremitäten (Ergotismus) nicht auszuschließen
ist. Das gilt auch für Theophyllin, obwohl Josamycin im
Gegensatz zu
Erythromycin die Serumkinetik nur sehr gering beeinflusst, sodass
eine gleichzeitige Behandlung mit Theophyllin in niedriger oder
mittlerer Dosierung gefahrlos möglich ist. Bei einer Langzeittherapie
bzw. bei Überdurchschnittlich hoher Dosierung von Theophyllin
sollte jedoch auf eine mögliche Kumulierung geachtet werden
[48]. Auch bei der gleichzeitigen Verabreichung von Cyclosporin
und Josamycin kann es zu einer Beeinflussung der Kinetik mit
erhöhten Cyclosporin-Konzentrationen
im Serum kommen [49, 50]. Vorsichtshalber sollten auch die Antihistamine
Astemizol (in Österreich nicht mehr registriert) und Terfenadin
(in Österreich nicht mehr im Handel) nicht in Kombination
mit Makrolid-Antibiotika eingesetzt werden [46].
Überdosierungen
Orale Überdosierungen von Makrolid-Antibiotika verlaufen
üblicherweise ohne große Probleme. Entsprechend den
Nebenwirkungen können vor allem Durchfalle, Erbrechen und
Übelkeit, eventuell auch ein Hörsturz auftreten.
Es genügt eine supportive Behandlung. Über die Bindungsfähigkeit
an Aktivkohle liegen keine gesicherten Daten vor [51].
|
Literatur:
| 1.
Wildfeuer A.: "Ein Beitrag zur Pharmakologie von Josamycin."
extracta medica practica 6 Suppl. I (1985) 9-18. |
| 2.
Bergan T., Tolas P., Oydvin B. : "Influence of food
and hepatobiliary disease on the excretion of josamycin."
Phaflllacology 8 (1972) 336-343. |
| 3.
Fraschini F., Braga P.C., Biella G., Scaglione F., Montoli
C., Scarpazza G.: "Pharmacokinetics and sputum levels
of josamycin after single and multiple administrations in
bronchopneumopathic patients." Int. J. Clin. Pharm.
Res. 3 (1983) 203-208. |
| 4.
Periti P., Mazzei T., Mini E., Novelli A.: "Clinical
pharmacokinetic properties of the macrolide antibiotics:
effects of age and various pathophysiological states (part.1)."
Clin. Pharmacokinet. 16 (1989) 193-214. |
| 5.
Sefton A.M., Maskell J.P., Kerawala C., Cannell H., Seymour
A., Sun Z.M. et al.: "Comparative efficacy and tolerance
of erythromycin and josamycin in the prevention of bacteraemia
following dental extraction." J. Antimicrob. Chemother.
25 (1990) 975-984. |
| 6.
Strausbaugh L.J., Bolton WK., Dilworth J.A., Guerrant R.L.,
Sande M.A.: "Comparative pharmacology of josamycin
and erythromycin stearate." Antimicrob. Agents Chemother.
10 (1976) 450-456. |
| 7.
Carlone N.A., Cuffini A.M., DelMastro S., Bonino S.: "Determinazione
microbiologica dei livelli tonsillari ed oculari di josamicina
in sogget ti ospedalizzati." G. Ital. Chemother. 29
Suppl. I (1982) 77-83. |
| 8.
Wildfeuer A., Laufen H., Räder K.: "Activity of
Josamycin in human tissue and neutrophils." 14th ICC
1985, Kyoto. |
| 9.
Wildfeuer A., Bockmeyer M.: "Penetration of Josamycin
into the sinus mucosa after oral treatment of patients with
chronic maxillary sinusitis." 15th ICC 1987, Istanbul. |
| 10.
Bella F., Font B., Uriz S., Munoz T., Espejo E., Traveria
J. et al.: "Randomized trial of doxycycline versus
josamycin for Mediterranean spotted fever." Antimicrob.
Agents Chemother. 34 (1990) 937-8. |
| 11.
Fraschini F., Braga P.C., Gagliardi V:, Falchi M., Scaglione
F., Scarpazza G. et al.: "Pharmakokinetik von Josamycin
beim Menschen und Verteilung in verschiedenen Kompartimenten."
extracta medica practica 6 Suppl. I (1985) 18-27. |
| 12.
Okolicsanyi L., Venuti M., Strazzabosco M., Biral A., Orlando
R., Iemmolo R.M.: "Pharmacokinetics of josamycin in
patients with liver cirrhosis and Gilbert's syndrome after
repeated doses." Int. J. Clin. Pharmacol. Ther. Toxicol.
23 (1985) 434-438. |
| 13.
Peyramond D., Biron E., Lucht F.: "Josamycin utilization
in paediatrics infections: 140 case reports." Drugs
Exptl. Clin. Res. 8 (1982) 297-302. |
| 14.
Privitera G., Bonino S., Del Mastro S.: "Clinical multicentre
trial with josamycin propionate in paediatric patients."
Int. J. Clin. Pharm. Res. 4 (1984) 201-207. |
| 15.
Strausbaugh L.J., Dilworth J.A., Gwaltney J.M. Jr., Sande
M.A.: "In vitro susceptibility studies with
josamycin and erythromycin." Antimicrob. Agents Chemother.
9 (1976) 546-548. |
| 16.
Wenzel R.P., Hendley J.O., Dodd W.K., Gwaltney J.M.: "Comparison
of josamycin and erythromycin in the therapy of Mycoplasma
pneumoniae pneumonia." Antimicrob. Agents Chemother.
10 (1976) 899-901. |
| 17.
Guggenbichler J.P.: "Josamycin, ein Makrolid-Antibiotikum
mit bemerkenswerten Eigenschaften." Arzneimittelpraxis
27 (4/5) (1997) 1061-1064. |
| 18.
Jebelean C., Luger C., Binder L., Watschinger R., Haditsch
M., Mittermayer H. : " Vergleich der antimikrobiellen
Aktivität der Makrolide auf 598 österreichischen
Pneumokokken." ICMAS 2002, Bologna. |
| 19.
Sauermann R., Gattringer R., Graninger W, Buxbaum A., Georgopoulos
A. : "Phenotypes of macrolide resistance of group A
streptococci isolated from outpatients in Bavaria and susceptibility
to 16 antibiotics." J. Antimicrob. Chemother. 51 (2003)
53-7. |
| 20.
Buxbaum A., Forsthuber S., Graninger W, Georgopoulos A.
on behalf of The Austrian Bacterial Surveillance Network:
"Serotype distribution and antimicrobial resistance
of Streptococcus pneumoniae in Austria." J.
Antimicrob. Chemother. 54 (2004) 247-250. |
| 21.
Georgopoulos A., 2004. Data on file. |
22.
Jebelean C., Mittermayer H.: "Makrolid-Resistenz
bei Streptococcus
pneumoniae
in Österreich: Prävalenz, Phänotypen und
Resistenz-Gene." Antibiotika Monitor tom XVII 5/6
(2001) 96-104.
|
| 23.
Giovanetti E., Brenciani A., Burioni R., Varaldo P.E.: "A
novel efflux system in inducibly erythromycin-resistant
strains of Streptococcus pyogenes." Antimicrob.
Agents Chemother. 46 (2002) 3750,5. |
| 24.
Nikaido H., Zgurskaya H.I.: "Antibiotic efflux mechanism."
Curr. Opinion Inf. Dis. 12 (1999) 529-536. |
| 25.
Tait-KamradtA., Davies T., Appelbaum P.C.: " Two new
mechanisms of macrolide resistance in clinical strains of
Streptococcus pneumoniae from Eastern Europe and
North America." Antimicrob. Agents Chemother. 44 (2000)
3395-3401. |
| 26.
Klugman K.P., Capper T., Widdowson C.A., Koornhof H.J.,
Moser W: "Increased activity of 16-membered lactone
ring macrolides against erythromycin-resistant Streptococcus
pyogenes and Streptococcus pneumoniae: characterization
of South African isolates." J. Antimicrob. Chemother.
42 (1998) 729-34. |
| 27.
Georgopoulos M., Ridl W., Mühlbacher J., Georgopoulos
A.: "In vitro susceptibility of Erythromycin-resistant
Staphylococci to Azithromycin versus Josamycin." Recent
advances in chemotherapy, 18th ICC 1993. |
28.
Georgopoulos A., Feistauer S.M., Guggenbichler J.P., Scharrer
P., Kobilonsky C., Dierich M.P.: "Comparative activity
of Josamycin, Roxithromycin
and Clarithromycin against Erythromycin-resistant staphylococci."
5th ECCMID 1991, Oslo.
|
| 29.
Shibutani J., Akimoto Y., Omata H., Kaneko K., Fujii A.:
"Postantibiotic effects of rokitamycin and josamycin
against intraleukocytic Staphylococcus aureus."
Recent advances in Chemotherapy, l8th ICC 1993, Stockholm,
Sweden. |
| 30.
Suzaki K., Miyaji T., Niitsu Y.: "Susceptability of
Mycoplasma pneumoniae isolate to Josamycin."
Jap. J. Antibiot. 35(2) (1982) 318-324. |
| 31.
Bornstein N., Roudier C., Fleurette J.: "Determination
ofthe activity on Legionella of eight macrolides and related
agents by comparative testing on three media." J. Antimicrob.
Chemother. 15(1) (1985) 17-22. |
| 32.
Mensa J., Trilla A., Tarrero I., Vidal J., Estruch R., Martinez
J.A.: "Tratamiento de la neumonia atipica con josamicina."
Med. Clin. (Barc) 92 (1989) 285-287. |
| 33.
Kenny G.E., Cartwright F.D.: "Susceptibilities of Mycoplasma
hominis, M. pneumoniae, and Ureaplasma
urealyticum to GAR-936, dalfopristin, dirithromycin,
evernimicin, gatifloxacin, linezolid, moxifloxacin, quinupristin-dalfopristin,
and telithromycin compared to their susceptibilities to
reference macrolides, tetracyclines, and quinolones."
Antimicrob. Agents Chemother. 45(9) (2001) 2604-2608. |
| 34.
Huang C., Liu Z., Lin N., Tu Y., Li J., Zhang D.: "Susceptibility
of mixed infection of Ureaplasma Urealyticum and Mycoplasma
hominis to seven antimicrobial agents and comparison
with that of Ureaplasma urealyticum infection."
J. Huazhong Univ. Sci. Technolog. Med. Sci. 23(2) (2003)
203-205. |
| 35.
Osono T.: "Efficacy rates and side effects in Josamycin
treatment. Post-marketing surveillance of 27090 cases covering
1971-1978." Basisinformation Josalid® 1979). |
| 36.
Fraschini F.: "Clinical Efficacy and Tolerance ofTwo
New Macrolides, Clarithromycin and Josamycin, in the Treatment
of Patients with Acute Exacerbations of Chronic Bronchitis."
J. Int. Med. Res. 18 (1990) 171-176. |
| 37.
Lozano R., BalaguerA.: "Josamycin in the treatment
of broncho-pulmonary infections." Clin. Ther. 13(2)
(1991) 281-288. |
| 38.
Yamaji E., Nakayama I., Hirata H., Kawaguchi H.: "ln
vitro antibacterial activity of macrolide antibiotics
against Propionibacterium acnes." 20th ICC
1997, Sydney, Australia. |
| 39.
Guo X., Ye Z., Deng R.: "Male urogenital tract mycoplasma
infection and drug-resistance evolution." Zhonghua
Nan Ke Xue 10(2) (2004) 122-124. |
| 40.
Akimoto Y., Shibutani J., Ikeda M., Takato T., Yamamoto
H.: "Antibiotic concentration in radicular granuloma
after oral administration of cefaclor, cephalexin, josamycin,
amoxicillin, bacampicillin or talampicillin." 20. ICC
1997, Sydney, Australia. |
| 41.
Sasaki J., Morihana T.: "Double blind comparison of
roxithromycin andjosamycin in odontogenic infections."
16th ICC 1989, Jerusalern, Israel. |
| 42.
Waßmer B., Schneider H.T.: "Multizentrische Studie
mit Josamycin bei 187 Kindern." extracta medica practica
6 Suppl.l ( 1985) 52-56. |
| 43.
Schreinert B.: "Josamycin- ein neues Makrolid-Antibiotikum.
Klinische Erfahrungen in der Pädiatrie." extracta
medica practica 6 Suppl. 1 (1985) 59-62. |
| 44.
Weigand K.H., Waßmer B.: "Bedeutung von Josamycin
bei der Therapie von Erkrankungen des Hals-, Nasen-, Ohren-
und des Respirations-Traktes im Kindesalter." extracta
medica practica 6 Suppl. 1 (1985) 82-85. |
| 45.
Portier H., Bourrillon A., Lucht F., Choutet P., Gehanno
P., Meziane L., Bingen E. : "Treatment of acute group
A beta-hemolytic streptococcal tonsillitis in children with
a 5-day course of josan1ycin." Arch. Pediatr. 8(7)
(2001) 700-706. |
| 46.
Fachinformation Josan1ycin. Austria Codex 2004 - Österreichischer
Apothekerverlag. |
| 47.
Söltz-Szöts J., Schneider S., Niebauer B., Knobler
R.M., Lindmaier A.: "Significance of the dose of josamycin
in the treatment of chlamydia infected pregnant patients."
Z. Hautkr. 64(2) (1989) 129-131. |
| 48.
Vallarino G., Merlini M., Vallarino R.: "Josamicina
e tiofillinicinella patologia respiratoria pediatrica."
Giornale Italiano di Chemioterapia 29 Suppl. 1 (1982) 129-133. |
| 49.
Kreft-Jais C., Billaud E.M., Gaudry C., Bedrossian J.: "Effect
of josamycin on plasma cyclosporine levels." Eur. J.
Clin. Pharmacol. 32 (1987) 327-328. |
| 50.
Azanza J.R., Catalan M., Alvarez M.P., Sadaba B., Honorato
J., Llorens R., Harreros J.: "Possible interaction
between cyclosporine and josamycin: a description of three
cases." Clin. Pharmacol. Ther. 51 (1992) 572-575. |
| 51.
Ellenhorn M.J., Schonwald S., Ordog G., Wasserberger J.:
"Medical Toxicology: Diagnosis and Treatment of Human
Poisoning. Section II(B) anti-infective drugs." 2nd
ed. Baltimore; Williams & Wilkins; 1997. |
Anschrift
des Verfassers:
Univ.-Prof. DDr. Apostolos Georgopoulos
Univ.-Klinik für Innere Medizin I,
Klin. Abt. für Infektionen und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: apostolos.georgopoulos@meduniwien.ac.at
|
|
|