Prophylaxe
enteraler Infektionen in der
pädiatrischen Onkologie:
Orale Dekontamination versus anti-adhäsiver Prophylaxe
mit Oligosacchariden aus der Karotte
|
| U. Kastner*,
B. Keck*, S. Matthes*, J.P. Guggenbichler**, C. Peters*, H.
Gadner*
* St. Anna Kinderspital, Wien, Österreich
(Vorstand: Univ.-Prof. Dr. H. Gadner)
** Univ.-Klinik für Kinder und Jugendliche der Universität
Erlangen/Nürnberg, Deutschland
(Vorstand: Univ.-Prof. Dr. W. Rascher) |
Schlüsselwörter:
Antiadhäsive Prophylaxe, enterale Infektionen, Oligosaccharide,
pädiatrische Onkologie |
|
Zusammenfassung
Die über
Kohlenhydratstrukturen vermittelte Haftung von Keimen an der
Oberfläche der Darmmukosa ist ein wesentlicher initialer
Schritt in der Pathogenese von gastrointestinalen Infektionen.
Wässerige Zubereitungen aus der Karotte enthalten saure
Oligosaccharide, die als Rezeptoranaloga in vitro die
Anhaftung von unterschiedlichen darmpathogenen Keimen blockieren.
In einer Pilotstudie an immunsupprimierten pädiatrischen
Patienten hat sich gezeigt, dass durch den Einsatz eines Karottendekokts
Schwere und Häufigkeit von enteralen Infektionen im Vergleich
zur bislang eingesetzten selektiven oralen Darmdekontamination
positiv beeinflusst werden können.
|
Key-words:
Anti-adhesive prophylaxis, gastrointestinal infections,
oligosaccharides, paediatric oncology |
|
Summary
Adherence of microorganisms
to the intestinal mucosa mediated by carbohydrate structures
is an important and initial step in the pathogenesis of gastrointestinal
infections. Aqueous extracts from carrots contain acidic oligosaccharides,
which act as receptor analogues and block the adherence of various
enteropathogenic microorganisms. A preliminary study showed
a positive effect of aqueous carrot extracts on the incidence
and severity of enteral infections in immunocompromised paediatric
patients in comparison to the traditional selective oral decontamination.
|
Einleitung
Prophylaxe und Therapie
enteraler Infektionen stellen ein großes Problem im Rahmen
der pädiatrischen Onkologie, wie auch der Stammzelltransplantation
(SZT) dar. Die Schädigung der Darmschleimhaut durch Zytostatika,
insbesondere im Rahmen der Konditionierung, und die mangelhafte
enterale Ernährung fördern das Auftreten von invasiven
enteralen Infektionen, die auch eine Graft-versus-Host-Erkrankung
(GvHD) des Darmes hervorrufen können. Zur Prophylaxe dieser
schwerwiegenden Komplikationen hat sich in den vergangenen Jahrzehnten
weltweit die selektive Darmdekontamination mit oralen Antibiotika
und Antimykotika durchgesetzt, welche allerdings in Kombination
mit der zumeist erforderlichen systemischen antimikrobiellen
Therapie zu einer Zunahme multiresistenter Keime und enteraler
Candidaüberwucherung geführt hat. Eine Alternative
zur Minimierung der enteralen Besiedelung stellt die Blockierung
der Keimadhäsion durch antiadhäsiv wirksame Oligosaccharide
dar. Im Rahmen einer Anwendungsbeobachtung wurde die Effizienz
von Oligosaccharid-reichen Zubereitungen aus der Karotte bei
Kindern im Rahmen einer allogenen SZT geprüft und retrospektiv
den Erfahrungen mit der selektiven oralen Darmdekontamination
gegenübergestellt. |
Mikrobielle
Adhärenz in der Pathogenese von gastrointestinalen Infektionen
Die Adhärenz von Mikroorganismen an Epithelzellen des Darmtraktes
ist ein wesentlicher initialer Schritt einer Magen-Darm-Infektion.
Erst wenn Keime (Bakterien, Viren, Pilze u.a.) an der Schleimhaut
haften und durch unspezifische Abwehrmechanismen (Schleim, Peristaltik,
Epithelabschilferungen) nicht mechanisch entfernt werden können,
entwickeln sie die Fähigkeit zur lokalisierten Proliferation,
was zur Besiedelung des Darmabschnittes führt. Bakterien,
die an der intestinalen Mukosa adhärieren, können
über Signalproteine die Degeneration der angrenzenden Schleimhaut
zur Folge haben oder durch Freisetzung von Toxinen zu einer
lokalen und systemischen Entzündungsreaktion führen.
Eine bereits toxische oder degenerativ vorgeschädigte Schleimhaut
verliert die Barrierefunktion, was zum Eindringen der Keime
in den Organismus führt (Translokation). Bei entsprechender
Abwehrlage des Wirtes kommt es letztlich zu systemischen Entzündungsreaktionen
und Krankheitssymptomen. Somit stellt die mikrobielle Adhärenz
an der Schleimhaut einen wesentlichen initialen Schritt in der
Pathogenese von Infektionen im Gastrointestinaltrakt dar [3].
Der Vorgang
der mikrobiellen Adhärenz ist ein komplexer und zeichnet
sich durch Gewebetropismus (Keime haften an spezifischen Rezeptoren,
die nur an bestimmten Epitheloberflächen exprimiert werden),
Speziesspezifität (tierpathogene, menschenpathogene Stämme),
Altersspezifität (unterschiedliche Ausprägung von
Adhärenzrezeptoren in unterschiedlichen Lebensaltern) und
genetische Spezifität aus [13, 14].
Escherichia
coli und andere Enterobacteriaceae haften über
Fimbrien und membranständige Adhäsine an der Darmschleimhaut
und anderen Organstrukturen. Fimbrien sind fingerartige Fortsätze
an der Bakterienoberfläche mit einer terminalen Lektin(artigen)-Domäne,
welche an distinkten mukosaständigen Oligosaccharid-Epitopen
(Glykokonjugaten) binden. Typ-1-Fimbrien werden von den meisten
Enterobakterien gebildet und erkennen die alpha-Mannose als
Oberflächenrezeptor. P-Fimbrien nützen Gal alpha 1-4
Gal-Sequenzen als Bindungsstelle, während Bakterien mit
S-Fimbrien bevorzugt an NeuAc-Resten binden. Darüber hinaus
sind noch zahlreiche weitere speziesspezifische Oberflächenproteine
bekannt, die für die Adhärenz verantwortlich gemacht
und als Virulenzfaktoren gewertet werden [7, 8, 10, 11, 12].
|
Ansätze
zur Blockierung der Adhärenz
Von großem
therapeutischem, aber auch prophylaktischem Interesse ist die
Möglichkeit, die Adhärenz als wesentlichen Bestandteil
der Virulenz eines Keimes an der Darmschleimhaut zu blockieren.
In der
Muttermilch sind zahlreiche Oligosaccharide mit Adhärenz-blockierender
Wirkung beschrieben, die nicht nur prophylaktische Wirkung besitzen,
sondern auch wesentlich für die Steuerung der bakteriellen
Besiedelung des Neugeborenen verantwortlich sind [1, 8]. Diesem
von der Natur vorgegebenen Modell nachgehend, wurden in letzter
Zeit Rezeptoranaloga der Epithelzellen definiert, die in
vitro eine Blockierung mikrobieller Adhärenz zeigten
[2, 15]. Mannose, alpha-Methyl-Mannopyranosid und Mannitol erwiesen
sich als wirksam in der Blockierung der Anhaftung von E.
coli mit Typ-1-Fimbrien ebenso wie Glykopeptide vom Oligomannosid-Typ
aus der Sojabohne und anderen Leguminosen [10].
Auf der
Suche nach dem Wirkprinzip wässeriger Zubereitungen aus
der Karotte (in Anlehnung an die von E. Moro 1905 eingeführte
Karottensuppe zur Behandlung von Durchfallerkrankungen im Säuglingsalter
[9]) konnten in einem Wirkstoff-orientierten Fraktionierungsverfahren
(Biological Assay Guided Isolation) am Institut für Pharmakognosie
der Universität Wien aktive Kohlenhydratfraktionen isoliert
werden. Zunächst handelte es sich um ein komplexes Gemisch
aus Spaltprodukten der Karottenpektine mit einem Molekulargewicht
zwischen 20.000 und 24.000 Dalton, die in einer Konzentration
von 1% (v/v) eine nahezu vollständige Blockierung der Haftung
von uropathogenen Escherichia coli an frisch isolierten
humanen Uroepithelien zeigten [4]. Nach wiederholter Auftrennung
dieser wässerigen Fraktionen erwiesen sich Oligogalakturonide,
welche auch aus Pektinen anderer natürlicher Quellen (z.B.
Apfel, Orangen) durch enzymatische und/oder saure Spaltung gewonnen
werden können, als besonders wirksam [5, 6]. Mittlerweile
ist es an verschiedenen Testmodellen (Adhärenz von enteropathogenen
E. coli und enterotoxischen E. coli an HEp-2,
Caco-Zellen und an Gefrierschnitten humaner Darmabschnitte)
gelungen, die Hemmwirkung semiquantitativ zu erfassen und dem
Polymerisationsgrad der Galakturonsäuren zuzuordnen. Lösungen
von aufgereinigten Oligosacchariden von 0,005% führen zu
den folgenden Adhäsionsreduktionen, was unter Berücksichtigung
der molaren Wechselwirkungen eine maximale Wirksamkeit der Trigalakturonsäure
bedeutet (Abbildung 1).
- Penta-,
Hexagalakturonsäuren: 23,8% Hemmung
- Tetragalakturonsäure: 52,7% Hemmung
- Trigalakturonsäure: 84,6% Hemmung
- Digalakturonsäure: 91,7% Hemmung
-
Galakturonsäure (mono): keine Hemmung
Abbildung
1: Antiadhäsiv wirksames Trigalakturonid
und Teilstruktur aus Pektin
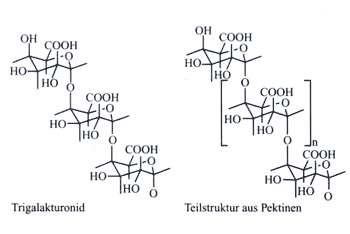
|
|
Klinische
Studie
In Anlehnung
an die Erfahrungen bei immunkompetenten Kindern mit Magen-Darm-Infektionen
und mit dem Wissen um die Adhärenz-blockierende Wirkung
von Oligosacchariden aus natürlichen Quellen wurde im St.
Anna Kinderspital ein Pilotprojekt induziert, welches den klinischen
Benefit wässeriger Karottenzubereitungen im Vergleich zur
bislang durchgeführten selektiven Darmdekontamination (SOD:
Paromomycin 30 mg/kg tägl. p.o., Vancomycin 20 mg/kg tägl.
p.o.) bei einem gut monitorisierten Patientenkollektiv (Abteilung
für Stammzelltransplantation nach Zustimmung der Ethikkommission
und „informed consent“) prüfen sollte (Abbildung
2, Abbildung 3).
|
Abbildung
2: Selektive orale Darmdekontamination in der
Stammzelltransplantation – Rationale
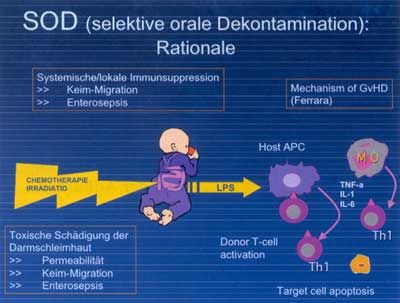
|
Abbildung
3: Antiadhäsive Wirkung von sauren Oligosacchariden
aus der Karotte im Gefrierschnittmodell
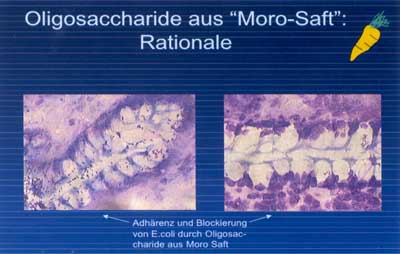
|
Die Karottensuppe
nach Moro wurde zur besseren Verträglichkeit und Akzeptanz
der Patienten modifiziert („Moro-Saft“), wobei durch
90-minütiges Kochen der geschälten und geraspelten
Karotten ein ausreichend hoher Gehalt an Oligosacchariden in
dem Dekokt erzielt und die primär unerwünschte obstipierende
Wirkung der Pektine vermieden werden konnte. In der noch laufenden
Pilotstudie sind bislang 27 Patienten auswertbar, welche einer
allogenen Knochenmark- bzw. Stammzelltransplantation unterzogen
wurden und „Moro-Saft“ anstatt der üblichen
selektiven oralen Darmdekontamination mit dem Zeitpunkt der
„Dekontamination“, 10 Tage vor Beginn der Konditionierung,
in einer Dosierung von 10 ml/kg/die (bei guter Akzeptanz bis
zu 15-20 ml/kg/die) bis zum Tag +28 nach Transplantation und/oder
Anzahl der mononukleären Zellen ANC>500/µl und
adäquater oraler Ernährung erhielten. Der Beginn der
„Moro-Saft“-Gabe ist bewusst noch vor der Schädigung
der Darmschleimhaut durch Chemo- und/oder Radiotherapie festgesetzt,
um das Anhaften der potenziell pathogenen Mikroorganismen bereits
in einem sehr frühen Stadium zu reduzieren, die Dosierung
wurde empirisch gewählt.
Survival
und Inzidenz von Enteroseptitiden wurden mit 25 Patienten mit
konventioneller SOD-Prophylaxe verglichen. Beide Gruppen waren
bezüglich Alter, Grunderkrankung (maligne vs. nichtmaligne),
Anzahl der Zweittransplantationen, Dauer der Aplasie und Konditionierungsschemata
vergleichbar (Leukämie n=30, inborn errors/Schwere Aplastische
Anämie (SAA) n=22, Spender: Geschwisterspender (MSD) n=16,
haploidenter Spender n=7, Fremdspender (MUD) n=29, T-cell-Depletion:
19/52, Tabelle 1). Neben der Erfassung von Schwere und Verlauf
von enteralen Septitiden werden zusätzlich Daten über
das Keimspektrum der Stuhlkulturen mit entsprechendem Antibiogramm
sowie über Anzahl und Schweregrad entstehender Darm-GvHD
erhoben und einem entsprechenden, mit SOD geführten Patientengut
gegenübergestellt. Bezüglich der Anzahl der fieberhaften
Episoden während der Aplasie bestand kein signifikanter
Unterschied zwischen den beiden Gruppen. Enteroseptitiden traten
bei 2/27 (7%) Patienten mit antiadhäsiver Prophylaxe versus
2/25 (8%) Patienten mit SOD auf. Die Transplantations-assoziierte
Mortalität war 18,5%, bei Patienten mit antiadhäsiver
Prophylaxe versus 32% bei Patienten mit SOD (Tabelle 2).
Tabelle
1: Patientendaten zur Pilotstudie (selektive
orale Dekontamination (SOD) versus „Moro-Saft“)
Patientendaten |
25
Patienten mit konventioneller SOD
versus
27 Pilot-Patienten mit „Moro-Saft“
(MORO) |
Exklusion:
- Patienten mit schwerem Immundefekt (SCID)
- Patienten
nach „mini“-Konditionierung |
|
| |
SOD |
MORO |
p |
| Alter
(median) |
8,28 |
9,73 |
n.s. |
| Tage
bis >500 ANC |
17,5 |
16 |
n.s. |
| maligne
Grunderkrankung |
60% |
76% |
n.s. |
| T-cell
Depletion |
52% |
22% |
p=0,026 |
| alternative
Spender |
76% |
65% |
n.s. |
| reduzierte
Konditionierung |
44% |
33% |
n.s. |
| GvHD
> Gr II |
16% |
33% |
n.s. |
| Darm-GvHD
|
8% |
4% |
n.s. |
|
|
Tabelle
2: Ergebnisse zur Pilotstudie (selektive orale
Dekontamination (SOD) versus „Moro-Saft“)
Ergebnisse |
| |
SOD |
MORO |
| Entero-Sepsis
|
8% |
7% |
| Candida
in Stuhlkultur |
64% |
66% |
| Dauer
der parenteralen Ernährung (Tage, median)
|
21 |
21 |
| Darm-GvHD
|
8% |
4% |
| Transplant-assoziierte
Mortalität |
32% |
18,5% |
|
|
Für
eine statistische Auswertung ist das bislang überblickbare
Patientengut noch zu gering, ebenso kann noch keine klare Aussage
bezüglich einer Prophylaxe von Transplantations-assoziierten
Komplikationen wie z.B. der GvHD des Darmes gegeben werden,
da der Beobachtungszeitraum zu gering ist.
Während
der Einsatz von „Moro-Saft“ auf der Transplantationsstation
des St. Anna Kinderspitals unter kontrollierten Studienbedingungen
erfolgt, wird der „Moro-Saft“ auch fallweise an
den onkologischen Basisstationen bei Auftreten von schweren
enteralen Infektionen bei neutropenischen Patienten und bei
Problemen mit dem Nahrungsaufbau bei durch Chemotherapie vorgeschädigter
Darmschleimhaut eingesetzt. „Moro-Saft“ wurde hier
erst bei Auftreten von klinischen Krankheitszeichen mit der
Dosierung von 15-20 ml/kg/die und bis zum Abklingen der Symptome,
wenn erforderlich, auch per nasogastraler Sonde verabreicht.
Die Erfahrungen, welche sich bislang nur auf Einzelbeobachtungen
stützen, zeigen eine gute Verträglichkeit und ein
rasches Abheilen der Infektionen, was für die Zukunft einen
breiteren Einsatz der Karottenzubereitung versprechen lässt.
Fallbericht
3-jährige
Patientin (13 kg) mit pleuropulmonalem Blastom, Therapie gemäß
MAKEI-98-Protokoll, Chemotherapie-induzierte Aplasie, Bauchschmerzen,
Fieber und Diarrhoe mit sonographisch massiv verdickten Darmwänden
im Bereich von Rektum, Sigma und Colon descendens und positivem
Nachweis von Clostridium difficile im Stuhl. Bei oraler
Nahrungskarenz enterale Zufuhr von „Moro-Saft“ (10
ml/kg KG/die), parenterale Ernährung und breite systemische
antibiotische Therapie (Ceftazidim, Amikacin, Teicoplanin, Metronidazol);
Steigerung von „Moro-Saft“ auf 20 ml/kg/die nach
2 Tagen, Verringerung der Stuhlfrequenz und Besserung der Stuhlkonsistenz
sowie deutlicher Rückgang der Darmwandverdickungen innerhalb
von 48 Stunden, nach weiteren 2 Tagen enterale Zufuhr von Pregomin
15%ig und „Moro-Saft“ mit täglicher Mengensteigerung
bei guter Toleranz.
|
Zusammenfassung
Zusammenfassend
erscheint der klinische Einsatz von wässeriger Karottenzubereitung
nicht nur im internen pädiatrischen Bereich sinnvoll. In
der Prophylaxe und Therapie von gastrointestinalen Komplikationen
bei immunsupprimierten Patienten mit hämato-onkologischer
Grunderkrankung hat sich in ersten Pilotstudien gezeigt, dass
Schwere und Häufigkeit der enteralen Infektionen positiv
beeinflusst werden können, obgleich die Anzahl der bislang
mit „Moro-Saft“ behandelten Patienten keinesfalls
noch eine definitive Aussage rechtfertigt. Es bleibt somit weiteren
prospektiven Studien vorbehalten, ob die Oligosaccharide aus
der Karotte oder anderen natürlichen Quellen generell die
mikrobielle Fehlbesiedelung des Magen-Darm-Traktes, die sehr
häufig als klinisches Problem nach langfristigen Antibiotikagaben,
Chemotherapie oder Radiatio gesehen wird, verhindern und somit
als Alternative zur bislang durchgeführten selektiven Darmdekontamination
gesehen werden können. |
Literatur:
| 1.
Cravioto A., Gross R.J., Scotland S.M., Rowe B.: „An
adhesive factor found in strains of Escherichia coli belonging
to the tradition-al infantile enteropathogenic serotypes.“
Curr. Microbiol. 3 (1997) 95-99. |
| 2.
Dai D., Nanthkumar N., Newburg D.S., Walker W.A.: „Role
of oligosaccharides and glycoconjugates in intestinal host
defense.“ J. Pediatr. Gastroenterol. Nutr. 30 (2000)
23-33. |
| 3.
Donneberg M.S.: „Interaction between enteropathogenic
Escherichia coli and epithelial cells.“ Clin. Infect.
Dis. 28 (1999) 451-455. |
| 4.
Guggenbichler J.P., De Bettignies A., Meissner P., Schellmoser
S. et al.: „Acidic oligosaccharides from natural sources
block adherence of E. coli on uroepithelial cells.“
Pharm. Pharmacol. Lett. 1 (1997) 35-38. |
| 5.
Guggenbichler J.P., Meissner P., Jurenitsch J., De Bettignies-Dutz
A.: Offenlegungsschrift; DE 4330773 A1, 16.03.95. |
| 6.
Guggenbichler J.P., Jurentisch J.: „Blockierung der
Anlagerung von Keimen an Epithelzellen.“ Kurzinformation
zu Patent, 1995. |
| 7.
Karlsson K.A.: „Microbial recognition of target-cell
glycoconjugates.“ Curr. Opin. Struct. Biol. (1995)
622-635. |
| 8.
Kunz C., Rudloff S.: „Biological functions of oligosaccharides
in human milk.“ Acta Pediatr. 82 (1993) 903-912. |
| 9.
Moro E.: „Karottensuppe bei Ernährungsstörungen
der Säuglinge.“ Münch. Med. Wschr. 31 (1908)
1637-1640. |
| 10.
Neeser J.R., Koellreuter B.: „Oligomannoside type
glycopeptides inhibiting adhesion of Escherichia coli strains
mediated by type 1 pili: preparation of potent inhibitors
from plantglycoproteins.“ Infect. Immun. 52 (1986)
428-436. |
| 11.
Ofek I., Sharon N.: „Adhesins as lectins: specifity
and role in infection.“ Curr. Top Microbiol. Immunol.
150 (1990) 91-114. |
| 12.
Ofek I., Mirelman D., Sharon N.: „Adherence of Escherichia
coli to human mucosa cells mediated by mannose receptors.“
Nature 265 (1977) 623-625. |
| 13.
Phillips A.D., Frankel G.: „Intimin mediated tissue
specifity in enterpathogenic Escherichia coli interaction
with human intestinal organ cultures.“ J. Infect.
Dis. 181 (2000) 1496-1500. |
| 14.
Service R.F.: „Sugar separates humans from apes.“
Science 2001; 291 (2001) 2340-2341. |
| 15.
Zopf D., Roth S.: „Oligosaccharides as anti-infective
agents.“ Lancet 347 (1996) 1017-1021. |
Anschrift der Verfasserin:
Univ.-Doz.
DDr. Ulrike Kastner
St. Anna Kinderspital
A-1090 Wien, Kinderspitalgasse 6
E-Mail:
ulrike.kastner@stanna.at
|
|
|