| Experimentelle
Untersuchungen der Adhärenz und Blockierung der Adhärenz
von pathogenen Mikroorganismen durch saure Galakturonide am humanen
terminalen Ileum |
| S.
Guggenbichler
Med. Fakultät der Universität Innsbruck
(Vorstand: Univ.-Prof. Dr. H. Grunicke)
|
Schlüsselwörter:
Escherichia coli, Gefrierschnitte, Adhärenz, Blockierung
der Adhärenz |
|
Zusammenfassung
Es wird ein In
vitro-Testsystem zur Testung der Adhärenz pathogener
Mikroorganismen vorgestellt. Dieses Testsystem eignet sich außerdem
auch zur Testung verschiedener Kohlenhydrate, die die Adhärenz
pathogener Mikroorganismen blockieren.
Zur Testung werden Gefrierschnitte menschlichen terminalen Ileums
verwendet. Die Blockierung der Adhärenz ist durch saure
Oligogalakturonide möglich, welche durch Fermentation aus
Pektin gewonnen werden. Der klinische Einsatz geht von Sondennahrung
in der Intensivmedizin bis zu Tierfuttermittelzusätzen
als antibiotischer Leistungsfördererersatz.
|
Key-words:
Escherichia coli, frozen sections, adherence,
blockage of adherence |
|
Summary
An in
vitro test model for investigations of adherence of pathogenic
microorganisms has been developed. This test system can also
be used for the investigations of various carbohydrates expected
to block the adherence of pathogenic microorganisms. Frozen
sections of human terminal ileum obtained by operations were
used in this assay. The blockage of adherence can be achieved
by acidic oligogalacturonides, which are fermented from pectin.
Isomaltose and D-mannose did not show any reduction of adherence
in this blinded investigation. Acidic oligogalacturonides can
be used for tube feeding in critically ill patients e.g. after
bone marrow transplantation in exchange of selective bowel decontamination.
These substances also can be used instead of antibiotic growth
promoters in veterinary medicine and are valuable alternatives
in the food chain.
|
Einleitung
Die
Entstehung einer bakteriellen Infektion ist ein komplexes Geschehen,
das von unterschiedlichen Faktoren sowohl auf Seiten des Erregers
als auch auf der des Wirtes abhängt. Bisher wurde die Virulenz
pathogener Mikroorganismen weitgehend auf die Bildung von Toxinen
reduziert, die zum Zelltod oder zu schweren funktionellen Störungen
von Körperfunktionen Anlass geben.
Die Adhärenz
pathogener Mikroorganismen an Schleimhautoberflächen wurde
jedoch als essenzieller, initialer Schritt für eine Infektion
erkannt [1]. Nur Bakterien, die an Epithelzellen adhärieren
und dadurch nicht von der unspezifischen körpereigenen
Abwehr wie der mukoziliären Clearance, Peristaltik, Sekretfluss
etc. beseitigt werden können, entwickeln die Fähigkeit
zur lokalisierten Proliferation, die die Besiedelung von Epitheloberflächen
ermöglicht; dadurch werden Toxine direkt an den Rezeptor
herangebracht. Bakterien, die an der intestinalen Mukosa adhärieren,
können über Signalproteine zur proteolytischen Auflösung
der angrenzenden Schleimhaut oder durch Freisetzung von Toxinen
zu einer lokalen oder systemischen Entzündung bzw. zu funktionellen
Störungen führen. Eine bereits toxisch oder degenerativ
vorgeschädigte Schleimhaut verliert die Barrierefunktion,
was zum Eindringen von Mikroorganismen in den Körper führt.
Dieser Vorgang wird als bakterielle Translokation bezeichnet.
Die Adhärenz
wird heute als gleichwertiger Virulenzfaktor wie z.B. die Bildung
von Toxinen oder die Gewebszerstörung durch bakterielle
Enzyme gewertet. Im Tiermodell konnte gezeigt werden, dass Toxin-bildende
Mikroorganismen (ETEC) nur in Kombination mit dem Kolonisationsfaktor
zur Manifestation einer Erkrankung führen. Ein weiterer
Hinweis für die klinische Bedeutung der Adhärenz kann
darin gesehen werden, dass pathogene Mikroorganismen (z.B. EHEC)
isoliert wurden, die zwar imstande sind, spezifische Toxine
wie zum Beispiel das Verotoxin zu bilden, jedoch ohne Adhärenzfaktoren
apathogen bleiben.
Escherichia
coli, Salmonellen, Campylobacter jejuni und andere
Mikroorganismen werden häufig bei bakteriellen Infektionen
gefunden. Klinisch manifestieren sich diese als akuter oder
protrahierter Durchfall, als Harnwegsinfekt, Tonsillitis, Pneumonie,
Bronchitis etc. [2]. E. coli, vor allem „p“-Fimbrien-tragende
Stämme mit besonderer Haftfähigkeit, werden bei Infektionen
der oberen Harnwege isoliert [3].
Bakterien
adhärieren durch hoch spezifische Mechanismen an Epithelzellen:
mit Hilfe von Pili, Fimbrien oder Fibrillen stellen sie einen
festen Kontakt mit der Wirtszelle her [4]. Auf der Seite des
Wirtes sind Adhärenzrezeptoren Glykolipide mit einem Tetrasaccharid
als Kohlenhydratanteil [5]. Diese Tetrasaccharide bestehen aus
1 Molekül Glukose und 3 Molekülen Galaktose, die in
Globoserie angeordnet sind. „p“-Fimbrien nützen
Gal alpha1-4 Gal-Sequenzen als Bindungsstelle, Bakterien mit
Typ I-Fimbrien D-Mannose. Darüber hinaus sind jedoch noch
eine Reihe von Spezies-spezifischen Oberflächenstrukturen
bekannt, die für die Adhärenz, eher aber für
die weitere feste Bindung nach dem Erstkontakt des Keimes mit
der Epitheloberfläche verantwortlich gemacht werden. Auch
für invasive Erreger ist eine feste Bindung an die Wirtszelle
zu Beginn der Infektion von entscheidender Bedeutung [6]. Wenn
der initiale Schritt der Adhärenz unterbunden werden kann,
ist das Risiko für das Angehen einer Infektion wesentlich
geringer.
Die Untersuchung
der Adhärenz bakterieller Mikroorganismen als Virulenzfaktor
wurde bisher jedoch weitgehend vernachlässigt. Für
die Untersuchung der Adhärenz von ETEC und EPEC sind Referenzmodelle
mit Zellkulturlinien bekannt (Hep-2-Zellen für EPEC, CaCo-2-Zellen
für ETEC). Für EHEC existiert jedoch keine Referenz-Zelllinie.
Für
die Untersuchung der bakteriellen Adhärenz wird ein Modell
benötigt, welches einen guten Einblick in die Verhältnisse
in vivo zulässt. Die Möglichkeit, in Zellkulturen
eine große Zahl an Versuchszellen gleichzeitig zur Verfügung
zu haben und damit viele verschiedene Proben unter gleichen
Bedingungen zu untersuchen, macht die Verwendung von Zellkulturen
attraktiv.
Jedoch
bestehen hierbei einige gravierende Probleme:
- Nichtpolarisierte
Zellen wie HeLa-, Hep-2- oder MadinDary-Nieren-Zellen spiegeln
die Verhältnisse im menschlichen Körper in keiner
Weise wider.
- Immortalisierte
Zellen von menschlichen intestinalen Tumoren wie CaCo-2 und
HAT-29 sind zwar in der Lage zu differenzieren und können
sogar eine apikale und basolaterale Seite ausbilden. Die Expression
von Membranproteinen und intestinalen Enzymen hängt jedoch
vom Differenzierungsgrad ab und ist ebenso nicht mit den In-vivo-Verhältnissen
vergleichbar.
- Die
Bildung von Rezeptor-Epitopen ist stark von der Kultivierungsdauer
und von Wachstumsbedingungen wie dem Nährmedium abhängig.
- Gesunde
menschliche Enterozyten sind schwierig zu isolieren und variieren
sehr stark von Spender zu Spender.
Es ist
also nicht möglich, selbst für alle Vertreter der
E. coli-Familie (ETEC, EPEC, EHEC und „p“-Fimbrien-tragende
E. coli) eine Zelllinie zu definieren, die alle erforderlichen
Eigenschaften besitzt, um ihre Adhärenz in vergleichenden
Studien zu untersuchen. Deshalb wird die Forderung nach einem
verbesserten Testmodell erhoben:
Menschliches intestinales Dünndarmgewebe entspricht der
In-vivo-Situation am besten und wird daher für
die weiteren Untersuchungen ausgewählt. Dieses Gewebe wird
in Gefrierschnitten präpariert, um die physiologischen
Verhältnisse so gut wie möglich erhalten zu können
und damit die Testung der Adhärenz wie in vivo
zu ermöglichen. Dieses Testsystem kann auch für Untersuchungen
zur Blockierung der Adhärenz pathogener Mikroorganismen
verwendet werden. |
| Material
und Methode
Bakterienstämme
Folgende
Bakterienstämme wurden in die Untersuchung einbezogen:
Es sind
dies einerseits Referenzstämme, die in der internationalen
Literatur (1-3) beschrieben sind, Referenzstämme vom Salmonella-Referenzzentrum
Hamburg (4-6), Referenzstämme vom EHEC-Referenzzentrum
Würzburg (7) sowie frische klinische Isolate aus der Klinik
für Kinder und Jugendliche in Erlangen (8-12).
1. ETEC:
human pathogenic strain H10407 serotype O78:H11 with CFA/I
2. ETEC
H1407g Nataro, Institute for Vaccine development, Maryland
3. EPEC
P2348, Serotype O127:H6 (Cravioto)
4. SATH
Dt104c
5. SAEN
2
6. Sat
02-01427
7. EHEC
9436/46
8. Salmonella
typhimurium (frisches klinisches Isolat) SaTh1
9. Salmonella
typhimurium (frisches klinisches Isolat) SaTh2
10. ETEC
117/86
11. EPEC
25496
12. EHEC
W3674/92
Wachstums-
und Kulturbedingungen der Keime
- Die
Stämme werden bei -70°C in Mikrobanken (ProLab Diagnostics,
Neston GB) gelagert.
- 1 Einheit
dieser tiefgefrorenen Kei-me wird in TSB-Y(30 g Trypcase Soja
+ 10 g Hefeextrakt/l Aqua bidest)-Bouillon angezüchtet:
Bebrütung erfolgt bei 37°C über 12 Stunden.
- 0,3
ml der trüben Bouillon wird in 10 ml TSB-Y eingebracht
und für 3 Stunden im Shaker bei 37°C bebrütet.
Dies resultiert in einer Ausgangskeimzahl von 5 x 10
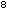 CFU/ml.
CFU/ml.
- Die
Bouillon wird zentrifugiert (1500 rpm, 10 min, in Raumtemperatur)
der Überstand wird abgekippt. Die Zellsuspension wird
1 x in 10 ml NaCl 0,9% gewaschen und anschließend in
1 ml Blockierungspuffer zur Hemmung der unspezifischen Adhärenz
resuspendiert. Der Blockierungspuffer enthält 2% Mannose
+ 0,05% Tween 20 in NaCl 0,9%.
- Eine
Keimzahl von 10
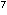 CFU/ml in der Testlösung wird durch Verdünnung mit
NaCl 0,9% hergestellt. Trübungsmessung bei 475 nm im
Photometer ergibt bei einer OD von 0,15 die gewünschte
Inokulumdichte von 10
CFU/ml in der Testlösung wird durch Verdünnung mit
NaCl 0,9% hergestellt. Trübungsmessung bei 475 nm im
Photometer ergibt bei einer OD von 0,15 die gewünschte
Inokulumdichte von 10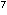 CFU/ml.
CFU/ml.
Gefrierschnitte
Gefrierschnitte
aus dem terminalen Ileum von Patienten wurden zur Untersuchung
verwendet. Die Gewebsproben wurden bei einer Operation –
z.B. Resektion eines Tumors im Colon ascendens, Reoperation
eines Ileostomas – gewonnen. Das Gewebe wurde im Gesunden
abgesetzt und histologisch als unversehrt dokumentiert. Die
Patienten weisen präoperativ keine Minderdurchblutung der
Darmschleimhaut auf.
Die Darmabschnitte
werden sofort zur Herstellung der Gefrierschnitte vorbereitet,
mit Kohlensäureschnee tiefgefroren und mit einem Gefriermikrotom
in 6 µm dicke Schnitte geschnitten und auf Objektträger
aufgenommen. Die Lagerung der Schnitte erfolgt bei -70°C.
Es ist
sichergestellt, dass jeweils mindestens 300 sequenzielle Proben,
die zur Untersuchung eines Keimes notwendig sind, von einem
Patienten stammen.
Untersuchungsgang
Untersuchung
der Adhärenz
Die Gefrierschnittprobe auf dem Objektträger wird mit einem
Daco Pen (DACO A/S Dänemark) eingekreist, anschließend
werden 200 µl der Bakteriensuspension auf den Gefrierschnitt
aufgebracht.
EPEC, ETEC
und Salmonellen werden für 30 Minuten mit dem Gefrierschnitt
inkubiert, EHEC für 60 Minuten. Nach der entsprechenden
Kontaktzeit wird der Gefrierschnitt mit PBS sorgfältig
gewaschen, getrocknet und nach Pappenheim gefärbt.
Nach der
Färbung wird der Gefrierschnitt mit einem Deckglas zur
Auszählung und weiteren Aufbewahrung geschützt.
Kohlenhydrate
3 verschiedene
Kohlenhydrate (Galfres, Isomalt, Mannose) werden geblindet in
doppelter Ausführung hergestellt. Die Konzentration beträgt
2% in der Ausgangslösung, um mit der 1:1 Keimverdünnung
eine ultimative Konzentration von 1% zu erreichen. Der pH-Wert
von 6 der Probe mit dem Kohlenhydrat stellt sich nach 1:1 Mischung
mit der Keimsuspension auf ca. 6,5-6,7 ein.
Untersuchung
der Blockierung der Adhärenz durch Kohlenhydrate
150 µl Keimsuspension + 150 µl Kohlenhydratsuspension
werden in Mikrotiterplatten eingebracht und 1 Stunde bei 37°C
vorinkubiert. Die weitere Untersuchung erfolgt wie bei der Adhärenztestung.
Auszählung der Proben
Die Keime,
die in 20 aneinander liegenden Krypten liegen, werden gezählt
und der Mittelwert der Keimzahl pro Krypte kalkuliert. Bei einer
Schnittdicke von 6 µm liegen die auszuzählenden Krypten
in den entsprechenden Proben aneinander und ermöglichen
dadurch den direkten Vergleich. Die Auswahl der Gefrierschnitte
erfolgt so, dass ein direkter Vergleich zwischen Adhärenz
und Blockierung der Adhärenz durch aufeinander folgende
Schnitte möglich ist. |
| Ergebnisse
Adhärenzuntersuchungen
Die Adhärenzmuster
unterschiedlicher Mikroorganismen werden als diffus, lokalisiert
oder aggregativ auf die Epithelschicht bezogen beschrieben.
Im darunter liegenden Bindegewebe werden keine adhärierenden
Mikroorganismen beobachtet. Für die einzelnen Bakterienstämme
zeigen sich charakteristische Adhärenzmuster, die für
die jeweilige Bakterienart typisch und reproduzierbar sind.
Durch die Verwendung des Gefrierschnittmodells und nach ausführlicher
Testung der jeweiligen Bakterienstämme konnte die Adhärenz
standardisiert werden. So konnte gezeigt werden, dass ETEC nur
an der Oberfläche der Epithelzellen haftet, EHEC aber den
Verband der Epithelzellen zerstört und in das Stroma unter
der Epithelschicht vordringt; EPEC zerstört den Mikrovillisaum
und wird intrazellulär beobachtet (Abbildung 1a, 1b, 1c).
Abbildung
1a: EPEC intrazellulär
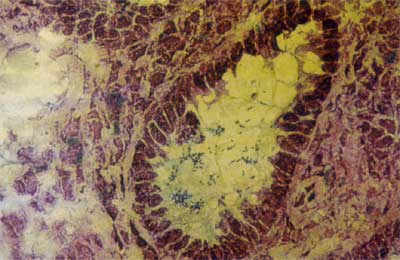
Abbildung
1b: ETEC an der Epitheloberfläche
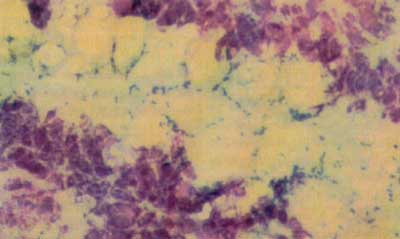
Abbildung
1c: Aggregative Adhärenz von EHEC
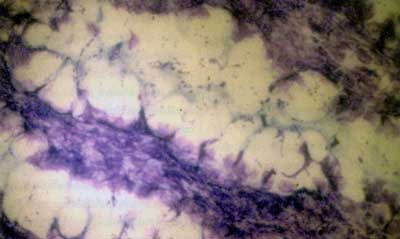
|
Blockierung
der Adhärenz
In den
geblindeten Untersuchungen konnte eindeutig das „wirksame“
Galfres von den Proben mit Isomalt und Mannose unterschieden
werden. Bei den von uns untersuchten Kohlenhydraten konnten
die Proben mit „Galfres“, einem sauren Oligogalakturonid
[7, 8], die Adhärenz fast vollständig reduzieren.
Dies ist dadurch zu erklären, dass dieses Kohlenhydrat
die Rezeptorstrukturen an den Fimbrien der Bakterien besetzt,
wodurch die Bakterien keine Möglichkeit mehr haben zu adhärieren.
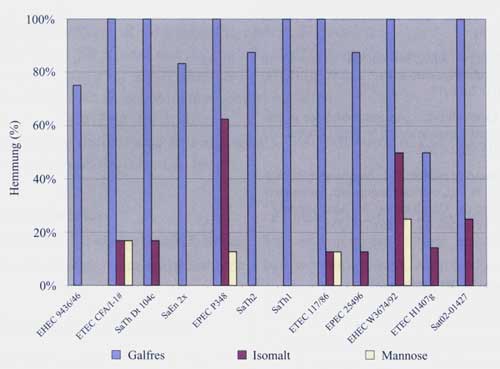
Sieben
der zwölf getesteten Stämme konnten durch das Kohlenhydrat
„Galfres“ komplett in ihrer Adhärenz gehemmt
werden, bei weiteren drei konnte die Adhärenz um mindestens
80% gesenkt werden. Im Gegensatz dazu hatten die beiden Kontrollsubstanzen
insgesamt nur geringe Hemmwirkung. Vier der zwölf getesteten
Stämme ließen sich überhaupt nicht beeinflussen,
weitere sechs Stämme zeigten eine Adhärenzreduktion
durch Maltose zwischen 10 und 20%. Bei zwei Stämmen wurde
eine Adhärenzreduktion um 50-60% beobachtet. Mannose hingegen
zeigte bei vier Stämmen eine Adhärenzreduktion zwischen
15-25%. Es ist bemerkenswert, dass bei diesen Stämmen trotz
des Einsatzes des 2%igen Mannose-Blockingpuffers zur Elimination
der unspezifischen Mannose-empfindlichen Resistenz durch Typ-I-Fimbrien
eine zusätzliche geringe Reduktion der Adhärenz erzielt
werden konnte. Die Reduktion der Adhärenz der verschiedenen
Bakterienstämme mit den unterschiedlichen Kohlenhydratproben
wird in Abbildung 2 gezeigt.
Abbildung
2: Hemmung der Adhärenz der getesteten Mikroorganismen
durch unterschiedliche Kohlenhydratproben
|
|
| Diskussion
Infektionen stellen ein großes Prob-lem für die moderne
Medizin dar. Nosokomiale Infektionen wie Sepsis, Pneumonie,
Harnwegsinfekte und Durchfall stehen als Todesursache auf Platz
eins bei kritisch Kranken auf Intensivstationen. Die Gesamtletalität
an Sepsis auf einer Intensivstation beträgt 20%, die 30-Tage-Letalität
bei einem Krankheitsbild mit Sepsis, septischem Schock und Organdysfunktion
beträgt 30-50% [9]. Der Einsatz von Antibiotika hat einen
positiven Effekt, kann aber die Sterblichkeit nicht nachhaltig
reduzieren. Die Zahl der multiresistenten Bakterien, die auf
Intensivstationen gefunden werden, steigt kontinuierlich. Um
diese Probleme zu kontrollieren, ist die Prophylaxe unumgänglich.
Da die
Adhärenz als ebenbürtiger Virulenzfaktor in der Entstehung
von Infektionen betrachtet werden kann, kommt einer Blockierung
der Adhärenz auch eine entscheidende Rolle zu. Die Blockierung
der Adhärenz kann durch Rezeptoranaloga erreicht werden,
wobei die Oberflächenantigene der Bakterien durch wasserlösliche
Kohlenhydratstrukturen besetzt werden. Wie in unseren Untersuchungen
gezeigt, sind saure Galakturonide, die durch Fermentation aus
Pektin gewonnen werden, für die von uns untersuchten enteropathogenen
Mikroorganismen in einem hohen Maße adhärenzhemmend.
Die Proben
mit Mannose und Isomalt können die Adhärenz nicht
wesentlich vermindern. Da weder der 6fachZucker D-Mannose noch
die zwei Glukosemoleküle bei der Maltose in der Lage waren,
die Strukturen, die zur Adhärenz benötigt werden,
zu besetzen, können die Bakterien weiterhin an den Epithelzellen
Halt finden. Es ist zwar in der Literatur bekannt, dass D-Mannose
die Adhärenz von E. coli-Stämmen mit dem
Fimbrientyp I blockieren kann, die klinisch relevanten, pathogenen
E. coli-Stämme mit dem Fimbrientyp II können
durch D-Mannose in ihrer Adhärenz nicht beeinflusst werden.
Auch das Disaccharid Maltose hat keinen nennenswerten Einfluss
auf die Adhärenz der untersuchten Bakterienstämme,
wie unsere Untersuchungen zeigen konnten.
|
| Ausblick
Saure Galakturonide
können sowohl in der Humanmedizin als auch in der Veterinärmedizin
zum Einsatz kommen. In der Humanmedizin können sie bei
bakteriellen Durchfallerkrankungen und Fehlbesiedelungen oberer
Dünndarmabschnitte und zur Stabilisierung der physiologschen
Flora dienen. Bei schwer kranken Patienten oder nach Knochenmarksablation
können saure Galakturonide die bakterielle Translokation
aus dem Darm günstig beinflussen und so zu einer rascheren
Genesung des Patienten und zur Einsparung von Antibiotika führen.
Von besonderer Bedeutung dieser Therapie ist das Fehlen einer
Resistenzinduktion durch diese sauren Galakturonide.
In der
Tiermedizin ist an einen Ersatz von Antibiotika als Leistungsförderer
zu denken, nachdem Antibiotika als Leistungsförderer ab
dem Jahr 2006 in der EU untersagt werden [10, 11].
Das Potenzial
saurer Oligogalakturonide kann im In vitro-Modell nur
erahnt werden. Das Einsatzgebiet muss in prospektiven klinischen
Studien ausgelotet werden, um einen möglichst breiten Einsatz
auf der gesamten Anwendungsbreite zu ermöglichen.
|
Literatur:
| 1.
Evans D.G., Silver R.P., Evabs D.J., Chase D.G., Gorbach
S.L.: „Plasmid controlled colonization factor associated
with virulence in ETEC for humans.“ Infect. Immun.
12 (1975) 656-667. |
| 2.
Sack R.B.: „Enterotoxigenic Escherichia coli: identification
and characterization.“ J. Infect. Dis. 142 (1980)
279-286. |
| 3.
Dominigue G.J., Roberts J.A., Laucirica R., Reiner M.H.,
Bell D.P., Suarez G.M., Kallenius G., Svenson S.B.: „Pathogenic
significance of P-fimbriated E. coli in urinary tract infections.“
J. Urol. 133 (1985) 983-989. |
| 4.
Donneberg M.S.: „Interaction between en-teropathogenic
Escherichia coli and epithelial cells.“ Clin. Infect.
Dis. 28 (1999) 451-455. |
| 5.
Cravioto A., Gross R.J., Scotland S.M., Ropwe B.: „An
adhesive factor found in strains of Escherichia coli belonging
to the traditional infantile enteropathic serotypes.“
Curr. Microbiol. 3 (1997) 95-99. |
| 6.
Yamamoto T., Endo S., Yokozta T., Eccheveria P.: „Characteristics
of adherence of enteroaggregative Escherichia coli to human
and animal mucosa.“ Infect. Immun. 59 (1991) 3722-3739. |
| 7.
Zopf D., Roth S.: „Oligosaccharides as anti-infective
agents.“ Lancet 347 (1996) 1017-1021. |
| 8.
Kastner U., Glasl S., Follrich B., Guggenbichler J.P., Jurenitsch
J.: „Saure Oligosaccharide als Wirkprinzip von wässerigen
Zubereitungen aus der Karotte in der Prophylaxe und Therapie
von gastrointestinalen Erkrankungen.“ Wiener Med.
Wochenschr. 152 (2002) 379-381. |
| 9.
Vincent J.L.:„Nosocomial infections in adult intensive
care units.“ Lancet 361 (9374) (2003) 2068-77. |
| 10.
Gorbach S.L.: „Antimicrobial use in animal feed –
time to stop.“ N. Engl. J. Med. 345 (2001) 1202-1203.
|
| 11.
Awad-Massalmeh M., Sagmeister H., Willinger H.: „Untersuchungen
zur Immunprophylaxe der Colidiarrhoe des Absetzferkels.“
ZBL Vet. Med. 32 (1985) 751-758. |
Anschrift
des Verfassers:
Cand. med. Siegmund Guggenbichler
A-6020 Innsbruck, Kaiserjägerstraße 7
E-Mail:
siegmund.guggenbichler@chello.at
|
|
|