Einsatz von
Antibiotika in der Nutztierhaltung.
Ersatz durch saure Oligogalakturonide |
| J.P. Guggenbichler
1, B. Follrich 2, Ch. Franz 3, J. Jurenitsch 2
1 Univ.-Klinik für Kinder und Jugendliche der Universität
Erlangen/Nürnberg
(Vorstand: Univ.-Prof. Dr. W. Rascher)
2 Institut für Pharmakognosie der Universität Wien
(Vorstand: Univ.-Prof. Dr. B. Kopp)
3 Angewandte Botanik und Pharmakognosie, Veterinärmedizinische
Universität Wien
(Vorstand: Univ.-Prof. Dr. Ch. Franz) |
Schlüsselwörter:
Antibiotika, Leistungsförderer, Resistenzentwicklung, saure
Galakturonide |
|
Zusammenfassung
Antibiotika werden
in der Tiermedizin in großen Mengen entweder als Therapeutikum,
zur Prophylaxe oder als Leistungsförderer zur Steigerung
der Lebendmassenzunahme eingesetzt. In zahlreichen Studien wird
der Einsatz von Antibiotika in der Fütterung von Nutztieren
mit der Entwicklung resistenter Mikroorganismen beim Menschen
in Zusammenhang gebracht. Dies wurde einerseits in Form einer
zunehmenden Resistenz von Salmonella-Stämmen,
Campylobacter und Enterococcus faecium mit
schweren, lebensbedrohlichen Erkrankungen und einer erheblichen
Einschränkung der therapeutischen Optionen beobachtet.
Mindestens ebenso beunruhigend ist der Transfer von Resistenzgenen
von E. coli, Bacteroides und Gram-positiven
Mikroorganismen von Nutztieren in die kommensale Flora des Menschen.
Durch die Europäische
Union sowie die WHO wurde daher der Einsatz von Antibiotika
als Leistungsförderer zeitlich bis zum Beginn des Jahres
2006 beschränkt. Die Empfehlungen der WHO besagen, dass
Antibiotika nur gezielt zur Therapie von Infektionen beim Tier
eingesetzt werden dürfen und von einem Tierarzt verschrieben
werden müssen. Antibiotika mit großer therapeutischer
Bedeutung beim Menschen wie Fluoroquinolone, Glykopeptide und
Cephalosporine der III. Generation dürfen nicht verwendet
werden.
Es ist daher von
großer Bedeutung, alternative Methoden zur Prophylaxe
von Durchfallerkrankungen und Sepsis bei Nutztieren sowie zur
Stabilisierung der Flora zu entwickeln. Die Adhärenz bakterieller
Mikroorganismen wurde als wesentlicher Virulenzfaktor erkannt.
Pathogene Mikroorganismen haften an Kohlenhydratstrukturen der
Epitheloberflächen. Durch den Einsatz von Kohlenhydraten,
die als Rezeptor-Analoga die Adhärenz bakterieller Mikroorganismen
an Epithelzellen blockieren, kann die Besiedelung von Schleimhäuten
verhindert und ein wichtiger Virulenzfaktor ausgeschaltet werden.
In mehreren eigenen
Tierversuchen wurden mit Karottenpektinen bzw. den aus diesem
Vorprodukt isolierten Oligogalakturoniden sehr gute prophylaktische
und therapeutische Wirkungen erzielt. Oligogalakturonide bieten
sich als Ersatz von Antibiotika in der Prophylaxe von z.B. Durchfallerkrankungen
in der Tieraufzucht sowie als Leistungsförderer an.
|
Key-words:
Antibiotics, resistance, growth promotors, acidic
galacturonides |
|
Summary
Antimicrobials
have been used in food animals for nearly half a century. Among
the most common drugs that are used are compounds either identical
or related to those administered in human medicine. These antimicrobial
agents are administered to food animals as therapy for an infection
or, in the absence of disease, for prophylaxis or for subtherapeutic
purposes for growth promotion and enhanced feed efficiency.
There is ample evidence that the use of antimicrobials selects
for resistant strains and enhances their persistence in the
environment. Multidrug resistance in Salmonella, Campylobacter
and Enterococcus faecium has been observed which can
increase the frequency and severity of infections and limit
treatment options. Another concern of similar magnitude is the
horizontal spread of the resistance genes from multiresistant
bacteria in food animals to commensal strains in the intestinal
microflora of humans. Extensive transfer of antimicrobial resistance
has been demonstrated among enteric bacteria, bacteroides and
gram-positive bacteria in the human colon.
On this
basis European health authorities and the WHO provided expert
recommendation. Antibiotics should be used only when indicated
in individual infected animals for targeted pathogens and prescribed
by veterinarians. The use of certain antibiotics with important
uses in humans such as fluoroquinolones, glycopeptides and third
generation cephalosporines should be prohibited in animals.
The subtherapeutic use of antimicrobials for growth promotion
will be banned by 2006.
Alternative
methods for prophylaxis of infections in animals have been described.
Adherence of bacterial microorganisms has been found as a major
virulence factor. The use of acidic galacturonides as receptor
analogs for blockage of adherence has been investigated extensively
in experimental and animal studies. Favorable results have been
obtained in prophylaxis of diarrhea of weaning piglets and in
the prevention of adnexitis in a laying hen battery. These oligogalacturonides
could serve as a valuable alternative to antibiotics in the
food chain.
|
Einleitung
Seit nahezu 50 Jahren werden
weltweit Antibiotika in der Tierernährung eingesetzt. Dies
wurde nötig, nachdem schwere lokale und septische Infektionen
in der Schweine- und Kälberaufzucht und in Legehühnerbatterien
als Folge der industriellen Nahrungsherstellung unter Intensivtierhaltung
beobachtet wurden [1]. Diese Infektionen treten vorzugsweise
nach dem Abstillen der Tiere und dem Transfer in ein neues mikrobielles
Milieu auf. Kreuzinfektionen werden durch beengte Raumverhältnisse
und daraus resultierenden Stress sowie durch die artspezifisch
erhöhte Adhärenz bestimmter Serotypen von Escherichia
coli und anderen fakultativ pathogenen Erregern beobachtet.
Antibiotika wurden in der Therapie dieser Infektionen verabreicht
sowie auch zur Prophylaxe als Fütterungsarzneimittel in
kritischen Phasen wie z. B. bei der Umstallung eingesetzt. In
der Folge kam es schließlich zum Einsatz von Antibiotika
in subtherapeutischen Dosen als Leistungsförderer, um eine
Steigerung der Lebendmassezunahme und eine Verringerung des
Futteraufwandes zu erzielen. Obgleich der Einsatz von Leistungsförderern
nur zur Verbesserung der Leistungsparameter und zur Stabilisierung
der physiologischen Mikroflora bzw. zur Unterstützung der
physiologischen Verdauungsprozesse erfolgte, wurde auch eine
Reduktion der Häufigkeit von Durchfallerkrankungen bei
diesen Tieren beobachtet. Als erwünschter Nebeneffekt stellte
sich auch eine verminderte Gülleproduktion ein.
Die in
therapeutischen Indikationen am häufigsten verwendeten
Antibiotika sind gleiche oder ähnliche Präparate,
die auch in der Humanmedizin eingesetzt werden wie Penicillin,
Tetrazykline, Cephalosporine der III. Generation, Fluoroquinolone,
das Avoparcin (ein Glykopeptid ähnlich dem Vancomycin)
und Virginiamycin (ein Streptogramin ähnlich dem neu entwickelten
Quinupristin-Dalfopristin) [2]. Beim Antibiotikaskandal 2000
musste man feststellen, dass in Niederbayern auch große
Mengen von Chloramphenicol verabreicht worden waren. |
| Klinische
Auswirkung antibiotischer Leistungsförderer
Durch die
therapeutische und prophylaktische Verabreichung von Antibiotika
in der Nutztierhaltung kommt es zur Selektion/Induktion resistenter
Mikroorganismen vor allem im Kot dieser Tiere [3, 4, 5, 6, 7].
Meist konzentriert sich die Diskussion in diesem Zusammenhang
auf den Transfer humanpathogener Mikroorganismen auf den Menschen.
Der Transfer resistenter Mikroorganismen wie Salmonella-Stämme
und Campylobacter spp. von Tieren auf den Menschen
ist ein bekanntes Phänomen [4, 5]. White berichtet über
den Nachweis von
Salmonellen bei 20% der kommerziell erhältlichen Packungen
von Hackfleisch, 84% der Isolate zeigten eine Resistenz auf
wenigstens eine Antibiotikaklasse [8]. Salmonellen und andere
resistente Mikroorganismen kommen jedoch auch in Gemüse-
und Salatzubereitungen, Hülsenfrüchten, Ölsamen,
Kräutertee-Mischungen und Pilzen vor, die mit organischem
Dünger von Tieren, die diese resistenten Mikroorganismen
ausscheiden, in Kontakt gekommen sind [9].
In weiteren
Studien wurden in Fleisch, insbesondere in Hühnchen Enterococcus
faecium sowie Campylobacter jejuni gefunden, ein
Bakterium mit zunehmender Bedeutung in der Humanmedizin [10].
Diese Mikroorganismen zeigen eine hohe Resistenz gegen Fluorochinolone,
seitdem diese Antibiotika in therapeutischem Gebrauch sind.
McDonald
berichtet von Hähnchen, die zu 17% mit einem Quinupristin-Dalfopristin-resistenten
Stamm von Enterococcus faecium, einem neu auf den Markt
gebrachten „Reserve-Antibiotikum“ mit Wirksamkeit
gegen MRSA, kontaminiert sind [11].
Ein Grund
zur erheblichen Sorge – und es bestehen genügend
wissenschaftliche Beweise – ist die horizontale Übertragung
von Resistenzgenen der normalen Stuhlflora von Tieren bzw. der
Mikroorganismen in Gülle auf die kommensale Flora des Menschen
[12]. Soerensen beschreibt einen Glykopeptid- und Streptogramin-resistenten
Stamm von Enterococcus faecium in Hühnchenteilen
und Schweinefleisch, der zu einer transienten Besiedelung von
freiwilligen Probanden geführt hat [13]. Dieser Resistenztransfer
wurde bei Enterobacteriaceae, Bacteroides spp.
und Gram-positiven Mikroorganismen wie Enterokokken in der Stuhlflora
des Menschen beobachtet. Vancomycin-resistente Enterokokken
wurden bei Hühnern sowie gleichzeitig bei Landarbeitern
auf Hühnerfarmen und Personal in Schlachthöfen isoliert
[14]. Die weit verbreitete Resistenz von Enterokokken auf Glykopeptide
bei Menschen resultierte aus der Anwendung von Avoparcin, das
jedoch bereits seit 1997 nicht mehr verwendet werden darf [15,
16]. Diese VanA-Typ Vancomycin-resistenten Enterokokken persistieren
jedoch für Jahre [17].
Über
die Menge der Antibiotika, die in der Tiermast verwendet wurde,
bestehen nur unzureichende Angaben [18]. Eine offizielle Schätzung
besagt, dass ca. 50% der Antibiotikamenge, die in den USA hergestellt
wird, in der Tierhaltung, vorwiegend in subtherapeutischen Dosen,
Verwendung findet. Die „Union of Concerned Scientists“
veröffentlichte eine Schätzung nach der in den USA
jährlich 11,2 Millionen kg als Leistungsförderer und
nur 900.000 kg als Therapeutika im Veterinärbereich verabreicht
werden. Demgegenüber finden nur 1,3 Millionen kg in der
Humanmedizin Verwendung. Etwas anders sieht die Situation in
Europa aus: Von den in der EU jährlich an Nutztiere verabreichten
4.700 t Antibiotika entfallen nur 1.000 t als Leistungsförderer
und die größere Menge auf den Einsatz in therapeutischen
Dosen, da bereits jetzt nur noch 4 Antibiotika als Futterzusatzstoffe
zugelassen sind [19]. Zusammenfassend muss man feststellen,
dass auf jeden Fall erhebliche Mengen an Antibiotika in der
industriellen Nahrungsherstellung zum Einsatz gelangen.
Seit nahezu
3 Jahrzehnten tobt ein Meinungsstreit über die Auswirkungen
der Verwendung von Antibiotika in der Tiermast auf den Menschen.
Nahezu 1,4 Millionen Erkrankungen durch Salmonellen werden pro
Jahr in den USA beobachtet [20, 21]. In Bayern werden pro Jahr
ca. 7.000-10.000 Fälle von Infektionen mit Salmonella
enteritidis registriert, wobei die Dunkelziffer erheblich
höher liegt [22]. Ca. 3% der Patienten zeigen eine extraintestinale
Ausbreitung, die Letalität beträgt 1%, wobei besonders
Personen >65 Jahre betroffen sind.
Trotz der
oben genannten beunruhigenden Faktoren warnt ein Teil der Tiermediziner
vor dem Verbot der antibiotischen Leistungsförderer, weil
dadurch nur der therapeutische Ansatz in höheren Dosen
ausgelöst würde wie gewisse Trends bereits gezeigt
haben sollen. Auch die Nahrungsmittelindustrie beharrt weiterhin
auf der Verwendung von Antibiotika in der Tiermedizin. [23,
24, 25]. Zu den Argumenten gehört z.B., dass Durchfallerkrankungen
bei Absetzferkeln in vielen Schweinebetrieben ein häufiges
Problem darstellen. Tiere finden sich nach dem Absetzen mit
unbekannten Artgenossen konfrontiert und in einer für sie
komplett neuen Umgebung mit neuer Mikroflora. Diese umweltbedingten
Veränderungen, diätetische Faktoren, virale und bakterielle
fakultativ pathogene Krankheitserreger in Kombination mit Stress
können zu Durchfallerkrankungen, aber auch Sepsis in Form
der Ödemkrankheit beim Ferkel führen [25]. Häufig
sind an diesen Durchfallerkrankungen nicht kommensale Escherichia
coli beteiligt. Es sind spezifische Sero- und Pathotypen
von Bakterien, deren Virulenz und Bedeutung für das Krankheitsgeschehen
durch ihre Adhärenz an den Epithelzellen des Intestinaltrakts
sowie an der Fähigkeit zur Bildung von Enterotoxinen mitbestimmt
wird. Erkranken diese Ferkel, kommt es zu einer verminderten
Lebendzunahme, oder die Tiere verenden. Die Freilandhaltung
von Hühnern ist durch Kreuzinfektionen zwischen Herden
mit dem hühnerpathogenen E. coli-Stamm O78 K80
mit Tierausfällen und einer erheblich verminderten Legeleistung
belastet [26].
Ein wesentlicher
Beweggrund für die Verwendung von Antibiotika als Leistungsförderer
ist vor allem der kommerzielle Nutzen, den man trotz erheblicher
Kosten von den Antibiotika erwartet.
1995 wurde
vom dänischen Landwirtschaftsministerium Avoparcin als
Leistungsförderer verboten [27, 28]. Nach dem europäischen
Recht mussten bei ausreichendem wissenschaftlichen Nachweis
alle europäischen Länder dieser lokalen Rechtsprechung
folgen. Durch die europäische Legislatur wurde daher in
den letzten Jahren dem Großteil der antimikrobiellen Leistungsförderer
die Zulassung entzogen.
Nach einer
vorübergehenden Steigerung der therapeutischen Anwendung
von Antibiotika bei Masttieren zur Behandlung von Durchfallerkrankungen
in Dänemark konnte bis 2000 eine Reduktion des Antibiotikaverbrauchs
um 50% erzielt werden [29]. Gleichzeitig konnte jedoch auch
ein Rückgang des Selektionsdrucks z.B. auf Enterokokken
in Geflügelfarmen beobachtet werden. Dieser Rückgang
wurde noch deutlicher, als auch das Makrolid-Antibiotikum Tylosinphosphat
als Leistungsförderer untersagt wurde. Eine Verbesserung
der Resistenzsituation konnte auch bei Campylobacter
gezeigt werden.
|
| Alternative
Methoden zum Ersatz von Antibiotika als Leistungsförderer
Untersuchungen
haben gezeigt, dass auch trotz Elimination von Antibiotika als
Leistungsförderer kommerzielle Nachteile für die Tierhalter
durch alternative Maßnahmen vermieden werden können.
Es sind
dies ein gutes Stallmanagement, die Beachtung hygienischer Maßnahmen
in Bezug auf Stallklima, Haltungs- und Fütterungstechniken
sowie die Stalldesinfektion. Auch kleinere Herden sowie ein
größeres Raumangebot zur Verhinderung von Stress
zeigen einen günstigen Einfluss. Als Futterzusatz wurden
Säurezusätze im Wasser und der Einsatz von Probiotika
beschrieben. Auch der Zusatz von sprühgetrocknetem bovinen
Plasma zur Milch gleichzeitig mit Fruktooligosacchariden, Molke
und Vitaminen/Elektrolyten führte in einer Studie bei Kälbern
zu einer Reduktion von Durchfallerkrankungen und einer gesteigerten
Gewichtszunahme [30, 31]. Die Fütterung mit gentechnologisch
verändertem Reis, der humanes Laktoferrin und Lysozym exprimiert,
schützte den Darm ähnlich gut vor bakterieller Besiedelung
wie die Verabreichung subinhibitorischer Mengen von Bacitracin
und Roxarsone [32]. Lysozym und Laktoferrin werden wie weitere
genkodierte Substanzen (ß-Defensine) als körpereigene
antimikrobielle Peptide (AP) bezeichnet, die von Epithelzellen
gebildet werden. Sie besitzen ein breites bakterizides Wirkspektrum
gegen Gram-positive, Gram-negative Mikroorganismen, Viren und
C. albicans [33]. Es scheint, dass Probiotika, aber
auch E. coli Nissle 1917 die Bildung dieser AP induzieren.
Auch die Züchtung resistenter Schweine sowie die Impfung
gegen bestimmte speziesspezifische Serotypen von E. coli
werden angewandt [34, 35].
Auf breites
Interesse stößt derzeit der Einsatz bioaktiver Pflanzeninhaltsstoffe.
Einerseits sind es antimikrobiell wirksame ätherische Öle
wie Thymian-, Oregano- und Zimtöl, anderseits pflanzliche
Phenole, die antioxidative und immunstimulierende Eigenschaften
besitzen und die Darmperistaltik positiv beeinflussen. Mehrere
diesbezügliche Projekte werden derzeit im 6. EU Forschungs-Rahmenprogramm
gefördert [36].
|
| Adhärenzblockierung
von Mikroorganismen an Epithelzellen
Ein innovatives
neues Konzept stellt die Blockierung der Adhärenz bakterieller
Mikroorganismen an Darmepithelien dar. Die Adhärenz bakterieller
Mikroorganismen an Epithelzellen ist ein wesentlicher initialer
Schritt von Infektionen. Erst wenn Keime (Bakterien, Viren,
Pilze) an der Schleimhaut haften und durch die unspezifischen
Abwehrmechanismen (Schleim, Peristaltik, Epithelabschilferung,
AP) nicht mehr mechanisch entfernt werden können, entwickeln
sie die Fähigkeit zur lokalen Proliferation und Besiedelung
der Schleimhäute [37].
Bakterien,
die an der intestinalen Mukosa adhärieren, können
entweder direkt durch Bildung von Proteasen und Hämolysinen
zur Degeneration der angrenzenden Schleimhaut oder durch Freisetzung
von Toxinen zu einer lokalen oder systemischen Entzündungsreaktion
bzw. zu funktionellen Störungen der Resorption führen
(Abbildung 1).
Abbildung
1: Adhärenz von EHEC an der Schleimhaut
des terminalen Ileums eines Saugferkels. Auflösung
der Mikrovillus-Struktur adhärenter Mikroorganismen
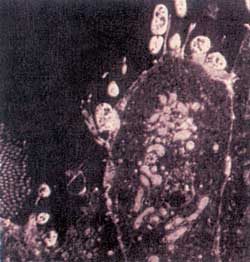
|
Somit stellt
die mikrobielle Adhärenz an der Schleimhaut einen wesentlichen
ersten Schritt in der Pathogenese von Infektionen insbesondere
des Gastrointestinal- und Urogenitaltrakts dar [38].
Der Vorgang
der mikrobiellen Adhärenz ist komplex und zeichnet sich
durch Gewebstropismus, Speziesspezifität, Altersspezifität
und genetische Spezifität aus [39]. Hinzu kommt, dass vor
allem Virusinfektionen zu einer wesentlichen Steigerung der
Adhärenz und somit zu einer Zunahme der Besiedelung von
Epitheloberflächen führen können.
Enteropathogene
Escherichia coli und andere Enterobacteriaceae
haften über Fimbrien und andere membranständige Adhäsine
an der Darmschleimhaut und anderen Organstrukturen. Fimbrien
sind Proteinstrukturen mit einer terminalen Lektin(artigen)-Domäne,
welche an membranständigen Oligosaccharid-Epitopen binden.
Dabei handelt es sich um ein Glykolipid, wobei der Kohlenhydratanteil
ein Tetrasaccharid mit einem Molekül Glukose und drei Molekülen
Galaktose in Globoserie darstellt [40, 41]. Fimbrien fakultativ
pathogener und pathogener Mikroorganismen nützen diese
Gal alpha1-4 Gal-Sequenzen als Bindungsstelle [42].
Von therapeutischem
und prophylaktischem Interesse ist die Möglichkeit, die
Adhärenz an Epithelzellen als Rezeptor-Analoga zu blockieren.
Chemisch handelt es sich dabei um saure Galakturonide, die aus
natürlichen Quellen aus dem Grundstoff Pektin durch Fermentation
gewonnen werden. Die Blockierung der Adhärenz wurde in
experimentellen Untersuchungen an immortalisierten Gewebskulturzellen
aus dem Intestinaltrakt, vor allem aber an Gefrierschnitten
menschlichen und tierischen Materials eindrucksvoll nachgewiesen
[43, 44]. Es ist zu betonen, dass die klinische Wirksamkeit
dieses Prinzips in der Humanmedizin in Form natürlicher
Heilmittel (Karottensuppe nach Moro) bereits seit Jahrhunderten
etabliert ist [45].
Basierend
auf den oben beschriebenen Kenntnissen wurden experimentelle
Feldstudien über den Einsatz von Karottenpektinen, die
Galakturonide enthalten, als Futterzusatz in der Ferkelaufzucht
am Lehr- und Forschungsgut der Veterinärmedizinischen Universität
Wien durchgeführt [46]. In der Folge wurde das wirksame
Agens Oligogalakturonide isoliert aus Pektin zur Therapie/Prophylaxe
von Adnexitiden in einer Legehühnerbatterie eingesetzt.
Die Möglichkeit der Blockierung der Adhärenz eines
Teststammes durch diese Galakturonide wurde auch im Rahmen einer
Pilotuntersuchung bei Labormäusen quantifiziert. |
| Fütterungsstudien
Ferkelstudie
In zwei
Studien wurden jeweils 3 Gruppen von Absetzferkeln verglichen.
In Studie 1 wurden 199 Saug- und Absetzferkel aus 20 Würfen
bezüglich der Durchfallhäufigkeit verglichen. Die
Ferkel wurden in 3 Fütterungsgruppen eingeteilt und erhielten
folgende Futtermischungen [46]:
1. Gruppe:
Karottenpulver ohne Leistungsförderer (LF)
2. Gruppe:
Tylosinphosphat als LF ohne Karottenpulver
3. Gruppe:
Futtermischung ohne eine der vorgenannten Substanzen (Kontrollgruppe)
Tabelle
1 zeigt die Resultate dieser Fütterungsversuche.
Tabelle
1: Durchfallhäufigkeit in den Gruppen
| Gruppe |
mit
Durchfall |
ohne
Durchfall |
gesamt |
| Karotte |
| Kontrolle |
| LFTylosinphosphat |
|
10 |
14,7% |
31 |
50,0% |
17 |
24,6% |
|
58 |
85,3% |
31 |
50,0% |
52 |
75,4% |
|
|
| Gesamt |
|
|
|
|
Die Gruppen
unterscheiden sich bezüglich der Durchfallhäufigkeit.
In der ersten Woche erkrankten signifikant weniger (p  0,003) Ferkel in der Karottengruppe und in der LF-Gruppe an
Durchfall als in der Kontrollgruppe. Zwischen der LF-Gruppe
und der Karottengruppe bestand bezüglich der Erkrankungshäufigkeit
kein signifikanter Unterschied (p=0,144).
0,003) Ferkel in der Karottengruppe und in der LF-Gruppe an
Durchfall als in der Kontrollgruppe. Zwischen der LF-Gruppe
und der Karottengruppe bestand bezüglich der Erkrankungshäufigkeit
kein signifikanter Unterschied (p=0,144).
In der
zweiten Studie wurden 54 Tiere, je 18 in einer Gruppe, auf die
Lebendmassenzunahme untersucht, wobei kein Tier an Durchfall
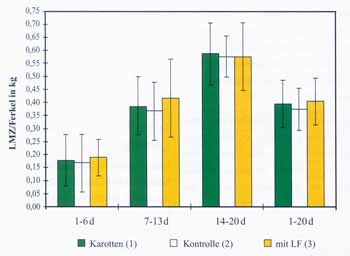
erkrankte. Die Abbildung 2 zeigt die durchschnittliche tägliche
Lebendzunahme pro Ferkel in den einzelnen Gruppen. In Summe
konnte kein Unterschied zwischen den einzelnen Gruppen beobachtet
werden, wenn auch ein Trend zu einer geringeren Lebendmassezunahme
bei der Kontrollgruppe festzustellen war. Da die Ferkel jeweils
aus einem Wurf stammten, war das Risiko der Belastung durch
den mikrobiellen Milieuwechsel zu vernachlässigen.
Abbildung
2: Zunahme der Lebendmassen in den 3 Gruppen
über 3 Wochen
|
In einer
erst kürzlich veröffentlichten Studie zur Wirkung
von Galakturoniden bei Absetzferkeln zeigten sich keine signifikanten
Leistungsunterschiede zwischen der Galakturonid-, Antibiotika-
und Kontrollgruppe, was auf die günstigen Haltungsbedingungen
zurückzuführen war. Die bakteriologischen Untersuchungen
ergaben jedoch tendenziell ein zeitlich früheres und geringeres
Ausscheiden hämolysierender E. coli-Serotypen,
ein Hinweis auf eine raschere Elimina-tion potenzieller Krankheitserreger
durch Zugabe saurer Oligogalakturonide [47].
Hühnerstudie
In einer
weiteren Fütterungsstudie wurde in einer Legehühnerbatterie
die prophylaktische und therapeutische Wirksamkeit saurer Galakturonide
untersucht. In einem Geflügelbetrieb mit Freilauf wurde
eine Häufung von schweren septischen Infektionen mit Peritonitis
und Adnexitis durch E. coli O 78 sowie Tierverlusten
von ca. 5 Tieren pro Tag beobachtet. Zudem wurde eine erhebliche
Verminderung der Legeleistung und eine schlechte Schalenqualität
der Eier im gesamten Kollektiv festgestellt (Abbildung 3) [48].
Abbildung
3: Anzahl der Tierverluste entsprechend des Fütterungsprotokolls.Vor
Beginn der Studie werden annähernd gleich hohe Tierverluste
in beiden Gruppen beobachtet. Mit Beginn der Verabreichung
von Galakturoniden nimmt die Zahl der Tierverluste ab
und bleibt auch in der Nachbeobachtungsphase bestehen.
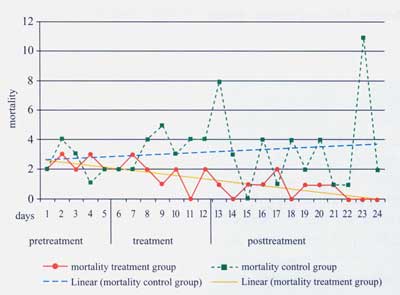
|
In einer
kontrollierten, randomisierten Studie wurden Galakturonide in
einer Konzentration von 1% für 7 Tage der Nahrung zugesetzt.
Nach einer Behandlungsdauer von 3 Tagen konnten die Tierverluste
in dieser Gruppe im Vergleich zur Kontrollgruppe weitgehend
eliminiert werden. Im Gegensatz zu einer Vorbehandlung mit Bacitracin,
bei der nach Absetzen des Antibiotikums sofort ein Reboundphänomen
auftrat, war dieser Effekt über mindestens 14 Tage nach
Absetzen der Galakturonide in der Nahrung noch erhalten. 14
Tage nach Beendigung des Fütterungsversuchs wurden Hühner
geschlachtet: Bei 10% der Galakturonid-behandelten Hühner
und bei 35% der Hühner in der Kontrollgruppe wurden pathologische
Organbefunde erhoben. Die semiquantitativen Untersuchungen der
Stuhlflora ergaben eine substanzielle Abnahme der pathologischen
Coliflora O 78 und eine Tendenz zur Normalisierung der Flora
in der Gruppe der Hühner, die Galakturonide erhielten.
Auch die Legeleistung und Eiqualität aller Tiere war während
und nach der Behandlung mit Galakturoniden wesentlich verbessert
(Abbildung 4).
Abbildung
4: Konzentration Hühner-pathogener E coli
O78 im Kot der Tiere nach Schlachtung in den beiden Fütterungsgruppen:
Die Zahl von E. coli O78 ist in der Galakturonid-Gruppe
deutlich niedriger als in der Kontrollgruppe.
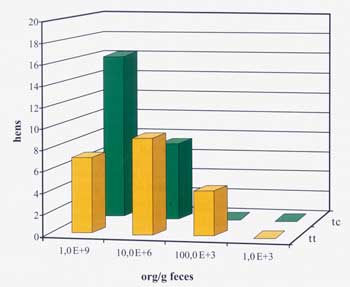
|
Mäusestudie
In einer
Pilotstudie wurde die Besiedelung des Darms von Labormäusen
mit dem E. coli-Stamm Nissle 1917 untersucht. Es wurde
bei je 10 Labortieren untersucht, ob Galakturonide in einer
Konzentration von 5% in der Nahrung zu einer Reduktion der Teststämme
im Dünn- und Dickdarm führen können [49].
Es wurden
wiederum 3 Gruppen gebildet:
1. Gruppe:
Kontrolle mit normalem Futter
2. Gruppe
mit 5% Galakturonide in Festnahrung: Beginn gleichzeitig mit
der Verabreichung des Infektionsstamms
3. Gruppe
mit 5% Galakturonide: Beginn der Fütterung mit Kohlenhydraten
2 Tage vor der Inokulation der Tiere mit dem Infektionsstamm
Die Ergebnisse
dieser Pilotuntersuchung zeigen, dass sowohl bei einem unmittelbaren
Beginn der Zugabe von Galakturoniden als auch bei Fütterungsbeginn
2 Tage vor Inokulation der Mäuse mit den Mikroorganismen
eine Reduktion der Besiedelung um 2-3 log 10 zu beobachten war.
Bei einem Fütterungsbeginn vor der Inokulation war das
Ergebnis besser, ohne jedoch statistische Signifikanz zu erreichen.
Dieses Ergebnis wurde in gleichem Ausmaß sowohl in der
Dünndarmflora als auch in der Dickdarmflora nachgewiesen.
Diese Untersuchungen bedürfen allerdings noch der Bestätigung
in einem größeren Kollektiv [48].
|
| Diskussion
In der
Literatur gibt es eine Vielzahl von Publikationen, die bei Verabreichung
von Antibiotika in der Tierernährung eine Selektion/Induktion
pathogener Mikroorganismen mit einer erheblichen Zunahme resistenter
Mikroorganismen bei Nutztieren nachweisen. Diese Mikroorganismen
weisen zum Teil erhebliche Resistenzen auf und können auf
den Menschen übertragen werden. Die Mikroorganismen im
Kot der Tiere und in organischem Dünger werden unter anderem
für die zunehmende Resistenz bakterieller Mikroorganismen
in der Humanmedizin verantwortlich gemacht [2, 5, 7]. Dabei
handelt es sich einerseits um humanpathogene Keime wie Salmonellen
und Campylobacter, die bereits eine erhebliche Resistenz aufweisen;
es kann jedoch auch zu einer Übertragung apathogener oder
fakultativ pathogener E. coli-Stämme mit Resistenz
gegen eine Vielzahl von Antibiotika kommen. Die resistenten
Keime der kommensalen Flora können ihre Resistenzgene auf
andere potenziell pathogene Mikroorganismen übertragen.
Man darf
jedoch nicht alle Resistenzprobleme in der Humanmedizin der
Verabreichung von Antibiotika an Tiere zuschreiben. Die zunehmende
Resistenz von Pneumokokken, Meningokokken, Gonokokken sowie
Gram-negativen Mikroorganismen auf Intensivstationen steht eher
im Zusammenhang mit einer nicht adäquaten Verabreichung
von Antibiotika (Wahl des Präparates, Tagesdosen, Dosierungsintervalle,
rechzeitiger Therapiebeginn). Auch die Auswahl von Präparaten
mit unvollständiger Bioverfügbarkeit und hohen Wirkstoffkonzentrationen
im Intestinaltrakt bzw. Präparaten mit langer Halbwertszeit
auf die normale Flora sind ein wesentlicher Faktor für
die Resistenzproblematik in der Humanmedizin.
|
| Schlussfolgerung
Inwieweit
die allgemeine Zunahme resistenter Mikroorganismen in der Humanmedizin
auf die Verwendung von Antibiotika in der Tiermedizin zurückzuführen
ist, ist noch nicht vollständig geklärt. Die WHO hat
jedoch globale Prinzipien zur Verabreichung von Antibiotika
in einem
40-Punkte-Programm definiert [50]. Als Leitsatz kann man die
Punkte 2 bis 4 ansehen, in denen festgehalten wird, dass die
Verabreichung von Antibiotika an Nutztiere in der Verantwortlichkeit
der Veterinärmediziner liegt.
Als wesentliche
weitere Punkte sind in die Verantwortlichkeit der Tierärzte
auch die Überwachung der Resistenzsituation und die Forschung
an alternativen Maßnahmen sowie die Ausbildung des relevanten
Personenkreises gelegt. Die Verabreichung der Antibiotika als
Leistungsförderer, die in der Humanmedizin als dringend
benötigte Therapeutika verwendet werden, wurde bereits
weltweit verboten. Die Verwendung von Antibiotika als Leistungsförderer
insgesamt ist ab dem Jahr 2006 nicht mehr zugelassen.
Man kann
Antibiotika in der Tiermedizin als Therapeutika nicht vollständig
eliminieren. Als Leistungsförderer sind sie jedoch, wie
das dänische Beispiel zeigt, verzichtbar [51]. Insgesamt
muss man festhalten, dass nur durch einen sorgfältigen
Umgang mit Antibiotika die gegenwärtige Resistenzsituation
in den Griff zu bekommen ist. Ein besonderes Augenmerk muss
dabei auf die Verwendung dieser Substanzen in der Tiermedizin
gelegt werden, um über weitere Jahrzehnte von diesen Gebrauch
machen zu können.
Für
die Tiermedizin ist von großer Bedeutung, alternative
Möglichkeiten zu evaluieren. Die Blockierung der Besiedelung
von Epitheloberflächen durch Rezeptor-Analoga, wie sie
in den sauren Oligogalakturoniden vorliegen, ist ein viel versprechender
Ansatz.
|
Literatur:
| 1.
Kyriakis S.C., Tsiloyiannis V.K., Vlemmas J., Sarris K.:
„The effect of probiotic LSP 122 on the control of
postweaning diarrhea syndrome in piglets.“ Res. Vet.
Sci. 67 (1999) 223-228. |
| 2.
Gorbach S.L.: „Antimicrobial use in animal feed –
time to stop.“ N. Engl. J. Med. 345 (2001) 1202-1203. |
| 3.
Witte W., Klare I., Werner G.: „Selective pressure
by antibiotics as feed additives.“ Infection 27 (1999)
35-38. |
| 4.
Kamphues J.: „Leistungsförderer mit antibiotischer
Wirkung aus Sicht der Tiernahrung.“ Berl. Münch.
Tierärztl. Wochenschr. 112 (1999) 370-379. |
| 5.
McEwen S.A., Fedorka-Cray P.J.: „Antimicrobial use
and resistance in animals.“ Clin. Infect. Dis. Suppl.
3 (2002) 93-106. |
| 6.
Andremont A., Brun-Buisson C., Strulens M.: „Evaluating
and predicting the ecologic impact of antibiotics.“
Clin. Microbiol. and Inf. 7 (2001) 1-6. |
7.
„Overcoming antimicrobial resistance.“ Geneva:
World Health Organization. 2001: http://www.who.int/infectious-disease-report/
2000index.html. |
| 8.
White D.G., Zhao S., Sudler R.: „The isolation of
antibiotic resistant salmonella from retail ground meats.“
N. Engl. J. Med. 345 (2001) 1147-1154. |
| 9.
Taylor J.P., Barnett B.J., del Ropsario L., Williams K.,
Barth S.S.: „Prospective investigation of cryptic
outbreaks of Salmonella agona salmonellosis.“ J. Clin.
Microbiol. 36 (1998) 2861-2864. |
| 10.
Wegener H.C.: „The consequences of food safety of
the use of fluoroquinolones in food animals.“ New
Engl. J. Med. 340 (1999) 1581-1582. |
| 11.
Mc Donald l.C., Rosstiter S., Mackinson C., Wang Y.Y., Johnson
S., Sullivan M., Sokolow R., DeBess E., Gilbert L., Benson
J.A., Hill B., Angulo F.J.: „Quinupristin-Dalfopristin-resistant
Enterococcus faecium on chicken and in human stool
specimen.“ New Engl. J. Med. 345 (2002) 1155-1160. |
| 12.
Eliopoulos G.M., Wennersten C.B., Gold H.S.: „Characterization
of vancomycin resistant Enterococcus faecium isolates
in the United States and their susceptibility in vitro
to dalfopristin-quinupristin.“ Antimic. Agents Chemoth.
37 (1993) 2119-2125. |
| 13.
Soerensen T.L., Blom M., Monnet D.I., Fridmodt Moeller N.,
Poulsen R.L., Espersen F.: „Transient intestinal carriage
after ingestion of antibiotic resistant Enterococcus
faecium from chicken and pork.“ N. Engl. J. Med.
345, 1161-1166. |
| 14.
Van-den Bogaard A.E., Willems R., London N., Top J., Stobberingh
E.E.: „Antibiotic resistance of fecal Enterococci
in poultry, farmers and poultry slaughters.“ J. Antimic.
Chemoth. (2002) 497-505. |
| 15.
Gold H.S.: „Vancomycin resistant Enterococci:
mechanisms and clinical observations.“ Clin. Infect.
Dis. 33 (2001) 210-219. |
| 16.
Moeller A., Aarestrup F., Seyfarth A.M., Emborg H.D., Pedersen
K., Hendriksen R.S., Bager F.: „Effect of abolishment
of the use of antimicrobial agents for growth promotion
on occurrence of antimicrobial resistance in fecal Enterococci
from food animals in Denmark.“ Antimic. Agents Chemoth.
45 (2001) 2054-2059. |
| 17.
Bager F., Aarestrup F.M., Madsen M., Wegener : „Glycopeptide
resistance in from broilers and pigs following
discontinued use of Avoparcin.“ Microb. Drug Resist.
5 (1999) 53-56. |
| 18.
Witte W.: „Medical consequences of antibiotic use
in agriculture.“ Science 279 (1998) 996-997. |
| 19.
Mellon M., Benbrook C., Benbrook K.L.: „Hogging it:
estimates of antimicrobial abuse in livestock.“ Cambridge,
Mass.: Union of Concerned Scientists. 2001. |
| 20.
Stephenson J.: „Researchers wrestle with spread and
control of emerging infections.“ JAMA 287 (2002) 2061-2063. |
| 21.
Mead P.S., Slutsker L., Dietz V.: „Food related illness
and death in the United States.“ Emerg. Inf. Dis.
5 (1999) 607-625. |
| 22.
Lederer M.: „Persönliche Mitteilungen des Landesgesundheitsamtes
Erlangen.“ 2004. |
| 23.
Kamphues J.: „Erfahrungen in Schweden mit dem Verbot
antimikrobiell wirksamer Leistungsförderer als Futterzusatzstoffe.“
Der praktische Tierarzt. 79, 2 (1998) 174-175. |
| 24.
Shoemaker N.B., Vlamakis H., Hayes K., Salyers A.A.: „Evidence
for extensive resistance gene transfer among Bacteroides
and other genera in the human colon.“ Appl. Envir.
on Microbiol. 67 (2001) 561-568. |
| 25.
Awad-Masalmeh M.: „Untersuchungen an enteropathogenen
E. coli des Ferkels – Serologie und Chemolumineszenz.“
Wien Tierärztl. Mschr. 69 (1982) 358-364. |
| 26.
Dozois C.M., Dsaigle F., Curtiss R.: „Identification
of pathogen specific and conserved genes expressed in
vivo by an avian pathogenic Escherichia coli
strain.“ Proc. Nat. Acad. Sci. USA. 100 (2003) 247-252. |
| 27.
Barber D., Miller G., McNamara P.: „Resistant bacteria
in retail meats and antimicrobial use in animals.“
New Engl. J. Med. 346 (2002) 777. |
| 28.
Aarestrup F.M.: „Association between the consumption
of antimicrobial agents in animal husbandry and the occurrence
of resistant bacteria among food animals.“ Int. J.
Antimic. Agents q12 (1999) 2774-2777. |
| 29.
Aarestrup F.M.: „Occurrence, selection and spread
of resistance to antimicrobial agents used for growth promotion
in Denmark.“ APMIS 108 (2000) 3-48. |
| 30.
Bager F., Madsen J., Aarestrup Christensen F.M..: „Avoparcin
used as a growth promoter is associated with the occurrence
of Vancomycin resistant Enterococcus faecium on
Danish poultry and pig farms.“ Prev. Vet. Med. 31
(1997) 95-112. |
| 31.
Donovan D.C., Franklin S.T., Chase C.C., Hippen A.R.: „Growth
and health of Holstein calves fed milk replacers supplemented
with antibiotics or Enteroguard.“ J. Dairy Sci. 85
(2002) 947-950. |
| 32.
Quigley J.D., Koist C.J., Wolfe T.A.: „Effects of
spray dried animal plasma in milk replacers of additives
containing serum and oligosaccharides on growth and health
of calves.“ J. Dairy Sci. 85 (2002) 413-421. |
| 33.
Humphrey B.D., Huang N., Klasing K.C.: „Rice expressing
lactoferrin and lysozyme has antibiotic like properties
when fed to chicks.“ J. Nutr. 132 (2002) 1214-1218. |
| 34.
Selsted M.E., Miller S.I., Henschen A.H., Quellette A.J.:
„Enteric defensins: antibiotic peptide components
of intestinal host defense.“ J. Cell Biol. 118 (1992)
929-936. |
| 35.
Awad-Massalmeh M., Sagmeister H., Willinger H.: „Untersuchungen
zur Immunprophylaxe der Colidiarrhoe des Absetzferkels.“
ZBL Vet. Med. 32 (1985) 751-758. |
| 36.
Nitsch P., Zitterl-Eglseer K., Köhler B., Gabler C.,
Losa R., Zimpernik I.: „The effect of two different
blends of essential oil components on the proliferation
of Clostridium perfringens in the intestine of
broiler chickens.“ Poultry sci. 83 (2004) 669-675. |
| 37.
Cravioto A., Gross R.J., Scotland S.M., Ropwe B.: „An
adhesive factor found in strains of Escherichia coli
belonging to the traditional infantile enteropathic
serotypes.“ Curr. Microbiol. 3 (1997) 95-99. |
| 38
Ofek I., Sharon N.: „Adhesins as lectins: specificity
and role in infection.“ Curr. Top Microbiol. and Immunol.
150 (1990) 91-114. |
| 39.
Zopf D., Roth S.: „Oligosaccharides as anti-infective
agents.“ Lancet 347 (1996) 1017-1021. |
| 40.
Yamamoto T., Endo S., Yokozta T., Eccheveria P.: „Characteristics
of adherence of enteroaggregative Escherichia coli
to human and animal mucosa.“ Infect Immun. 59(1991)
3722-3739. |
| 41.
Sack R.B.: „Enterotoxigenic Escherichia coli:
identification and characterization.“ J. Infect. Dis.
142 (1980) 279-286. |
| 42.
Donneberg M.S.: „Interaction between enteropatogenic
Escherichia coli and epithelial cells.“ Clin.
Infect. Dis. 28 (1999) 451-455. |
| 43.
Guggenbichler S.: „Experimentelle Untersuchung der
Adhärenz und Blockierung der Adhärenz von pathogenen
Mikroorganismen durch saure Galakturonide am humanen terminalen
Ileum.“ Antibiotika Monitor 5/6/2004 selbe Zeitung |
| 44.
Kastner U., Glasl S., Follrich B., Guggenbichler J.P., Jurenitsch
J.: „Saure Oligosaccharide als Wirkprinzip von wässerigen
Zubereitungen aus der Karotte in der Prophylaxe und Therapie
von gastrointestinalen Erkrankungen.“ Wiener Med.
Wochenschr. 152 (2002) 379-381. |
| 45.
Moro E.: „Karottensuppe bei Ernährungsstörungen
der Säuglinge.“ Münch. Med. Wochenschr.
31 (1908) 1637-1640. |
| 46.
Jugl M., Zitterl-Eglseer K., Beier T., Schilcher F., Gabler
C., Schuh M., Kastner U., Guggenbichler J.P., Franz Ch.:
„Experimentelle Feldstudie über den Einsatz von
Karottenpektinen als Futterzusatzstoff zur Durchfallprophylaxe
in der Ferkelaufzucht.“ Tierärztl. Praxis 29
(2001) 308-312. |
| 47.
Jugl-Chizzola M., Spergser J., Zitterl-Eglseer K., Gabler-Eduardo
C., Schilcher F., Bucher A., Schuh M., Troxler J., Franz
Ch.: „Untersuchungen zur Wirkung von Galakturoniden
als Futtermittelzusatz im Vergleich zum Leistungsförderer
Flavophospholipol und einer Kontrollgruppe bei Absatzferkeln.“
Tierärztl. Praxis 32 (2004) 147-154. |
| 48.
Pichler H.P., Follrich B., Thannesberger O., Schwarz E.,
Guggenbichler J.P.: „Behandlung von lokalen und septischen
Komplikationen in einer Legehühnerbatterie mit Oligogalakturoniden.“
Eigene unpublizierte Beobachtungen 2002. |
| 49.
Guggenbichler J.P., Schubert, unpubl. Beobachtungen 2000. |
| 50.
World Health Organization: „WHO Global strategy for
the containment of antimicrobial resistance.“ Geneva,
Switzerland. WHO/CDS/CSR/DRS/2001.2 |
| 51.
Wegener H.: „Ending the use of antimicrobial growth
promotors is making a difference.“ ASM News 69 (2003)
443-48. |
Anschrift
des Verfassers:
Univ.-Prof. Dr. J. Peter Guggenbichler
Klinik mit Poliklinik der Universität Erlangen-Nürnberg
D-91054 Erlangen, Loschgestraße 15
E-Mail:
prof.guggenbichler@gmx.de
|
|
|