| Das häufig
kranke Kind – Störung der Mukosa-Immunität als
Ursache rezidivierender Infektionen und Möglichkeiten der
Intervention |
| J.P. Guggenbichler
Univ.-Klinik für Kinder und Jugendliche der Universität
Erlangen/Nürnberg
(Vorstand: Univ.-Prof. Dr. W. Rascher) |
Schlüsselwörter:
Rezidivierende Infekte,
inadäquate Erstbehandlung, Defekte der spezifischen körpereigenen
Abwehr, anatomische und funktionelle Störungen, Mukosa-Immunität,
Bakterienlysate
|
|
Zusammenfassung
Rezidivierende
Infektionen im Kindesalter stellen ein besonderes Problem dar.
Defekte der spezifischen körpereigenen Abwehr, d.h. Antikörpermangel
und T-Zelldefekte sind ein seltenes Ereignis. Viel häufiger
ist eine inadäquate Erstbehandlung die Ursache, wobei nicht
nur die Wahl des Antibiotikums, sondern auch Tagesdosis, Dosierungsintervalle,
Therapiedauer und die unterstützende Behandlung den Ausschlag
geben. Anatomische und funktionelle Störungen spielen zusätzlich
eine wesentliche Rolle. Neue theoretische Einsichten bezüglich
der Mukosa-Immunität lassen die Ätiologie, Pathogenese
und die Behandlungsmöglichkeiten rezidivierender Infekte
in einem neuen Licht erscheinen. Bei der Abklärung kann
man aus einer sorgfältigen Anamnese bereits wertvolle Hinweise
bezüglich der Ätiologie erhalten. Durch eine adäquate
Erstbehandlung einschließlich der unterstützenden
Therapie kann eine Reihe von rezidivierenden Infektionen verhindert
werden. Die Untersuchung auf anatomische und funktionelle Störungen
der unspezifischen Abwehr (Adenoidhyperplasie, Septumdeviation,
Ziliendysfunktion) ist ein wesentlicher Baustein der Abklärung.
Zuletzt ist es nötig, Defekten der Mukosa-Immunität
eine entsprechende Bedeutung bei rezidivierenden Infektionen
vor allem bei monotopen Infektionen in einem Organsystem zuzumessen
bzw. diese zu definieren.
In einer
klinischen Beobachtung wurde bei 23 Patienten mit rezidivierenden
Infekten das ß-Defensin in Wangenschleimhautepithelzellen
bestimmt. Bei 19 der 23 Patienten wurde eine Verminderung der
ß-Defensin-Bildung um mindestens >25% des Kontrollwertes
gefunden. Die Verabreichung von Bakterienlysaten (Bronchovaxom®)
ergab eine Besserung bis Normalisierung der ß-Defensin-Bildung
sowie eine deutliche klinische Besserung bei 16 Patienten.
Die neuen
Erkenntnisse auf der Basis der theoretischen Grundlagenforschung
können nicht nur zu einem besseren Verständnis der
Pathogenese rezidivierender Infektionen, sondern auch zu interessanten
und viel versprechenden neuen therapeutischen Ansätzen
bei dringenden klinischen Problemen führen. Auf Grund dieser
neuen Erkenntnisse kann man sich vorstellen, dass Bakterienlysate
auf verschiedenen Ebenen der körpereigenen Abwehr eingreifen
können. In prospektiven randomisierten klinischen Studien
ist dieses nun unter Berücksichtigung der unterschiedlichen
Pathomechanismen zu beweisen.
|
Key-words:
Recurrent
infections, defects of specific host defense mechanisms, impairment
of nonspecific host defense, anatomic and functional disturbances
of host defense, mucosal immunity, bacterial lysates
|
|
Summary
Recurrent
infections in infants and children pose a special problem. Impairment
of specific defense mechanisms i.e. a defect in humoral and
cellular immunity is a rare event. In the majority of patients
with recurrent infections particularly in one organ system an
inadequate initial therapy
is responsible. This is not limited to the choice of the appropriate
antibiotic but more in the correct total daily dose, mode of
administration, dosing interval and duration of therapy. Anatomic
and functional disturbances leading to impairment of nonspecific
host defense mechanisms are also responsible as well as an inadequate
supportive therapy. The results of recent investigative work
regarding mucosal „innate“ immunity give an additional
new insight on recurrent infections in children. The clinical
workup of patients with recurrent infections includes a careful
history. Adequate initial antimicrobial therapy and optimum
supportive care are able to prevent the transition of an infection
into a chronic recurrent infection. Investigations of anatomic
and functional disturbances are mandatory. Also the investigation
of the mucosal immunity has to be performed and abnormal results
can be expected particularly in patients with recurrent infections
in the same organ system.
In a clinical
survey of 23 patients with recurrent infection a ß-defensin
production of less than 25% of the control values was observed
in 19. Bacterial lysates (Bronchovaxom®) were administered
once daily for 30 days to these patients. In 14 of them an increase
(>40%) of ß-defensin formation was observed concomitant
with a substantial clinical improvement. This was determined
by a decrease in severity, duration and frequency of infections.
The newly
gained insight from theoretical investigations provide not only
a better understanding of the pathophysiology of recurrent infections
but also enables us to initiate a curative therapy. The administration
of bacterial lysates orally or locally influence the body’s
own defense mechanisms on different levels. Prospective randomised
studies are necessary to define the role of the mucosal immunity
in children with recurrent infections and clarify their therapeutic
value.
|
Einleitung
Rezidivierende Infektionen
der oberen und unteren Luftwege stellen bei Säuglingen
und Kleinkindern ein großes Problem dar. Rezidivierende
Mittelohrentzündungen werden nach einer ersten Otitis media
und persistierendem Tuben-Paukenhöhlenkatarrh bei ca. 8-12%
aller Patienten beobachtet. Dies macht wiederholte orale oder
intravenöse Antibiotikagaben, eine Adenotomie, Parazentese
und/oder Paukenröhrchen nötig. Zudem kommt es durch
eine Schallleitungsstörung zu Hörstörungen und
durch die eingeschränkte Hörleistung zu einer psychosozialen
Entwicklungsverzögerung mit abnormem Sozialverhalten und
Sigmatismus [1].
Ein Rezidiv
einer akuten Sinusitis führt zu chronischen Kopfschmerzen,
durch mangelnden Appetit zu Gedeihstörung und Gewichtsabnahme,
verminderter körperlicher Leistungsfähigkeit und Konzentrationsschwäche.
Zudem werden bei einer chronischen Sinusitis häufig akute
Exazerbationen mit akuten Krankheitssymptomen beobachtet [2].
Rezidivierende
Infektionen der tiefen Atemwege bergen ein potenzielles Risiko
für Komplikationen wie eine Störung der Lungenfunktion
und die Entwicklung von Bronchektasien, eine chronisch obstruktive
Lungenerkrankung und Asthma Bronchiale [3].
Rezidivierende
Harnwegsinfektionen können nach Jahren zu Nierennarben,
Hypertonie, zur Einschränkung der Nierenfunktion und bei
Frauen
zu Komplikationen während der Schwangerschaft und Frühgeburt
führen [4].
Häufige
Infekte bedingen auch wiederholte Krankenhausaufenthalte mit
Fehlzeiten in der Schule und erheblichen psychosozialen Problemen.
|
| Definition
rezidivierender Infekte
Von einem
häufig kranken Kind spricht man, wenn im Alter zwischen
1 und 5 Jahren mehr als 6 – manche Autoren sprechen von
8 – Infektionen pro Jahr auftreten. Dabei ist es von Bedeutung,
zwischen protrahierten Krankheitsbildern, bei denen zwischen
den einzelnen Exazerbationen keine völlige klinische Heilung
erzielt werden konnte, von Rezidiven im gleichen Organsystem
sowie von rezidivierenden Infekten in verschiedenen Organsystemen
zu unterscheiden, wobei die Kinder zwischen den einzelnen Krankheitsepisoden
für Tage bis Wochen völlig gesund sind [5].
Sozioökonomische
Faktoren wie die Zahl und das Alter der Geschwister, die Größe
und Beschaffenheit der Wohnverhältnisse, Rauchen der Eltern
sind bezüglich der Häufigkeit der Infektionen zu berücksichtigen.
Entsprechend diesen anamnestischen Daten und einer sorgfältigen
klinischen Untersuchung ist es möglich, einen guten Hinweis
auf die Ätiologie und eine mögliche kausale Therapie
und Prävention ins Auge zu fassen.
|
| Pathogenese
rezidivierender Infektionen und Abwehrmechanismen des Körpers
Defekte
der spezifischen körpereigenen Abwehr
Es gibt
eine Reihe von Ursachen für rezidivierende Infektionen:
Defekte der spezifischen körpereigenen Abwehr wie ein Antikörpermangel
einschließlich eines selektiven IgA-Mangels oder eines
IgG-Subklassendefektes, die vordergründig häufig für
rezidivierende Infektionen verantwortlich gemacht werden, spielen
mit <2% eine untergeordnete Rolle und sind meist bereits
klinisch durch eine typische Symptomenkonstellation erkennbar.
Von noch geringerer Bedeutung sind Defekte des Phagozytose-
oder Komplement-Systems. Meist manifestiert sich eine angeborene
Störung der spezifischen körpereigenen Abwehr bereits
im Alter von 6-9 Monaten bei Abnahme der mütterlichen Antikörper
durch Infekte in verschiedenen Organsystemen, unüblich
langdauernde Infekte durch Mikroorganismen, die man bei dem
betreffenden Krankheitsbild normalerweise nicht als Infektionserreger
beobachtet. Hautaffektionen, kalte Abszesse, vor allem aber
chronische Durchfallerkrankungen und eine Gedeihstörung
sind typische Zeichen für einen Defekt der spezifischen
körpereigenen Abwehr [6].
Defekte
der unspezifischen körpereigenen Abwehr
Eine entscheidende
Bedeutung in der Pathogenese rezidivierender Infekte kommt der
lokalen Abwehr an Epitheloberflächen zu. Die mukoziliäre
Clearance stellt die erste Front gegen das Eindringen von Krankheitserregern
in den Körper dar und wird im Vorfeld durch das Sekretions-IgA
unterstützt [7]. Wichtig ist eine korrekte Viskosität
der Schleimschicht auf Epithelzellen, wobei bereits die Abnahme
des Flüssigkeitspools bei verminderter Flüssigkeitszufuhr
eine vermehrte Perspiratio insensibilis bei Fieber und geringer
Luftfeuchtigkeit der Raumluft zu einer erheblichen Änderung
der Viskosität der Mucinschicht der Schleimhäute und
einer Funktionseinbuße der normalen Klärfunktion
der Mukosa führen kann. Rauchen bzw. Mitrauchen bei Säuglingen
und Kleinkindern lähmt die Zilienfunktion für mehrere
Stunden. Hier machen sich Summationseffekte deutlich bemerkbar,
so dass eine Vielzahl scheinbar unbedeutender Defizite letztlich
den kritischen Wert übersteigt.
Die Störung
der unspezifischen Abwehr, insbesondere der mukoziliären
Clearance, besitzt einen hohen Stellenwert in der Pathogenese
rezidivierender Infekte der Luftwege. Sie besteht in anatomischen
Besonderheiten, die einen regulären Sekretfluss und eine
normale Belüftung der Schleimhäute behindern, und
in einer Lähmung der Zilienfunktion im Rahmen von rezidivierenden
Virusinfektionen. Hierzu zählt auch eine gesteigerte oder
verminderte Viskosität der Schleimschicht. Untersuchungen
bei rezidivierenden Harnwegsinfektionen zeigten, dass eine fehlende
restharnfreie Miktion zu rezidivierenden Harnwegsinfektionen
führt. Gerade dieser ersten Abwehrlinie wird in der Literatur
breiter Raum eingeräumt [8].
Inadäquate
Ersttherapie
Eine häufige
Ursache rezidivierender Infekte ist eine inadäquate Behandlung
des Erstinfektes, wobei es nicht nur auf die korrekte Wahl des
Antibiotikums ankommt, sondern ebenso auf eine korrekte Tagesdosis,
das Dosierungsintervall und die Therapiedauer. Anderseits kommt
auch der unterstützenden Behandlung zur Verbesserung des
Sekretflusses und Abschwellung der entzündeten Schleimhäute
eine wesentliche Bedeutung zu.
Körpereigene stabile Flora
Die Körperoberflächen
des Menschen sind ständig einer mikrobiellen Besiedelung
ausgesetzt, dennoch sind normalerweise Infektionen der gesunden
Haut bzw. Schleimhäute selten. Es handelt sich bei dieser
„normalen Flora“ um apathogene oder fakultativ pathogene
Mikroorganismen, die bei einer quantitativen Kultur der Nasenschleimhaut
im Bereich von 10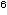 -10 -10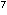 CFU/cm² liegen. Wenn man jedoch die Keimzahlen pro Epithelzelle
betrachtet, finden sich 1 bis maximal 2 Mikroorganismen/Epithelzelle.
CFU/cm² liegen. Wenn man jedoch die Keimzahlen pro Epithelzelle
betrachtet, finden sich 1 bis maximal 2 Mikroorganismen/Epithelzelle.
Ein vielfach
unterschätzter Mechanismus der körpereigenen Abwehr
ist eine stabile körpereigene Flora. Die normale Flora
verhindert die Besiedelung mit obligat pathogenen Mikroorganismen.
Eine Destabilisierung der normalen Flora durch Antibiotika ermöglicht
es bereits einem kleinen Inokulum von pathogenen Mikroorganismen,
die Schleimhäute zu besiedeln.
Gesteigerte
Adhärenz bakterieller Mikroorganismen
Ein wesentlicher
Virulenzfaktor pathogener Mikroorganismen ist die Adhärenz
an Epithelzellen. In zahlreichen Untersuchungen wurde beobachtet,
dass nur Mikroorganismen, die gleichzeitig mit der Bildung von
Toxinen auch die Schleimhäute besiedeln, zu einer Erkrankung
führen. Mikroorganismen haften an speziellen Kohlehydratstrukturen
von Epithelzellen. Die Besiedelbarkeit von Schleimhäuten
und damit auch die Infekthäufigkeit hängt damit auch
von der Rezeptordichte für bakterielle Mikroorganismen
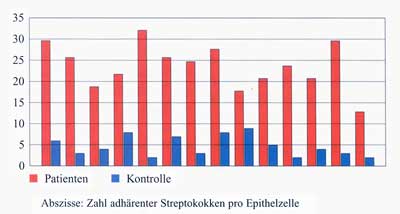
an Epithelzellen ab. So konnten wir beobachten, dass Patienten
mit rezidivierenden Streptokokkeninfektionen der Tonsillen (>3
durch Kultur bewiesene Streptokokkeninfekte pro Jahr) eine um
das 5fache höhere Zahl an adhärenten Streptokokken/Epithelzelle
aufweisen als altersentsprechende Kontrollpatienten ohne rezidivierende
Streptokokkeninfektionen (Abbildung 1) [9].
Abbildung
1: Adhärenz von Streptokokken an Wangenschleimhautepithelien:
Unterschiede in der Zahl adhärenter Streptokokken
zwischen Patienten mit > 3 kulturell bewiesenen Streptokokkenanginen/Jahr
und nach Alter und Geschlecht identischen Kontrollpatienten.
|
Bei Patienten
mit wiederholten Harnwegsinfektionen und normaler Urodynamik
konnte beobachtet werden, dass eine 5-6fach höhere Adhärenz
von Mikroorganismen an Uroepithelien des Morgenharns (29 ±
5 versus 5 ± 2 Mikroorganismen pro Epithelzelle) nachzuweisen
war als bei Patienten ohne häufige Rezidive. Auch der Besiedelung
mit einem besonders adhärenten „p“-Fimbrien-tragenden
„uropathogenen“ E. coli-Stamm kommt für
rezidivierende Infektionen eine Bedeutung zu (Abbildung 2) [10,
11].
Abbildung
2: Uroepithelien aus dem Morgenharn mit adhärenten
E. coli von einem Patienten mit rezidivierenden
Harnwegsinfektionen
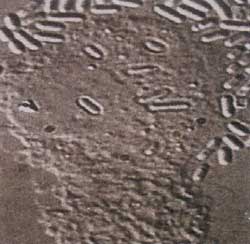
|
Die
mukosale Abwehr
In den
letzten Jahren wurden Forschungsergebnisse zur angeborenen Immunität
veröffentlicht, die einen völlig neuen Einblick in
die initiale Abwehr von Infektionen bei Neugeborenen geben.
Neugeborene besitzen bereits Abwehrmechanismen gegen bakterielle
und virale Mikroorganismen, bevor die spezifische, stimulierbare
humorale und zelluläre Abwehr wirksam wird. Dieselben Mechanismen
spielen natürlich auch in der Infektabwehr von Säuglingen
und älteren Kindern sowie bei Patienten, bei denen die
spezifische Abwehr durch Medikamente oder die Grundkrankheit
geschwächt ist, eine wesentliche Rolle. Dies wird als angeborene
körpereigene Abwehr oder Mukosa-Immunität bezeichnet
[12].
Die Mukosa-assoziierte
Abwehr beruht neben der bekannten physikalischen Barriere auf
der Bildung von Lysozym sowie anderen genkodierten, antimikrobiellen
Peptiden (AP) durch Epithelzellen. AP, auch Defensine genannt,
besitzen ein breites bakterizides Wirkspektrum gegen Gram-positive,
Gram-negative Mikroorganismen, Viren und C. albicans
[13, 14, 15].
Zahlreiche
verschiedene Strukturen von Defensinen wurden in der Zwischenzeit
beschrieben. Einige dieser antimikrobiellen Peptide –
die alpha-Defensine – werden ständig in gleich bleibenden
Mengen, andere wiederum – die ß-Defensine –
in erster Linie durch Kontakt der Epithelzellen mit pathogenen
Mikroorganismen bei Kontakt pathogener Mikroorganismen mit der
Epithelzelle gebildet [16]. Diese Kohlehydratstrukturen der
Zellwand von pathogenen Mikroorganismen – als „pathogen
associated molecular patterns“ (PAMPs) bezeichnet –,
aber auch Lipopolysaccharide, Lipoproteine, Peptidoglykane sowie
die CpG-Oligonukleotid-Sequenzen bakterieller und viraler DNA
stimulieren über TOLL- und TOLL-like-Rezeptoren (TLR) auf
Makrophagen die Entzündungskaskade und initiieren dadurch
die Abwehrreaktion [17, 18]. Unterschiede im Aufbau von bakterieller
und viraler DNA (so genannte CpG Motife) im Vergleich zur menschlichen
DNA ermöglichen
dem Immunsystem, diese potenziellen Krankheitserreger aufgrund
ihrer DNA-Struktur zu erkennen und eine entsprechende Abwehrantwort
zu initiieren. Diese antimikrobiellen Peptide arrangieren sich
in der Zellwand von Mikroorganismen in einem aus 6 Bestandteilen
bestehenden Kanal, durch den das Zytoplasma austritt und dadurch
zum Tod des Keimes führt.
|
| Diagnostik
Die Abklärung
rezidivierender Infekte besteht in einer profunden Anamnese.
Die Bestimmung der Antikörperkonzentration in Blut und
Speichel (sekr. IgA) ist sicher indiziert, obwohl meist normale
Werte erhoben werden können. Bei bildgebenden Verfahren
ist die Organmanifestation zu berücksichtigen. Auf Grund
der beschriebenen Pathomechanismen ist bei der Abklärung
von Patienten mit rezidivierenden Infektionen ein erheblich
breiteres Abklärungsprogramm durchzuführen, nämlich
auch die Untersuchung der angeborenen Abwehr neben der Bildung
von antimikrobiellen Peptiden (ß-Defensine) durch Epithelzellen,
um eine gezielte Behandlung initiieren und Prophylaxe anbieten
zu können.
|
| Möglichkeiten
der Intervention
Die adäquate
Erstbehandlung eines Infektes ist für eine rasche Keimelimination
und den Rückgang der Entzündungszeichen von wesentlicher
Bedeutung. Sie beruht natürlich auf der Verabreichung eines
wirksamen Präparates, gemessen an der antimikrobiellen
Empfindlichkeit und Bioverfügbarkeit des Medikamentes sowie
der Berücksichtigung pharmakodynamischer Besonderheiten
[19].
Wichtig
ist zudem eine unterstützende Behandlung mit abschwellenden
Nasentropfen, Sekretolytika und Medikamenten, die die Viskosität
des Schleimes harmonisieren, die Zilientätigkeit anstoßen
bzw. antientzündliche Eigenschaften aufweisen, um z.B.
die Funktion der Eustachischen Tube wieder in Gang zu setzen.
Bisweilen ist bereits die ausreichende Hydratation des Körpers
hilfreich. Auch die chirurgische Korrektur anatomischer Fehlbildungen,
z.B. die Korrektur einer Deviation der Nasenscheidewand, ist
von großer Bedeutung und kann durch keine medikamentöse
Therapie ersetzt werden.
1.8 Cineol wurde als potenter Antagonist gefäßwirksamer
proinflammatorischer Zytokine (Leukotriene, Prostaglandine)
erkannt und hat einen sicheren Stellenwert in der unterstützenden
Therapie. Der Wirkstoff wird sowohl oral als auch als Balsam
über die Haut resorbiert und rasch in der Atemluft ausgeschieden
[20].
Ein wesentlicher
Beitrag zur Verhinderung rezidivierender Infekte kommt auch
der Stärkung bzw. Stimulation der körpereigenen Abwehr
zu. Prospektive, kontrollierte, randomisierte Doppelblindstudien
bei mehreren 1.000 Patienten zeigten eine mindestens 50%-Reduktion
der Zahl und Schwere von Infekten durch die Gabe von Bakterienlysaten.
Die Wirkmechanismen sind bisher im Gegensatz zu den günstigen
klinischen Ergebnissen nicht geklärt. Eine Steigerung des
Gesamt-Sekretions-IgA wurde beschrieben. Hinweise deuten jedoch
als wesentlichen Wirkmechanismus auf eine Steigerung der angeborenen,
Mukosa-assoziierten Immunität hin [21, 22, 23, 24].
Natürliche,
aber auch synthetische Oligonukleotide – z.B. in Bakterienlysaten
– enthalten alle Strukturen, die die ß-Defensinbildung
umfassend
stimulieren. Sie stellen einerseits ein überaus potentes
Adjuvans dar, anderseits stimulieren sie über diese verschiedenen
TLR-Strukturen die Bildung proinflammatorischer Zytokine.
|
| Experimentelle
und klinische Untersuchung der Mukosa-Immunität
Es war
nun von Interesse, ob eine gestörte Mukosa-Immunität
durch eine verminderte Bildung von ß-Defensin bei rezidivierenden
Infektionen im Kindesalter eine Rolle spielt und ob Bakterienlysate
sowohl in experimentellen Untersuchungen als auch in einer klinischen
Pilotuntersuchung eine positive Wirkung durch Stimulation der
Bildung von ß-Defensin entfalten können.
Experimentelle
Untersuchungen
Material
und Methode
a) Untersuchung
der Bildung von ß-Defensin durch Epithelzellen nach Stimulation
mit lebenden Mikroorganismen und hitzeinaktivierten Bakteriensuspensionen:
Vergleich: S. aureus, P. aeruginosa ATCC-Referenzstämme
und Bronchovaxom:
Epithelzellen
aus der Wangenschleimhaut von gesunden Probanden wurden mit
einem Plastikspatel gewonnen. Eine Epithelzellsuspension mit
5.000 Epithelzellen in einem Milliliter physiologischer Kochsalzlösung
wurde zubereitet. Die Wangenschleimhautepithelien wurden mit
vitalen Mikroorganismen (S. aureus ATCC 65283, P.
aeruginosa ATCC 65284 in einer Konzentration von 5.000
KBE/ml) zur Stimulation der Bildung von ß-Defensin für
90 Minuten inkubiert und dann scharf zentrifugiert. Im Überstand
wurde die ß-Defensin Bildung in einem biologischen Testsystem
gemessen. Dieselbe Untersuchung wurde mit 10 mg/ml Bakterienlysat
(Bronchovaxom®) durchgeführt.
b)
Messung der antimikrobiellen Wirksamkeit von ß-Defensin
aus einer definierten Epithelzellsuspension in einem biologischen
Testsystem:
Ein Inokulum
von 5 x 10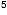 CFU/ml
P. aeruginosa (ATCC) in Trypcase-Soja-Nährmedium
wurde mit dem 0,75 ml Überstand der mit den Testorganismen
stimulierten Epithelzellsuspension (S. aureus, P.
aeruginosa ATCC und Bronchovaxom 10 mg in 1 ml NaCl phys.)
in einer Küvette inkubiert und die Trübung der Suspension
in 30-Minuten-Abständen über 4 Stunden gemessen. CFU/ml
P. aeruginosa (ATCC) in Trypcase-Soja-Nährmedium
wurde mit dem 0,75 ml Überstand der mit den Testorganismen
stimulierten Epithelzellsuspension (S. aureus, P.
aeruginosa ATCC und Bronchovaxom 10 mg in 1 ml NaCl phys.)
in einer Küvette inkubiert und die Trübung der Suspension
in 30-Minuten-Abständen über 4 Stunden gemessen.
Gleichzeitig
wurden über 4 Stunden 0,05 ml der Bakteriensuspension im
Abstand von jeweils 30 Minuten auf eine Blut-Agarplatte aufgebracht
und für 24 Stunden bei 37°C inkubiert. Anschließend
wurde die Keimzahl bestimmt. Die mit verschiedenen Antigenen
stimulierten Proben wurden mit den Proben von unstimulierten
Epithelzellsuspensionen verglichen.
Resultate
Abbildung
3 zeigt die Ergebnisse der experimentellen Untersuchung der
antimikrobiellen Eigenschaften von Wangenschleimhautepithelzellen
von 2 gesunden Probanden nach Stimulation mit 4 unterschiedlichen
Stimuli [S. aureus, ATCC 25723 (SA), P. aeruginosa,
Standardkeim für
Ringversuche (PA), Bronchovaxom 10 mg/ml (BV)] + Kontrolle (Leerwert).
Die Untersuchungen wurden 5fach wiederholt. Testorganismus:
P. aeruginosa, Standardkeim für Ringversuche.
Abbildung
3: Ergebnisse der experimentellen Untersuchung
der antimikrobiellen Eigenschaften von Wangenschleimhautepithelzellen
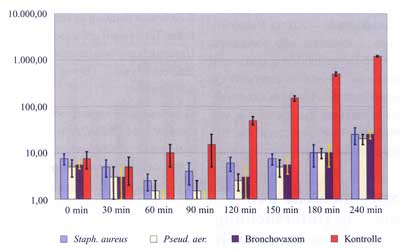
|
Klinische Beobachtungen
Ein-
und Ausschlusskriterien
Die Ergebnisse
von 23 Patienten im Alter zwischen 3 und 18 Jahren, die zur
Abklärung rezidivierender Infektionen zugewiesen wurden,
wurden retrospektiv ausgewertet. Bei diesen Patienten wurde
eine sorgfältige Anamnese und physikalische Untersuchung
durchgeführt. Besonderer Wert wurde auf vorangegangene
Behandlungen (Antibiotikum, Dosierung, Dosierungsintervalle,
Therapiedauer, unterstützende Therapie) gelegt. An laborchemischen
Untersuchungen wurden die Entzündungsparameter gemessen
und es erfolgte die Untersuchung der spezifischen körpereigenen
Abwehr einschließlich IgE, ev. RAST. Weiters wurde die
unspezifische Abwehr beurteilt sowie nach anatomischen und funktionellen
Defekten gefahndet. Außerdem wurde die Mukosaimmunität
untersucht und das ß-Defensin mit dem biologischen Testsystem
bestimmt. Die Patienten erhielten nach der Erstuntersuchung
eine effektive antimikrobielle Therapie nach den oben beschriebenen
Gesichtspunkten sowie eine entsprechende unterstützende
Behandlung.
Als Einschlusskriterium
galt: mehr als 6 Infekte der oberen Luftwege pro Jahr im vergangenen
Kalenderjahr. Ausschlusskriterien für die ß-Defensinbestimmung
waren der Nachweis eines spezifischen Immundefekts (Antikörpermangel,
T-Zelldefekt). Bei Patienten mit Adenoid- oder Tonsillenhyperplasie
wurde die ß-Defensinbildung bestimmt, wenn keine zusätzlichen
anatomischen Fehlbildungen (z.B. Lippen-Kiefer-Gaumenspalte)
vorlagen.
Die Entnahme
von Wangenschleimhautepithelien und die Bestimmung des ß-Defensins
erfolgte bei der Erstuntersuchung, nach 3-6 Monaten
und nach 1 Jahr. Patienten mit einer ß-Defensin-Produktion
< 75% des Wertes der Referenzperson erhielten Bronchovaxom
1 x 1 Tablette täglich für 30 Tage. Die klinische
Beobachtung des weiteren Verlaufes erfolgte durch die Eltern
und den Hausarzt. Alle Episoden von Infekten wurden von den
Eltern bzw. vom Hausarzt dokumentiert. Nach 3-6 Monaten und
nach 12 Monaten wurden die Patienten erneut in unserer Poliklinik
beurteilt.
Der klinische
Verlauf, d.h. die Häufigkeit und Schwere von Infektionen,
das Auftreten von Komplikationen und insbesondere die Indikation
für eine Verabreichung von Antibiotika, die Absenztage
vom Kindergarten, versäumte Schultage und eventuelle stationäre
Aufnahmen ins Krankenhaus wurden im Vergleich zur Vorperiode
beurteilt.
Ergebnisse
der Pilotuntersuchung
Insgesamt
wurde bei 23 Patienten eine initiale ß-Defensin-Bestimmung
durchgeführt (Tabelle 1)
Tabelle
1 : Ergebnisse der Pilotuntersuchung
Insgesamt
wurde bei 23 Patienten
eine initiale ß-Defensin-Bestimmung durchgeführt |
| Diagnosen
bestanden in: |
Patientenzahl |
|
| Rezidivierende
Sinusitis |
10
Patienten |
| Rezidivierende
Pneumonie/Bronchitis |
6
Patienten |
| Rezidivierende
Otitis media |
2
Patienten |
| Mukokutane
Candidiasis |
2
Patienten |
| Rezidivierende
Harnwegsinfektionen |
1
Patient |
| Rezidivierende
Durchfallerkrankungen |
1
Patient |
| Rezidivierende
Hautgranulome |
1
Patient |
|
Von
diesen Patienten zeigten initial
eine ß-Defensin-Konzentrationen in % des Kontrollwertes |
| <
10 % |
2
Patienten |
|
20 - 29 % |
5
Patienten |
|
30 - 39 % |
5
Patienten |
|
40 - 49 % |
5
Patienten |
|
50 - 69 % |
2
Patienten |
| >
70 % |
4
Patienten |
|
|
19 Patienten
wurden mit Bronchovaxom behandelt:
- Bei
einem Patienten mit chronisch karnifizierender Pneumonie konnte
die ß-Defensin-Bildung innerhalb von 3 Monaten von <10%
auf 25-40% (Mehrfachbestimmung) gesteigert werden. Der Patient
zeigte eine deutliche klinische Besserung mit Gewichtszunahme
und einer Verbesserung der Leistungsfähigkeit und Infektfreiheit
über >9 Monate.
- Bei
weiteren 13 Patienten konnte die ß-Defensin-Bildung
von <75% auf zwischen 60 und 100% der Kontrollperson gesteigert
und mit einer wesentlichen Abnahme der Häufigkeit und
Schwere der Infektionen korreliert werden.
- Bei
5 Patienten konnte keine Änderung des Befundes erreicht
werden:
2 Patienten
mit mukokutaner Candidiasis zeigten ein deutlich vermindertes
ß-Defensin initial (25% der Kontrollperson), jedoch
keine Stimulation durch Verabreichung von Bronchovaxom. Der
Patient mit P. aeruginosa-Granulomen der Haut (ß-Defensin-Bildung
<10% durch P. aeruginosa) zeigte ebenfalls keine
Steigerung der ß-Defensin-Bildung. 1 Patient mit rezidivierenden
Sinusitiden zeigte keine Steigerung der ß-Defensin-Bildung
und keine klinische Besserung der wiederholten Infekte, bei
der Patientin mit rezidivierenden P. aeruginosa-Pneumonien
wurde zwar vorübergehend eine Steigerung der ß-Defensinbildung
erreicht, jedoch ohne nachhaltige klinische Besserung.
- 4 Patienten
erhielten kein Bronchovaxom
|
| Diskussion
Strategische
Überlegungen zur Abklärung des „häufig
kranken Kindes“ beruhen keineswegs allein auf einer laborchemischen
und immunologischen Abklärung. Sie werden in erster Linie
durch Anamnese und klinische Symptome geleitet. Rekurrente,
prolongierte, pyogene Infektionen in verschiedenen Organsystemen
bei mangelndem Gedeihen mit Beginn nach dem zweiten Trimenon
weisen auf einen B-Zelldefekt und ein Antikörpermangelsyndrom
hin. Ungewöhnlich häufige Pilz- und Protozoeninfektionen
oder eine protrahierte Virusinfektion deuten auf einen Defekt
der T-Zellimmunität oder einen kombinierten B- und T-Zelldefekt
(SCID) hin. Rekurrente Staphylokokkeninfektion der Haut und
kalte Abszesse der Lymphknoten lassen auf einen Granulozytendefekt
schließen [25]. Monotope Infektionen in einem Organsystem
bei normalerweise gutem Gedeihen und gutem Allgemeinzustand
müssen den Verdacht auf eine Störung der Barrierefunktion,
auf anatomische Besonderheiten in dem betreffenden Organsystem
oder Strukturanomalien, aber auch – entsprechend der Ergebnisse
der Pilotuntersuchung – auf eine Störung der Mukosa-Immunität
richten.
Für
viele Jahre hat man sich auf die Erforschung der adaptativen
Immunität konzentriert, die natürlich eine wichtige
Rolle in der Prävention und Bekämpfung vieler Infektionen
spielt. Das adaptative Immunsystem ist in der Evolution eine
vergleichsweise junge Strategie, die besonders bei höher
entwickelten Vertebraten gut ausgebildet ist [26].
Die Oberflächen
höherer Organismen sind normalerweise mit zahlreichen Mikroorganismen
übersät, es kommt aber nur selten zu Infektionen.
Es ist jedoch verwunderlich, dass in bestimmten Körperregionen
Mikroorganismen trotz optimaler Wachstumsbedingungen (Anwesenheit
von Feuchtigkeit, Salzen, Aminosäuren, Wärme) in ihrer
Zahl nahezu konstant bleiben. Das verwundert insbesondere im
Lichte der Erkenntnis, dass dieselben Mikroorganismen unter
optimalen Bedingungen ihre Anzahl in jeweils 20 Minuten verdoppeln
können. Bisher galt, dass Haut und Schleimhäute primär
als physikalische Barriere wirken und Infektionen durch eine
undurchdringliche Schicht aus Lipiden, Hornschuppen und Schleim,
durch die Zilienbewegung und durch eine mechanische Klärfunktion
abgewehrt werden. Diese Beobachtung ließ vermuten, dass
die Haut und andere Körperoberflächen mit Kontakt
zur Umwelt neben der physikalischen Barriere auch ein chemisches
Abwehrsystem besitzen, das die Besiedelung durch Mikroorganismen
sowohl qualitativ als auch quantitativ kontrolliert [27].
Dies wurde
insbesondere durch die Bildung genetisch kodierter antimikrobieller
Substanzen, die von Epithelzellen von Pflanzen, Wirbellosen-
und Wirbeltieren einschließlich des Menschen auf Haut
und Schleimhäuten produziert werden, erklärt. Bereits
Fleming hatte 1922 das „bactericidal permeability increasing
protein“ – heute als Lysozym bezeichnet –
beschrieben, das aber im Lichte der Entdeckung des Penizillins
durch den selben Autor völlig in den Hintergrund gedrängt
wurde [28]. Einige dieser antimikrobiellen Peptide – die
alpha-Defensine – werden ständig in gleich bleibenden
Mengen, andere wiederum – die ß-Defensine –
in erster Linie durch Kontakt der Epithelzellen mit pathogenen
Mikroorganismen über bisher weitgehend unbekannte Rezeptoren
oder über proinflammatorische Zytokine bei Kontakt pathogener
Mikroorganismen mit der Epithelzelle gebildet [29, 30, 31].
Diese stimulierbaren
antimikrobiellen Peptide, ß-Defensine genannt, sind cysteinreiche,
kationische Proteinmoleküle mit einem Molekulargewicht
von ca. 5.000 kD. Sie bestehen aus 38-41 Aminosäuren [32].
Elektronenmikroskopische Aufnahmen lassen darauf schließen,
dass die antimikrobielle Wirksamkeit auf einer Perforation der
Zellwand pathogener Mikroorganismen beruht [33]. Die
ß-Defensine arrangieren sich in einem Ring und bilden
einen Kanal in der Bakterienwand, welcher zum Ausfluss von Zytoplasma
führt. ß-Defensin I wird vorwiegend im Urogenitaltrakt
gebildet und besitzt eine Wirksamkeit gegen Gram-negative Mikroorganismen,
ß-Defensin II wird in den Epithelzellen der oberen Luftwege
gebildet und ist ebenfalls gegen Gram-negative Erreger und Pilze
wirksam, das ß-Defensin III wirkt gegen S. aureus
und Enterokokken, unabhängig von deren Resistenz gegen
Antibiotika [34].
Entzündungsmediatoren,
die durch diese TLR induziert werden, sind TNFa, TNFgamma, Il
1 und Il 6, die ebenso wie bakterielle Mikroorganismen z.B.
ß-Defensin II freisetzen. Als TLR-Signaltransduktoren
für die Freisetzung der proinflammatorischen Zytokine fungieren
MyD88, Tirap, Trif, Tram. Bisher kennt man mindestens 9 (+1)
verschiedene TL-Rezeptoren, die auf unterschiedliche Strukturen
bakterieller Mikroorganismen reagieren, eine bestimmte Sequenz
von Entzündungsmediatoren freisetzen und bakterizide Eigenschaften
besitzen [35, 36, 37]. TLR 4 wird durch LPS Gram-negativer Mikroorganismen
stimuliert, TLR 2 von Gram-positiven Keimen initiiert. In Bakterienlysaten
(z.B. Bronchovaxom®) sind viele dieser stimulierenden Stoffe
vorhanden.
Die Mukosa-Immunität,
eben die Bildung von ß-Defensinen, kann sowohl bezüglich
Konzentration als auch Zeitpunkt der Bildung bei Säuglingen,
Klein- und Schulkindern mit rezidivierenden Infekten gestört
sein. Dies bedeutet, dass bei diesen Patienten Schleimhäute
leichter und mit höheren Keimzahlen durch bakterielle Mikroorganismen
besiedelt werden bzw. Keime, die an Epithelzellen haften, nicht
eliminiert werden können.
Möglichkeiten
einer Störung bestehen insofern, als
- Patienten
mit rezidivierenden Infekten kein oder im Vergleich zu gesunden
Vergleichspersonen zu wenig ß-Defensin bilden oder eine
bestimmte ß-Defensinklasse nicht bilden.
- Patienten
nach Kontakt mit bestimmten Mikroorganismen (z.B. P. aeruginosa)
kein ß-Defensin bilden.
- Patienten
verzögert auf die bakterielle Besiedelung von Epithelzellen
mit der Bildung von ß-Defensin reagieren und dadurch
einer kleinen Inokulummenge Zeit geben zu proliferieren, wodurch
das System überfordert ist, da ß-Defensine nur
gegen eine kleine Inokulummenge wirksam sind.
Unsere
Pilotuntersuchung hat gezeigt, dass bei Patienten mit rezidivierenden
Infektionen und intakter spezifischer körpereigener Abwehr
ein Mangel an ß-Defensinen eine pathogenetische Rolle
spielen kann. In diesem vorselektionierten Krankengut wurde
bei der Majorität der Patienten eine massive bis deutliche
Verminderung der Bildung antimikrobieller Peptide beobachtet.
Es ist gerechtfertigt, diesem lokalen Defekt der Mukosa-Immunität
bei der Pathogenese rezidivierender Infekte eine wesentlich
größere Bedeutung beizumessen als z.B. einem Defekt
der spezifischen Immunität wie z.B. der Brutonschen Agammaglobulinämie.
Bei der
Behandlung von Patienten mit rezidivierenden Infektionen vor
allem der Atemwege kommt der Optimierung der antimikrobiellen
Behandlung eine entscheidende Bedeutung zu. Für einen nachhaltigen
Behandlungserfolg sind neben der Wahl eines wirksamen Antibiotikums
die richtige Tagesdosis, die richtigen Dosierungsintervalle
(optimale Pharmakodynamik und Überschreiten der mittleren
Hemmkonzentrationen am Infektionsort für mindestens 66%
besser 75-90 % der Zeit bis zur nächsten Dosis) und die
korrekte Verabreichungsweise ausschlaggebend. Zuletzt ist auch
eine korrekte Therapiedauer, die sich primär nach pathophysiologischen
und funktionellen Gesichtspunkten richtet, von wesentlicher
Bedeutung im Hinblick auf das Auftreten von Rezidiven.
Eine antibiotische
Dauerprophylaxe zur Verhinderung rezidivierender Infekte ist
nur in Ausnahmefällen ge-rechtfertigt und erfolgreich.
Sie führt zur Selektion sowie Induktion resistenter bakterieller
Mikroorganismen als Erreger von Rezidiven, was den Einsatz von
oft nur parenteral verabreichbaren Breitspektrum-Antibiotika
erforderlich macht. Gleich wichtig, obwohl in ihrer Bedeutung
vielfach unterschätzt, ist auch eine entsprechende unterstützende
Therapie mit Verbesserung der mukoziliären Clearance. Auch
die Untersuchung von anatomischen und funktionellen Störungen
des Sekretflusses und der Belüftung von Oberflächen
sowie der Mukosa-Immunität ist von Bedeutung.
Bei Säuglingen
und Kleinkindern mit rezidivierenden Infektionen können
auf verschiedenen Ebenen der körpereigenen Abwehr Defekte
bestehen. Eine effiziente Behandlung rezidivierender Infekte
muss sich nun einer entsprechenden Diagnostik bedienen, um die
einzelnen pathogenetischen Ursachen gezielt behandeln zu können.
Hinweise
mehren sich, dass die Stimulation der Mukosa-Immunität
z.B. durch detoxifiziertes Lipid A bzw. dem Monophosphoryl Lipid
A über TLR 4 in Kombination mit einer Vakzine eine dramatische
Steigerung der Immunantwort zur Folge hat [38]. Neueste Untersuchungen
weisen auch darauf hin, dass es über die Aktivierung der
TLR 4 auch zu einer Aktivierung der adaptiven Immunität
kommt [39].
In Bakterienlysaten
ist unter anderem auch detoxifiziertes Lipid A enthalten. Unsere
Untersuchungen weisen darauf hin, dass die Verabreichung von
Bakterienlysaten, obwohl nach wie vor nicht allgemein akzeptiert,
in einem hohen Prozentsatz der Patienten mit rezidivierenden
Infektionen
zu einer Besserung der Mukosa-Immunität und zu einer substanziellen
Abnahme der gehäuften Infekte führt. Allerdings ist
eine optimierte antimikrobielle und funktionelle Behandlung
der Infekte Voraussetzung. Bakterienlysate greifen in mehreren
Ebenen der körpereigenen Abwehr günstig ein.
1) Bakterienlysate
enthalten sowohl LPS, Oberflächenstrukturen Gram-negativer
Mikroorganismen, Lipoteichonsäure und Peptidoglykane der
bakteriellen Zellwand Gram-positiver Keime als auch Kohlenhydratstrukturen
aus der Zellwand Gram-negativer Mikroorganismen. Diese stimulieren
direkt die Bildung von ß-Defensinen.
2) Stimulation
von proinflammatorischen Cytokinen durch TLR über Bakterienlysate
und bakterielle/virale DNA (CpG Motif), die ebenso wiederum
über die Bildung von NO oder ß-Defensinen Keime an
Epitheloberflächen eliminieren, ohne eine entsprechende
Aktivierung der stimulierbaren humoralen oder zellulären
Immunität.
3) Bildung
von spezifischen Sekretions-IgA-Antikörpern in Sekreten
des Nasen-/Rachenraums, die gegen Oberflächenstrukturen
von Keimen gerichtet sind und die Adhärenz bakterieller
Mikroorganismen blockieren. Die Induktion von Sekretions-IgA-Antikörpern,
die die Adhärenz von Keimen blockieren, wurde in eigenen
randomisierten Doppelblinduntersuchungen dokumentiert [40 ].
|
Ausblick
Die körpereigene
Abwehr ruht auf 3 Säulen, von denen jede Säule bei
rezidivierenden Infektionen im Kindesalter gestört sein
kann.
1) Die
stimulierbare spezifische körpereigene Abwehr, die auf
der Bildung von Antikörpern inklusive Sekretions-IgA-Antikörpern
und der T-Zell-Immunität beruht. Defekte dieses Abwehrsystems
sind selten.
2) Die
unspezifische körpereigene Abwehr, zu der in erster Linie
die mukoziliäre Clearance mit Zilienschlagfrequez, regulärer
Schleimschicht, Belüftung von Schleimhäuten und freier
Sekretfluss zählen und die die Besiedelung der Schleimhäute
mit Mikroorganismen reguliert. Die unspezifische Abwehr, die
bei Entzündungsprozessen profund gestört ist, wird
vorwiegend durch eine rasche Elimination der Mikroorganismen
durch eine optimierte antimikrobielle Behandlung sowie eine
adäquate unterstützende Behandlung beeinflusst
3) Die
neu entdeckte angeborene Abwehr oder Mukosa-Immunität:
Sie beruht darauf, dass der Körper Rezeptoren besitzt,
die ohne einen vorangegangenen Kontakt Strukturen bakterieller
Mikroorganismen (PAMPs) über die so genannten TOLL- und
TOLL-like-Rezeptoren (TLR) erkennen und eine Kaskade von proinflammatorischen
Cytokinen mit direkter antimikrobieller Wirkung oder über
Vermittlung von ß-Defensin freisetzen.
Von besonderem
Interesse ist es in Zukunft, das Ausmaß der Verminderung
der Mukosa-Immunität bei Patienten mit rezidivierenden
Infektionen zu definieren. In der Folge ist es notwendig, eine
zeitliche Auflösung für die ß-Defensin-Bildung
zu ermitteln, d.h. zeitliche Unterschiede zwischen Kontrollpersonen
und den Probanden bezüglich der Bildung von ß-Defensin
zu bestimmen. Eine zeitliche Verzögerung der ß-Defensin-Bildung
kann zu einer erheblichen Beeinträchtigung der Mukosa-Immunität
führen, da ß-Defensin nur gegen ein kleines Inokulum,
wie es bei einer Tröpfcheninfektion zustande kommt, wirkt.
Bei zeitlicher Verzögerung der Wirkung kann durch Proliferation
der Keime die Wirksamkeit erheblich vermindert sein. Da im Rahmen
einer Virusinfektion eine erhebliche Störung der unspezifischen
körpereigenen Abwehr und insbesondere der mukoziliären
Clearance besteht, jedoch nur ein kleiner Prozentsatz der Patienten
an bakterieller Superinfektion leidet, ist der angeborenen Mukosa-Immunität
eine möglicherweise entscheidende Rolle zuzuschreiben.
Es wäre dringend nötig, diese Fragestellung in prospektiven
klinischen Untersuchungen abzuklären.
|
Literatur:
| 1.
Gillespie M.B.: „Recurrent otitis media in children.“
JAMA 289 (2003) 1383-1384. |
| 2.
Dagan R., Leibovitz E., Greenberg D., Yagupsky P., Fliss
D.M., Leiberman A.: „Early eradication of pathogens
from middle ear fluid during antibiotic treatment of acute
otitis media is associated with improved outcome.“
Pediatric Infectious Dis. Journal. 17 (1998) 778-782. |
| 3.
Diament M.J.: „The diagnosis of sinusitis in infants
and children. X-ray, computed tomography, and magnetic resonance
imaging. Diagnostic imaging in pediatric sinusitis.“
J. Allergy Clin. Immunol. 90 (1990) 442-444. |
| 4.
Horn M.E., Reed S.E., Taylor P.E.: „Role of viruses
and bacteria in acute wheezy bronchitis in childhood. A
study of sputum.“ Arch. Dis. Child. 54 (1979) 587-592. |
| 5.
Hobermann A., Wald E.R., Hickey R.W.: „Oral versus
initial intravenous therapy of acute urinary tract infections
in young febrile children.“ Pediatrics 104 (1999)
79-86. |
| 6.
Horowith M.E.: „Stem cell transplantation for inherited
immunodeficiency syndromes.“ Ped. Clin. North. Am.
47 (2000) 1371-1387. |
| 7.
Goss C.H.: „Airway clearance in cystic fibrosis.“
Resp. Care. 48 (2003) 20-21. |
| 8.
Ogra: „Vaccination Strategies for Mucosal Immune Responses.“
Clin. Microbiol. Rev. 14 (2001) 430-445. |
| 9.
Hagashi M.: „Adhärenz von Streptococcus pyogenes
an Wangenschleimhautepithelien bei Kindern mit rezidivierenden
Streptokokkeninfektionen.“ Dissertation Univ. Erlangen,
1994. |
| 10.
Ruder H., Thurn C.H., Guggenbichler J.P.: „Adherence
of E. coli to uroepithelia in children and adolescents after
renal transplantation.“ Transplant Proc. 24 (1992)
2576-2577. |
| 11.
Hagen P., Hobisch A., Guggenbichler J.P., Schwanninger J.,
Bartsch G.: „Korrelation von vesiko-ureteralem Reflux
und rezidivierenden Harnwegsinfektionen mit erhöhter
bakterieller Adhärenz.“ Urologe. 31 (1992) 186-188. |
| 12.
Schröder J.: „Antimikrobielle Peptide –
Antibiotika der Zukunft.“ MMP 22 (1999) 270-277. |
| 13.
Brandtzaeg P.: „Mucosal immunology: with special reference
to specific immune defense of upper respiratory tract.“
Otolaryngology 50 (1988) 225-235. |
| 14.
Benesch K.W., Raida M., Mägert H.J., Schulz-Knappe
P., Forssmann W.G.: „A novel ß-Defensin from
human plasma.“ FEBS Letter 368 (1995) 331-335. |
| 15.
Hancock R.E.: „Peptide antibiotics.“ Lancet
349 (1997) 418-422. |
| 16.
Medzhitov R., Janeway C.: „Innate immune recognition:
mechanisms and pathways.“ Immunol. Review 173 (2000)
89-97. |
| 17.
Medzhitov R.: „Toll like receptors and innate immunity.“
Nature Reviews 1 (2001) 135-145. |
| 18.
Barton G.M., Medzhitov R.: „Control of adaptive immune
responses by Toll like receptors.“ Curr. Opin. Immunol.
14 (2002) 380-383. |
| 19.
Dagan R., Klugman K.P., Craig W.A., Baquero F.: „Evidence
to support the rationale that bacterial eradication in respiratory
tract infection is an important aim of antimicrobial therapy.“
J. Antimic. Chemoth. 47 (2001) 129-140. |
| 20.
Jürgens U.R., Stöber M., Vetter H.: „Steroidartige
Hemmung des monozytären Arachidonsäuremetabolismus
und der IL-1-Produktion durch 1,8-Cineol.“ Atemw.
Lungenkrkh. 1 (1998) 2-10. |
| 21.
Cvoriscec B., Ustar M., Pardon R., Palecek I., Stipic Marcovic
A., Zimic B.: „Oral Immunotherapy of chronic bronchitis:
a double blind placebo controlled multicentre study.“
Respiration 55 (1989) 129-135. |
| 22.
Gutierrez-Tarango M.D., Berber A.: „Efficacy of a
bacterial extract (OM-85 BV) in preventing recurrent respiratory
tract infections in susceptible children.“ Clin. Drug
Invest. 13 (1997) 76-84. |
| 23.
Maestroni G.J., Losa G.A.: „Clinical and immunobiological
effects of an orally administered bacteria extract.“
Int. J. Immunopharm. 6 (1984) 111-117. |
| 24.
Fischer H., Eckenberg P., Van Aubel A., Kämmereit A.,
Elsasser U.: „Prävention von Infektrezidiven
der oberen und unteren Luftwege.“ Atemw. und Lungenkrankheiten.
18 (1992) 146-155. |
| 25.
Johnston R.B. jr.: „Clinical aspects of chronic granulomatous
disease.“ Curr. Opin. Hematol. 8 (2001) 17-22. |
| 26.
Maune St., Meyer J.E.: „Potential körpereigener
antibiotischer Peptide bei der angeborenen Abwehr von Rhinusinusitiden.“
Allergologie 24 (2001) 23-32. |
| 27.
Mackay I., Rosen F: „Innate Immunity New Engl. J.
Med. 343 (2000) 338-344. |
| 28.
Fleming A.: „On a remarkable bacteriolytic element
founding tissues and secretions.“ Proc. R. Soc. London
93 (1922) 306-317. |
| 29.
Fulton C., Anderson G.M., Stolzenberg E.D., Kari U.P., Zasloff
M., Wilson J.M.: „Human ß-Defensin 1 is a salt
sensitive antibiotic in lung that is inactivated in cystic
fibrosis.“ Cell 88 (1997) 553-560. |
| 30.
Medzhitov R., Janeway C.G.: „Fly immunity great expectations.“
Genomen Biology 1 (2000) 1-4. |
| 31.
Fan J., Kapuis A., Marsden P.A., Li Y.H., Orpoulos G.: „Regulation
of Tolllike receptor 4 expression in the lung following
hemorrhagic shock and lipopolysaccharides.“ J. Immunology
168 (2002) 5252-5259. |
| 32.
Hoffmann J.A., Kafatos F.C., Janeway C.A., Ezekowitz: „Phylogenetic
perspectives in innate immunity.“ Science 284 (1999)
1313-1318. |
| 33.
Wiedow O., Young J.A., Davison E.: „Anti Leukoprotease
in psoriatic scales.“ J. Invest. Dermatol. 101 (1993)
305-309. |
| 34.
Selsted M.E., Miller S.I., Henschen A.H., Quellette A.J.:
„Enteric defensins: antibiotic peptide components
of intestinal host defense.“ J. Cell Biol. 118 (1992)
929-936. |
| 35.
Harder J.U., Bartels E., Christophers J.M., Schröder
J.M.: „A peptide antibiotic from human skin.“
Nature 387 (1997) 861. |
| 36.
Medzhitov R., Janeway Ch.A.: „How does the immune
system distinguish self from nonself.“ Seminars in
Immunology 12 (2000) 185-188. |
| 37.
Bendelac A., Medzhitov R.: „Adjuvans of Immunity:
Harnessing innate Immunity to promote adaptive Immunity.“
J. Exp. Med. 195 (2002) F 19-F23. |
| 38.
Persing D.H., Coler R.N., Lacy M.J., Johnson D.A., Baldridge
J.R., Hersberg R.M., Reed S.G.: „Taking toll: lipid
a mimetics as adjuvants and immunomodulators.“ Trends
Microbiol. 10 Suppl. (2002) 32-39. |
| 39.
Check W.: „Innate immunity depends on toll-like receptors.“
ASM News 70 (7) (2004) 317-322. |
| 40.
Wichels M., Wolfschaffner H.: „Stimulation des Sekretions
Ig A-Systems durch Bakterienlysate und Blockierung der Adhärenz
von Mikroorganismen an Schleimhautepithelien.“ Dissertation
zur Erlangung des med. Doktorgrades, Univ. Erlangen (1998). |
Anschrift
des Verfassers:
Univ.-Prof. Dr. J. Peter Guggenbichler
Klinik mit Poliklinik der Universität Erlangen-Nürnberg
D-91054 Erlangen, Loschgestraße 15
E-Mail:
prof.guggenbichler@gmx.de
|
|
|