Durch Zecken übertragene
Krankheitserreger
(Tick-Transmitted Diseases) |
|
G. Stanek
Klinisches Institut für Hygiene und Medizinische Mikrobiologie
der Universität Wien
(Vorstand: Univ.-Prof. Dr. M. Rotter)
|
Einleitung
In den 1980er Jahren
bestätigten sich die Vermutungen, dass heimische Zecken außer
dem FSME-Virus noch andere bis dahin unbekannte oder bei uns weitgehend
unbeachtete Krankheitserreger auf den Menschen übertragen können.
Zu den neu entdeckten gehören die Erreger der Lyme-Borreliose,
zu den wenig wahrgenommenen gehören bestimmte Rickettsienarten
und Ehrlichien. Dazu kommen noch die selten auf diesem Weg auf den
Menschen übertragenen Erreger der Hasenpest (Tularämie)
und der Babesiose.
Diese Fülle an Möglichkeiten bringt dem behandelnden Arzt
differentialdiagnostische Probleme, insbesondere dann, wenn sich
der Patient mit Fieber nach Zeckenstich einfindet. Der vorliegende
Band des ANTIBIOTIKA MONITOR bezieht sich auf Beiträge
zum „Symposium on Tick-Transmitted Diseases“, welches
die dritte gemeinsame Veranstaltung der Österreichischen Gesellschaft
für Hygiene, Mikrobiologie und Präventivmedizin (ÖGHMP)
und der Slovenian Society for Infectious Diseases war, die zuletzt
diesmal im September 2001 im University Medical Centre in Ljubljana
stattgefunden hat. Der Bericht gibt Einblick in die Eigenheiten
des Vektors Ixodes ricinus, behandelt bestimmte Aspekte der
Lyme-Borreliose, Früh-Sommer-Meningo-Enzephalitis (FSME), Ehrlichiose,
Infektionen mit Rickettsia slovaca, Tularämie und Babesiose.
Die therapeutischen Angaben stützen sich alle auf kontrollierte
klinische Studien und gelten daher als Therapieempfehlungen im Sinn
der „evidence based medicine“. Im Anhang findet sich ein
Protokoll der Lyme-Borreliose, Ehrlichiose und FSME. Alle Literaturzitate
aus dem Jahr 2002, die nur im Text und nicht in der Literaturliste
angeführt sind, wurden zur Publikation eingereicht und befinden
sich im Druck.
|
Introduction
In the 1980ies it became
evident that Ixodes ricinus ticks in Europe are not only transmitting
the TBE (tick-borne encephalitis) virus but also other hitherto
unknown or not recognized human pathogens. The newly discovered
pathogens were the agents of Lyme borreliosis, and the less recognized
were certain species of the genus Rickettsia and Ehrlichia. Additionally,
infections of humans with the agents of tularaemia and babesiosis
were also observed in consequence of a tick-bite.
The possibility to become infected with various pathogens by a tick-bite
focuses the physician on differential diagnoses, particularly in
cases where the patient presents with fever after a tick-bite. The
present volume of the ANTIBIOTIKA MONITOR refers to contributions
to the „Symposium on Tick-Transmitted Diseases“ which
was the third meeting of that type, co-organised by the Austrian
Society for Hygiene, Microbiology and Preventive Medicine (ÖGHMP)
and the Slovenian Society for Infectious Diseases. It took place
at the University Medical Centre in Ljubljana in September 2001.
The report offers information about the vector tick Ixodes ricinus,
about certain aspects of Lyme borreliosis, tick-borne encephalitis
(TBE), ehrlichiosis, infection with Rickettsia slovaca, tularaemia
and babesiosis. The therapeutic schedules are all based on controlled
clinical studies and should be considered as recommendations of
evidence based medicine. The attachment contains protocols for Lyme
borreliosis, ehrlichiosis, and TBE. All references indicating the
year 2002 which are not listed in the list of references are in
press and will be available in full during the year 2002.
|
Zecken
Lederzecken und Schildzecken
Zecken lassen sich in Lederzecken (Argasidae) und in Schildzecken
(Ixodidae) unterteilen. Sie unterscheiden sich in ihrer Morphologie,
ihren Lebensbereichen und in Einzelheiten ihres Lebenszyklus. Alle
ernähren sich vom Blut von Wirbeltieren. Während aber
die Leder- oder Argas-Zecken in kurzer Zeit (Minuten bis Stunden)
wiederholt relativ kleine Blutmengen saugen, nehmen die Schildzecken
nur einmal in jedem Entwicklungsstadium (Larve, Nymphe, adulte weibliche
Zecke) über mehrere Tage eine große Blutmahlzeit von
derselben Körperstelle des Wirts. Männliche Zecken können,
wenn überhaupt, nur eine kleine Blutmahlzeit aufnehmen. Obwohl
Zecken selbst direkt den Wirt schädigen können, besteht
ihre Hauptbedeutung in der Übertragung von Krankheitserregern.
Lederzecken leben gewöhnlich in der nächsten Umgebung
ihrer Wirte, in Tierhöhlen oder Nestern (sie sind endophil)
und suchen ihren Wirt (oder ihre Wirte) wiederholt auf, um Blut
zu saugen. Einige Lederzecken übertragen gefährliche Erkrankungen,
wie das endemische Rückfallfieber, eine lebensgefährliche
Infektionskrankheit des Menschen, und das Afrikanische Schweinefieber,
aber ihre medizinische Bedeutung wird sowohl in der Humanmedizin
als auch in der Veterinärmedizin bei weitem von den Schildzecken
übertroffen.
Schildzecken gelten weltweit als die wichtigsten Ektoparasiten,
sowohl für den Viehbestand als auch als Vektoren gefährlicher
Erkrankungen des Menschen. Einige Schildzecken leben endophil, aber
die Mehrzahl ist exophil, das heißt, wenn sie hungrig sind,
klettern sie auf die Vegetation, von wo aus sie vorbeikommenden
Wirten auflauern. Im letzten Viertel des 20. Jahrhunderts wurde
die Rolle bestimmter Ixodes-Arten als Überträger
von Krankheitserregern sehr intensiv studiert.
Verbreitung und Entwicklungszyklus
von Schildzecken
Schildzecken übertragen in den gemäßigten Zonen
der nördlichen Hemisphäre die Erreger von Lyme-Borreliose,
granulozytäre Ehrlichiose, Früh-Sommer-Meningo-Enzephalitis
(FSME), Tularämie und andere. Die Verbreitung der Zecken deckt
sich jedoch nicht vollständig mit dem Vorkommen der Erkrankungen.
Zum Beispiel kommt Lyme-Borreliose, die am weitesten verbreitete
von Zecken übertragene Erkrankung, weder in den südlichen
Staaten der USA noch in Südeuropa vor. Andere Erkrankungen
wie FSME und murine Babesiose sind in ihrer Verbreitung noch mehr
begrenzt, was mit den Schwierigkeiten in der Übertragungsdynamik
in den verschiedenen Gebieten zu erklären ist und/oder in Unterschieden
der Pathogenität der Erreger selbst.
Der Lebenszyklus der vier wichtigen Schildzeckenarten (Ixodes
ricinus, I. persulcatus, I. scapularis, I. pacificus) ist sehr
ähnlich. Er lässt sich anhand der europäischen Zecke
Ixodes ricinus darstellen. Jede der drei Entwicklungsstufen,
Larve, Nymphe und Adulte, klettert auf die bodennahe Vegetation,
um einen vorbeikommenden Wirt zu erreichen. Auf dem Wirt sucht die
Zecke eine geeignete Hautstelle für die Blutmahlzeit, schlitzt
die Haut mit den skalpellartigen Mundwerkzeugen (Chelicerae) auf,
führt den gezahnten Rüssel (Hypostom) in die Wunde, welcher
zusammen mit dem so genannten Zement, der von den Speicheldrüsen
sezerniert wird, die Zecke fest an ihrem Platz verankert (Abb. 1).
An diesem bleibt sie für einige Tage (Larven 2-3 Tage, Nymphen
4-5 Tage, adulte weibliche Zecken 7-9 Tage) haften, in denen sowohl
der Darm als auch die Haut aktiv wächst, um die enormen Blutmengen
zu bewältigen, welche in den letzten 24 Stunden der Blutmahlzeit
aufgenommen werden. Die adulte männliche Zecke nimmt nur sehr
selten eine Blutmahlzeit und kann sich niemals so auffüllen
wie die Vorstadien und das adulte Weibchen.
|
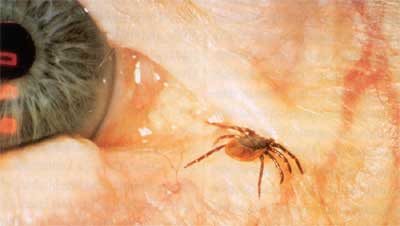
Abbildung
1: Im Augenwinkel fixierte adulte weibliche Ixodes
ricinus-Zecke (Foto: Univ.-Prof. Dr. M. Zehetmayer, Univ.-Augenklinik
Wien)
|
Zecken stechen Blutgefäße
nicht direkt an, sondern bilden durch Sekretion vasoaktiver Mediatoren
und Immunmodulatoren einen Ernährungs-Teich, den so genannten
„feeding pool“, in dem das Blut flüssig bleibt und
Gegenreaktionen des Wirts unterdrückt werden. Die Blutmahlzeit
wird durch Wasser-Extraktion konzentriert, das Wasser durch die
Speicheldrüsen der Zecke in den Wirt zurück sezerniert.
Wasser ist damit auch ein wichtiges Transportmittel für Krankheitserreger
in den Blutwirt. Wenn die Zecke vollgesogen ist, zieht sie das Hypostom
zurück, fällt auf den Boden, beginnt, die Blutmahlzeit
zu verdauen und sich ins nächste Stadium zu entwickeln. Die
Verdauung besteht aus Pinozytose (Mikrophagozytose) und Endozytose
der Blutbestandteile durch die Darmwandzellen. Danach folgt eine
intrazelluläre Verdauung anstelle einer intraluminalen Verdauung,
wie sie bei den meisten anderen Arthropoden üblich ist, die
sich von Blut ernähren. Die Verdauung und die anschließende
Verwandlung in ein neues Entwicklungsstadium gehen langsam vor sich.
Die Entwicklung kann in den gemäßigten Klimazonen, in
denen diese Zecken leben, einige Monate dauern. Nach der Metamorphose
verharrt die ungesogene Zecke für einige Zeit in Ruhe, klettert
schließlich auf die Vegetation und lauert einem neuen Blutwirt
auf. Bei Ixodes ricinus kann ein ganzes Jahr zwischen den
Blutmahlzeiten vergehen.
Übertragung von
Krankheitserregern
Im Darm von Zecken fehlen Verdauungs-Enzyme. Das ermöglicht
ein Überleben von aufgenommenen Mikroorganismen und erklärt
auch, warum Zecken eine größere Vielfalt von Mikroorganismen
übertragen können als andere Arthropoden.
Die meisten von Zecken übertragenen Krankheitserreger durchdringen
die Darmwand kurz nach ihrer Aufnahme mit der Blutmahlzeit und finden
sich als Infektionserreger in den Speicheldrüsen des nächsten
Entwicklungsstadiums der Zecke. Ausnahmen bilden Borrelien des Borrelia
burgdorferi sensu lato (s.l.)-Komplexes. Diese Krankheitserreger
bleiben im Darm und wandern erst bei der Blutmahlzeit des nächsten
Entwicklungsstadiums der Zecke in ihre Speicheldrüsen. Selbst
wenn die Krankheitserreger schon in der Speicheldrüse sind,
benötigen sie eine bestimmte Zeit zur Aktivierung, welche gewöhnlich
durch Temperaturerhöhung bei der Blutmahlzeit erreicht wird.
Da jedes Zecken-Entwicklungsstadium nur einmal eine Blutmahlzeit
nimmt, werden die Infektionserreger durch ein Entwicklungsstadium
aufgenommen (Larve oder Nymphe) und durch das nächste übertragen
(Nymphe bzw. adulte weibliche Zecke). Viele Krankheitserreger werden
transovariell, nach Infektion der Ovarien, von einer Zecken-Generation
auf die nächste übertragen, so dass die Zecken-Larven,
die aus den Eiern schlüpfen, bereits infektiös sind, wie
im Fall von Babesia divergens. Diese Babesie kann mehrere
Generationen in Zecken bleiben, obwohl gewöhnlich für
eine lange Persistenz eine Infektion über die Blutmahlzeit
notwendig ist. Im Gegensatz dazu kann Babesia bovis, pathogen
für Rinder, nicht über das Larvenstadium hinaus existieren.
Für die meisten Zoonose-Erreger, z.B. Babesia microti, Borrelia
burgdorferi s.l., Ehrlichia spp., FSME-Virus, erfolgt
die Übertragung von Krankheitserregern transstadial, das heißt,
die Krankheitserreger werden durch Larven oder Nymphen aufgenommen
und von Nymphen oder Adulten übertragen. Gelegentlich wird
auch transovarielle Übertragung beobachtet, die eine Bedeutung
in der Ökologie der Erreger haben mag. Das Risiko einer Infektionsübertragung
durch infizierte Zecken-Larven ist allerdings sehr gering.
Für lange Zeit hat man geglaubt, dass Wirbeltiere nur dann
für Vektorzecken infektiös sind, wenn sie durch den Krankheitserreger
systemisch infiziert sind, das heißt, wenn sie eine permanente
Blutinfektion haben. Heute weiß man, dass zumindest einige
Krankheitserreger durch so genanntes „co-feeding“ auf
andere Vektoren übertragen werden [1]. Unter „co-feeding“
versteht man die Aufnahme von Krankheitserregern durch nicht infizierte
Zecken, die auf einer Hautstelle eines Blutwirts gleichzeitig oder
kurz nach der Blutmahlzeit einer infizierten Zecke Blut saugen.
Durch die kurzzeitige lokalisierte Hautinfektion während und
kurz nach der Blutmahlzeit der infizierten Zecke gelangen Krankheitserreger
in den „feeding pool“ der nicht-infizierten Zecke. Dieser
Mechanismus ist insbesondere für die Übertragung von FSME-Viren
von Bedeutung, da eine Virämie in Wirtstieren nur kurze Zeit
dauert, auch infolge der inhärenten immunologischen Resistenz.
Durch „co-feeding“ können diese aber dennoch als
Infektionsquelle dienen.
Die Übertragung von Borrelia burgdorferi s.l durch „co-feeding“
wurde ebenfalls nachgewiesen. Allerdings ist dieser Infektionsweg
in der Öko-Epidemiologie der Lyme-Borreliose von untergeordneter
Bedeutung, da sehr viele Tiere in typischen Lyme-Borreliose-Habitaten
dauernd systemisch mit Borrelien infiziert sind.
Lebensraum
Die frei lebenden Stadien von Schildzecken sind gegenüber Austrocknung
sehr empfindlich und können in einem Milieu mit weniger als
80% relativer Feuchte nicht überleben. Diese Lebensbedürfnisse
zwingen die Zecken in Lebensbereiche (Habitate), in denen die relative
Feuchte in der bodennahen Vegetation selbst im Hochsommer nicht
unter 85% abfällt.
Ungesogene Zecken und solche, die kürzlich eine Blutmahlzeit
beendet haben, beziehen Wasser aus der feuchten Umgebungsluft über
Aufnahme durch hygroskopisches Material, das durch ihre Speicheldrüsen
sezerniert wird. Mit dieser Eigenschaft ausgestattet, können
ungesogene Zecken ihre Wirtssuche auch in die obere Vegetation ausdehnen
und ihren Blutwirten über einige Tage auflauern, bevor sie
zur Rehydrierung wieder auf den Erdboden zurück müssen.
Zecken können in offenen Gebieten mit häufigen Regenfällen
und dichter Vegetation existieren, wie z.B. in den rauhen Hügelländern
von Großbritannien und Irland. Dort sind die Haupt-Blutwirte
für alle Entwicklungsstadien der Zecken Schafe, Rinder und
Wild. Allerdings ist ein Habitat aus Laub- und Mischwäldern
typischer, welche generell die Lebensbedingungen für alle Entwicklungsstufen
gewähren und dazu noch eine Fülle von Wirtstieren bereitstellen,
sowohl für Ixodes ricinus als auch für andere Mitglieder
des Ixodes-Komplexes.
Wirtsspezifität
Die drei Entwicklungsstadien der Zecken befallen in verschiedener
Verteilung verschiedene Wirte. Fast überall befallen Larven
gewöhnlich Nager, Nymphen Vögel und mittelgroße
Säugetiere, und adulte weibliche Zecken große Wirtstiere,
wie z.B. Wild. Die verschiedenen Entwicklungsstadien der Zecken
lauern auf ihre Wirte wegen der unterschiedlichen Austrocknungsgefahr
in unterschiedlicher Höhe auf der Vegetation. Larven bewegen
sich bis zu 20 cm, Nymphen bis 40 cm und adulte Zecken bis zu 80
cm über den Erdboden und nur so lange, bis sie die Austrockungsgefahr
hinuntertreibt in das Mikroklima mit der idealen relativen Luftfeuchte.
Doch selbst adulte Zecken klettern gewöhnlich nie höher
als einen halben Meter über dem Boden. Die stratifizierte Verteilung
auf der Vegetation erklärt wahrscheinlich auch die relative
Wirtsspezifität der Zecken.
Alle Stadien von Ixodes ricinus befallen auch den Menschen,
aber es ist vielfach belegt, dass Nymphen den Menschen viel öfter
befallen als Larven oder Adulte. Das Gleiche gilt auch für
die Ixodes-Arten Ixodes scapularis und Ixodes pacificus.
Regulierung der saisonalen
Aktivität
Um auf einen Wirt zu kommen, klettern Zecken auf günstige Stellen
der Vegetation und sind in dieser Phase ihres Lebenszyklus besonders
empfindlich gegenüber Austrocknung. Sie können, wie bereits
gesagt, zurück zum feuchten Boden, um zu rehydrieren, aber
das kostet Energie. Daher vermeiden wirtssuchende Zecken trockene
und kalte Perioden des Jahres. In den meisten Habitaten ist die
Wirtssuche im Frühling und Frühsommer am intensivsten
und im Sommer am geringsten. In einigen Gebieten beobachtet man
im Herbst einen zweiten, etwas niedrigeren Aktivitätsgipfel
der Zecken. Dieses Grundmuster variiert selbstverständlich
aufgrund der Wirtsvariabilität und des Einflusses von Makro-
und Mikroklima.
Um die Perioden der Wirtssuche zu regulieren, bedienen sich die
Zecken eines Mechanismus, der Diapause genannt wird. Diapause ist
z.B. die Ruhepause nach einer Stadienwandlung, gilt für Eier,
voll gesogene Larven und Nymphen. Die Diapause schützt Zecken
davor, ihre Entwicklung im Frühwinter zu beginnen, und verzögert
die Aktivität der ungesogenen, hungrigen Zecken bis nach dem
Hochsommer.
Zunahme der Zeckenpopulationen
In jedem Habitat hängt die Dichte der Zeckenpopulationen sowohl
von der Art der Vegetation, dem Klima und Wetter ab, welche Überleben
und Entwicklung der frei lebenden Zecken-Stadien bedingen, als auch
vom Erfolg der Zecken, in den parasitischen Lebensphasen Blutwirte
zu finden. Die frei lebenden Zecken-Stadien sind sehr von einem
ganzjährig bestehenden feuchten Mikroklima und entsprechenden
Temperaturen für ihre Entwicklung abhängig. Die optimalen
Habitate sind Laubwälder in gemäßigten Klimazonen,
welche gewöhnlich auch Habitate für zahlreiche verschiedene
Blutwirte der Zecken sind, so dass die unreifen Entwicklungsstadien
praktisch unbegrenzt in ihren Nahrungsquellen sind. Die adulten
Zecken hingegen brauchen große Säugetiere, wie z.B. Wild,
um zu einer vollen Blutmahlzeit zu kommen und so die nächste
Generation bereiten zu können. Die großen Tiere haben
als Blutwirte daher den größten Einfluss auf die Zeckenpopulationsdichte.
Falls das Habitat speziell für die frei lebenden Entwicklungsphasen
der Zecken geeignet ist, genügt sogar eine relativ kleine Zahl
von Wild, um eine sehr große Zeckenpopulation zu erhalten.
Das Verständnis der Faktoren, die eine dichte Zeckenpopulation
bedingen, hat auch einen Voraussagewert für z.B. Klimaänderungen.
Dies belegt eine Studie aus Schweden, in der die Ausbreitung von
Ixodes ricinus in den Norden des Landes und die damit verbundene
Zunahme von FSME-Fällen in Schweden auf die seit mehr als 1
Jahrzehnt wärmeren Wintertemperaturen zurückgeführt
wird. Temperaturzunahme kann die Zeckendichte und Zecken-Verteilung
auf verschiedene Weise fördern. Dazu gehören mehr Zeit
für die Zeckenentwicklung innerhalb einer Saison, Ausdehnung
der Zeckenhabitate durch intensiver wachsende Vegetation und wegen
der besseren Winterbedingungen für Wildtiere mehr Möglichkeiten,
geeignete Blutwirte auch im Herbst und Winter zu finden.
|
Tabelle
1: Von Zecken des Ixodes-Komplexes übertragene Krankheitserreger
(modifiziert nach G. Gray, 2002)
| Zeckenart |
Geographische
Verbreitung |
Krankheitserreger |
|
| Ixodes
ricinus |
Europa |
Borrelia
burgdorferi sensu lato
(Coxiella burnetii)
FSME-Virus
Anaplasma (Ehrlichia)
phagocytophila
Francisella tularensis |
| Rhipicephalus
sanguineus |
|
Rickettsia
conorii |
| Dermacentor
marginatus |
|
Rickettsia
slovaca |
|
| I.
persulcatus |
Russland,
gemäßigte
Klimazonen in Asien |
Borrelia
burgdorferi sensu lato
FSME-Virus |
|
| I.
pacificus |
Westliches
Nordamerika |
Borrelia
burgdorferi sensu lato
Anaplasma (Ehrlichia)? |
|
| I.
scapularis |
Östliches
Nordamerika |
Borrelia
burgdorferi sensu lato
Anaplasma (Ehrlichia)
phagocytophila
Babesia microti
Powassan-Virus |
|
|
|
| Lyme-Borreliose
Reservoire der Erreger
der Lyme-Borreliose
(B. burgdorferi s.l.-Komplex)
Das Überleben von B. burgdorferi s.l. in der Natur erfordert
das Zusammenwirken von Krankheitserreger, Überträger (Vektor)
und Wirt. In Europa wurden bisher die Borrelienarten B. burgdorferi
sensu stricto, B. afzelii, B. garinii, B. valaisiana und
B. lusitaniae von Schildzecken isoliert. Drei Zeckenarten
der Gattung Ixodes wurden als Vektoren identifiziert. Der wichtigste
Vektor ist die Zecke Ixodes ricinus, die mehr als 300 Wirbeltierarten
als Blutwirte benützt. Nur ein kleiner Teil dieser Blutwirte
wurde bisher auf seine Reservoir-Kompetenz, also auf seine Eignung,
Krankheitserreger auf Zecken weiterzugeben, überprüft.
Am ausführlichsten wurden bisher Nager studiert, die als die
wichtigsten Reservoir-Wirte von B. burgdorferi s.l. gelten
[2].
Die Rolle von Vögeln als Borrelien-Reservoir war lange Zeit
umstritten. Jetzt ist klar, dass sie ein bedeutendes Erregerreservoir
darstellen, insbesondere für B. garinii. Dazu weisen
Studienergebnisse auf die Möglichkeit hin, dass Zugvögel
B. burgdorferi s.l. auch über Hemisphären verbreiten
können.
Der Kreislauf der Borrelienverbreitung in der Natur wird dadurch
kompliziert, dass verschiedene Borrelienarten nicht gleicherweise
zwischen wirbellosen Tieren und Wirbeltieren übertragen werden
können. So besteht eine enge Beziehung zwischen B. afzelii
und kleinen Säugetieren, B. burgdorferi s.s. und B.
afzelii und Eichhörnchen und zwischen B. garinii, B.
valaisiana und Vögeln. Allerdings wurden auch andere Beziehungen
je nach den lokalen Ökosystemen in Europa beschrieben. Ein
besseres Verständnis der Wechselwirkungen zwischen Krankheitserregern,
Vektoren und Wirten muss – trotz der bisherigen Leistungen
– weiterhin erarbeitet werden.
Übertragungsquote
von B. burgdorferi s.l. nach Zeckenstich
Wenn man die Übertragungsquote von Borrelien auf den Menschen
nach Zeckenstich studiert und die Borrelien-Infektion der Zecke
mittels Immunfluoreszenz, Nukleinsäureamplifikationstests und/oder
Kultur ermittelt, dann findet man, dass nach dem Stich durch eine
Borrelien-infizierte Zecke 36% der betroffenen Personen infiziert
werden und 75% mit klinischen Symptomen erkranken [2].
Wenn man die Infektion der Zecken nicht identifiziert, sondern ermittelt,
wie viele Personen nach Zeckenstich erkranken, dann sind das nur
2% der Gestochenen. Wenn man nun weiß, dass in Mitteleuropa
etwa 10% der Bevölkerung pro Jahr von Zecken gestochen werden,
lässt sich auch die Inzidenz der Lyme-Borreliose in dieser
Region abschätzen. Für Österreich (Gesamtbevölkerung
etwa 8 Mio. Einwohner) errechnet sich eine Inzidenz der Lyme-Borreliose
von 0,4%, das ist die Anzahl der neu aufgetretenen Erkrankungen
pro Jahr, also ca. 16.000 Fälle pro Jahr.
Klinische Aspekte
der Lyme-Borreliose
Erythema migrans (EM)
EM ist bei weitem die häufigste Manifestation der Lyme-Borreliose
in Zentraleuropa (Abb. 2). Die Geschlechtsverteilung des EM zeigt
eine geringfügige oder deutliche Überzahl von weiblichen
Patienten. In einer Studie aus dem Jahr 2000 wurden 535 jugendliche
und erwachsene Patienten mit einem typischen EM auf die verschiedensten
Aspekte dieser frühen lokalisierten Manifestation der Lyme-Borreliose
untersucht (Strle 2002). Das Verhältnis weiblicher und männlicher
Patienten betrug 1,37, das Alter bewegte sich von 15 bis 80 Jahre
(Median 47 Jahre). Ein Zeckenstich wurde von etwa 58% der Patienten
wahrgenommen, und zwar im Median 14 Tage vor dem Auftreten des EM.
Das EM bestand im Median 8,5 Tage bis zur klinischen Diagnose. Der
mittlere Durchmesser aller EM betrug 12 cm (Variation zwischen 4
und 87 cm) und die durchschnittliche Fläche des betroffenen
Hautareals war 75 cm². Multiple EM (2 bis 21) wurden bei 6,7%
aller Patienten beobachtet.
|
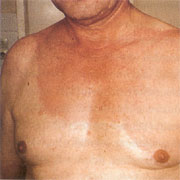
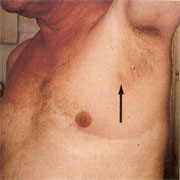
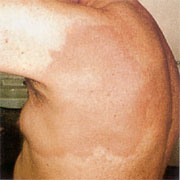
Abbildung
2: Ausgedehntes Erythema migrans nach Zeckenstich in der
linken Achsel
|
Folgende Begleiterscheinungen
wurden beobachtet:
|
Lokale
Symptome 52,2 %
|
| Juckreiz |
(45,2
%)
|
| Brennen |
(12,9
%)
|
| Schmerzen |
(7,1
%)
|
|
|
Systemische
Symptome 35,7 %
|
| Müdigkeit |
(17,4
%)
|
| Kopfschmerzen |
(17,2
%)
|
| Muskelschmerzen |
(12,6
%)
|
| Gelenksschmerzen |
(11,2
%)
|
| Schwindel |
(3,6
%)
|
| Fieber |
(2,5
%)
|
| Schüttelfrost |
(1,5
%)
|
|
Multiples Erythema
migrans (EM)
Unter multiplem EM versteht man das gleichzeitige Auftreten von
EM an verschiedenen Hautstellen, wobei sich nur eines um die Zeckenstichstelle
entwickelt. Die „akzessorischen“ EM sind durch hämatogene
Ausbreitung der Borrelien entstanden, die sich in den betroffenen
Hautstellen nachweisen lassen. Dabei stellt sich die Frage, ob durch
die systemische Infektion auch das Zentralnervensystem infiziert
wird.
Multiple EM bei Kindern
In einer prospektiven Langzeitstudie von 5 Jahren wurden 214 Kinder
(Patienten unter 15 Jahren) aus Slowenien mit multiplem EM diagnostiziert
und von allen Liquorproben genommen (Arnez 2002). Der Liquor wies
bei 55 von 214 (25,7%) Kindern eine Pleozytose auf (Zellzahlen 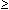 5 x 10
5 x 10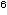 /l), die in
94,5% lymphozytär war. Die Zellzahlen bewegten sich von 5 bis
320 x 10 /l), die in
94,5% lymphozytär war. Die Zellzahlen bewegten sich von 5 bis
320 x 10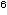 /l (im Mittel
10 x 10 /l (im Mittel
10 x 10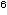 /l). Im Vergleich
zu den Patienten mit einem normalen Liquor hatten die Patienten
mit Pleozytose viel häufiger früher schon Lyme-Borreliose,
eine längere Inkubationszeit (25,5 gegenüber 14 Tagen),
häufiger Allgemeinsymptome (45,5% gegenüber 21,4%), positive
meningeale Zeichen in 10,9% gegenüber 1,9%, und öfter
eine positive Liquor-Kultur von B. burgdorferi s.l., nämlich
in 7 von 52 gegenüber einem von 147 Patienten. /l). Im Vergleich
zu den Patienten mit einem normalen Liquor hatten die Patienten
mit Pleozytose viel häufiger früher schon Lyme-Borreliose,
eine längere Inkubationszeit (25,5 gegenüber 14 Tagen),
häufiger Allgemeinsymptome (45,5% gegenüber 21,4%), positive
meningeale Zeichen in 10,9% gegenüber 1,9%, und öfter
eine positive Liquor-Kultur von B. burgdorferi s.l., nämlich
in 7 von 52 gegenüber einem von 147 Patienten.
Multiple EM und Liquorbefunde
bei Erwachsenen
Über einen Zeitraum von 9 Jahren wurden 332 Patienten mit multiplem
EM diagnostiziert und 200 in die prospektive Studie rekrutiert (mittleres
Alter 46 Jahre, Altersbereich 15-80 Jahre; Maraspin et al. 2002).
Durchschnittlich wurden 3 multiple Hautläsionen beobachtet,
die Anzahl bewegte sich von 2 bis 60 Läsionen. Allgemeinsymptome
fanden sich bei der Hälfte der Patienten. Bei 62 Patienten
(31%) wurden abnorme Liquorbefunde erhoben, wie lymphozytäre
Pleozytose (8%) und erhöhte Liquorproteine (22%). Es stellte
sich also heraus, dass abnorme Liquorbefunde bei Patienten mit multiplen
Erythemen nicht selten sind, wobei diese mit oder ohne klinische
Zeichen eines Befalls des Zentralnervensystems bestehen können.
Begleiterscheinungen
bei Acrodermatitis chronica atrophicans (ACA)
Wie schon aus Untersuchungen anderer Autoren lange vor und kurz
nach der Entdeckung der Erreger der Lyme-Borreliose bekannt wurde,
befällt die ACA meist die Haut der unteren Extremitäten,
dann die oberen Extremitäten und seltener auch den Abdominal-
und Rumpfbereich [3, 4]. In einer prospektiven Langzeitstudie über
9 Jahre (Logar et al. 2002) wurden 123 Patienten mit ACA rekrutiert,
mit einem medianen Alter von 61 Jahren (20 bis 80 Jahre) und einem
überwiegenden Anteil von Frauen (65%). Bei mehr als der Hälfte
der Patienten (54%) waren zwei Extremitäten und/oder auch der
Rumpf mit Läsionen betroffen. Myalgien und Arthralgien bestanden
in 42% bzw. 27%, Parästhesien und Kopfschmerz bei 18% und 27%
der Patienten.
Multiple Sklerose
und Lyme-Borreliose
Die Multiple Sklerose (MS) ist eine chronisch-progressive Erkrankung
mit höchstwahrscheinlich autoimmuner Grundlage, welche hauptsächlich
oder ausschließlich das Zentral-Nerven-System (ZNS) betrifft
und zur Demyelinisierung und Remyelinisierung führt. Zahlreiche
Krankheitserreger wurden als direkte Verursacher oder Auslöser
eines Autoimmunprozesses innerhalb des ZNS angeschuldigt. Schon
kurz nach der Entdeckung des Erregers der Lyme-Borreliose wurde
auch B. burgdorferi s.l. als Verursacher in Betracht gezogen.
Obwohl es bis heute weder biologische noch biochemische oder molekularbiologische
Beweise für einen derartigen Zusammenhang gibt, lassen einige
Autoren nicht locker, eine Kausalität zwischen Lyme-Borreliose
und MS wiederholt zu behaupten. Nun wurden die beiden Erkrankungen
MS und chronisch progressive Neuroborreliose mittels einer deduktiven
Methodik gegenübergestellt (Schmutzhard 2002). Zur Differenzierung
wurden die vielfältigen klinischen Erscheinungsformen, Seroepidemiologie,
Neuroimaging, Liquor-Befunde, Liquor-Serologie, spezifische Proteine
im Liquor, Antikörper gegenüber neuronalen Strukturen,
Kynurenine und Matrix Metalloproteinasen im Liquor, molekulare Mimikry
sowie die jüngsten Erkenntnisse über verschiedene dendritische
Zellen im Liquor herangezogen.
Der Autor kommt nach sorgfältiger Analyse zum Schluss, dass
es sich bei MS und akuter Neuroborreliose zweifelsfrei um völlig
verschiedene Erkrankungen handelt. Ähnlichkeiten gibt es allerdings
mit der progressiven Borrelien-Enzephalomyelitis, die sich MS-artig
präsentieren kann. Aber auch hier kann MS klar von der chronischen
Form der Neuroborreliose abgegrenzt werden. Da die Behandlungsmöglichkeiten
und die Prognose für MS und chronische Neuroborreliose ganz
verschieden sind, ist es allerdings notwendig, die Differenzierung
so früh wie möglich durchzuführen.
Morphea (zirkumskripte
Sklerodermie) und Lyme-Borreliose
Eine ursächliche Rolle von B. burgdorferi s.l. bei der
Entstehung der Morphea wird seit der erstmaligen Anzüchtung
dieser Spirochäten aus Hautproben von betroffenen Hautbezirken
bei Morphea-Patienten diskutiert [5], und zwar kontroversiell, weil
einerseits bloß bezweifelt, andererseits, weil andere Untersucher
mit ihren Methoden nicht erfolgreich waren [6]. Nun ist die wiederholte
Anzüchtung von B. burgdorferi s.l. nicht nur bei Fällen
von Morphea, sondern auch aus betroffenen Hautbezirken bei Patienten
mit Lichen sclerosus et atrophicus [7, 8] zweifellos ein stärkerer
Hinweis auf einen ursächlichen Zusammenhang, aber dennoch kein
Beweis. Wieso nicht? Um den Krankheitserreger zu definieren, sind
weder die erweiterten Koch´schen Postulate erfüllt, noch
kontrollierte klinische Studien durchgeführt worden, deren
Ergebnisse den Zusammenhang statistisch sichern könnten. So
bleibt es zunächst bei der Beschreibung von Einzelfällen,
bei denen B. afzelii aus betroffenen Hautbezirken isoliert
worden ist und eine antibiotische Behandlung zumindest teilweise
erfolgreich war.
Laboratoriumsdiagnose
Die klinische Diagnose Lyme-Borreliose verlangt eine Bestätigung
durch mikrobiologische Verfahren. Mit diesen kann man den Krankheitserreger
im jeweils geeigneten Untersuchungsmaterial entweder direkt nachweisen
oder die Reaktion des Organismus auf die Infektion erfassen, was
in der Regel durch den Nachweis spezifischer Serum-Antikörper
erfolgt.
Anzüchtung von
Borrelia burgdorferi s.l. (Abb. 3)
Welche Borrelienarten werden von Patienten aus Europa am häufigsten
isoliert? Dieser Frage gingen Kollegen aus Slowenien (Ruzic-Sabljic
et al. 2002) nach, indem sie eigene Anzüchtungen von 642 B.
burgdorferi s.l.-Stämmen identifizierten, die von Patienten
mit solitärem Erythema migrans (n = 470), multiplem Erythema
migrans (n = 35), der Neuroborreliose vorausgehendem Erythema migrans
(n = 24), unspezifischen Hautläsionen (n = 3), Lymphozytom
(n = 7), Acrodermatitis chronica atrophicans (n = 65) und dem Liquor
von klinisch diagnostizierter Neuroborreliose (n = 38) stammten.
Die Ergebnisse zeigen (Tabelle 2), dass wohl B. afzelii am
häufigsten aus der Haut, B. garinii überwiegend
aus dem Liquor und B. burgdorferi s.s. nur sehr selten isoliert
worden ist. Aber es kommt dabei auch klar heraus, dass die Pathogenität
nicht von der Genospezies allein abhängt, sondern auch auf
anderen Faktoren beruhen muss, die noch nicht klar erkannt worden
sind.
|
Abbildung
3: B. afzelii in BSK-Medium; Dunkelfeldmikroskopie
|
|
Tabelle
2: Charakterisierung von 642 B. burgdorferi s.l.-Stämmen,
die von Patienten aus Slowenien isoliert wurden
| Erkrankung |
Anzahl
|
Genospezies
|
|
|
B.
afzelii
|
B.
burgdorferi s.s.
|
B.
garinii
|
|
| Erythema
migrans |
529
|
450
|
4
|
75
|
| unspezifische
Hautläsionen |
3
|
3
|
|
|
| Lymphozytom |
7
|
6
|
|
1
|
| ACA |
65
|
58
|
3
|
4
|
| Neuroborreliose |
38
|
10
|
1
|
27
|
|
| Gesamt |
642
|
527
|
8
|
107
|
| (%) |
(100)
|
(82)
|
(1,3)
|
(16,7)
|
|
|
Serologie
Direkte Nachweisverfahren sind an Speziallabore gebunden, die Erfahrung
in der Anzüchtung von Borrelien sowie im Nachweis von Nukleinsäureabschnitten
der verschiedenen Borrelien haben. Die Borrelienserologie allerdings
soll bestimmten Regeln folgen, welche in einer Schriftenreihe der
Deutschen Gesellschaft für Hygiene und Mikrobiologie erstmals
vor 2 Jahren dargelegt wurden [9]. Die „MIQ 12 Lyme-Borreliose“
(Mikrobiologische Infektiologische Qualitätsstandards) empfiehlt
den Nachweis von Antikörpern gegen Borrelien in 2 Schritten.
Im ersten Schritt werden Antikörper gegen Borrelien gesucht.
Im positiven Fall muss im zweiten Schritt die Spezifität dieser
Antikörper bestätigt werden. Als Suchtests sollen Enzym-Immuno-Assays
(EIA, ELISA) eingesetzt werden, zur Bestätigung eines positiven
Ergebnisses dient ein standardisiertes Immunoblot (Western-Blot-)-Verfahren.
Falls dafür Ganzzell-Lysate verwendet werden, muss das Vorliegen
diagnostischer Banden zuerst durch monoklonale Antikörper identifiziert
werden. Bei rekombinanten Blots mit ausgewählten relevanten
Antigenen ist dies naturgemäß viel einfacher. Der Nachweis
von Serumantikörpern allein reicht für die Laboratoriums-Diagnose
Neuroborreliose nicht aus. In diesem Fall muss der Liquor/Serum-Index
der spezifischen Antikörper bestimmt werden.
Über die Qualität der Lyme-Borreliose-Serologie in Routinelaboratorien
wurden die Ergebnisse eines Ringversuch-Programms aus Deutschland/Österreich
vorgestellt (Hunfeld et al. 2002). Das Prinzip dieses Ringversuchs
ist, 2 Serumproben zuerst in 5 Sollwertlaboratorien zu testen und
anschließend an die Teilnehmer des Ringversuchs zu versenden.
Die Anzahl der teilnehmenden Laboratorien bewegte sich zwischen
229 und 337 in den Jahren 1999 bzw. 2001. In diesen Ringversuchen
wurden für IgG „korrekte“ Ergebnisse für ELISA
in durchschnittlich 90,5% und für IgG Immunoblot in 81,3% erzielt;
für IgM waren die ELISA-Ergebnisse im Mittel bei 83,9% und
die Immunoblot-Ergebnisse bei 79,5%. Die Autoren sehen darin einen
dringenden Bedarf für Standardisierung der Methoden zur serologischen
Diagnostik der Lyme-Borreliose (Abb. 4).
|
Abbildung
4: SDS-PAGE von Borrelien; Haut- und Liquorisolate

|
Eine andere Frage ist,
ob nach einer Behandlung des Erythema migrans überhaupt eine
spezifische Immunreaktion zu erwarten ist. Diese Frage wurde im
Rahmen einer vergleichenden Therapiestudie behandelt (Arnez et al.
2002). Zum Zeitpunkt der ersten Untersuchung hatten in jeder Behandlungsgruppe
4 der 42 Patienten Antikörper gegen B. burgdorferi s.l.,
ebenso 6 Wochen sowie 12 Monate nach Behandlungsbeginn. Diese Ergebnisse
zeigen, dass eine serologische Therapiekontrolle nicht möglich
ist, da offensichtlich eine humorale Immunantwort nach erfolgreicher
Behandlung nicht erfolgt.
Nukleinsäure-Amplifikationstechnik
(NAT)
Die MIQ nimmt zu Nukleinsäure-Amplifikationstechniken Stellung,
welche nur in den Referenzlaboratorien und nur mit geeignetem Untersuchungsmaterial
durchgeführt werden sollen. Dieses ist in erster Linie Haut
(Hautbiospien), auch Liquor, der insbesondere am An-fang der Erkrankung
und bei Kindern, die noch keine ausgeprägte Pleozytose in der
Liquorzytologie zeigen, mit NAT untersucht werden soll. Zurückhaltend
äußert sich die MIQ über den Nachweis von Borrelien-DNA
aus dem Urin. Dieser gelingt offensichtlich nur in wenigen Laboratorien
und wurde bisher noch keiner kritischen Vergleichsstudie unterzogen.
Therapie der Lyme-Borreliose
Die Behandlung der Lyme-Borreliose mit Antibiotika wird zwar allgemein
akzeptiert, die Meinungen über die geeigneten antimikrobiellen
Chemotherapeutika und die Dauer ihrer Verabreichung gehen aber weit
auseinander. Die Gründe für die Vielfalt der Meinungen
könnten Gegenstand eigener Forschungsarbeit werden, sicher
ist jedenfalls, dass über 3 Wochen hinausgehende Behandlungszeiten
durch keine kontrollierte Studie begründet sind. Vorschläge
für die Langzeitbehandlung (monatelang) der Lyme-Borreliose
stammen vor allem von einzelnen Mitgliedern privater Vereine aus
den USA, die darüber hinaus auch Symptomenlisten in ihre Websites
stellen, in denen alle möglichen Symptome als Ausdruck der
Lyme-Borreliose aufgelistet sind. Für klinisch tätige
und niedergelassene Kolleginnen und Kollegen zählen aber nur
Informationen über geeignete Behandlungsverfahren, die auf
den Ergebnissen von kontrollierten klinischen Studien aus
Europa beruhen.
Antibiotika-Prophylaxe
der Lyme-Borreliose?
Kann die Einnahme von Antibiotika nach einem Zeckenstich den Ausbruch
der Lyme-Borreliose verhindern? Das ist eine oft gestellte Frage.
In Europa war die Antwort bisher „nein“, weil es Beispiele
gibt, wo sich kein Erfolg eingestellt hat. Kollegen des Medical
Centre der Universität Laibach (Maraspin et. al. 2002) arbeiteten
die Krankengeschichten von 5.056 Patienten (Zeitraum 1994 bis 2001)
mit klinisch typischem Erythema migrans durch und fanden, dass 7
davon, also 0,14%, innerhalb von 72 Stunden nach einem Zeckenstich
systemisch mit Antibiotika behandelt worden sind und dennoch ein
Erythema migrans entwickelt haben. Die Autoren schließen aus
den Ergebnissen ihrer retrospektiven Studie allerdings, dass sie
weder die Häufigkeit des Versagens noch die Wirksamkeit der
individuellen Antibiotika-Prophylaxe abschätzen können.
Einzig gesichert ist, dass die Antibiotika-Prophylaxe der Lyme-Borreliose
keinen vollständigen Schutz vor der Krankheit gewährleistet.
Es ist daher nötig, in Europa prospektive Studien zur Feststellung
der Wirksamkeit, Sicherheit und des Kosten-Nutzen-Effekts der antibiotischen
Behandlung eines Ixodes ricinus-Zeckenstichs zur Vermeidung
der Lyme-Borreliose durchzuführen.
Die Ergebnisse einer prospektiven Studie zu dieser Fragestellung
wurde von Kollegen aus dem New York Medical Center im Sommer 2001
veröffentlicht [10]. Diese Arbeitsgruppe führte eine randomisierte,
doppelblinde, Plazebo-kontrollierte Studie mit einer einzigen Dosis
von 200 mg Doxycyclin bei 482 Personen durch, die eine anhaftende
Ixodes scapularis-Zecke innerhalb von 72 Stunden vor Behandlungsbeginn
aus ihrer Haut entfernt hatten. Die Ergebnisse waren folgende: Erythema
migrans entwickelte sich bei einem signifikant kleineren Anteil
von Personen mit Doxycyclin-Behandlung als in der Plazebo-Gruppe,
nämlich bei einer von 235 (0,4%) gegenüber acht von 247
Personen (3,2%). Die Autoren schließen daraus, dass eine Einzeldosis
von 200 mg Doxycyclin die Entwicklung von Lyme-Borreliose verhindern
kann, falls sie innerhalb von 72 Stunden nach dem Stich durch eine
Ixodes scapularis-Zecke verabreicht wird.
Die Kritik an dieser Studie blieb nicht aus. Der Beobachtungszeitraum
nach Behandlungsbeginn betrug nur 6 Wochen; Komplikationen könnten
noch auftreten. Mehr als 95% der „Zeckenstich-Opfer“ würden
unnötigerweise mit Antibiotika behandelt. Eine gezielte Behandlung
des Erythema migrans würde genauso gut Spätkomplikationen
verhindern. Kurz, die Frage nach der Nützlichkeit der antibiotischen
Behandlung eines Zeckenstichs kann nicht klar beantwortet werden
und erfordert in Europa in der Tat prospektive Studien mit langer
Beobachtungszeit.
Welches Antibiotikum
zur Behandlung des Erythema migrans?
Erythema migrans wird bei etwa 90% der Patienten als objektives
Zeichen einer Borrelien-Infektion beobachtet. Die Behandlung der
Lyme-Borreliose mit Antibiotika ist besonders am Beginn der Infektionskrankheit
wirksam und auch bei allen anderen Manifestationen zweckmäßig.
Die Antibiotika-Behandlung verkürzt die Dauer der Erkrankung
und verhindert sehr wirksam spätere Manifestationen der Lyme-Borreliose.
Es gibt zahlreiche Vergleichsstudien aus früheren Jahren, und
es gibt ganz aktuelle, randomisierte, prospektive Vergleichsstudien
mit Erwachsenen, die zeigen, dass die Wirksamkeit von Penicillin
V, Ampicillin, Doxycyclin und Azithromycin in der Behandlung des
Erythema migrans praktisch nicht verschieden ist. Unsicherheit gibt
es bei der Antwort auf die Frage, ob die Behandlung des Erythema
migrans bei Kindern mit Azithromycin ebenfalls durchgeführt
werden kann.
In einer Studie zum Vergleich der Wirksamkeit und Nebenwirkungen
von Azithromycin und Phenoxymethylpenicillin wurden Kinder unter
15 Jahren mit einem zunächst unbehandelten typischen solitären
Erythema migrans in die prospektive Studie einbezogen. Die Wirksamkeit
der Behandlung der akuten Erkrankung, das Auftreten von größeren
oder kleineren Spätmanifestationen der Lyme-Borreliose und
von Nebenwirkungen der Behandlung wurden in Folgeuntersuchungen
während eines Jahres festgestellt. 42 Patienten erhielten Azithromycin
(20 mg/kg/Tag am ersten Tag, gefolgt von 10 mg/kg/Tag für weitere
4 Tage) und 42 erhielten Phenoxymethylpenicillin (Penicillin V:
100.000 IU/kg/Tag für 14 Tage). In den demographischen und
klinischen Daten vor Behandlung gab es zwischen den Gruppen keinen
Unterschied. Ein Jahr nach der antibiotischen Behandlung waren alle
Patienten frei von Beschwerden, und Azithromycin und Phenoxymethylpenicillin
erwiesen sich gleichermaßen wirksam in der Behandlung des
solitären Erythema migrans bei Kindern.
|
|
Früh-Sommer-Meningo-Enzephalitis
(Infektionen
durch das FSME-Virus)
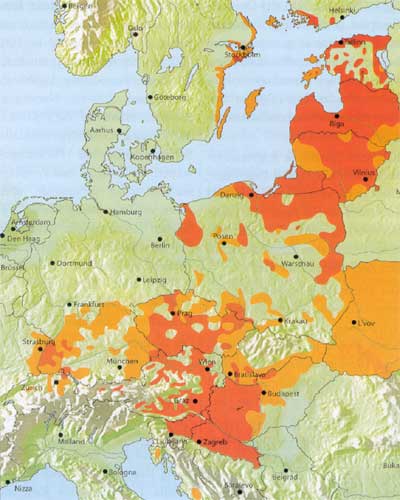
Die Früh-Sommer-Meningo-Enzephalitis (FSME) ist in umschriebenen
geographischen Gebieten Europas endemisch. Immer wieder werden neue
Verbreitungsgebiete entdeckt, wie das Auftreten von zahlreichen
schweren FSME-Fällen im südöstlichen Baden-Württemberg
(Schwarzwald) zeigen [11]. Das FSME-Virus ist das bedeutendste von
Zecken übertragene Flavivirus. Das Virus ist sehr homogen.
Man kennt bisher nur 3 FSME-Virus-Subtypen, nämlich den europäischen,
zentralsibirischen und den fernöstlichen Subtyp. Das Virus
zirkuliert in Naturherden zwischen kleinen Säugetieren und
Schildzecken. Menschen werden gewöhnlich durch Zeckenstich
in einem Naturherd infiziert. Es besteht aber auch die seltene Möglichkeit,
die FSME-Viren durch Genuss nicht pasteurisierter Milch von infizierten
Milchtieren aufzunehmen. Wegen des uncharakteristischen Krankheitsbildes
erfolgt die Diagnose im virologischen Laboratorium, welche gewöhnlich
durch Nachweis spezifischer IgM- und IgG-Serum-Antikörper gestellt
wird. Beim Ausbruch der Erkrankung des Zentralnervensystems lassen
sich im Liquor cerebrospinalis nur in 50%, erst ab dem 10. Krankheitstag
bei allen Patienten spezifische Antikörper nachweisen. Für
die spezifische Prophylaxe stehen Impfstoffe zur intramuskulären
Verabreichung zur Verfügung, die aus hochgereinigten, inaktivierten
Viren hergestellt werden. Experimente mit Carrier-Vakzinen zur Verabreichung
als Nasenspray wurden von Kollegen aus dem Forschungszentrum für
Virologie und Biotechnologie in Nowosibirsk berichtet (Goncharova
et al. 2002) (Abb. 5).
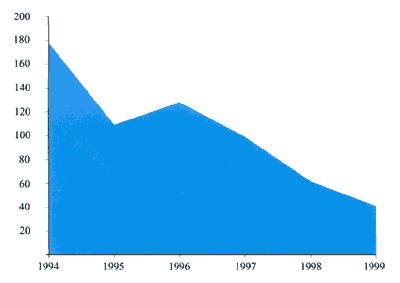
Die österreichische
Bevölkerung hat
die Empfehlungen zur Schutzimpfung gegen FSME eindrucksvoll bejaht.
Mehr als 80% der Gesamtbevölkerung sind geimpft. Erst diese
umfassende Immunisierung, nicht aber die gezielte Immunisierung
von exponierten Personen allein, hat zu einer signifikanten Reduktion
der FSME in Österreich geführt (Abb. 6).
|
Abbildung
5: Verbreitung der FSME in Europa
|
Abbildung
6: FSME-Fälle in Österreich
|
Schwere Verläufe
der FSME werden von Ländern berichtet, in denen keine generelle
Impfempfehlung besteht. In Slowenien mussten in den Jahren 1996
bis 2000 30 Patienten mit schwerer FSME wegen Bewusstseinsstörungen
und neurologischer Ausfälle einer intensivmedizinischen Behandlung
zugeführt werden (Jereb et al. 2002). Der Verlauf war bei 16
Patienten monophasisch, bei den verbleibenden 14 biphasisch. Zwei
Patienten verstarben.
Seitdem die Verbreitung der Ehrlichiose in Mitteleuropa und insbesondere
in Slowenien nachgewiesen worden ist, stellt die Ehrlichiose eine
Differentialdiagnose bei fieberhaften Erkrankungen nach Zeckenstich
dar. Die Unterscheidung gegenüber FSME erfolgt durch die klinischen
Angaben von Schüttelfrost, Myalgien und Arthralgien sowie folgende
Laboratoriumsbefunde: erhöhte Laktatdehyrogenase und erhöhte
Werte von C-reaktivem Protein (Lotric-Furlan et al. 2002).
|
Humane Granulozytäre
Ehrlichiose (HGE)
(Infektionen durch Anaplasma
phagocytophila, früher HGE-Agens).
Ehrlichien sind obligat intrazelluläre Bakterien, die sich
in Vakuolen im Zytoplasma von eukaryontischen Zellen vermehren.
Taxonomisch wurden sie den Rickettsien zugeordnet. Sie unterscheiden
sich von diesen insbesondere durch den Befall von zirkulierenden
Leukozyten. Ehrlichia canis verursacht eine Panzytopenie
bei Hunden, wobei bestimmte Hundearten schwere Infektionen entwickeln,
die durch Fieber, Anorexie mit dramatischem Gewichtsverlust, ausgeprägte
Panzytopenie, Anämie, periphere Ödeme und Haemorrhagien
gekennzeichnet sind. Ehrlichia risticii verursacht schwere
Diarrhoen bei Pferden. Andere Ehrlichien spielen ebenfalls in der
Veterinärmedizin eine Rolle. Den tierpathogenen Ehrlichien
verwandte Arten verursachen akute, fieberhafte Erkrankungen des
Menschen. Als Krankheitserreger des Menschen wurden E. canis
und verwandte Arten erstmals in den USA diskutiert [12] und kurz
darauf in verschiedenen Teilen Nordamerikas [13] und auch in Europa
identifiziert. Überträger von Ehrlichien sind verschiedene
Ixodes-Zecken.
Während in verschiedenen Teilen der USA von inzwischen mehreren
hundert Krankheitsfällen humaner Ehrlichiose berichtet worden
ist, gab es in Europa bis vor kurzem nur den Hinweis auf das Vorkommen
von HGE durch den Nachweis von spezifischen Antikörpern in
gesunden Personen.
Über die natürlichen Wirte der Krankheitserreger ist noch
wenig bekannt, da bisher Ehrlichien nur von kranken Wild- und Haustieren
isoliert worden sind.
Aufgrund genetischer Analysen der tierpathogenen Spezies E. equi
und E. phagocytophila sowie des HGE-Agens wurden diese 3
Arten wegen zu geringer Unterscheidungsmerkmale als Anaplasma
phagocytophila neu klassifiziert [14]. Weltweit kennt man derzeit
3 humanpathogene Arten: Anaplasma phagocytophila, Erreger
der humanen granulozytären Ehrlichiose (HGE), Ehrlichia
chaffeensis, Erreger der humanen monozytären Ehrlichiose
(HME) und Ehrlichia ewingii. Erkrankungen des Menschen durch
die beiden letztgenannten Arten
traten bisher nur in Nordamerika auf. Anaplasma phagocytophila
ist ein kleines (0,5-2 µm), pleomorphes, obligat intrazelluläres,
gramnegatives Bakterium. Es bildet in den Zielzellen, den neutrophilen
Granulozyten, in Einschlusskörpern intrazytoplasmatische Mikrokolonien
aus, so genannte Morulae, aus denen sie durch Zytolyse freigesetzt
werden und weitere neutrophile Granulozyten befallen können.
A. phagocytophila befällt also die neutrophilen Granulozyten,
die primären Effektorzellen der antibakteriellen Abwehr und
verfügt über Mechanismen gegen die intrazelluläre
Abtötung. Einerseits unterbleibt die Verschmelzung von Morulae
mit Lysosomen, andererseits wird der so genannte „respiratory
burst“ gehemmt, die NADPH-abhängige Sauerstoffradikalbildung,
welche eine Voraussetzung für die intrazelluläre Abtötung
von Mikroorganismen ist. Die Hemmung des „respiratory burst“
durch A. phagocytophila wird durch „down-regulation“
eines Schlüsselproteins (gp91phox) im NADPH-Oxidase-Komplex
bewerkstelligt, was, wie in Experimenten gezeigt werden konnte,
die Sauerstoffradikalbildung in neutrophilen Granulozyten deutlich
herabsetzt. Die Folge ist eine Schwächung der unspezifischen
zellulären Abwehr [15].
Klinische Symptome beginnen relativ kurz nach Zecken-Exposition.
Die Anamnese ergibt, dass der Patient etwa 1 Woche zuvor eine Zecke
aus der Haut entfernt hat, oder dass er bei Freizeitaktivitäten
oder beruflich Zecken-exponiert war.
Die Erkrankung beginnt akut mit unspezifischen „Grippe-ähnlichen“
Symptomen (Leitsymptomen) wie hohes Fieber (> 39°C), Schüttelfrost,
allgemeines Krankheitsgefühl, Kopf- und Muskelschmerzen und
zusätzlichen Beschwerden wie Schwindelgefühl, Erbrechen,
Gelenksschmerzen, trockener Reizhusten. Im Rahmen der physikalischen
Untersuchung finden sich meist keine Auffälligkeiten. Die Erkrankung
dauert gewöhnlich nur einige Tage, allerdings wurden auch Verläufe
von mehr als 2 Monaten beschrieben. Nach Beginn einer geeigneten
antibiotischen Therapie entfiebern die Patienten typischerweise
prompt. Etwa 50% der Patienten werden wegen der klinischen Situation
hospitalisiert. Die Erkrankung scheint bei älteren Patienten
und solchen mit Abwehrschwäche einen schwereren Verlauf zu
nehmen [16].
Bisher sind aus den USA und Europa über 600 HGE-Fälle
beschrieben worden. Der erste durch positive Blutkultur gesicherte
Fall von HGE stammt aus Slowenien [17]. Von Kindern liegen bisher
nur einige Berichte über Krankheitsfälle vor, jedoch fand
man bei gesunden Kindern in Slowenien IgG-Antikörper gegen
A. phagocytophila in 15% [18]. In Gebieten Europas mit dichter
Zeckenbesiedelung (Südwestdeutschland, Schweiz, Norwegen, Spanien,
Slowenien etc.) wurden bei klinisch Gesunden ebenfalls Seroprävalenzen
um 15% nachgewiesen, die belegen, dass Anaplasma-Infektionen vorkommen,
aber selten zur Erkrankung führen. Die meisten Erkrankungen
treten zur Zeit der höchsten Aktivität der Zecken-Nymphen
im Frühsommer auf (Mai, Juni, Juli) und etwas seltener im Herbst,
wenn die adulten weiblichen Zecken aktiver sind.
Die Diagnose erfolgt sowohl durch hämatologische als auch durch
mikrobiologische Untersuchungen. Veränderungen im Blutbild
sind Thrombozytopenie, Leukozytopenie, Erhöhung von Transaminasen
und C-reaktivem Protein. Die spezifische Diagnose wird nach den
in Tabelle 1 angegebenen Kriterien gestellt. Für die mikrobiologische
Diagnose werden benötigt: EDTA-Blut für Nukleinsäure-Amplifikationstests
und für den Ausstrich zum Nachweis der Morulae in neutrophilen
Granulozyten, Serum (Nativblut) für den Nachweis spezifischer
Antikörper.
Differentialdiagnostisch
ist die HGE vor allem gegenüber Virusinfektionen, in erster
Linie gegenüber der Früh-Sommer-Meningo-Enzephalitis (FSME)
abzugrenzen. FSME-Patienten haben ähnliche Laborbefunde, nämlich
häufig Thrombozytopenie, Leukopenie und gelegentlich Transaminasen-Erhöhung.
Aber im Unterschied zur HGE findet sich fast immer Meningismus [19,
Rakar et al. 2002]. Die Behandlung erfolgt
bei Kindern und Erwachsenen mit Doxycyclin (4 mg/kg/Tag auf 2 Dosen
für 7 Tage bzw. 200 mg/Tag) für 7 Tage.
Reservoire von A.
phagocytophila
Die neu aufgetauchte, von Zecken übertragene („emerging
tick-borne disease“) HGE ist selbstverständlich weder
in der Erreger-Ökologie noch in ihrem epidemiologischen Hintergrund
vollständig aufgeklärt. Durch die erstmalige Isolierung
von A. phagocytophila aus dem Blut eines Patienten in Slowenien
[17] gelang in Europa ein Durchbruch zu humanen Stämmen, die
denen aus dem Tierreich gegenübergestellt werden können.
Da Ixodes ricinus als der Vektor von A. phagocytophila
in Europa identifiziert worden ist, stellt sich die Frage, welche
Rolle die bedeutenden Blutwirte dieser Zecken, nämlich Reh-
und Rotwild, im Infektionszyklus der Anaplasmen spielen. In einer
prospektiven Studie wurden Blutproben und Gewebeteile dieser Wildtiere
serologisch und molekularbiologisch untersucht. Es stellte sich
heraus, dass Reh- und Rotwild nach den Ergebnissen der serologischen
und molekularbiologischen Untersuchungen in einem sehr hohen Prozentsatz
(über 80%) mit A. phagocytophila infiziert sind. Die
Vergleiche von spezifischen Genomsequenzen zeigten allerdings keine
Übereinstimmung mit den vom Menschen isolierten Anaplasmen
(Petrovec et al. 2002).
Prävalenz von
Antikörpern gegen A. phagocytophila
Slowenien weist in Europa die höchste Inzidenz an FSME und
Lyme-Borreliose auf. Da in Slowenien – so wie in anderen Teilen
Europas auch – jedes Jahr in den Sommermonaten zahlreiche Personen
nach einem Zeckenstich mit hohem Fieber erkranken, das aber nicht
durch FSME-Viren oder Borrelien verursacht ist, wurde die mikrobiologische
Diagnostik auf andere durch Zecken übertragbare Infektionskrankheiten
einschließlich HGE ausgedehnt. Während eines Zeitraumes
von fünf Jahren (1996-2000) wurden Seren von 846 Patienten
getestet und 94 (11%) positiv befunden. Nach den Kriterien der Consensus
Approach for Ehrlichiosis (CAFE) Society waren 17 dieser Fälle
gesichert, 64 wahrscheinlich und die verbleibenden 13 mögliche
Infektionen mit A. phagocytophila (Avsic-Zupanc T., Vortrag
beim „Symposium on Tick-Transmitted Diseases“, Ljubljana,
September 2001). Aufgrund der hohen Prävalenz gehören
Verfahren zum serologischen sowie direkten (NAT) Nachweis von A.
phagocytophila-Infektionen zum Routineprogramm von mikrobiologisch-immunologischen
Referenzlaboratorien.
Eine seroepidemiologische Untersuchung unter Jägern in Südost-Österreich,
also einer kontinuierlich Zecken-exponierten Personengruppe, zeigte
eine sehr hohe Prävalenz von Antikörpern gegen B. burgdorferi
sensu lato (42%) und gegen A. phagocytophila (15%) (Stünzner
D., Präsentation beim „Symposium on Tick-Transmitted Diseases“,
Ljubljana, September 2001). Ergebnisse ähnlicher Untersuchungen
liegen aus Bayern vor. Beruflich Zecken-exponierte Personen wiesen
Antikörper gegen A. phagocytophila in 14% auf, während
die Prävalenz bei der durchschnittlichen gesunden Bevölkerung
nur bei 1,9% liegt (Fingerle et al., Präsentation beim „Symposium
on Tick-Transmitted Diseases“, Ljubljana, September 2001).
Eine noch höhere Prävalenz von Antikörpern gegen
A. phagocytophila zeigt sich bei einer Untersuchung von Patienten
mit Dermatoborreliose in der Steiermark. 19% der Patienten mit klinisch
diagnostiziertem Erythema migrans oder mit Acrodermatitis chronica
atrophicans waren seropositiv (Müllegger et al., Präsentation
beim „Symposium on Tick-Transmitted Diseases“, Ljubljana,
September 2001). Ähnlich sind die Ergebnisse einer Studie aus
Tirol, wo bei Personen mit Antikörpern gegen B. burgdorferi
sensu lato in 18% Antikörper gegen A. phagocytophila gefunden
wurden und nur in 8,7% bei Blutspendern (Walder et al., Präsentation
beim „Symposium on Tick-Transmitted Diseases“, Ljubljana,
September 2001).
Die Prävalenz von
Antikörpern gegen A. phagocytophila bei Kindern (USA:
< 1 bis 19 Jahre) war Gegenstand der Untersuchung in einem Endemiegebiet
der Lyme-Borreliose und HGE im Nordosten der USA. Bei einer durchschnittlichen
Seroprävalenz von 5,3% wurde der
höchste Anteil positiver Ergebnisse in der Altersgruppe von
5 bis 9 Jahren gefunden. Da HGE im Gegensatz zu Lyme-Borreliose
bei Kindern in den USA nur selten als akute Erkrankung diagnostiziert
wird, bleiben Bedeutung und Ursache der Seroprävalenz bei Kin-dern
zunächst unklar (Wormser G.P., Vortrag beim „Symposium
on Tick-Transmitted Diseases“, Ljubljana, September 2001).
Ein ungewöhnlicher Fall einer HGE bei einem Jugendlichen wurde
in Wien beobachtet. Der Patient kam mit Bauchschmerzen und Fieber
zur Aufnahme und zeigte in der computergesteuerten Abdominal-Tomographie
einen Leberabszess. Antikörper-Titer gegen A. phagocytophila
zeigten einen signifikanten Anstieg im Vergleich der Serum-Proben
aus der akuten und aus der rekonvaleszenten Krankheitsphase. Der
Patient wurde mit Doxycyclin behandelt und war nach 1 1/2 Monaten
vollständig genesen (Kager et al., Präsentation beim „Symposium
on Tick-Transmitted Diseases“, Ljubljana, September 2001).
|
TIBOLA (tick-borne
lymphadenopathy)
Seit 1996 durchgeführte
Beobachtungen aus Ungarn führten zur Beschreibung eines neuen
Syndroms. Es wurden Daten von Patienten gesammelt, die nach einem
Zeckenstich mit bislang nicht beobachteten Erscheinungen in das
„Centre for Tick-borne Diseases“ in Budapest kamen. Die
Krankheitserscheinungen bestanden in vergrößerten regionalen
Lymphknoten und/oder vesikulären ulzerativen Hautveränderungen
an der Zeckenstichstelle. Für den Antikörpernachweis und
für molekularbiologische Untersuchungen wurden Serumproben
und Feinnadelbiopsien genommen. Als Überträger wurde die
Schildzecke Dermacentor marginatus identifiziert. Der Zeckenstich
war bei 96% der Patienten auf der behaarten Kopfhaut lokalsiert.
Die Zeit vom Zeckenstich bis zum Ausbruch der Symptome betrug im
Mittel 9 Tage (von 1 bis 55 Tagen). Eine charakteristische Lokalreaktion
(Eschar) fand sich bei 82%. Der Eschar war bei 21% der Patienten
von einem Erythema umgeben. Das andere Leitsymptom bestand in vergrößerten
und manchmal schmerzhaften Lymphknoten im Bereich des Zeckenstichs,
überwiegend im Hinterkopfbereich oder hinter dem Musculus sternocleidomastoideus.
Allgemeinsymptome waren geringgradig erhöhte Körpertemperatur,
Müdigkeit, Benommenheit, Kopfschmerzen, Schwitzen, Myalgien,
Arthralgien und Appetitverlust. Ohne Behandlung bestanden die Symptome
bis zu 18 Monate. Die demographische Auswertung ergab, dass Kinder
ganz überwiegend von diesem Syndrom betroffen sind (mittleres
Alter: 13 Jahre, Altersbereich: 2 bis 57 Jahre; über 60% weniger
als 10 Jahre alt) und weibliche Patienten häufiger als männliche.
Die Behandlung mit Doxycyclin verkürzte die Krankheitsdauer
der offenbar gewöhnlich gutartig verlaufenden Erkrankung signifikant.
Mittels molekularbiologischer Untersuchungen der Lymphknoten-Biopsien
wurde in 77% Rickettsia slovaca nachgewiesen (Lakos 2002).
|
Tularämie (Infektionen
durch Francisella tularensis)
Zu beiden Seiten der
March ist die Landschaft mit zahlreichen Tierarten und einer gewaltigen
Zahl von Zecken besiedelt. Die österreichisch-slowakische Grenzlandschaft
ist auch ein Endemiegebiet der Tularämie. In verschiedenen
Kleinsäugerarten wurden Mischinfektionen mit verschiedenen
Borrelienarten und mit Francisella tularensis nachgewiesen.
Während Borrelien durchgehend von Mai bis Jänner in Reservoirtieren
nachgewiesen werden konnten, gelang dies für Francisella
tularensis nur von August bis Dezember (Vyrostekova, 2002).
|
Babesiose
Die Erkenntnis, dass
Zecken als Überträger von Krankheitserregern fungieren,
geht auf wirtschaftliche Probleme zurück. Was geschah da? Im
Jahr 1868 wurden mehr als 70.000 Rinder („Texas Longhorns“)
von Texas nach Kansas getrieben und von dort mit der Eisenbahn in
den Mittelwesten und den Osten Nordamerikas verfrachtet. Einen Monat
nach ihrer Ankunft begannen die bodenständigen Nordrinder an
einer mysteriösen Krankheit zu sterben, die als „Texas
fever“ bezeichnet wurde. Viele Herden gingen verloren und andere
wurden stark dezimiert. Die Ursache dieser Erkrankung blieb lange
unbekannt. In den Jahren 1889 bis 1893 gelang es Theobald Smith,
in einem eleganten Experiment zu zeigen, dass die Erkrankung von
den gesunden Rindern aus dem Süden auf die Rinder im Norden
übertragen worden war. Er konnte auch zeigen, dass die Erkrankung
von einem Protozoon, damals Pyrosoma bigeminum benannt, verursacht
wird. Heute nennen wir die Erreger des „Texas fever“ Babesia
bigemina und Babesia bovis.
Was ging da damals vor?
Die einzigen Schildzecken, die in Nordamerika das „Texas fever“
übertragen, sind Boophilus annulatus und Boophilus
microplus. Diese einwirtigen Zecken vollziehen gewöhnlich
ihren gesamten Entwicklungszyklus auf ein und demselben Rind. Die
vollgesogene weibliche Zecke fällt zur Eiablage zu Boden. Der
Krankheitserreger Babesia bigemina wird transovariell übertragen.
Die aus den Eiern schlüpfenden Larven sind bereits mit Babesien
infiziert und übertragen die Babesien auf das nächste
Rind, das sie für die Blutmahlzeit befallen.
Theobald Smiths origineller Beitrag war, dass er erstmals zeigte,
dass Zecken Krankheitserreger übertragen. Er schuf dadurch
die Grundlage für weitere Studien über den Zusammenhang
zwischen infizierten tierischen Wirten und Zecken als Überträger
(Assadian 2002).
Babesiose der Tiere wird durch die Schildzecken-Gattungen Boophilus,
Dermacentor und Rhipicephalus übertragen. Eine
Übertragung auf den Menschen kann durch Ixodes-Arten erfolgen.
Der erste Fall einer von Zecken übertragenen Babesiose wurde
in Strmec nahe Zagreb beobachtet und 1957 von Skarbalo und Deanovic
beschrieben. Allerdings scheint die menschliche Babesiose in Europa
eine Rarität zu sein. Von Ixodes ricinus wird Babesia
divergens gewöhnlich auf Rinder übertragen, die am
so genannten Weiderot (Hämoglobinurie) erkranken. Unbehandelt
verläuft diese Weidekrankheit tödlich. Tödliche Verläufe
von menschlicher Babesiose durch Babesia microti wurden aus
dem Osten der USA berichtet.
|
Literatur:
| 1. Randolph
S.E., Gern L., Nuttall P.A.: „Co-feeding ticks: epidemiological
significance for tick-borne pathogen transmission.“ Parasitology
Today 12 (1996) 472-479. |
| 2. Gern
L., Humair P.F.: „Natural history of Borrelia burgdorferi
sensu lato.“ Wien. Klin. Wochenschr. 110 (1998) 856-858. |
| 3. Asbrink
E., Hovmark A.: „Early and late cutaneous manifestations
in Ixodes-borne borreliosis (erythema migrans borreliosis, Lyme
borreliosis).“ Ann. New York Acad. Scie. 539 (1988) 4-15. |
| 4. Kristoferitsch
W., Sluga E., Graf M., Partsch H., Neumann R., Stanek G., Budka
H.: „Neuropathy associated with acrodermatitis chronica
atrophicans: clinical and morphological findings.“ Ann.
New York Acad. Scie. 539 (1988) 35-45. |
| 5. Aberer
E., Stanek G.: „Histological evidence for spirochetal origin
of morphea and lichen sclerosus et atrophicans.“ Am. J.
Dermatopathol. 9 (1987) 374-379. |
| 6. Weide
B., Schittek B., Klyscz T., Schuz K., Stark M., Rassner G.,
Wilske B., Garbe C.: „Morphea is neither associated with
features of Borrelia burgdorferi-infection, nor is this
agent detectable in lesional skin by polymerase chain reaction.“
Br. J. Dermatol. 143 (2000) 780-785. |
| 7. Breier
F.H., Aberer E., Stanek G., Khanakah G., Schlick A., Tappeiner
G.: „Isolation of Borrelia afzelii from circumscribed
scleroderma.“ Br. J. Dermatol. 140 (1999) 925-930. |
| 8. Breier
F., Khanakah G., Stanek G., Kunz G., Aberer E., Schmidt B.,
Tappeiner G.: „Isolation and polymerase chain reaction
typing of Borrelia afzelii from a skin lesion in a seronegative
patient with generalized ulcerating bullous lichen sclerosus
et atrophicus.“ Br. J. Dermatol. Feb. 144 (2) (2001) 387-392. |
| 9. Wilske
B., Zöller L., Brade V., Eiffert H., Göbel U.B., Stanek
G.: „MiQ 12/2000 Qualitätsstandards in der mikrobiologisch
infektiologischen Diagnostik.“ Urban & Fischer, München-Jena
(2000) 59 Seiten. |
| 10. Nadelman
R.B., Nowakowski J., Fish D., Falco R.C., Freeman K., McKenna
D., Welch P., Marcus R., Aguero-Rosenfeld M.E., Dennis D.T.,
Wormser G.P., Tick Bite Study Group: „Prophylaxis with
single-dose doxycycline for the prevention of Lyme disease after
an Ixodes scapularis tick-bite.“ N. Engl. J. Med.
345 (2001) 79-84. |
| 11. Kaiser
R., Kern A., Kampa D., Neumann-Haefelin D.: „Prevalence
of antibodies to Borrelia burgdorferi and tick-borne
encephalitis virus in an endemic region in southern Germany.“
Zentralbl. Bakteriol. 286 (1997) 534-541. |
| 12. McDade
J.E.: „Ehrlichiosis – a disease of animals and humans.“
J. Infect. Dis. 161 (1990) 609-617. |
| 13. Dumler
J.S., Bakken J.S.: „Ehrlichial diseases of humans: emerging
tick-borne infections.“ Clin. Infect. Dis. 20 (1995) 1.102-1.110. |
| 14. Dumler
J.S., Barbet A.F., Bekker C.P., Dasch G.A., Palmer G.G.H., Ray
S.C., Rikihisa Y., Rurangirwa F.R.: „Reorganization of
genera in the families Rickettsiaceae and Anaplasmataceae
in the order Rickettsiales: unification of some species of Ehrlichia
with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with Neorickettsia,
descriptions of six new species combinations and designation
of Ehrlichia equi and „HGE agent“ as subjective synonyms
of Ehrlichia phagocytophila.“ Int. J. Syst. Evol.
Microbiol. 51 (2001) 2.145-2.165. |
| 15. Kager
L., Kastner U., Gadner H., Stanek G.: „Humane granulozytäre
Ehrlichiose. Eine neue durch Zecken übertragene Infektionskrankheit.“
Pädiatrische praxis 61 (2002) 455-461. |
| 16. Paddock
C.D., Suchard D.P., Grumbach K.L., Hadley W.K., Kerschmann R.L.,
Abbey N.W., Dawson J.E., Anderson B.E., Sims K.G., Dumler J.S.
et al.: „Fatal seronegative ehrlichiosis in a patient with
HIV infection.“ N. Engl. J. Med. 329 (1993) 1.164-1.167. |
| 17. Petrovec
M., Lotric-Furlan S., Zupanc T.A., Strle F., Brouqui P., Roux
V., Dumler J.S.: „Human disease in Europe caused by a granulocytic
Ehrlichia species.“ J. Clin. Microbiol. 35 (1997) 1.556-1.559. |
| 18. Cizman
M., Avsic-Zupanc T., Petrovec M., Ruzic-Sabljic E., Pokorn M.:
„Seroprevalence of ehrlichiosis, Lyme borreliosis and tick-borne
encephalitis infections in children and young adults in Slovenia.“
Wien. Klin. Wochenschr. 112 (2000) 842-845. |
| 19. Lotric-Furlan
S., Avsic-Zupanc T., Petrovec M., Nicholson W.L., Sumner J.W.,
Childs J.E., Strle F.: „Human granulocytic ehrlichiosis
in Europe: Clinical and laboratory findings in four patients
from Slovenia.“ Clin. Infect. Dis. 27 (1998) 424-428. |
|
Anschrift
des Verfassers:
Univ.-Prof. Dr. Gerold Stanek
Klinisches Institut für Hygiene und Medizinische Mikrobiologie
der Universität Wien
1095 Wien, Kinderspitalgasse 15
E-Mail:
gerold.stanek@univie.ac.at |
|
Lyme-Borreliose
Krankheitserreger
Borrelien, Bakterien
aus der Familie Spirochäten
B. burgdorferi sensu lato (s.l.), 10 Arten (sog. Genospezies),
3 Borrelien-Arten gelten derzeit als human pathogen: B. afzelii,
B. burgdorferi sensu stricto (s.s.) und B. garinii
Endemiegebiete
Nördliche Hemisphäre
(Nord-, Zentral- und Ost-Europa, Russland, China, Japan, Nordamerika)
Geographische Verteilung der Borrelien-Arten
Europa: B. afzelii,
B. garinii, B. burgdorferi s.s.,
Asien: B. afzelii, B. garinii
USA: B. burgdorferi s.s.
Übertragung
Durch Stich (umgangssprachlich
fälschlich Zeckenbiss) von Schildzecken der Gattung Ixodes:
I. ricinus
(Europa)
I. persulcatus (europäisches Russland und
Asien)
I. scapularis (USA Ost und Zentralnord)
I. pacificus (USA West)
In den Endemiegebieten
sind 2 bis 50% der Zecken infiziert.
Klinik
Inkubationszeit
3-40 Tage (frühe lokale Infektion), 4 bis 16 Wochen (frühe
disseminierte Infektion)
Nur etwa 60% der Patienten erinnern sich an den Zeckenstich.
Verlauf
~ 20% inapparent
Lokalinfektion: Erythema (chronicum) migrans (bei ca. 60%
einzige Manifestation), Borrelien-Lymphozytom (seltene Manifestation),
unspezifische Allgemeinsymptome (seltene Begleiterscheinung)
Systemische Infektion (ca 20%): Neuroborreliose (Radikuloneuritis,
Meningoradikulitis, Hirnnerven- paresen, Meningitis, Meningoenzephalitis,
Radikulomyelitis, Enzephalitis, Enzephalomyelitis), Arthritis
(intermittierend), Myositis, Karditis, Ophthalmitis (selten),
Hepatitis (sehr selten)
Chronische Erkrankung
chronische Arthritis, Acrodermatitis chronica atrophicans, chronische
Neuroborreliose (sehr selten; Meningoenzephalitis, Radikulomyelitis,
Enzephalitis, Enzephalomyelitis)
Kriterien für
die Diagnose (Tabelle 3)
Behandlung (Tabelle
4)
|
Tabelle
3: Kriterien für die Diagnose
|
Kriterien
für die Diagnose
|
|
Erkrankung
|
Serologie |
PCR,
Kultur
(positiv=beweisend)
|
|
| Erythema
migrans (EM) |
Nicht
obligat
Null- Wert (Ergebnis ohne diagnostische Bedeutung),
2. Blutprobe 6-8 Wochen später
(Serokonversion oder Titerbewegung bedeutet bloß
Bestätigung der klinischen Diagnose, keine
weitere Konsequenz)
|
Hautbiopsie,
PCR, Kultur |
|
| Borrelien-Lymphozytom |
Obligat
2 Proben wie oben
|
Hautbiopsie,
PCR, Kultur
und Histologie |
|
Acrodermatitis chronica
atrophicans (ACA) |
Obligat
spezifische IgG-Antikörper
(meist in hoher Konzentration) |
Hautbiopsie,
PCR, Kultur
und Histologie |
|
|
Frühe
Neuroborreliose
(Meningopolyradikuloneuritis,
Hirnnervenparesen u.a.)
|
Obligat
Liquor und Serum
zur Ermittlung intrathekal
gebildeter IgG-Antikörper |
Liquor-PCR,
-Kultur positiv
am
Krankheitsbeginn, ohne
ausgeprägte Pleozytose
(Lymphozyten, Plasmazellen)
|
|
Chronische
Neuroborreliose
(sehr selten) |
Obligat
Liquor und Serum
zur Ermittlung intrathekal
gebildeter IgG-Antikörper |
|
|
| Lyme-Karditis |
Obligat
IgG-Antikörper |
|
|
| Lyme-Arthritis |
Obligat
spezifische IgG-Antikörper in
hoher Konzentration |
PCR
von Synoviabiopsie
oder Synovialpunktat |
|
| Ophthalmoborreliose |
Obligat
spezifische IgG-Antikörper |
PCR,
Kultur
je nach Klinik
|
|
|
|
Tabelle
4: Behandlung
|
Behandlung
|
| Antibiotikum |
Gabe |
Dosierung
(Kinder) |
Dauer |
Spezielle
Kontraindikation |
|
|
ERYTHEMA
MIGRANS & BORRELIEN-LYMPHOZYTOM
|
|
Penicillin
V
Phenoxymethyl-
Penicillin
|
oral |
3
x 1-1,5 Mio
(0,1-0,15 Mio/kg) |
14
Tage
(10-21 Tage) |
|
|
Azithromycin |
oral |
2
x 500 mg
(20 mg/kg)
1 x 500 mg
(10 mg/kg)
|
1. Tag
nächste
4 Tage
|
|
|
Doxycyclin |
oral |
2
x 100 mg |
14
Tage
(10 -21 Tage) |
NICHT
für Kinder,
Schwangere,
Stillende |
|
Amoxicillin |
oral |
3
x 500-1000 mg
(20-50 mg/kg) |
14
Tage
(10-21 Tage) |
|
|
|
NEUROBORRELIOSE
|
| Certriaxon |
iv |
2
g
(50-100
mg/kg) |
14
Tage
(10-30 Tage) |
|
|
Penicillin G |
iv |
20
Mio
(0,25-0,5
Mio/kg) |
14 Tage
(10-30 Tage) |
|
|
Doxycyclin* |
oral |
2
x 100 mg |
21 Tage
(14-30 Tage) |
NICHT
für Kinder,
Schwangere, Stillende |
|
Amoxicillin** |
oral |
3
x 500-1000 mg
(20-50 mg/kg) |
21
Tage
(14-30 Tage) |
|
|
Ausnahmefälle:
|
* Penicillinallergie (Doxycyclin),
*/** Isolierte Fazialisparese und negativer Liquorbefund
(keine Pleozytose,
keine intrathekalen Antikörper) |
|
|
ARTHRITIS
(intermittierend, chronisch), selbes Schema bei
KARDIOBORRELIOSE
|
| Doxycyclin |
oral |
2
x 100 mg |
21 Tage
(14-30 Tage) |
NICHT
für Kinder,
Schwangere, Stillende |
|
Amoxicillin |
oral |
3
x 500-1000 mg
(20-50 mg/kg) |
21
Tage
(14-30 Tage) |
|
|
|
ACRODERMATITIS CHRONICA ATROPHICANS
|
| Certriaxon |
iv |
2
g (50-100 mg/kg) |
21
Tage
(14-30 Tage) |
|
|
Doxycyclin |
oral |
2
x 100 mg |
21
Tage
(14-30 Tage) |
NICHT
für Kinder,
Schwangere, Stillende |
|
Amoxicillin |
oral |
3
x 500-1000 mg
(20-50 mg/kg) |
21
Tage
(14-0 Tage) |
|
|
|
Bemerkungen zur Laboratoriums-Diagnostik
der Lyme-Borreliose
SEROLOGIE
„Zwei-Test-Verfahren“
ist Standard
Zahlreiche kommerziell erhältliche Produkte stehen zur Verfügung.
Damit erzielte Ergebnisse müssen nicht notwendigerweise übereinstimmen,
weder quantitativ noch qualitativ! Das heißt, Ergebnisse
aus verschiedenen Laboratorien dürfen nicht miteinander verglichen
werden.
Regel: Korrekt kann eine Änderung der Antikörperkonzentration
in Körperflüssigkeiten (Blut-, Liquorproben) nur erfasst
werden, wenn die zu verschiedenen Zeitpunkten gewonnenen Proben
mit demselben Testsystem gleichzeitig untersucht werden (selbe
Methode und Fehlerbreite unter denselben Bedingungen).
Erster Test
ELISA IgG und IgM, mit Ganzzell- oder rekombinanten Antigenen
oder Flagellin oder
Immunfluoreszenz-Test mit Ganzzellantigen(en)
Zweiter Test
Immunoblot (Westernblot) IgG und IgM mit Ganzzell- oder rekombinanten
Antigenen
Dieser Test zeigt, mit welchen Antigenen von elektrophoretisch
aufgetrennten Borrelienproteinen die im Serum (Plasma) oder Liquor
enthaltenen Antikörper reagieren. Aufgrund des Reaktions-
musters lässt sich entscheiden, ob der erste Test ein unspezifisch
positives Ergebnis angezeigt hat.
KULTUR = Anzüchten
von Borrelien
Anzüchten von Borrelien aus Hautbiopsie, Liquor cerebrospinalis,
Blut, Muskel- und Herzmuskelbiopsie, Gelenkspunktat und Synovia-Biopsien
Material vor Beginn der Antibiotikabehandlung gewinnen!
Zuvor Rücksprache mit Referenz-Laboratorium
Anzüchtung und Identifizierung von Borrelien im Referenz-Laboratorium
NUKLEINSÄURE-AMPLIFIKATIONSTECHNIKEN
(NAT)
Borrelien-Nukleinsäure kann auch nach Beginn der Behandlung
mit Antibiotika aus Untersuchungs- material nachgewiesen werden.
Geeignetes Untersuchungsmaterial: Hautbiopsie, Gelenkspunktat,
Synovia-Biopsien. NATs mit Liquor und Blut sowie Muskel- und Herzbiopsien
sind nur bei be- stimmten Fragestellungen angezeigt.
Durchführung von Borrelien-NATs nur im Referenz-Laboratorium
Interpretation serologischer
Ergebnisse durch den behandelnden Arzt
- Grundsätze
für die Interpretation von „Borrelien-Serum-Antikörpern“
!! Nie ohne Kenntnis des Patienten und seiner Erkrankung !!
!! Positive Borrelien-Serologie allein keine Indikation für
antibiotische Behandlung !!
Im Unterschied zur Virologie können serologische Ergebnisse
der Bakteriologie nicht unmittelbar als Indikatoren gesicherter
Infektion bezeichnet werden.
- Beispiele für
Serum-Antikörper-Konstellationen
IgM und IgG positiv:
Ohne Klinik keine Indikation für eine Behandlung ÆKontrolle
in 1-2 Monaten.
IgM und IgG negativ:
Häufiges Ergebnis bei Patienten mit Erythema migrans; Behandlung
notwendig, auch wenn keine humorale Immunreaktion auf die klinisch
eindeutige Infektion angezeigt wird.
Spätere Serumuntersuchungen können ebenfalls negativ
ausfallen oder positiv werden. Letzteres Ergebnis zeigt jedoch
keinen Therapieversager an (Klinik!).
IgM positiv, IgG negativ:
Ohne Klinik keine Behandlung; Kontrolle in 1-2 Monaten; gleich
bleibendes Ergebnis zeigt Problem der
IgM-Sensitivität des verwendeten Testsystems auf ÆReferenzlaboratorium.
IgM negativ, IgG positiv:
Ohne Klinik Anzeige einer früher durchgemachten Infektion,
ev. Teil-Immunität. Kontrolle in 2-4 Monaten
Prophylaxe
Chemoprophylaxe
= Gabe eines Antibiotikums nach Zeckenstich
wird NICHT empfohlen
Immunprophylaxe
Steht nicht zur Verfügung (in den USA wurde ein rekombinanter
OspA-Serotyp 1-Impfstoff Anfang 2002
vom Markt zurückgezogen)
Ehrlichiose
(Humane Granulozytäre Ehrlichiose = HGE)
Erreger
Anaplasma phagocytophila
(neu klassifiziert aus den früheren Arten Ehrlichia phagocytophila,
E. equi und dem HGE-Agens)
Endemiegebiete
Nordamerika, Europa,
Asien?
Übertragung
Zeckenstich (Ixodes-Zecken),
Durchseuchung noch nicht erfasst, Reservoire der humanpathogenen
Arten ebenfalls noch nicht ermittelt
Inkubationszeit
4-14 Tage
Klinik
Fieber, Krankheitsgefühl,
Muskelschmerzen, Kopfschmerzen. Blutbild: progressive Leukozytopenie,
Thrombozytopenie und Anämie. Erhöhung der Serumtransaminasen
(GOT, GPT) und LDH
Komplikationen in ca. 15%: Akutes Nierenversagen, disseminierte
intravasale Gerinnung, Kardiomegalie, Krampfanfälle, Koma.
Letalitat zwischen 2 und 5%
Prophylaxe
Spezifische Prophylaxe
ist nicht zur Verfügung
Diagnostische Methoden
Serologie, Antikörpernachweis
mittels Immunfluoreszenztest, Nukleinsäureamplifikationstests,
Nachweis von spezifischen Nukleinsäureabschnitten aus peripherem
Blut (EDTA-Blut einsenden)
Therapie
Mittel der Wahl: Doxycyclin
Früh-Sommer-Meningo-Enzephalitis
(FSME)
Erreger
Flavivirus (+RNA)
Endemiegebiete
Zentral- und Ost-Europa,
südliches Skandinavien, Russland, China
Übertragung
a) Zeckenstich, zwischen
0,1-10% der Zecken sind in Endemiegebieten infiziert
b) Ziegenmilch (nicht pasteurisiert) - selten
Inkubationszeit
4-14 Tage
Klinik
Erkrankung: meist biphasischer
Verlauf
Etwa 70% inapparent oder nur milde erste Phase
1. Phase: grippeartige
fieberhafte Erkrankung, in den meisten Fällen gefolgt von
einem
symptomfreien Intervall ( ca. 1 Woche )
2. Phase: etwa 30% (Meningitis 45%, Meningoenzephalitis 50%,
Enzephalomyeloradikulitis 5%);
ca. 10% neurologische Dauerkomplikationen
0,5-2% Letalität
(in Ostländern bis 20%)
Behandlung: symptomatisch
Prophylaxe
Aktive Immunisierung
Impfung mit inaktiviertem FSME-Ganzvirus-Impfstoff (Baxter, Behring)
Kinder 0,25 ml FSME Vakzine i.m.
Erwachsene 0,5 ml FSME Vakzine i.m.
Vollimmunisierung 0-1-12 Monate, Auffrischungs-Impfung alle 3
Jahre
Serokonversionsrate 98- 99%
Schutzrate > 98%
Passive Immunisierung
Wird wegen der geringen oder fraglichen Schutzwirkung und der
möglichen Kommplikationen bei
verspäteter Gabe heute äußerst zurückhaltend
gehandhabt.
Wenn überhaupt, dann nur 48 Stunden nach Zeckenstich und
nur für Personen über 14 Jahre.
Da etwa nur die Hälfte aller Zeckenstiche bemerkt wird, nimmt
man von der passiven Immunisierung
in Endemiegebieten und bei dauernd exponierten Personen überhaupt
Abstand.
Diagnostische Methoden
Serologie
IgG ELISA *, IgM ELISA (µl-capture ),
Hämagglutinationshemmtest* , Neutralisationstest
* Achtung: Kreuzreaktion mit Antikörpern durch andere Flavivirus-Infektionen
und/oder Impfungen (Gelbfieber, Japan B)
Virusnachweis
Virusnachweis nur vor Serokonversion und in Post-mortem-Material
erfolgreich
Diagnose
Akute Infektion
Anamnese: Zeckenstich oder Aufenthalt in Endemiegebiet
Serologie: Spezifische IgM + IgG praktisch immer nach Beginn der
2. Phase nachzuweisen;
im Liquor sind IgG + IgM-Antikörper nicht immer nachzuweisen
Serum-Antikörper-Konstellationen
IgM und IgG positiv:
Gesicherte Infektion außer kurz nach einer 1. oder
2. FSME-Impfung
IgM und IgG negativ:
Kontrolle anfordern
IgM positiv, IgG negativ:
Verdacht auf FSME, Kontrolle
IgM negativ, IgG positiv:
Immunität außer bestehende Flavivirus-Antikörper
(Durchbruch, kreuzreaktive
Antikörper, passive Immunisierung), IgM-Kontrolle in 10
Tagen
Immunität
IgG ELISA
ACHTUNG, kreuzreagierende Antikörper;
Neutralisationstest zur Ermittlung der spezifischen Immunität
Literatur
Holzmann Heidemarie:
"Früh-Sommer-Meningo-Enzephalitis." In: Kollaritsch
H., Wiedermann G.,
Leitfaden für Schutzimpfungen. Springer Verlag Wien New York
(2001) 143-151.
|
Zeckenentfernung
Am einfachsten wird
eine Zecke mit einer geeigneten Pinzette aus der Haut gezogen.
Dabei soll die Zecke so nah an der Haut wie möglich gefasst
und ohne zu reißen herausgezogen werden. Die Einstichstelle
sollte idealerweise danach mit sterilem Alkohol betupft werden.
An schwer zugänglichen oder sehr empfindlichen Hautbereichen
haftende Zecken (zum Beispiel Genitalbereich, Gehörgang, Augenlider
oder Bindehaut) sollen durch den Arzt/Facharzt, manchmal sogar
unter mikroskopischer Hilfe, entfernt werden (siehe Abbildung
1).
Aufbringen von Öl,
Cremen, azetonhältigen Substanzen wie Nagellack/Klebstoff auf
anhaftende Zecken oder Quetschen und Herausdrehen der Zecken erhöht
das Infektionsrisiko nicht [Kahl 1998], Allerdings ist das Abbrennen
von Zecken streng abzulehnen; daraus können schwere Verletzungen
resultieren.
|
| Literatur:
Kahl O., Janetzki-Mittmann
C., Gray J.S., Jonas R., Stein J., de Boer R.: "Risk of infection
with Borrelia burgdorferi sensu lato for a host in relation
to the duration of nymphal Ixodes ricinus feeding and the
method of tick removal." Zentralbl. Bakteriol. 287 (1998) 41-52.
|
zurück
zum Inhalt
|







