| Enterohämorrhagische Escherichia coli und hämolytisch-urämisches Syndrom |
| H. Fischer 1, H.M. Verwyen
2, L.B. Zimmerhackl 2, P. König 3, P.A. Kyrle 4, Katharina Grif 5, R. Allerberger 5 1 Universitätsklinik für Kinder- und Jugendheilkunde, Innsbruck |
| Schlüsselwörter Zusammenfassung Key-words Summary Einleitung Epidemiologie Diagnostik Therapie Prävention Literatur |
| Schlüsselwörter: enterohämorrhagische E. coli, EHEC, hämolytisch-urämisches Syndrom, HUS, Shiga-Toxin |
| Zusammenfassung Enterohämorrhagische Escherichia coli (EBEC) sind in Österreich die dritthäufigsten bakteriellen Durchfallerreger. Als postinfektiöse lebensbedrohliche Komplikation kommt es bei 5-10% der Erkrankten zu dem Vollbild des hämolytisch-urämischen Syndroms (BUS). Für Österreich errechnet sich aus den kulturell oder serologisch verifizierten BUS-Fällen des Jahres 1998 eine Inzidenz von 0,65 EBEC-assoziierten BUS-Fällen per 100.000 Kindern im Alter von 0-14 Jahren (8x O157, 1 x O26). Es dominieren die EBEC-Serotypen O157:H7 und O157:H-. Da außer der Produktion von Shiga-Toxinen keine verläßlichen phänotypischen Marker für EBEC bekannt sind, die eine Isolierung der verschiedenen EBEC-Serovare aus der Stuhlflora ermöglichen, sollte die diagnostische Strategie auf den Nachweis der Shiga-Toxine oder der Shiga-Toxingene ausgerichtet sein und unbedingt die Erregerisolierung anstreben. Serologisch kann der Nachweis vonAntikörpern gegen Lipopolysaccharide von E. coli O157 diagnostisch genutzt werden. Eine kausale Therapie steht für EHEC-Infektionen bislang nicht zur Verfügung. Im Vordergrund stehen eine symptomatische Behandlung der Diarrhoe und gegebenenfalls der akuten Niereninsuffizienz sowie prophylaktische Maßnahmen. |
| Key-words: enterohemorrhagic E. coli, EHEC, hemolytic uremic syndrome, HUS, Shiga toxin |
| Summary Enterohemorrhagic Esherichia coli (EHEC) have been indentified as a worldwide cause of serious human gastrointestinal disease and the life-threatening hemolytic uremic syndrome (HUS). The most common serotype implicated is E. coli O157:H7, but infections involving various non-O157 serotypes have been found with increasing frequency in many countries. At the end of 1998 the cumulative number of culture confirmed EHEC O157 infections totaled 69, including 9 (14%) cases with HUS. A lethal course was observed in 1997 in Salzburg (10 year old boy). Kidney transplantation was performed on a 3 year old girl suffering from an EHEC O26:H- infection in the Tyrol in 1998. The incidence of HUS (due to EHEC as confirmed by culture or serology) in 1998 was 0.65 HUS-cases per 100,000 children of age 0-14 years (8x O157, 1x O26) and 0.04 HUS-cases per 100,000 in the age group 15-59 years (2x O157). Typing results show a wide distribution of strains, which argues against any epidemic in the classical sense. The elimination of EHEC O157 from cattle is considered impractical, therefore preventive measures must be taken to reduce the risk of infection. Public health authorities are focusing attention on decreasing faecal contamination of beef cattle before and at slaugther. In addition, the risk of cross contamination from raw meats to cooked foods must be minimised. Safety for the consumer (especially for preschool aged children) lies in following well known rules of good hygiene:
|
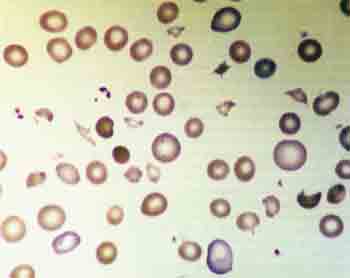
Einleitung Escherichia coli-Stämme, die unter Bildung von Shiga-Toxinen eine hämorrhagische Kolitis und/oder ein hämolytisch-urämisches Syndrom (HUS) verursachen können, werden auch als enterohämorrhagische E. coli (EHEC) bezeichnet. Die Shiga-Toxine wurden auch als Shiga-Iike Toxine (SLT) oder Verotoxine (VT) bezeichnet. Sie werden heute aufgrund ihrer Verwandtschaft zum Shiga-Toxin von Shigella dysenteriae Typ 1 als Shiga-Toxin 1 und Shiga-Toxin 2 bezeichnet. Bei der Mehrzahl der klinischen Isolate sind außer den Shiga-Toxinen noch andere Pathogenitätsfaktoren nachweisbar. Im Jahre 1982 wurde die humanpathogene Bedeutung von enterohämorrhagischen E. coli O157 (O als Abkürzung für "Ohne Hauch", da die Lipopolysaccarid-Oberflächenantigene initial bei nicht-schwärmenden Stämmen von Proteus sp. beschrieben wurden) im Rahmen des epidemischen Auftretens von hämorrhagischen Kolitiden nach Genuß ungenügend erhitzter "Hamburger" erstmalig in den USA erkannt. Dieser Erreger wurde bei Rindern vor 1982 nur in einem einzigen Fall dokumentiert [1]. Mittels immunomagnetischer Anreicherungstechniken lassen sich heute EHEC O157 als Bestandteil der Fäkalflora bei circa 8% der Rinder nachweisen [2]. Aus einem im Jahr 1955 erstmals beschriebenen Syndrom, dem HUS, wurde mittlerweile ein relevantes Public Health Problem (Abb. 1,2,3).
|
| Krankheitsbild Die meisten Darmerkrankungen durch EHEC bei Kindern unterscheiden sich in ihrem Verlauf nicht von anderen bakteriellen oder viralen Ursachen. In einer prospektiven Studie konnten wir zeigen, daß das durchschnittliche Alter der Kinder mit EHEC-Infektionen mit 27,6 Monaten deutlich unter dem der Kinder mit Salmonelleninfektionen (38,8 Monate) lag [3]. EHEC erwiesen sich nach Salmonella enteritidis und Campylobacter jejuni als dritthäufigste bakterielle Enteritiserreger [3]. Nur bei etwa der Hälfte der Fälle traten neben dem Durchfall auch Fieber und Erbrechen auf [3]. Der zunächst wäßrige Durchfall geht bei 15-20% der Erkrankten in eine profuse hämorrhagische Diarrhoe über. Blutige Durchfälle sind ein Hinweis für eine besonders schwere Infektion, die einen Risikofaktor für das Auftreten eines HUS darstellt. So haben 70% der HUS-Patienten vorher blutige Durchfälle.
Die glomeruläre Nierenschädigung führt oft zur Einschränkung der Nierenfunktion, mit oder ohne Anurie, sowie zu Elektrolytentgleisungen und Überwässerung. Häufige extrarenare Komplikationen sind zerebrale Krampfanfälle, Koma und Hirnödem. Auch eine Invagination mit mechanischem Ileus, akutes Lungenversagen, eine Pankreatitis mit Bildung eines Insulin-abhängigen Diabetes mellitus, oder eine Schädigung des Myokard wurden beschrieben [4]. Diese Komplikationen können in bis zu 10% der Fälle zum Tode im akuten Stadium führen. Der bislang einzige amtlich gemeldete Todesfall durch EHEC in Österreich betraf 1997 einen 10jährigen Salzburger (mögliche Infektionsquelle: unbekannt). Auch nach Überstehen der akuten Symptomatik, oft unter Intensivtherapie mit Hämodialyse, können schwere bleibende Schäden auftreten, wie eine arterielle Hypertonie oder eine chronische Niereninsuffizienz, die eine ambulante Hämodialyse/Peritonealdialyse bzw. eine Nierentransplantation notwendig machen kann [5,6,7,8,9, 10, 11, 12, 13, 14]. Ein 3jähriges Tiroler Mädchen mit HUS nach E. coli O26:H-Infektion im Juli 1998 erhielt nach 5monatigem stationären Krankenhausaufenthalt die erste EHEC-assoziierte Nierentransplantation Österreichs (wahrscheinliche Infektionsquelle: Konsum unpasteurisierter Kuhmilch). |
| Epidemiologie Mit Jahresende 1998 wurden bislang 69 humane EHEC-O157-lnfektionen kulturell nachgewiesen, davon 9 (14 %) mit HUS (Abb. 5).
Der Anstieg der Diagnosen von EHEC-Infektionen spiegelt zum Teil nur die gestiegenen labordiag nostischen Bemühungen wider. HUS-Surveillance eignet sich wesentlich besser zur Beurteilung der Häufigkeit dieser neuen Infektionskrankheit. In Österreich wurde 1994 ein auf freiwilliger Mitarbeit von Internisten und Pädiatern basierendes Surveillancesystem etabliert [15]. Aus den kulturell oder serologisch verifizierten EHEC-assoziierten HUS-Fällen des Jahres 1998 errechnet sich eine Inzidenz von 0,65 HUS-Fällen per 100.000 Kindern im Alter von 0-14 Jahren (8x O157, 1x O26) und von 0,04 HUS-Fällen per 100.000 Einwohnern im Alter von 15-59 Jahren (2x O157); in der Altersgruppe > 60 Jahre fand sich in Österreich im Jahr 1998 kein kulturell/serologisch verfizierter HUS-Fall (Tab. 1 ). Für das Nord/Süd-Gefälle der Häufigkeit von HUS in Europa gibt es bislang keine Erklärung (Tab. 2).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostik Verbindliche Untersuchungsverfahren für Laboruntersuchungen auf EHEC- Infektionen liegen bisher nicht vor. Grundsätzlich wird der kulturelle Nachweis von EHEC erschwert durch die biochemische Ähnlichkeit dieser Erreger mit den Kommensalen der Darmflora und durch die relativ geringe Anzahl im Vergleich zur physiologischen Flora, die auch bei EHEC-Patienten kaum unterdrückt ist. Nicht selten findet sich nur ein EHEC auf 200-300 E. coli der physiologischen Flora. Erschwerend kommt die große Anzahl an E. coli-Serovaren, die zur Shiga-Toxin-Bildung befähigt sind (bisher 160 beim Menschen), hinzu. Daher sollte die diagnostische Strategie auf den Nachweis der Toxine und/oder der Toxingene ausgerichtet sein. Zudem sollte die Erregerisolierung und Subdifferenzierung angestrebt werden, damit epidemiologische Zusammenhänge aufgedeckt werden können. HUS-Patienten bilden regelmäßig Antikörper gegen das Zellwandantigen Lipopolysaccharid (LPS), die im indirekten Hämagglutinationstest oder im Immunoblot nachgewiesen werden können. Diese Tests stehen kommerziell noch nicht zur Verfügung und sind deshalb Speziallaboratorien vorbehalten. |
| Therapie Die bakterielle Ursache der EHEC-Enterokolitis als zugrundeliegender Faktor eines EHEC-assoziierten HUS legt den frühzeitigen Einsatz von Antibiotika nahe. Jedoch zeigten Untersuchungen an hospitalisierten Patienten eher einen ungünstigen Effekt, wenn Antibiotika in der frühen Phase einer E. coli O157-assoziierten Enterokolitis eingesetzt wurden (erhöhte Inzidenz und Letalität von HUS) [16]. Wenn auch in manchen Studien kein negativer Einfluß einer antibiotischen Therapie auf die Progression der EHEC-Enterokolitis zu HUS beobachtet wurde, sind positive Auswirkungen einer antibiotischen Therapie selten beschrieben. Die Interpretation solcher Studienergebnisse ist schwierig, da sie retrospektiv erhoben, die Patientenkollektive heterogen und die eingesetzten antibiotischen Regimes vielfältig sind. Zudem ist denkbar, daß eher Patienten mit schweren Krankheitsverläufen einer antibiotischen Therapie zugeführt werden. Die einzige vorliegende prospektive Studie an 47 Kindern mit kulturell nachgewiesener E. coli O157-Enteritis zeigte keinen positiven Effekt einer Antibiotikatherapie auf den klinischen Verlauf [17]. Die ungünstige Antibiotikawirkung kommt möglicherweise durch verstärkte Freisetzung von Shiga-Toxinen durch Bakterienlyse zustande. Außerdem können subinhibitorische Konzentrationen diverser Antibiotika die Produktion von Stx in vitra beeinflussen [18]. Generell sind Antibiotika in der Therapie von EHEC-Erkrankungen oder EHEC-assoziiertem HUS nach dem jetzigen wissenschaftlichen Stand nicht indiziert. Mögliche zukünftige Therapiestrategien zielen auf die rasche Inaktivierung freien Shiga-Toxins noch im Gastrointestinaltrakt, bevor die systemische Toxizitätswirkung an den Endothelzellen eintreten kann. Ein Kanditat für eine solche Therapie ist an Kieselerde gebundener synthetischer Shiga-Toxin Pk-Trisaccharid-Rezeptor (Synsorb-PK), der spezifisch an Stx 1 und in geringerem Maße an Stx 2 bindet. In einer kanadischen plazebokontrollierten Doppelblind-Phase-1-Studie an gesunden Probanden wurde oral verabreichtes Synsorb-PK gut vertragen. Stuhlproben der Probanden am 3. bzw. 9. Tag nach oraler Einnahme zeigten eine 99% Neutralisationskapazität gegen Stx1. Der Zusatz des Präparates zum Stuhl von Kindern mit unkomplizierter EHEC-Enterokolitis bewirkte eine 30%-100%-Bindung von Stx [19]. Ob therapeutisch ausreichende Synsorb-Pk-Spiegel im Stuhl auch bei Durchfall erreicht werden können und somit die Möglichkeit einer effektiven Toxinabsorption bei enterohämorrhagischer Kolitis und HUS besteht, gilt es in weiteren Studien zu untersuchen. Ein ähnlicher experimenteller Therapieansatz zur Toxinelimination ist die Gabe von bovinem Kolostrum. Lactoglobin ist ein standardisiertes Immunglobulinpräparat, das aus Kolostren nicht-immunisierter Kühe hergestellt wird. Es enthielt in einer Untersuchung von Lissner et al. ausreichend hohe Titer von spezifischen Antikörpern gegen EHEC-Bestandteile, um den zytotoxischen Effekt sowohl von Stx 1 als auch von Stx 2 auf Verozellen sowie den zytolytischen Effekt von EHEC-Härnolysin auf Erythrozyten zu hemmen [20]. Aufgrund dieser breiten Wirkung auf die wichtigsten Virulenzfaktoren von EHEC O157 erhoffen die Autoren in der frühzeitigen klinischen Anwendung eine günstige Beeinflussung des Verlaufs von EHEC-Infektionen sowie die Verhinderung der Progression zum HUS. Bei manifestem HUS haben verschiedenste Therapieversuche mit dem Ziel der Wiederherstellung der Balance zwischen Endothelzelle und Gerinnungssystem sich als nicht effizient erwiesen. Der in Einzelberichten dargestellte günstige Effekt von Antikoagulantien (Heparin) und Thrombozytenaggregationshemmern (Dipyridamol) war in kontrollierten Studien nicht nachzuvollziehen. Über Acetylsalicylsäure liegen nur anekdotische Berichte vor. Fibrinolytika (Streptokinase, Urokinase) waren entweder wirkungslos oder mit Blutungskomplikationen verbunden. Prostazyklininfusionen haben sich ebenfalls als nicht-effektiv erwiesen [21]. Kontrovers beurteilt wird auch die Gabe von Frischplasmainfusionen. Diese zeigten in mehreren kontrollierten Studien keinen günstigen Effekt. Günstige Verläufe hingegen wurden von einer belgischen Arbeitsgruppe in einer nicht-kontrollierten Studie nach Einsatz von Frischplasma bei 33 Kindern mit HUS berichtet [22]. Unterschiedlich eingesetzt wird heute die frühzeitige Plasmapherese. Sie wird bei Erwachsenen im Akutstadium des komplizierten HUS und der thrombotisch thrombozytopenischen Purpura verwendet. Rationell begründbar ist der Einsatz beim Fehlen von Von Willebrand Factor-Cleaving Protease [23]. Bei einer pädiatrischen Patientenpopulation wies Fitzpatrick eine Senkung der Letalität durch Plasmapherese beim atypischen HUS nach [24] .Ergebnisse kontrollierter Studien wurden bislang jedoch nicht publiziert. Wenig überzeugend waren Therapieversuche mit intravenösen Immunglobulininfusionen. Auch die Hoffnungen auf einen therapeutischen Effekt von Vitamin E beim HUS durch seine antioxidierende und thrombozytenaggregationshemmende Wirkung wurden nicht erfüllt. Wichtig ist die frühzeitige Erkennung eines beginnenden HUS. In der ersten Woche nach Beginn einer dokumentierten EHEC-Infektion ist auf Zeichen wie Blässe und Oligurie zu achten. Bei Kindern unter 5 Jahren und älteren Patienten besteht ein erhöhtes Risiko, ein HUS zu entwickeln, weswegen Blutbild- und Harnanalysen zu empfehlen sind. Die Supportivmaßnahmen eines HUS (Therapie von Störungen des Flüssigkeits- und Elektrolythaushaltes, Ernährung etc.) hängen ab vom Ausmaß der Nierenfunktionseinschränkung und vom Schweregrad der assoziierten Organmanifestationen. Bei Versagen dieser Maßnahmen ist der Einsatz einer Nierenersatztherapie erforderlich. Die Wahl des Dialyseverfahrens, Hämo- oder Peritonealdialyse, hat dabei keinen Einfluß auf den klinischen Verlauf. In der Pädiatrie wird die Peritonealdialyse aufgrund der einfacheren und bei Kleinkindern schonenderen Anwendbarkeit bevorzugt. Klinische Kriterien zum Dialysebeginn sind Anstieg des Harnstoffes über 150 mg/dl, Hyperkaliämie, Azidose und Überwässerung. Unspezifische medikamentöse Interventionen umfassen die Senkung erhöhter arterieller Blutdruckwerte und die Behandlung zerebraler Krampfanfälle. Letztere sind meist generalisiert und treten gehäuft bei Hyponatriämie, Überwässerung oder arterieller Hypertonie auf. Bei Patienten mit therapieresistenten Krampfanfällen oder einer Bewußtseinsstörung mit einem Glasgow Coma Scale < 8 ist die Intubation und maschinelle Beatmung indiziert. Erythrozytentransfusionen sind bei ausgeprägter Hämolyse und Abfall des Hämoglobins auf Werte von 50-70 g/l erforderlich. Die Behandlung einer Thrombopenie durch Thrombozytenkonzentrate birgt die Gefahr der Bildung weiterer intravasaler Mikrothromben; Thrombozytenkonzentrate sind daher nur bei klinisch manifester Blutung oder bei geplanten invasiven Maßnahmen (z.B. Anlage von Venenkathetern, Peritonealkathetern) indiziert. Der Einsatz von Darmmotilitätshemmern kann schwere Verläufe an EHEC-Infektionen und die Entwicklung eines HUS begünstigen und ist daher kontraindiziert. Mangels einer verfügbaren etablierten Kausaltherapie steht heute die rasche Diagnosestellung sowie der frühzeitige Einsatz unspezifischer supportiver Maßnahmen im Mittelpunkt der medizinischen Versorgung eines HUS. Die Prognose des EHEC-assoziierten HUS ist günstiger als die der atypischen HUS-Formen. Die Spontanheilungsrate beträgt > 50%. In nur weniger als 5% der Fälle kommt es zur Ausbildung eines chronischen, dialysepflichtigen Nierenversagens. Ziel der zur Verfügung stehenden symptomatischen Maßnahmen ist daher, die Phase bis zur Spontanheilung zu überbrücken sowie Komplikationen zu vermeiden oder zu vermindern. |
| Prävention Eine Sanierung der Viehbestände wird von der WHO einstweilen als nicht realisierbar angesehen [25, 26, 27]. Daher müssen derzeit Präventivmaßnahmen ausreichen, um diesen schweren Infektionen vorzubeugen. Die Santiätsbehörden richten ihr Hauptaugenmerk auf die Verringerung der fäkalen Kontamination von Rinderfleisch (Abb. 6).
Für den Verbraucher (insbesondere für Kinder im Vorschulalter!) gelten unverändert jahrzehntealte Hygieneregeln: rohe Milch vor Verzehr abkochen, Rinderhackfleisch vor Verzehr gut durchbraten, und - wegen der Gefahr von Schmierinfektionen - Händewaschen nach Toilettenbesuch und vor dem Essen sowie Kontakte von Kindern mit Durchfall zu gesunden Kindern vermeiden. Die Bedeutung der Etablierung und Betreibung eines HUS-Surveillance-Systems liegt in der frühen Erkennung etwaiger Ausbrüche als Voraussetzung für gezielte interventionsepidemiologische Maßnahmen zur Unterbrechung der Infektketten. Der Beitrag des einzelnen Arztes bei der jährlichen HUS-Fragebögen-Aktion ist der wesentliche Baustein für dieses präventivmedizinische Sicherheitsnetz. |
|||||||||||||||
| Literatur: 1. Oskov F., Orskov I., Villar J.A.: "Cattle asa reservoir of verotoxin-producing Escherichia coli 0157:H7." Lancet ii: (1987) 276. 2. Chapman P.A., Wright D.J., Siddons C.A.: "A comparison of immunomagnetic separation and direct culture for the isolation of verocytotoxin-producing Escherichia coli 0157 from bovine faeces." J. Med. Microbiol. 40 (1994) 424-427. 3. Allerberger F., Rossboth D., Dierich M.P., et al.: "Prevalence and clinical manifestations of Shiga toxin-producing Escherichia coli infections in Austrian children." Eur. J. Clin. Microbiol. Infect. Dis. 15 (1996) 545-550. 4. Kaper B.J., O'Brien A.D.: "Escherichia coli 0157:H7 and Other Shiga Toxin-Producing E. coli Strains." ASM Press, Washington, D.C., 1998. 5. Siegier R.I., Pavia A. T., Christofferson R.D.: "A 20 year population-based study of post-diarrheal hemolytic uremic syndrome in Utah." Pediatrics 94 (1994) 35-40. 6. Keles A., Van Dyck M., Proesmanns W: "Childhood hemolytic uremic syndrome: long-term outcome and prognostic features." Eur. J. Pediatr. 153 (1994) 38-42. 7. Siegier R.L., Milligan M.K., Burningham T.H., Christofferson R.D., Chang S.Y., Jorde L.B.: "Long-term outcome and prognostic indicators in the hemolytic-uremic syndrome." J. Pediatr. 118 (1991) 195-200. 8. Tönshoff B., Sammet A., Sanden I., Mehls 0., Waldherr R., Schärer K.: "Outcome and prognostic determinants in the hemolytic uremic syndrome of children." Nephron. 68 (1994) 63-70. 9. Gianantonio C.A., Vitacco M., Mendilaharzu F., Gallo G .E., Sojo E. T. : " The hemolytic-uremic syndrome." Nephron. II (1973) 174-192. 10. Fitzpatrick M.M., Shah v:, Trompeter R.S., Dillon M.J., Barratt T.M.: "Long term renal outcome of childhood hemolytic uremic syndrome." Br. Med. J. 303 (1991) 489-492. 11. Gagnadoux M.F., Habib R., Gubler M.C., Bacri J.L., Broyer M.: "Long-term (15-25 years) outcome of childhood hemolytic-uremic syndrome." Clin. Nephrol. 46 (1996) 39-41. 12. De Jong M., Monnens L.: "Hemolytic-uremic syndrome: a 10 year follow-up study of73 patients." NDT 3 (1988) 379-382. 13. Van Dyck M., Proesmans WD., Depraetere M.: "Hemolytic uremic syndrome in childhood: renal function ten years later." Clin. Nephrol. 29 (1988) 109-112. 14. Trompeter R., Schwartz R., Chantier C., DilIon M., Haycook G., Kay R., Barratt T.: "HemoIytic-uremic syndrome: an analysis of prognostic features." Arch. Dis. Child. 58 (1983) 101-105. 15. Allerberger F., Sölder B., König P., Karch H.: "Hemolytic uremic syndrome surveillance to monitor trends in infection with Escherichia coli 0157 and non-0157 EHEC." Acta Clinica. Belgica. 54 (1999) 36. 16. Ryan C.A., Tauxe R.V:, Hisek G.: "Escherichia coli 0157:H7 diarrhea in a nursing horne: clinical, epidemiological, and pathological finding." J. Infect. Dis. 154 (1986) 631-638. 17. Arenson E.B., August C.S.: "Preliminary report: treatrnent of the hemolytic-uremic syndrome with aspirin and dipyridamole." J. Pediatr. 86 (1975) 957-961. 18. Grif K., Karch H., Dierich M.P., et al.: "Strain-specific differences in the amount of Shiga toxin released from enterohemorrhagic Escherichia coli 0157 following exposure to sub-inibitory concentrations of antimicrobial agents." Eur. J. Clin. Microbiol. Infect. Dis. 17 (1998) 761-766. 19. Armstrong G.D., Rowe P.C., Goodyer P., et al.: "A phase I study of chemically synthesized verotoxin (Shiga-Iike toxin) Pk-trisacchardie receptors attached to chromosorb for preventing hemolytic-uremic syndrome." J. Infect. Dis. 171 (1995) 1042-1054. 20. Lissner R., Schmidt H., Karch H.: "A standard immunoglobulin preparation produced from bovine colostra shows reactivity and neutralization activity against Shiga-Iike toxins and EHEC- hemolysin of Escherichia coli 0157:H7." Infection 24 (1996) 378-383. 21. Taylor C.M., Lote C.J.: "Prostacyclin in diarrhoe-associated hemolytic uremic syndrome." Peiatr. Nephrol. 7 (1993) 515-519. 22. Brichard B., Vermylen C., Herernans M. T., et al.: "Plasma infusions as treatment for 33 children with hemolytic uremic syndrome: a good therapy?" Acta Clin. Belg. 48 (1993) 156-163. 23. Furlan M., Robles R., Galbusera M., Remuzzi G., KyrIe P.A., Brenner B., Krause M., Scharrer I., Aumann V., Mittler U., Solenthaler M., Lammle B.: "Von Willebrand factor-cleaving protease in thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome." New Eng. J. Med. 339 (1998) 1578-1584. 24. Fitzpatrick M.M., Walters M.D.S., Trompeter R.S., et al.: "Atypical (non-diarrhea-associated) hemolytic-uremic syndrome in childhood." J. Pediatr. 122 (1993) 532-537. 25. Karch H., Bielaszewska M., Bitzan M., Schmidt H.: "Epidemiology and diagnosis of Shiga toxin-producing Escherichia coli infections." Diagn. Microbiol. Infect. Dis. 34 (1999) 229-43. 26. Health and Safety Executive. Avoiding ill health at open farms-advice to farmers (with teachers' supplement). London: HSE Agriculture Information Sheet, 23.03.1998. 27. Reilly A. : "Prevention and control of entero- hemorrhagic Escherichia coli (EHEC) infections: memorandum from a WHO meeting." Bull World Health Organ 76 (1998) 245-55. |
| Anschrift des Verfassers: Univ.-Prof. Dr. F. Allerberger Institut für Hygiene und Bundesstaatliche bakt.-serol. Untersuchungsanstalt Innsbruck A-6020 Innsbruck, Schöpfstraße 41 |