| Infektionen des oberen Respirationstraktes am Beispiel von Sinusitis, Otitis media, Tonsillitis |
|
J.P. Guggenbichler |
|
Bei Kindern sind in den ersten 5 Lebensjahren 6 bis 8 Infektionen der oberen Luftwege im Jahr nichts Ungewöhnliches, wobei die Majorität dieser Infektionen viraler Genese ist. Im Sommer gilt das für 95%, im Winter für über 80% der Infekte. Immerhin bei 20-35% der primär viralen Infektionen kommt es in der Folge zu einer Reihe von Störungen der funktionellen unspezifischen Abwehr, die den Weg für bakterielle Superinfektionen bereiten. Die bakterielle Superinfektion kann innerhalb weniger Stunden, aber auch erst Tage nach der Primärinfektion manifest werden. |
| Akute
Sinusitis
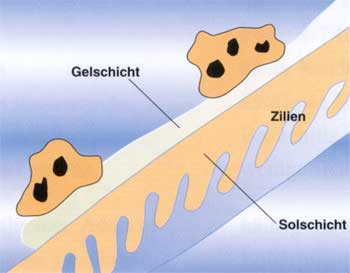
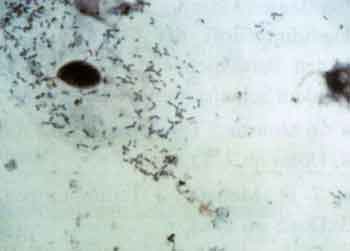
Physiologischerweise
ist jede zweite Epithelzelle der Nasenschleimhaut mit einem Keim
besiedelt. Im Rahmen einer Virusinfektion steigt die Keimbesiedelung
drastisch an – auf mehrere hundert Keime pro Epithelzelle (Abb.
2). Diese hohe Keimbelastung macht nun eine Besiedelung
Ein weiterer Faktor, der zu einer Progredienz des Geschehens beiträgt, ist die infektionsbedingte reaktive Schleimhautschwellung, die zu Abflussbehinderungen führen kann. Da ein Virus die von ihm besiedelte Epithelzelle nicht sofort abtötet – was seinen eigenen Untergang bedeuten würde – bleiben Viren in der Zelle über mehrere Tage lebensfähig. Als Reaktion darauf produziert der Körper proinflammatorische Zytokine, wie z.B. Leukotriene. Diese gefäßaktiven Substanzen führen zu einer Vasodilatation der zuführenden Arteriolen, zu einer Vasokonstriktion der abführenden Venolen und damit zur Ausbildung eines submukösen Ödems mit dem klinischen Bild der „zugeschwollenen“ Nase. Diese submuköse Schwellung verursacht in angrenzenden Strukturen funktionelle Störungen. So kann der Schleim aus der Kieferhöhle durch das zilientragende Respirationsepithel nicht mehr in die mittlere Nasenmuschel transportiert werden, da der Abflussweg durch die Mukosaschwellung blockiert ist. Dazu reicht bei kleinen Kindern eine beidseitige Schwellung der Schleimhaut von nur 1 mm aus. Im Rahmen der Virusinfektion fällt dann, wie bereits beschrieben, die Zilientätigkeit aus, der Schleim dickt ein, der Weg für die bakterielle Superinfektion ist geebnet. Als schwerwiegende Folge der Abflussbehinderung im Kieferbereich kann sich eine Orbitalphlegmone entwickeln. Dieses potenziell lebensbedrohliche septische Krankheitsbild ist gekennzeichnet durch entzündliche Schwellung der Lider und der Bindehaut, Rötung und Bewegungseinschränkung des Bulbus, hohes Fieber und einseitigen, pochenden Kopfschmerz. Durch ihr typisches klinisches Bild bereitet die Orbitalphlegmone diagnostisch kein Problem. Zu bedenken ist, dass bereits Säuglinge Sinusitiden entwickeln können – der jüngste Patient an unserer Klinik war erst 6 Monate alt. Erreger Antibiotikaauswahl Die Bedeutung einer ausreichenden Dosierung eines Beta-Laktam-Antibiotikums über einen genügend langen Zeitraum wird klar, wenn man sich den Wirkmechanismus dieser Antibiotikagruppe vor Augen führt. Im ersten Schritt verhindert jedes Beta-Laktam-Antibiotikum, dass sich der Keim an der dafür vorgesehenen Stelle teilt – der Keim wächst daraufhin in die Länge. Im nächsten Schritt entstehen durch Hemmung der Transpeptidase, welche die Zellwand des Keims „verschweißt“, Schwachstellen in der Zellwand. Wächst der Keim weiter in die Länge, platzt an dieser Stelle zunächst die Zellwand, in der Folge die Zellmembran, und der Zellinhalt läuft aus. Wird nicht ausreichend dosiert, dann kann sich im Rahmen dieses Vorganges ein Teil des Keimes ablösen und den Circulus vitiosus wieder in Gang setzen – der Keim entwickelt sich bei Gabe der nächsten Antibiotika-Dosis wieder zum Filament. Dadurch kann es lange dauern, bis alle Keime endgültig eliminiert sind. Es ist daher unbedingt nötig, mit dem eingesetzten Antibiotikum im Zielgewebe die minimale Hemmkonzentration (MHK) über einen ausreichend langen Zeitraum zu überschreiten. Gefordert ist, den MHK-Wert am Infektionsort für mindestens 50%, besser 90% der Zeit bis zur nächsten Dosis zu überschreiten. Aufgrund der besonders günstigen Pharmakodynamik von Cefpodoxim proxetil (Biocef®) ist es mit dieser Substanz möglich, bei Moraxella catarrhalis die MHK für 90% der Zeit, für Haemophilus influenzae, Streptococcus pyogenes und Pneumokokken für 100% der Zeit zu überschreiten. Die günstige Pharmakodynamik von Cefpodoxim proxetil erklärt, warum diese Substanz eine bessere klinische Wirksamkeit hat als z.B. Amoxicillin + Clavulansäure. Unterstützende
Therapie Was vielfach unterschätzt wird, ist die Bedeutung der Bettruhe für den Heilungsverlauf. Diese verkürzt die Krankheitsdauer deutlich. Der unterstützende Effekt von Bakterienlysaten wird derzeit intensiv beforscht. |
| Chronische
Sinusitis
Diagnostisch bereitet die chronische Sinusitis gerade bei Kindern oft ein Problem. Wie auch für rezidivierende Harnwegsinfekte gilt, dass sich die Klinik eines Rezidivs umso asymptomatischer präsentiert, je kürzer der zeitliche Abstand zur akuten Erkrankung ist. Neben Symptomen wie migräneartigem Kopfschmerz, subfebriler Temperatur, Gedeihstörungen, vermindertem Appetit, Konzentrationsstörungen können auch Bauchschmerzen auf eine chronische Sinusitis hinweisen. Bei monatelang anhaltender chronischer Sinusitis ist auch mit Wachstumsstörungen im Bereich des Mittelgesichtes zu rechnen. Daraus können sich orthodontische Probleme entwickeln, die mit einer schlechten Belüftung des Nasen-Rachenraumes einhergehen. Bei über Jahre rezidivierenden chronischen Sinusitiden bringen kieferorthopädische Maßnahmen gute Erfolge. Ursachen Therapie |
| Akute
Otitis media
Die Frage: „Antibiotika bei Otitis media?“ wird selbst in Fachkreisen diskutiert. Sie ist aber aufgrund der Pathogenese der Erkrankung eindeutig mit „Ja“ zu beantworten. Die Begründung liegt darin, dass bei schmerzhaften Zuständen im Bereich des Mittelohres ein Paukenhöhlenempyem oft nicht mit Sicherheit ausgeschlossen werden kann, daher ist bei dieser Symptomatik eine antibiotische Therapie bei Kindern bis zu 3 Jahren zu empfehlen. Schwillt im Rahmen eines viralen Infekts die Wand der Eustachischen Tube an, kommt es sehr rasch zu einem kompletten Verschluss des Lumens. Bereits die Resorption der Luft in der Paukenhöhle ist ein schmerzhafter Prozess, der aber oft durch die Gabe z.B. von abschwellenden Nasentropfen innerhalb von 24 Stunden beherrschbar ist. Kommt es aber zur Infektion des Sekretes in der Paukenhöhle, dann entwickelt sich ein Paukenhöhlenempyem, das bei Kindern bis zum Alter von 3 Jahren unbedingt antibiotisch behandelt werden muss. Bei älteren Kindern ist es vertretbar, bis zu 24-36 Stunden zuzuwarten, allerdings sind regelmäßige Kontrollen nötig. Erregerspektrum Therapie Die Therapie der akuten Otitis media besteht in der Gabe von Amoxicillin + Clavulansäure in der Dosierung von 60 mg/kg Körpergewicht in 2 oder 3 Dosen, wobei sich am ersten Tag das Therapieregime „Amoxicillin mit Zweitschlag“ besonders bewährt hat:
Mit diesem Therapieregime wird der MHK-Wert in der Paukenhöhle während der gesamten ersten 24 Stunden zu über 90% überschritten. Gerade zu Beginn der Therapie ist die ausreichende Dosierung von besonderer Bedeutung. Als Alternative eignet sich Cefpodoxim proxetil. Unter Cefpodoxim proxetil traten in 14% der Fälle rezidivierende Paukenhöhlenkatarrhe auf, im Gegensatz zu 28% unter Amoxicillin + Clavulansäure. Das dürfte auf die bessere Pharmakodynamik von Cefpodoxim proxetil zurückzuführen sein. Beim sog. „Zweitschlag“
lag die Rate an persistierenden Paukenhöhlenergüssen unter
Amoxicillin/Amoxicil-lin + Cavulansäure bei 8%. |
| Chronische
Otitis media
Ursache Eine weitere, erst seit kurzem bekannte Ursache könnte eine fehlende Mukosaimmunität sein. Seit ca. 2 Jahren weiß man, dass auch Epithelzellen bakterizide Substanzen i.e. antimikrobielle Peptide produzieren und damit Keime abtöten können. Pathogene Mikroorganismen tragen an ihrer Oberfläche Zuckerstrukturen, die von Epithelzellen erkannt werden. Docken diese Zuckermoleküle an der Oberfläche der Epithelzellen an, so sezernieren diese Epithelzellen das humane Defensin 1, ein Peptid mit 28 bis 41 Aminosäuren. Dieses arrangiert sich ringförmig in der Zellmembran des Keims, der Zellinhalt fließt durch die ringförmige Öffnung aus. Einigen wenigen Kindern fehlt dieser Abwehrmechanismus gänzlich, bei einer größeren Zahl tritt dieser Mechanismus mit Verzögerung und auch nicht bei allen pathogenen Keimen in Aktion. Es besteht die Vermutung, dass genau diese Kinder an bakteriellen Superinfektionen erkranken. Bekannt ist, dass dieser Mechanismus durch Bakterienlysate stimuliert werden kann, wodurch diese in das therapeutische Regime mit einbezogen werden können. Therapie |
| Tonsillitis
Die Tonsillitis kommt sowohl als selbständige Infektion wie auch als obligate (Grippe, Masern) oder als fakultative Mitreaktion vor. Klinisches
Bild Keime
Bei Kindern kaum, jedoch bei Jugendlichen und Erwachsenen kommen auch Corynebacterium hämolyticum, Gonokokken, Treponemen, Chlamydien bzw. verschiedene Mykoplasmaarten (hominis, genitalis) in Frage. Therapie Folgekrankheiten und Komplikationen können so wirkungsvoll verhindert werden, die pädiatrische Literatur weist auch auf eine rasche klinische Besserung unter effizienter antibiotischer Behandlung hin. Das Mittel der Wahl ist auch heute noch das Oralpenicillin. Eine gut wirksame Alternative ist ein Cephalosporin z.B. Cefpodoxim, Cefadroxil. Antimikrobielle
Wirksamkeit Keine
Resistenzinduktion der körpereigenen Flora Kosten Optimale Vorgehensweise: Die Entscheidung zur Gabe eines Antibiotikums, in erster Linie Penicillin, beruht auf dem Schnelltest und der Beachtung der Klinik der Streptokokkenangina. Wenn Zweifel: Abstrich zur Kultur und Beginn einer Behandlung mit Penicillin. Die Dosierung beträgt 100.000 iE, aufgeteilt auf 3 ev. 2 Dosen, Behandlungsdauer 10 Tage. Gut geeignet sind, insbesondere bei rezidivierenden bakteriellen Tonsillitiden, Cephalosporine. Bei Verabreichung von Makrolidantibiotika ist gegenwärtig eine Resistenzprüfung nötig. |
|
Anschrift
des Referenten: |