| A. Buxbaum
Univ.-Klinik für Innere Medizin IV, Abt. für Pulmologie,
AKH Wien
(Vorstand: Univ.-Prof. Dr. L.H. Block) |
|
Zusammenfassung
Teicoplanin
ist ein Glykopeptid-Antibiotikum mit einer Molekularstruktur
ähnlich dem Vancomycin. Gram-positive Bakterien wie Staphylokokken,
Streptokokken, Enterokokken und viele Gram-positive Anaerobier
sind empfindlich gegenüber Teicoplanin. Ein wichtiges Merkmal
ist die lange Halbwertszeit von Teicoplanin, die eine 1-mal
tägliche Gabe ermöglicht. Bei ambulanter Therapie
können mit drei Applikationen pro Woche hohe Erfolgsraten
erreicht werden. Um ein optimales Therapieergebnis zu erzielen,
empfiehlt es sich, mit einer Startdosis von 12-20 mg/kg zu beginnen.
Teicoplanin ist wirksam bei einer Vielzahl von Gram-positiven
Infektionen wie Sepsis, Endokarditis, Haut- und Weichteilinfektionen
und Katheter-assoziierten Infektionen. Die Substanz ist gleichermaßen
wirksam gegenüber Methicillin-empfindlichen wie Methicillin-resistenten
Staphylokokken. Nebenwirkungen bleiben zumeist beschränkt
auf lokale Effekte oder Hyperreagibilität. Trotz einer
gewissen potentiellen Oto- und Nephrotoxizität ist die
Inzidenz gering, wenn die empfohlenen Serumkonzentrationen eingehalten
werden. Die günstigen pharmakokinetischen Eigenschaften
und die niedrige Nebenwirkungsrate machen Teicoplanin zu einer
wertvollen Alternative in APAT (ambulant parenterale Antibiotia-Therapie).
|
Key-words:
Teicoplanin,
activity, pharmacokinetics, OPAT |
|
Summary
Teicoplanin
is a glycopeptide antibiotic with a molecular structure which
is related to that of vancomycin. Gram-positive bacteria such
as staphylococci, streptococci, enterococci and many anaerobic
Gram-positive bacteria are susceptible to teicoplanin. Teicoplanin
has an exceptionally long half-life, allowing once-daily administration.
In outpatient therapy high success rates can be achieved even
with 3 applications a week. In order to obtain an optimal therapy
result it is recommended to start with a loading dose of 12-20
mg/kg.
It is effective against a wide variety of Gram-positive infections
such as septicemia, endocarditis, skin and soft tissue infections
and infections associated with venous catheters. The drug is
equally efficacious against methicillin-resistant and methicillin-susceptible
staphylococci. Adverse effects with teicoplanin are generally
limited to local effects or hypersensitivity reactions. While
teicoplanin has the potential for ototoxicity and nephrotoxicity,
the incidence appears to be quite low when recommended serum
concentrations are maintained. Due to its favourable pharmacokinetic
properties and low rate of adverse events teicoplanin is a valuable
therapy op-tion in OPAT (outpatient parenteral antibiotic treatment).
|
Antibakterielle
Aktivität
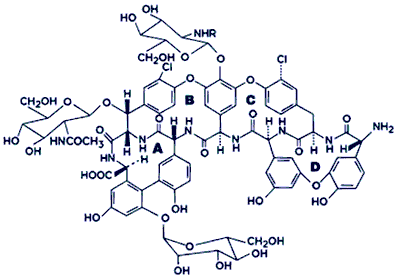
Teicoplanin (ursprünglich Teichomycin A2
genannt) wird vom Actinomyceten Actinoplanes teichomyceticus
erzeugt. Es ist ein Komplex aus 5 eng verbundenen Glykopeptid-Antibiotika
mit einer tetrazyklischen Molekularstruktur, ähnlich dem
Vancomycin (Abbildung 1).
Abbildung
1: Teicoplanin
|
Gram-positive
Bakterien, wie Staphylokokken (Staphylococcus aureus,
S. epidermidis, S. hominis), Streptokokken
(Streptococcus pyogenes, S. pneumoniae, S. bovis, Viridans-Gruppe
und Streptokokken der Gruppen B, C, F und G), Enterokokken und
viele Gram-positive Anaerobier (Clostridium difficile, C.
perfringens) und Listeria monocytogenes, sind
empfindlich gegenüber Teicoplanin in vitro (minimale
Hemmkonzentration 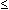 4 mg/l). ß-Laktamase-produzierende und/oder Methicillin-resistente
Staphylokokken sind zumeist ebenso empfindlich wie nichtresistente
Stämme [1-3]. Teicoplanin ist wesentlich wirksamer gegenüber
Enterokokken als Vancomycin, wobei jedoch Vancomycin-resistente
Enterokokken auch kreuzresistent gegenüber Teicoplanin
sein können.
4 mg/l). ß-Laktamase-produzierende und/oder Methicillin-resistente
Staphylokokken sind zumeist ebenso empfindlich wie nichtresistente
Stämme [1-3]. Teicoplanin ist wesentlich wirksamer gegenüber
Enterokokken als Vancomycin, wobei jedoch Vancomycin-resistente
Enterokokken auch kreuzresistent gegenüber Teicoplanin
sein können.
Teicoplanin ist nicht wirksam gegenüber Gram-negativen
Bakterien, da die großen polaren Teicoplanin-Moleküle
die äußere Lipidmembran des Gram-negativen Keimes
nicht durchdringen und somit auch nicht an das terminale Acyl-D-Alanyl-D-Alanin
der Zellwand binden können. Diese Inhibition der Peptidoglykan-Polymerisation
bei empfindlichen Keimen führt zur Schädigung der
Zellwand und zum Zelluntergang durch die Aktivität der
hydrolytischen Enzyme [4].
Generell wirkt Teicoplanin bakterizid gegenüber Gram-positiven
Bakterien. In-vitro-Ergebnisse hängen jedoch stark
von Testmedium und Testbedingungen ab, in höherem Ausmaß
als bei Vancomycin. Laboruntersuchungen lassen den Schluss zu,
dass Teicoplanin gegenüber Coagulase-negativen Staphylokokken
bakteriostatisch wirkt [5].
Synergismus-Studien haben gezeigt, dass die Kombination von
Teicoplanin mit Rifampicin additiv oder subadditiv wirkt, während
bei der Kombination mit Ampicillin Antagonismus vorliegt. Synergismus-Effekte
lassen sich mit Kombinationen aus Teicoplanin mit Aminoglykosiden,
Imipenem, Fosfomycin und anderen Antibiotika gegenüber
Enterokokken und Staphylokokken erzielen [6]. |
| Pharmakokinetische
Eigenschaften
Intravenöse Injektionen von 3 bzw. 6 mg/kg Teicoplanin
resultieren im Plasmaspitzenspiegel von 53,5 und 111,8 mg/l.
Die Plasmakonzentrationen sanken nach 24 Stunden auf ca. 4 mg/l
und waren nach 10 Tagen immer noch nachweisbar (0,4 mg/l). Die
Bioverfügbarkeit nach i.m. Injektion von 3 mg/kg beträgt
90% mit einem Plasmaspitzenspiegel von 7,1 mg/l nach 2 Stunden
und einem Talspiegel von 2,3 mg/l nach 24 Stunden. Nach Dosen
von 6 mg/kg/Tag wurde nach 1 Woche ein durchschnittlicher Spiegel
von 10 mg/l erreicht, nach Dosen von 12 mg/kg/Tag einer von
21 mg/dl [12]. Ähnliche Spiegel wie nach täglicher
Verabreichung von 400 mg/Tag können durch die Gabe von
15 mg/kg jeden 2. Tag erreicht werden [21]. Vorraussetzung ist
eine entsprechende Schnellaufsättigung über 2-4 Tage
[11, 13, 21, 22]. Es gibt keine relevante gastrointestinale
Resorption.
Die Plasmabindung von Teicoplanin liegt bei 90%. Nach einer
i.v. Bolusgabe von 400 mg liegt die Konzentration von Teicoplanin
in Gallenblasenwand, Galle, Tonsillen, Knorpel, Mucosa, Leber,
Pankreas und Knochen über der minimalen Hemmkonzentration
von empfindlichen Stämmen. Etwas niedrigere Konzentrationen
werden in Fett, Haut und CSF erreicht. Ebenfalls hoch sind die
Konzentrationen, die im Urin nach multipler Gabe von Teicoplanin
bestimmt werden konnten [7].
Teicoplanin wird nahezu vollständig über die Niere
ausgeschieden und unterliegt keinem nennenswerten Metabolismus
(< 3%). Die Eliminations-Halbzeit variiert je nach verwendetem
pharmakokinetischen Modell stark, ein Wert zwischen 70 und 100
Stunden nach Einmalgabe ist jedoch anzunehmen. Renale Clearance-Werte
für Teicoplanin entsprechen der Kreatinin-Clearance und
sind reduziert bei Patienten mit verminderter Nierenleistung
[8, 9]. Teicoplanin wird durch Hämodialyse aus dem Kreislauf
entfernt, abhängig vom Fluss und von der Art der verwendeten
Dialyse-Membran.
Die Teicoplanin-Pharmakokinetik bei älteren Patienten reflektiert
die erniedrigte Nierenleistung mit erniedrigter Clearance der
Substanz und verlängerter Eliminations-Halbzeit. Die Pharmakokinetik
von Kindern zwischen 2 und 12 Jahren entspricht den Werten der
Erwachsenengruppe, obwohl gelegentlich eine Erhöhung der
Gesamtclearance mit korrespondierender verkürzter Eliminationshalbzeit
registriert wurde [10]. |
| Klinischer
Einsatz
Die wichtigsten Indikationsgebiete von Teicoplanin sind Sepsis
durch Gram-positive Erreger, Endokarditis, Haut- und Weichteilinfektionen,
Knochen- und Gelenksinfektionen. Weiters kommt Teicoplanin in
der empirischen Therapie beim neutropenischen Patienten und
bei der Katheter-assoziierten Sepsis zum Einsatz. Teicoplanin
hat gegen Vancomycin eine Reihe von Vorteilen: die lange Halbwertszeit,
die geringere Nephrotoxizität und die fehlende Notwendigkeit
von Serumspiegelkontrollen. Es hat sich bewährt, die Behandlung
mit einer Startdosis (Gabe von 12-15 mg/kg täglich über
3-4 Tage) zu beginnen und im weiteren Therapieverlauf täglich
6 mg/kg zu verabreichen [13, 21]. Auf die initiale Ladungsdosis
und die niedrige Erhaltungsdosis wurde in letzter Zeit besonders
hingewiesen [13, 22]. Durch die günstigen pharmakokinetischen
Eigenschaften ist eine Gabe 1-mal täglich bzw. jeden 2.
Tag möglich. Aus diesem Grund ist Teicoplanin eine wertvolle
Substanz in der ambulanten Therapie.
Die gute klinische Wirkung bei ambulantem Einsatz konnte in
einer multizentrischen Studie an 342 Patienten (davon 220 voll
auswertbar) mit Osteomyelitis und septischer Arthritis bewiesen
werden. Die Behandlung erfolgte mit täglich 6-12 mg/kg
über 4-6 Wochen. Ein Teil der Patienten erhielt am Beginn
der Therapie dreimal eine Startdosis von 12 mg/kg im Abstand
von jeweils 12 Stunden. Die besten Ergebnisse wurden mit täglich
12 mg/kg erzielt (Tabelle 1). Bei akuter Osteomyelitis erwies
sich eine höhere Startdosis (12 mg/kg, 12-stündig)
als sinnvoll. Vor allem bei septischer Arthritis erscheinen
6 mg/kg als zu niedrige Dosis und sollten nicht routinemäßig
eingesetzt werden. Durch die höhere Dosierung konnte der
klinische Erfolg von 64,29% auf 93,94% gesteigert werden [12].
Tabelle
1: Klinischer Erfolg (Heilung/Besserung) durch
Teicoplanin
| Dosis |
Dosis
Akute
Osteomyelitis
n=90 |
Chronische
Osteomyelitis
n=79
|
Septische
Arthritis
n=51
|
|
| Täglich
6 mg/kg |
89,18% |
88% |
64,29%* |
84,21% |
Täglich
6 mg/kg
plus
3x Startdosis
12
mg/kg |
100% |
82,14% |
50% |
87,72% |
| Täglich
12 mg/kg |
82,19% |
96,15% |
93,94%* |
90,80% |
| *
p = 0,04 |
|
|
|
|
|
Auch bei Staphylokokken-Infektionen ist eine ambulante Behandlung
möglich. Um den Aufwand zu verringern, kann Teicoplanin
dreimal pro Woche verabreicht werden. Das zeigt eine Studie
an Patienten mit akuter Exazerbation einer chronischen Osteomyelitis
(n=44) bzw. Endokarditis (n=10). Bei den Erregern handelte es
sich um Staphylococcus aureus (n=41, davon 13 Methicillin-resistent)
und Coagulase-negative Staphylokokken (n=13, davon 1 Methicillin-resistent).
Nachdem über 3-10 Tage eine Startdosis von 15 mg/kg verabreicht
worden war, erhielten die Patienten dreimal wöchentlich
durchschnittlich 15 mg/kg. Die Dosierungen wurden individuell
modifiziert, um bei Osteomyelitis Serumkonzent-rationen von
etwa 10 mg/l und bei Endokarditis ca. 20 mg/l zu erreichen.
Teicoplanin wurde 28-150 Tage lang verabreicht (Osteomyelitis
Ø 62 Tage, Endokarditis Ø 49 Tage). 84% der Patienten
mit Osteomyelitis und 80% mit Endokarditis wurden erfolgreich
behandelt. Diese Studie beweist, dass eine erfolgreiche, ambulante
Behandlung mit dreimal wöchentlicher Applikation möglich
ist [13].
Dieses Ergebnis wird durch eine Studie an 37 Patienten mit akuter
Exazerbation einer chronischen Osteomyelitis bestätigt.
Mit einem ähnlichen Therapieregime (ambulante Applikation:
Montag-Mittwoch-Freitag) konnte bei 84% der Patienten ein klinischer
Erfolg erreicht werden [14]. Über eine 90%ige Heilungsrate
berichten auch die Autoren einer rezenten Pilotstudie an Patienten
mit akuter Osteomyelitis, verursacht durch Methicillin-resistente
Staphylokokken. In dieser Studie erhielten die Patienten als
Startdosis drei Tage lang zweimal täglich 400 mg Teicoplanin
i.v. Danach folgte eine mindestens vierwöchige ambulante
Therapie mit Montag und Mittwoch 1000 mg und Freitag 1200 mg
Teicoplanin [15].
Die Bedeutung einer ausreichenden Dosierung belegen auch kleinere
Studien. So konnte mit einer zu niedrigen Dosis von täglich
200-400 mg/kg nur bei 36,9% von 75 Patienten ein klinischer
Erfolg erreicht werden [16].
Einige Studien haben die Wirksamkeit von Teicoplanin im Vergleich
zu anderen antimikrobiellen Substanzen evaluiert. In einer frühen
Arbeit wurde Teicoplanin 400 mg (Tag 1), gefolgt von 200 mg
täglich mit Flucloxacillin 2 g alle 6 Stunden bei schweren
Staphylokokken-Infektionen (zumeist mit begleitender Sepsis)
verglichen. Hier zeigte sich, dass Teicoplanin in dieser niedrigen
Dosierung sehr niedrige Ansprechraten hat.
Bei einigen Studien an immunsupprimierten Patienten mit infiziertem
Hickman-Katheter und konkomitanter Sepsis konnte eine gute Aktivität
von Teicoplanin 400 mg täglich beobachtet werden. Hierbei
erbrachte Teicoplanin Ergebnisse, die mit Vancomycin 1 g zweimal
täglich, sowohl als Monotherapie als auch in Kombination
mit Gentamicin und Piperacillin, vergleichbar waren. Es zeigte
sich eine deutliche Überlegenheit von Teicoplanin über
Vancomycin bei Tunnelinfektionen.
Teicoplanin hat sich als wertvoller Bestandteil in der empirischen
Therapie beim febrilen, immunsupprimierten Patienten erwiesen.
Die Patientengruppe, die am meisten von der Antistaphylokokken-Wirksamkeit
des Teicoplanin profitiert, sind Patienten mit persistierender
Neutropenie [17, 18, 19]. Teicoplanin zeigt in dieser Patientengruppe
im Vergleich zu Vancomycin eine niedrigere Inzidenz von Pilz-Superinfektionen
und wurde auch besser toleriert. Ebenso erwies sich Teicoplanin
als wirksam bei der Behandlung von Patienten, die auf die initiale,
empirische Therapie mit Ceftazidim, alleine oder in Kombination
mit Amikacin, Piperacillin, oder einem ß-Laktam und Aminoglykosid,
nicht ansprachen [20].
Für eine erfolgreiche perioperative Prophylaxe in der Herzchirurgie
werden hohe Dosen benötigt. Auffallend ist das Auftreten
von Atemwegs- und Harnwegsinfektionen durch Gram-negative Erreger
[23]. Ein anderes Einsatzgebiet ist die Prophylaxe für
Risikopatienten (mit z.B. Herzklappenersatz) vor zahnärztlichen
Eingriffen.
Bei einer der für Teicoplanin wichtigsten Indikationen,
der Behandlung von Knochen- und Gelenksinfektionen, liegen zahlreiche
Studien vor.
In diesen Untersuchungen wurde eine Heilungsrate von 83 bis
100% bei Patienten mit akuter oder chronischer Osteomyelitis
und septischer Arthritis durch Gram-positive Keime, die mit
Teicoplanin (6 mg/kg 1-mal täglich) behandelt worden waren,
beobachtet. Im Follow-up dieser Studien zeigte sich bei 71 bis
90% dieser Patienten 6 Monate nach Behandlungsende ein kompletter
Rückgang der akuten oder chronischen Osteomyelitis [24,
25].
Weiters hat sich Teicoplanin als orale Gabe (100 bis 200 mg
täglich) als wirksam bei Clostridium-difficile-assoziierter
Kolitis erwiesen [26].
Auf Grund seiner hohen Wirksamkeit gegenüber einer Vielzahl
von Gram-positiven Keimen stellt Teicoplanin eine gute Möglichkeit
bei der ambulanten Behandlung von Patienten dar. Gute Erfolge
konnten hier bei Haut- und Weichteilgewebeinfektionen durch
S. aureus und bei akuter und chronischer Osteomyelitis
erreicht werden [27, 28].
Auch bei Haut- und Weichteilinfektionen ist eine ausreichende
Dosierung wichtig. In einer Studie an 418 Patienten wurden Cefazolin
(1,5-4 g/Tag) und Teicoplanin (3 mg/kg/Tag vs. 6 mg/kg/Tag)
verglichen. Die Applikation von Teicoplanin erfolgte intravenös
oder intramuskulär. Die besten Erfolge (100%) konnten durch
die intravenöse Verabreichung von Teicoplanin in hoher
Dosis erreicht werden. Die intramuskuläre Gabe von 6 mg/kg/Tag
ist möglich (Tabelle 1a) [28].
Tabelle
1a: Klinische und mikrobiologische Erfolgsraten
bei Patienten mit Haut- und Weichteilinfektionen
| |
Teicoplanin |
Teicoplanin |
Teicoplanin |
Teicoplanin |
Cefazolin |
| Tagesdosis |
3
mg/kg i.m. |
3
mg/kg i.v. |
6
mg/kg i.m. |
6
mg/kg i.v. |
1,5-4
g |
| Klinischer
Erfolg |
88% |
90% |
93,8% |
100% |
95,5%-97,4% |
| Elimination
der Erreger |
83,7% |
83,3% |
96,8% |
100% |
83,3%-85,9% |
|
|
|
Unerwünschte
Arzneimittelwirkungen
Seltene
Nebenwirkungen durch Teicoplanin sind Hypersensibilität
und lokale Irritationen an der Verabreichungsstelle. Diese Hypersensibilität
bleibt zumeist auf Hautreaktionen beschränkt, kann jedoch
gelegentlich auch Bronchospasmen und anaphylaktische Reaktionen
umfassen. Eine Kreuzreaktivität zwischen Vancomycin und
Teicoplanin bleibt fraglich.
Teicoplanin hat auch ein Potential für Oto- und Nephrotoxizität,
das jedoch insgesamt als gering einzustufen ist und deutlich
niedriger liegt als bei Vancomycin [7, 29].
Selten werden nicht spezifische Reaktionen wie Tremor, Tachykardie,
Kopfweh, Abgeschlagenheit oder Durchfall beobachtet. Weiters
können vorübergehende Erhöhungen der Leberenzyme
vorkommen (Tabelle 2 und 3). Selten kann eine reversible Thrombopenie
nach mehr als 4-wöchiger Therapie beobachtet werden.
Im Gegensatz zu Vancomycin kann Teicoplanin als Bolus oder Kurzinfusion
verabreicht werden.
Tabelle
2: Nebenwirkungen bei einer großen multizentrischen
Studie [30]
| Nebenwirkung |
Inzidenz |
| Intoleranz
an Injektionsstelle |
41
(2,8%) |
| Schmerz,
Rötung (i.m.) |
28
(2,0%) |
| Phlebitis
(i.v.) |
13
(0,9%) |
| Hypersensibilität |
72 (5,0%) |
| Hautreaktionen |
39
(2,4%) |
| Bronchospasmen |
3
(0,21%) |
| Anaphylaktoide
Reaktionen |
1
(0,07%) |
| Ototoxizität |
4
(0,28%) |
| Nephrotoxizität |
5
(0,35%) |
| Hämatologische
Abweichungen |
31
(2,2%) |
| Biochemische
Abweichungen |
67
(4,7%) |
| Unspezifische
Reaktionen |
73
(5,1%) |
|
Tabelle
3: Verträglichkeit von Teicoplanin in Vergleichsstudien
| |
Im
Vergleich zu Vancomycin
|
Im
Vergleich zu ß-Laktamen
|
| |
Teicoplanin
(n = 111)
(%)
|
Vancomycin
(n = 108)
(%) |
Teicoplanin
(n = 124)
(%) |
ß-Laktam
(n = 99)
(%) |
| Anzahl
der Nebenwirkungen |
26 |
50 |
33 |
23 |
| Anzahl
der Pat. mit Nebenwirkungen |
21
(18,9) |
42
(38,9) |
19
(15,3) |
13
(13,1) |
| Anzahl
der Pat. mit Dosismodifikation |
4
(3,6) |
15
(13,9) |
9
(7,3) |
6
(6,0) |
|
Art der Nebenwirkung |
|
|
|
|
| Nephro-/Ototoxizität |
10
(9,0) |
19
(17,6) |
3
(2,4) |
0 |
| Allergie |
4
(3,6) |
19
(17,6) |
6
(4,8) |
2
(2,0) |
| Lokale
Intoleranz |
3
(2,7) |
5
(4,6) |
7
(5,6) |
1
(1,0) |
|
|
| Aktuelle
Dosierungsempfehlungen Teicoplanin Hospitalisierter
Patient*
Teicoplanin - bei Sepsis,
Fremdkörperinfektionen

APAT
- ambulant parenterale Antibiotika-Therapie*
Teicoplanin - bei Endokarditis,
Osteomyelitis, diabetischem Fußsyndrom und
Spondylodiscitis - Langzeittherapie 3x wöchentlich

Teicoplanin
- bei Endokarditis ( bes. IVDA
intravenöser Drogenmissbrauch) sowie APAT
- Langzeittherapie 2x wöchentlich


|
Literatur:
| 1.
Gorzynski E.A., Amsterdam D., Bea T.R., Rotstein C.: „Comparative
in vitro activities of teicoplanin, vancomycin, oxacillin
and other antimicrobial agents against bacteremic isolates
of Gram-positive cocci.“ Antimicrob. Agents Chemother.
33 (1989) 2019-2022. |
| 2.
Naumann G., Schmidt H., Pinkenelle T., Witt M.: „Susceptibility
of staphylococci against teicoplanin and ciprofloxacin.“
16th ICC Proceedings, pp. 3-4, Jerusalem, Israel, June 11-16,
1989. |
| 3.
Pantosti A., Luzzi I., Cardines R., Gianfrilli P.: „Comparison
of the in vitro activities of teicoplanin and vancomycin
against Clostridium difficile and their interactions with
cholestyramine.“ Antimicrob. Agents Chemother. 28
(1985) 848-848. |
| 4.
Parenti F.: „Glycopeptide antibiotics.“ Journal
of Clin. Pharmacol. 28 (1988) 136-140. |
| 5.
Felmingham D., Solomonides K., O`Hare M.D., Wilson A.P.R.,
Gruneberg R.N.: „The effect of medium and inoculum
on the activity of vancomycin and teicoplanin against coagulase-negative
staphylococci.“ J. Antimicrob. Chemother. 20 (1987)
609-619. |
| 6.
Chen H.Y., Williams J.D.: „The activity of vancomycin
and teicoplanin alone and in combination with gentamicin
or ampicillin against Streptococcus faecalis.“ Eur.
J. Clin. Microbiol. 3 (1984) 436-438. |
| 7.
Campoli-Richards D.M., Brogden R.M., Faulds D.: „Teicoplanin.
A review of its antibacterial activity, pharmacokinetic
properties and therapeutic potential.“ Drugs 40 (1990)
449-486. |
| 8.
Carver P.L., Nightingale C.H., Quintiliani R., Sweeney K.,
Stevens R. et al.: „Pharmacokinetics of single- and
multiple-dose teicoplanin in healthy volunteers.“
Antimicrob. Agents Chemother. 33 (1989) 82-86. |
| 9.
Verbist L., Tjandramaga B., Hendrickx B., Van Hecken A.N.,
Van Melle P. et al.: „In vitro activity and human
pharmacokinetics of teicoplanin.“ Antimicrob. Agents
Chemother. 26 (1984) 881-886. |
| 10.
Terragna A., Ferrea G., Loy A., Danese A., Bernareggi A.
et al.: „Pharmacokinetics of teicoplanin in pediatric
patients.“ Antimicrob. Agents Chemother. 32 (1988)
1223-1226. |
| 11.
Schaison G., Graninger W., Bouza E.: „Teicoplanin
in the treatment of serious infection.“ J. Chemother.
12, Suppl 5 (2000) 26-33. |
| 12.
LeFrock J., Ristuccia A., and The Teicoplanin Bone and Joint
Cooperative Study Group: „Teicoplanin in the treatment
of bone and joint infections: An open study.“ J. Infect.
Chemother. 5 (1999) 32-39. |
| 13.
Graninger W., Presterl E., Wenisch C., Schwameis E., Breyer
S., Vukovich T.: „Ma-nagement of serious staphylococcal
infections in the outpatient setting.“ Drugs 54, Suppl.
6 (1997) 21-8. |
| 14.
Graninger W., Wenisch C., Wiesinger E., Menschik M., Karimi
J., Presterl E.: „Experience with outpatient intravenous
teicoplanin therapy for chronic osteomyelitis.“ Eur.
J. Clin. Microbiol. Infect. Dis. 14(7) (1995) 643-647. |
| 15.
Lazzarini L., Tramarin A., Bragagnolo L., Tositti G., Manfrin
V. de LF.: „Three-times weekly teicoplanin in the
outpatient treatment of acute methicillin-resistant staphylococcal
osteomyelitis: a pilot study.“ J. Chemother. 14, 1
(2002) 71-5. |
| 16.
Eitel F., Bauernfeind A., Lang E.: „Teicoplanin in
the treatment of bone and joint infections.“ Curr.
Ther. Res. 51 (1992) 97-111. |
| 17.
Chow A.W., Jewesson P.J., Kureishi A., Phillips G.L.: „Teicoplanin
versus vancomycin in the empirical treatment of febrile
neutropenic patients.“ Eur. J. Haematol. 51 (1993)
18-24. |
| 18.
Kureishi A., Jewesson P.J., Rubinger M., Cole C.D., Reece
D. et al.: „Double-blind comparison of teicoplanin
versus vancomycin in febrile neutropenic patients receiving
concomitant tobramycin and piperacillin: effect on cyclosporin
A-associated nephrotoxicity.“ Antimicrob. Agents Chemother.
35 (1991) 2246-2252. |
| 19.
Micozzi A., Nucci M., Venditti M., Gentile G., Girmenia
C. et al.: „Piperacillin/tazobactam/amikacin versus
piperacillin/teicoplanin in the empirical treatment of neutropenic
patients.“ Eur. J. Med. Microbiol. Inf. Dis. 12 (1993)
1-8. |
| 20.
Del Favero A., Menichetti F., Guerciolini R., Bucaneve G.,
Baldelli F. et al.: „Prospective randomized clinical
trial of teicoplanin for empiric combined antibiotic therapy
in fe-brile, granulocytopenic acute leukemia patients.“
Antimicrob. Agents Chemother. 31 (1987) 1126-1129. |
| 21.
Rouveix B., Garnier M., Pinta P., Kreutz M.: „Residual
serum concentrations and safety of teicoplanin administered
intravenously to healthy volunteers (HV) at a 15 mg/kg dose
on alternate days, compared with a 6 mg/kg daily dose.“
41st Interscience Conf. Antimicrob. Agents Chemother. (ICAAC),
Chicago, Abstract 24, (2001) 949. |
| 22.
Pea F., Brollo L., Viale P., Pavan F., Furlanut M.: „Teicoplanin
therapeutic drug monitoring in critically ill patients:
a retrospective study emphasizing the importance of a loading
dose.“ J. Antimicrob. Chemother. 51 (2003) 971-975. |
| 23.
Wilson A.P.R.: „Antibiotic prophylaxis in cardiac
surgery.“ J. Antimicrob. Chemother. 1988 (21) 522-524. |
| 24.
Eitel F., Bauernfeind A., Lang E.: „Teicoplanin in
the therapy of bone and joint infections.“ Curr. Ther.
Res. 51 (1992) 97-111. |
| 25.
LeFrock J.L., Ristuccia A.M., Ristuccia P.A., Quenzer R.W.,
Haggerty P.G. et al.: „Teicoplanin in the treatment
of bone and joint infections.“ Eur. J. Surg. 567 (1992)
10-13. |
| 26.
De Lalla F., Nicolin R., Rinaldi E., Scarpellini P., Rigoli
R. et al.: „Prospective study of oral teicoplanin
versus oral vancomycin for therapy of pseudomembraneous
colitis and Clostridium difficile-associated diarrhea.“
Antimicrob. Agents and Chemother. 36 (1992) 2192-2196. |
| 27.
Dagan R., Einhorn M., Howard C.B., Williams A.H.: „Outpatient
and inpatient teicoplanin treatment for serious Gram-positive
infections in children.“ Pediatr. Inf. Dis. J. 12
(1993) 17-20. |
| 28.
Stevens D.L.: „Teicoplanin for skin and soft tissue
infections: An open study and a randomized, comparative
trial versus cefazolin.“ J. Infect. Chemother. 5,
1 (1999) 40-45. |
| 29.
Brogden R.N., Peters D.H.: „Teicoplanin. A reappraisal
of its antimicrobial activity, pharmacokinetic properties
and therapeutic efficacy.“ Drugs 47 (1994) 823-854. |
| 30.
Lewis P., Garaud J.J., Parenti F.: „A multicentre
open clinical trial of teicoplanin in infections caused
by Gram-positive bacteria.“ J. Antimicrob. Chemother.
21 (1988) 61-67. |
Anschrift
der Verfasserin:
Dr. Astrid Buxbaum
Univ.-Klinik für Innere Medizin IV,
Klin. Abt. für Pulmologie, AKH Wien
A-1090 Wien, Währinger Gürtel 18-20
E-Mail:
astrid.buxbaum@akh-wien.ac.at
|
|
|