| Wirksamkeit
von Teicoplanin oder Vancomycin in Kombination mit Linezolid gegenüber
Methicillin-resistentem Staphylococcus aureus mittels
spektrophotometrischer Trübungsmessung |
| N. Geisler,
R. Gattringer, W. Graninger, A. Georgopoulos
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, AKH Wien
(Vorstand: Univ.-Prof. DDr. W. Graninger) |
Schlüsselwörter:
Teicoplanin, Linezolid, Kombinationstherapie, Bioscreen C Analyzer |
|
Zusammenfassung
Obwohl
die meisten Infektionskrankheiten mit einem einzelnen Antibiotikum
behandelt werden könnten, gibt es einige Situationen, in
denen eine Kombinationstherapie angezeigt ist. So kann zum Beispiel
durch die Verabreichung mehrerer Antibiotika gleichzeitig die
Wahrscheinlichkeit einer Resistenzentwicklung gesenkt werden.
Oder durch die Kombination zweier oder mehrerer Antibiotika
versucht man eine Potenzierung des Effekts der Einzelantibiotika
zu erzielen und so einen bakteriziden oder bakteriostatischen
Effekt zu erreichen.
Bei den bisher
angewandten Methoden zur Kombinationsprüfung wird immer
eine lineare Dosis-Wirkungsbeziehung der einzelnen Antibiotika
angenommen. Da dies aber auf sehr wenige tatsächlich zutrifft,
ist die Interpretation der Ergebnisse durch die FIC unzureichend.
Dem klinischen Verhalten viel näher kommt hingegen die
Berechnung mittels Wachstumskonstante. Damit wird nicht nur
einer nichtlinearen Dosis-Wirkungsbeziehung Rechnung getragen,
sondern durch kontinuierliche Trübungsmessungen lässt
sich auch der Verlauf der Kombination beurteilen.
In dieser Studie
wurde mittels BIOSCREEN C Analyzer die Wirkung von Antibiotikakombinationen
gegenüber jeweils 5 Stämmen von Methicillin-resistentem
Staphylococcus aureus anhand der Wachstumskonstante
getestet.
Die Verwendung
der IC50 von Linezolid und ansteigenden
Konzentrationen von Teicoplanin führte in fast allen Fällen
zu einem Synergismus, während die Kombination von Vancomycin
mit Linezolid entweder Autonomie oder einen Antagonismus zeigte.
Somit kann festgehalten
werden, dass Teicoplanin in Kombination mit Linezolid eine interessante
Alternative bei der Therapie von schweren MRSA-Infektionen darstellen
könnte. Über die klinische Relevanz dieser Daten kann
hier keine Aussage getroffen werden, aber auf Grund der viel
versprechenden In-vitro-Ergebnisse sollte dieser Antibiotikakombination
mehr Beachtung geschenkt werden.
|
Key-words:
Teicoplanin, linezolid, combination therapy, Bioscreen
C Analyzer |
|
Summary
Although
most infectious diseases are treatable with a single antibiotic
agent, in some cases an antibiotic combination therapy is indicated.
One potential benefit of antibiotic combination is the risk
reduction for development of resistance. Another positive aspect
is the potentiation of the effects of each single substance,
thereby increasing both bactericidal and bacteriostatic effects.
Currently
used methods in evaluating the efficacy of antibiotic combinations
postulate a linear dose-effect relationship between single substances.
Since this is only true for some agents, an exact interpretation
of results using FIC is insufficient. Clinically more useful
could be the evaluation by growth constant. This allows both
for non-linear dose-effect relationships and continuous measurements
of cloudiness.
In
this trial we evaluated the efficacy of combined antibiotics
against 5 strains of methicillin-resistant Staphylococcus
aureus (MRSA) using the Bioscreen C Analyzer method, which
is based on the growth constant.
When
using the IC50 of linezolid and increasing
concentrations of teicoplanin synergistic action was observed
in nearly all cases, whereas the combination of vancomycin and
linezolid showed either autonomy or antagonistic effects.
It
can therefore be stated that the combination of teicoplanin
and linezolid could be a valuable alternative in the treatment
of severe MRSA infections.
To
date the clinical relevance of these data has yet to be elucidated.
Nevertheless these favourable in vitro results for
this antibiotic combination merit further investigation.
|
Einleitung
Seit der
Einführung der Antibiotika in den vierziger Jahren des
20. Jahrhunderts hat sich die Behandlung von Infektionen durch
Gram-positive Bakterien enorm verändert. Heute stellen
multiresistente Bakterien ein großes Problem in der Therapie
dar, weil es nur ein begrenztes Angebot an Antibiotika gibt
und immer häufiger Berichte über neu auftretende Resistenzen
erscheinen. Besonders alarmierend ist die Situation seit gegenüber
den bisher als Reserveantibiotika verwendeten Glykopeptiden
immer mehr Resistenzen entstehen, weil nun die Frage nach neuen
Therapiemöglichkeiten immer dringender wird.
Durch
ein vermehrtes Auftreten nosokomialer Infektionen steigt nicht
nur die Morbidität und Mortalität, es fallen auch
durch eine viel längere Behandlungsdauer höhere Kosten
an. Durch eine gezielte Kombinationstherapie könnte nicht
nur eine Verkürzung der Behandlungsdauer zu einer drastischen
Kostensenkung führen, sondern die Wirkung eines Antibiotikums,
gegenüber dem Bakterien schon Resistenz entwickelt haben,
verbessert werden.
In-vitro-Tests
können auf verschiedene Art und Weise durchgeführt
werden. In dieser Arbeit wurde ein kinetisches Verfahren angewendet,
bei dem über einen Zeitraum von 16 Stunden hindurch in
regelmäßigen Abständen das Bakterienwachstum
gemessen wurde. Dadurch lässt sich ein genauerer Verlauf
der Kombinationsprüfung im Vergleich zu statischen Methoden
wie Checkerboard erkennen. Sowohl die Durchführung dieser
Tests als auch die Interpretation der Ergebnisse ist nicht so
einfach, doch durch die kontinuierlichen Messungen kommt die
spektrophotometrische Trübungsmessung dem In-vivo-Verlauf
einer Antibiotikakombination sicherlich näher als bei Checkerboard.
Gegenüberstellung
Checkerboard - spektrophotometrische Analyse
Die Effektivität eines einzelnen Antibiotikums wird gewöhnlich
an der geringsten Dosis, die kein Bakterienwachstum mehr zulässt
(MKH: minimale Hemmkonzentration), oder bei bakteriziden Präparaten
auch an derjenigen Konzentration, bei der 99,9% des Anfangsinoculums
abgetötet wird, gemessen.
Werden
zwei oder mehrere Antibiotika miteinander kombiniert, so liegt
das Ergebnis unabhängig von der verwendeten Methode immer
zwischen Synergismus und Antagonismus (Definition siehe Tabelle
1).
Tabelle
1: Vergleich der Definitionen von Antibiotikainteraktionen
unter Annahme einer linearen/nichtlinearen Dosis-Wirkungsbeziehung
[1]
| Ergebnis |
Annahme
einer linearen
Dosis-Wirkungsbeziehung |
Annahme
einer nichtlinearen
Dosis-Wirkungsbeziehung |
Berechnung
mittels Wachstumskonstante
(g) |
| Synergismus |
Das
Ergebnis mit 2 Antibiotika ist signifikant größer
als bei Additivitä |
Das
Ergebnis mit 2 Antibiotika ist signifikant größer
als bei Additivität |
|
| Additivität |
Das
Ergebnis mit 2 Antibiotika ist gleich der Summe der
Ergebnisse jedes einzelnen Antibiotikums allein |
Das
Ergebnis mit 2 Antibiotika ist gleich der kombinierten
Wirkung jedes Antibiotikums allein |
|
| Autonomie |
|
Das
Ergebnis mit 2 Antibiotika ist gleich dem Ergebnis,
wenn das besser wirkende Antibiotikum alleine verwendet
wird |
|
| Antagonismus |
Das
Ergebnis mit 2 Antibiotika ist signifikant schlechter
als das Ergebnis bei Additivität |
Das
Ergebnis mit 2 Antibiotika ist signifikant schlechter
als bei Autonomie |
|
|
Bei
Checkerboard, der am meisten verwendeten statischen Methode,
werden die unterschiedlichen Konzentrationen der beiden Antibiotika
auf Mikrotiterplatten aufgebracht.
(Verdünnungsreihen
von Antibiotikum A entlang der x-Achse und Verdünnungsreihen
von Antibiotikum B entlang der y-Achse der Platte). Nach der
Inkubationszeit werden die einzelnen Proben auf Trübung
überprüft. Die Interpretation der Ergebnisse erfolgt
mittels Isobologrammen, wobei man hier von der Definition der
Additivität ausgeht: Das Ergebnis ist gleich der Summe
der Effekte der einzelnen Antibiotika [1], oder die Antibiotika
verhalten sich so, als wären sie mit sich selbst kombiniert
[2] (ein Teil Antibiotikum A plus zwei Teile Antibiotikum B
ist gleich wie drei Teile Antibiotikum A). Ist das Ergebnis
besser als bei Additivität, so spricht man von Synergismus
- ist es schlechter, von Antagonismus.
Nach
Ablauf des Tests erhält man immer Alles-oder-Nichts-Ergebnisse,
das heißt, entweder kann in den Proben Wachstum festgestellt
werden oder nicht. Es ist daher nicht möglich, den Verlauf
von Antibiotikakombinationen zu erkennen. Das Hauptproblem allerdings
betrifft das Verhalten vieler antimikrobieller Substanzen, abhängig
von der Konzentration. Nur sehr wenige haben eine lineare Dosis-Wirkungsbeziehung
[3] (die doppelte Menge an Antibiotikum zeigt auch die doppelte
Inhibition), die aber eine Voraussetzung für oben genannte
Definitionen ist.
Dosis
und Wirkung der meisten Antibiotika verhalten sich logarithmisch
bzw. exponentiell. Dies trifft auch auf die hier verwendeten
Antibiotika zu.
Eine
weitere Schlussfolgerung aus obiger Definition ist, dass immer
dann, wenn beide Antibiotika nicht signifikant interagieren,
das Ergebnis Additivität ist. Doch zeigen Studien, dass
immer nur ein metabolischer Schritt bei einem Organismus wachstumshemmend
wirken kann. Das bedeutet, dass, wenn die zwei Substanzen kaum
miteinander agieren, immer nur ein Antibiotikum, nämlich
das wirkstärkere, wirksam ist und das andere somit keinen
Einfluss auf das Ergebnis hat.
Durch
die neue Methode mittels Bioscreen C Analyzer kommt unter der
Annahme einer nichtlinearen Dosis-Wirkungsbeziehung die Definition
der Autonomie hinzu: Das Ergebnis von 2 Substanzen ist gleich
der Wirkung des besser wirkenden Antibiotikums allein (verschiedene
Definitionen siehe Tabelle 1). Es besteht aber hier trotzdem
ein Unterschied zu Additivität. Während bei Autonomie
keine Veränderung durch die Kombination feststellbar ist,
so kann bei Additivität sehr wohl die Wirkung ein wenig
verbessert werden.
Wird
das Ergebnis anhand von Wachstumskurven dargestellt, wie es
bei spektrophotometrischen Messungen der Fall ist, so zeigen
bei Autonomie die Kurve des besser wirkenden Antibiotikums und
die Kurve der Kombinationsprüfung einen ähnlichen
Verlauf. Bei Additivität hingegen kommt es bei der Kombination
zwar zu einer Reduktion des Wachstums, aber die beiden Substanzen
interagieren nicht so stark, dass sich ihr Effekt potenziert
(sondern die "Einzeleffekte" werden nur addiert).
Die
Definition von Antagonismus besagt nach dieser Theorie, dass
das Ergebnis schlechter als bei Autonomie ist. Das würde
bei Verwendung von Wachstumskurven zur Interpretation und in
Anlehnung an oben erwähnte Erklärung bedeuten, dass
die Wachstumskurve der Kombination eine geringere Inhibition
zeigt als das besser wirkende Antibiotikum allein. Es wäre
also sinnlos, beide Substanzen gleichzeitig zu verabreichen,
da zumindest einer der beiden Kombinationspartner alleine das
Wachstum der Bakterien besser hemmt als die zwei zusammen.
Ziel
dieser Arbeit war es, zu überprüfen, ob die Kombination
des neuen Antibiotikums Linezolid, das hauptsächlich im
Gram-positiven Bereich wirksam ist, mit einem Glykopeptid (Vancomycin
oder Teicoplanin) gegenüber Methicillin-resistenten Staphylokokken
zu einer Wirkungsverbesserung führt.
Bakterien
unterliegen, wie alle Organismen, die sich durch Teilung vermehren,
einem exponentiellen Wachstum. Ausgehend von diesem Wachstumsverhalten
kann die Vermehrung der Bakterienmasse mit einer Formel angegeben
werden:
Wobei
B(t) die Bakterienpopulation nach der
Zeit t ist und B(0) die Population vor
Beginn der Inkubation am Anfang der Messung. g ist die Wachstumskonstante,
die für jeden Zeitpunkt der Kurve neu bestimmt werden muss,
weil auf Grund der unterschiedlichen Wachstumsgeschwindigkeit
natürlich auch die Konstante in jedem Punkt der Kurve einen
anderen Wert hat.
Laut
King und Krogstad [4] ist die Bakterienpopulation proportional
zur Optical Density (OD) und kann somit auch zur Berechnung
der Wachstumskonstante herangezogen werden.
Nach
Umwandlung der Formel, bei der aus der Euler'schen Zahl der
Logarithmus naturalis wird, ergibt sich dann für die Wachstumskonstante
g:
Als
0 % Inhibition und somit Kontrollwert wurde der Wert von g der
Wachstumskurve ohne Antibiotikum herangezogen, und ein Fehlen
jeglichen Wachstums (kein Anstieg der Optical Density) wurde
mit 100 % festgesetzt.
Für
die Testung einer Antibiotikakombination sind vier verschiedene
Kurven notwendig: Antibiotikum A allein, Antibiotikum B allein,
Antibiotikum A + B in Kombination und das Wachstum des Keimes
ohne Antibiotikum.
Dabei
wird die Konzentration eines Antibiotikums fix gewählt.
Um den Unterschied zwischen einem möglichen additiven oder
autonomen Ergebnis zu verdeutlichen, wurde zuerst die IC50
(inhibitory concentration) des jeweiligen Antibiotikums bestimmt
[8]. IC50 ist diejenige Konzentration,
bei der das Wachstum des Bakterienstamms die Hälfte, nämlich
50 %, des Wachstums ohne Antibiotikum beträgt und deutlich
unter dem MHK-Wert der getesteten Stämme liegt. Dieser
Wert wurde gewählt, weil er einerseits eine deutliche Reduktion
des Wachstums im Vergleich zur Wachstumskurve zeigt, andererseits
aber immer noch eine weitere eindeutige Reduktion des Bakterienwachstums
bei eventuellem Synergismus ermöglicht.
Für
die Kombinationsprüfung wird dann das zweite Antibiotikum
in verschiedenen Konzentrationen zugefügt. Da das Ergebnis
auch von der Wahl des ersten, also des Antibiotikums mit der
fixen Konzentration, abhängig ist, wurde in einer zweiten
Versuchsreihe die IC50 des zweiten Antibiotikums
als feste Größe verwendet und das ursprünglich
erste Antibiotikum in wechselnden Konzentrationen zugegeben.
Nach
Abschluss der Messungen wurden die OD-Werte (optical density)
der Wachstumskurve des fixen Antibiotikums in die vorhin beschriebene
Formel eingesetzt und die so erhaltenen Wachstumskonstanten
für jeden Zeitpunkt der Kurve in eine Tabelle eingetragen.
Zur Vereinfachung wurden nur die Messungen zu jeder vollen Stunde
verwendet. Danach musste jener Zeitpunkt bestimmt werden, bei
dem die Wachstumskonstante des Antibiotikums mit der fixen Konzentration
ungefähr 50 % (40 - 60 %) der Wachstumskonstante der Kontrollkurve
ohne Antibiotikum beträgt.
Zur
Berechnung des Effektes einer Antibiotikakonzentration wurden
auch die Wachstumskonstanten der übrigen Kurven - die des
Antibiotikums, das in wechselnden Konzentrationen zugegeben
wurde, und die Kurve, bei der beide Antibiotika kombiniert wurden,
bestimmt. Die Auswertung erfolgte in Diagrammen, wobei auf der
x-Achse die Konzentration des Antibiotikums, das zugegeben wurde,
aufgetragen wurde und auf der y-Achse die Reduktion der Wachstumskonstante
in Bezug auf die Wachstumskonstante der Kurve ohne Antibiotikum
in Prozent (percent reduction in growth rate constant).
Darüber
hinaus wurde das Ergebnis auch noch anhand der Formeln in Tabelle
1 für jeden Messpunkt berechnet. Um den Unterschied zwischen
Autonomie und Additivität zu maximieren und somit die Interpretation
zu erleichtern, wurde für die x-Achse eine logarithmische
Skalierung verwendet.
|
| Material
und Methoden
Bakterienstämme
Getestet wurden pro Kombination jeweils 5 Methicillin-resistente
Staphylococcus aureus-Stämme, die am AKH Wien
isoliert wurden.
Medien
Alle Untersuchungen wurden mit Mueller-Hinton-Bouillon (Merck,
Basingstoke, Hampshire, England) als Wachstumsmedium durchgeführt.
Zur Kultivierung der Bakterien wurden Columbia-Agarplatten mit
5 % Hammelblut (BioMérieux, Frankreich) verwendet.
Antibiotika
Für die Kombinationsprüfung wurden die zwei Standardantibiotika
Teicoplanin und Vancomycin und ein neues Antibiotikum Linezolid
verwendet. Die Antibiotika wurden nach Vorschrift des Herstellers
in Aqua dest. als Standardkonzentration von 1000 µg/ml
gelöst und in flüssigem Stickstoff aufbewahrt. Aufgetaute
Antibiotika wurden am gleichen Tag verwendet.
Herstellung
des Inoculums
Die 5 Stämme wurden auf Blutagarplatten aufgebracht und
über Nacht bei 37°C inkubiert und am nächsten
Tag mit Mueller-Hinton-Bouillon suspendiert, um nach Mc Farland
eine Dichte von 0,5 zu erreichen. Dieses Inoculum - ~1 bis 3
x 10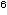 CFU/ml entsprechend
- wurde neuerlich zehnfach verdünnt, damit das endgültige
Inoculum ~ 1 bis 3 x 10 CFU/ml entsprechend
- wurde neuerlich zehnfach verdünnt, damit das endgültige
Inoculum ~ 1 bis 3 x 10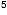 CFU/ml ergibt.
CFU/ml ergibt.
Bioscreen
C Analyzer
Alle Tests in dieser Studie wurden mit dem Bioscreen C Analyzer
(Labsystems, Oy, Finnland) durchgeführt. Dieses Gerät
misst spektrophotometrisch die Veränderungen der Trübung
in einem Kulturmedium auf Grund von Bakterienwachstum. Dies
erfolgt mittels einer Halogenlampe, die vertikal durch bis zu
200 Proben gleichzeitig strahlt. Hier wurde eine Wellenlänge
von 540 nm gewählt.
Nach
abgeschlossener Messdauer werden die Ergebnisse in Diagrammen,
wobei die Zeit auf der x-Achse und die Trübung (Optical
Density) auf der y-Achse aufgetragen werden, durch die PC-Software
BIOLINK (Labsystems, Oy, Finnland) dargestellt. |
| Ergebnisse
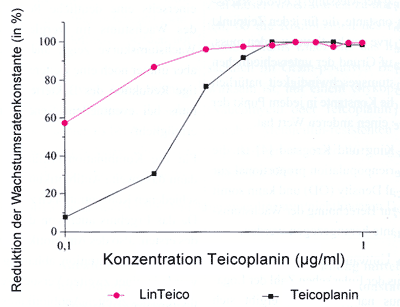
Kombination Linezolid/Teicoplanin
Bei der Kombination der IC50 von
Linezolid und ansteigenden Konzentrationen von Teicoplanin zeigt
sich in allen Tests im niedrigen Konzentrationsbereich entweder
ein leichter Synergismus oder eine Autonomie bezüglich
Linezolid. Nur einmal findet man über einen großen
Konzentrationsbereich einen Synergismus und erst bei hohen Konzentrationen
von Teicoplanin tritt eine Autonomie auf. War schon zu Beginn
eine Autonomie feststellbar, so bleibt dieser Trend über
alle Konzentrationspunkte gleich, allerdings besteht dann eine
Autonomie bezüglich Teicoplanin (Diagramm 1).
Diagramm
1: Kombinationsprüfung von Linezolid (0,6
µg/ml) und Teicoplanin in ansteigenden Konzentrationen
von 0,1 - 1 µg/ml nach 5 Stunden
|
Bei
der Verwendung von Teicoplanin als fixem Antibiotikum und Linezolid,
das dazutitriert wurde, findet sich in allen Kurven ein Synergismus,
der im Großen und Ganzen auch im hohen Konzentrationsbereich
erhalten bleibt. Setzt man die berechneten Wachstumskonstanten
für jeden Punkt der Kurve in die Synergismusformel von
Tabelle 1 ein, so erhält man das gleiche Ergebnis (Diagramm
2).
Diagramm
2: Kombinationsprüfung von Teicoplanin
(0,7µg/ml) und Linezolid in ansteigenden Konzentrationen
von 0,1 - 2 µg/ml nach 8 Stunden
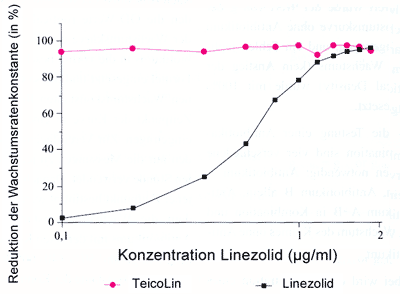
|
Kombination
Linezolid/Vancomycin
Unter Linezolid als fixem Antibiotikum kommt es in 4 von 5 Fällen
zu einem mehr oder weniger schwachen Antagonismus im hohen Konzentrationsbereich,
während sich im niedrigen eine Autonomie in Bezug auf Linezolid
feststellen lässt (Diagramm 3).
Diagramm
3: Kombinationsprüfung von Linezolid (1,2
µg/ml) und Vancomycin in ansteigenden Konzentrationen
von 0,2 - 2 µg/ml nach 6 Stunden
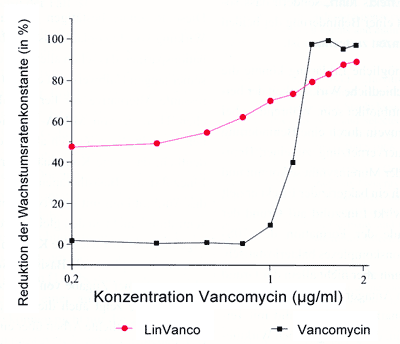
|
Verwendet
man die IC50
von Vancomycin und gibt Linezolid in unterschiedlichen
Konzentrationen hinzu, tritt in fast jedem Experiment ein anderer
Effekt auf. Zweimal lässt sich sogar ein Synergismus erkennen,
der aber einmal schon zu Beginn vorhanden ist, während
er sich im anderen Fall erst im hohen Konzentrationsbereich
von Linezolid entwickelt. In den anderen Kurven schwankt der
Effekt immer zwischen leichtem Antagonismus und Additivität
(Diagramm 4).
Diagramm
4: Kombinationsprüfung von Vancomycin
(1,1 µg/ml) und Linezolid in ansteigenden Konzentrationen
von 0,2 - 2 µg/ml nach 11 Stunden
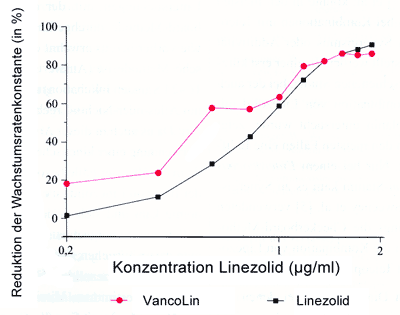
|
|
| Diskussion
Die
Anzahl der Studien über die Kombinationsprüfungen
von Vancomycin mit Linezolid sind sehr begrenzt. Über die
Kombination von Teicoplanin mit Linezolid gibt es überhaupt
erst eine Studie, die kürzlich veröffentlicht wurde
[5]. Es fehlen allerdings gänzlich In-vitro-Studien
über Kombinationsprüfungen mittels spektrophotometrischer
Trübungsmessung. Deshalb war es auch wichtig, mit dieser
Arbeit aufzuzeigen, dass mit kinetischen Methoden ähnliche
Ergebnisse wie mit den bisher bekannten statischen Methoden
erzielt werden können. Ein großer Vorteil besteht
in der Möglichkeit, die Effektivität der untersuchten
Antibiotikakombination zu jedem Zeitpunkt der Wachstumskurve
zu berechnen, womit diese Methode dem In-vivo-Verlauf
eine Antibiotikakombination mit Sicherheit näher kommt
als die Checkerboardmethode.
Die
neuesten Studien über eine Kombination von Linezolid mit
Vancomycin [6, 7], die mit Time-kill-Kurven getestet wurde,
zeigten auch, wie hier beschrieben, einen leichten Antagonismus.
Bei
der Verwendung von Linezolid als Antibiotikum mit der fixen
Konzentration und Zugabe von ansteigenden Konzentrationen von
Vancomycin kam es im niedrigen Konzentrationsbereich zu einer
Autonomie in Bezug auf Linezolid, im hohen allerdings zu einer
Autonomie bezüglich Vancomycin. Dieser Verlauf würde
die These bestätigen, dass immer nur ein metabolischer
Schritt bei einem Organismus wachstumshemmend wirken kann, wenn
die beiden Kombinationspartner nicht miteinander agieren.
Die
vorherrschende Autonomie in allen Kurven spricht auch dafür,
dass es hier zu keiner wesentlichen Interaktion der beiden Antibiotika
kommt. Da aber doch - wenn auch bei jedem Keim in unterschiedlich
starker Ausprägung - Antagonismus, einmal sogar Additivität
auftritt, muss man von einer gewissen Interaktion von Linezolid
und Vancomycin ausgehen. Abschließend kann ganz klar festgehalten
werden, dass sich die untersuchten Substanzen, sofern sie miteinander
agieren, hauptsächlich negativ beeinflussen.
Bei
der Umkehrung der Kombination, wenn Vancyomcin als Antibiotikum
mit der fixen Konzentration gewählt wird, sind die Ergebnisse
im Allgemeinen ähnlich.
Allgemein
kann man nun über die Kombination von Linezolid und Vancomycin
sagen, dass zwar in manchen Fällen eine Interaktion der
beiden Antibiotika stattfindet, diese aber unterschiedliche
Ergebnisse zeigt, in den meisten Fällen sogar zu einem
leichten Antagonismus führt. Zu dem gleichen Resultat kamen
auch Jaqueline et al. [8], die die gleiche Antibiotikakombination
mit Time-kill-Kurven untersuchten. Somit ist festzustellen,
dass eine Therapie von Vancomycin und Linezolid gleichzeitig
zu keiner Verbesserung des antibakteriellen Effekts führt,
sondern dass sogar mit einer Behinderung der beiden Substanzen
zu rechnen ist.
Eine
mögliche Erklärung könnte die unterschiedliche
Wirksamkeit der beiden Antibiotika sein. Während es bei
Vancomycin durch eine Behinderung der Quervernetzung zu einer
Hemmung der Mureinsynthese kommt und dadurch ein bakterizider
Effekt erzielt wird, wirkt Linezolid auf Grund der Blockade
der Formation des 70S-Initiationskomplexes bakteriostatisch.
Dies kann aber nicht allein der Grund für den Antagonismus
sein, weil eine Kombination von Linezolid mit Teicoplanin, das
ja den gleichen Wirkmechanismus wie Vancomycin besitzt, ein
synergistisches Ergebnis bringt.
Bei
Jones R. N. et al. [6] und Clark C. L. [7] et al. konnte in
den meisten Fällen bei Kombinationen mit Teicoplanin Synergismus
oder Additivität festgestellt werden. In einer erst kürzlich
erschienenen Studie, bei der auch die Kombination von Linezolid
mit Teicoplanin untersucht wurde, zeigt sich in den meisten
Fällen eine Indifferenz. Nur bei einem Enterococcus
faecium-Stamm kam es zu Synergismus. Sweeney et al. [5]
verwendeten allerdings die Checkerboard-Methode, um die Kombination
von Linezolid mit Teicoplanin zu testen.
In
den Diagrammen, bei denen die Ergebnisse unter Verwendung einer
fixen Konzentration von Linezolid und ansteigenden Konzentrationen
von Teicoplanin dargestellt wurden, findet man in 3 von 5 Fällen
eine Autonomie.
Bei
der Kombination mit der IC50 von Teicoplanin
und ansteigenden Konzentrationen von Linezolid kommt es in 4
von 5 Fällen zu einem eindeutigen Synergismus.
Diese
Resultate bestätigen die gute Wirkung von Teicoplanin als
Kombinationspartner, das schon allein wegen seiner langen Halbwertszeit
eine interessante Alternative zur herkömmlichen Therapie
von MRSA-Infektionen darstellt. Es zeigt sich aber auch deutlich,
dass eine Kombination mit Linezolid als Basistherapeutikum -
das Antibiotikum mit der fixen Konzentration - nicht zu den
gleich guten Ergebnissen führt wie eine Kombination mit
Teicoplanin als Basisantibiotikum und einer Zugabe von Linezolid.
Teilweise zeigt auch die einzige bisher veröffentlichte
Arbeit über eine Kombination dieser beiden Antibiotika
ähnliche Ergebnisse. Hier kam es in allen untersuchten
Fällen zu Indifferenz. Allerdings wurden diese Untersuchungen
mit der Checkerboard-Methode durchgeführt, die ja wie vorher
bereits erwähnt eine statische Methode ist (Auswertung
nach 16 - 24 Stunden Inkubation) und somit nur Alles-oder-Nichts-Ergebnisse
liefert. Da es auch in dieser Arbeit unter Verwendung einer
kinetischen Methode in ca. 50% der Fälle besonders mit
der IC50 von Linezolid zu einer Autonomie
kam und sich in den übrigen Fällen ein Synergismus
fand, kann man davon ausgehen, dass eine Kombination von Linezolid
und Teicoplanin unter bestimmten Voraussetzungen (Teicoplanin
mit fixer Konzentration und Zugabe von Linezolid in geringer
Konzentration) zu einer Potenzierung der Wirkung führt.
Wenn aber dieser Effekt nicht eintritt, kommt es zumindest nicht
zu einer Verschlechterung der Wirkung, das heißt, die
beiden Kombinationspartner behindern einander nicht in ihrer
Wirkung, so wie dies bei der Kombination von Linezolid mit Vancomycin
teilweise der Fall ist.
Durch
das stete Ansteigen von Infektionen durch resistente Bakterien
wird eine parenterale Therapie immer wichtiger. Ein damit verbundener
verlängerter Krankenhausaufenthalt erhöht die Gefahr
einer Aufnahme oder Verbreitung weiterer resistenter Keime [9].
Durch die lange Halbwertszeit von Teicoplanin, durch die eine
einmalige Gabe am Tag - oder sogar eine Verabreichung dreimal
wöchentlich - ausreicht, um therapeutische Dosen zu erreichen
[10], besteht auch die Möglichkeit einer ambulanten Therapie.
So können nicht nur die oben genannten negativen Aspekte
vermieden werden, sondern auch Kosten gespart werden, die bei
einem langen Spitalsaufenthalt anfallen [10].
Ob
es durch die Zugabe von Linezolid, das oral verabreicht wird
und somit einer ambulanten Therapie nicht im Wege steht, zu
einer weiteren Verkürzung der Behandlungsdauer kommt, kann
hier nicht beantwortet werden. Hierfür wären weitere
klinische Studien notwendig. Aber durch die bisherigen synergistischen
Ergebnisse und die alarmierende Situation nicht nur in Bezug
auf die immer häufiger auftretenden Resistenzen, sondern
auch in Bezug auf die explodierenden Krankenhauskosten, sollte
dieser Antibiotikakombination in Zukunft mehr Beachtung geschenkt
werden. |
Literatur:
| 1.
King T.C., Schlesinger D., Krogstad D.J.: "The assessment
of antimicrobial combinations." Rev. of Infect. Dis.
3(3) (1981) 627-633. |
| 2.
Berenbaum M.C.: "A method for testing for synergy with
any number of agents." J. Infect. Dis. 137 (1978) 122-130.
|
| 3.
Venditti M., Gelfusa V., Serra P., Brandimarte C., Micozzi
A., Martino P.: "4-week treatment of streptococcal
native valve endocarditis with high-dose teicoplanin."
Antimicrob. Agents Chemother. 36 (1992) 723-726. |
| 4.
King T.C., Krogstad D.J.: "Spectrophotometric assessment
of dose-response curves for single antimicrobial agents
and antimicrobial combinations." J. Infect. Dis. 147(4)
(1983) 758-764. |
| 5.
Sweeney T., Zurenko G.E.: "In-vitro-activities of Linezolid
combined with other antimicrobial agents against Staphylococci,
Enterococci, Pneumococci, and selected Gram-negative Organisms."
Antimicrob. Agents Chemother. 47(6) (2003) 1902-1906. |
| 6.
Jones R.N., Marshall S.A., Grimm H.: "Antimicrobial
interactions (synergy) of teicoplanin with two broad-spectrum
drugs (cefotaxime, ofloxacin) tested against Gram-positive
isolates from Germany and the United States." Diagn.
Microbiol. Infect. Dis. Oct 29(2) (1997) 87-94. |
| 7.
Clark C.L., Jacobs M.R., Appelbaum P.C.: "Activities
of Clinafloxacin, alone and in combination with other compounds,
against 45 Gram-positive and -negative organisms for which
clinafloxacin MICs are high." Antimicrob. Agents Chemother.
Sep. 43(9) (1999) 295-298. |
| 8.
Jaqueline C., Caillon J., Le Mabeque V., Miegeville A.F.,
Donnio P.Y., Bugnon D., Potel G.: "In-vitro
activity of Linezolid alone and in combination with Gentamicin,
Vancomycin or Rifampicin against methicillin-resistant Staphylococcus
aureus by time-kill curve methods." JAC Apr. 51(4)
(2003) 857-864. |
| 9.
Graninger W., Presterl E., Wenisch C., Schwameis E., Breyer
S., Vukovich T.: "Management of serious Staphylococcal
infections in the outpatient setting." Drugs 54, Suppl
6 (1997) 21-28. |
| 10.
Graninger W., Wenisch C., Wiesinger S., Menschik M., Karimi
J., Presterl E.: "Experience with outpatient intravenous
Teicoplanin therapy for chronic osteomyelitis." Eur.
J. Clin. Microbiol. Infect. Dis. 14(7) (1995) 643-47. |
Anschrift des Verfassers:
Univ..Prof. DDr. Apostolos Georgopoulos
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail:
apostolos.georgopoulos@akh-wien.ac.at
|
|
|