| Intravenöse Fosfomycin-Therapie
bei schweren diabetischen Fußinfektionen
|
|
D. Stengel 1,
W. Graninger 2
1 Chirurgische Universitätsklinik, Abteilung für Unfall-
und Wiederherstellungschirurgie, Ernst-Moritz-Arndt Universität
Greifswald, Berlin
(Vorstand: Prof. Dr. med. A. Ekkernkamp)
2 Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
(Vorstand: Univ.-Prof. DDr. W. Graninger) |
|
Schlüsselwörter:
Diabetische Fußinfektion, Osteomyelitis, Amputation, Fosfomycin |
|
Zusammenfassung
Prävention
und multidisziplinäre Therapie diabetischer Fußinfektionen
stellen weiterhin ein ungelöstes Problem dar; ihre Konsequenzen,
wie die Amputation, sind sowohl für den Betroffenen als
auch die Solidargemeinschaft erheblich. Fosfomycin reichert
sich in hohen Konzentrationen in entzündetem Knochen- und
Weichteilgewebe an und stellt damit eine mögliche Therapieoption
dar. In eine multizentrische Anwendungsbeobachtung wurden 35
Männer und 17 Frauen (mittleres Alter 63 ± 8 Jahre)
mit schweren diabetischen Fußinfektionen und Knochenbeteiligung
(d.h. Stadium 38 und höher nach Texas-Klassifikation) eingeschlossen.
Alle Patienten erhielten Fosfomycin als Kurzinfusion; 41 Patienten
erhielten eine Kombinationstherapie, bevorzugt mit Beta-Laktamen.
Die mittlere
Behandlungsdauer betrug 14 ± 8 Tage. Durchschnittlich
wurden 15 ± 5 g Fosfomycin täglich verabreicht.
Der Erhalt einer belastungsfühigen unteren Extremität
gelang unter diesem Regime in 48 von 52 Fällen (92 %, 95
% Konfidenzintervall 81 - 98 %). Es mussten drei Oberschenkel-
und eine Unterschenkelamputation durchgeführt werden.
Die Daten
stützen die Bedeutung von Fosfomycin bei der Behandlung
schwerer Weichteil- und Knocheninfektionen und dienen als Gerüst
für die methodische Planung einer randomisierten, kontrollierten
Studie.
|
Key-words:
diabetic foot infection, osteomyelitis, amputation,
fosfomycin |
|
Summary
Prevention
and multidisciplinary treatment of diabetic foot infections
remain a challenge of modern healthcare; complications like
major limb amputations pose significant threats to individuals
and the society. The epoxide fosfomycin penetrates well into
inflamed bone and soft tissue, thus representing an interesting
therapeutic option. We enrolled 35 men and 17 women (mean age
63 ± 8 years) with severe diabetic foot infections and
bone involvement (that is, Texas grade 3B, and higher) in a
multicenter compassionate use program. All subjects received
intravenous fosfomycin as a short infusion. Additional antibiotics,
preferably beta-lactam compounds, were applied to 41 patients.
Treatment
duration averaged 14 ± 8 days, whereas the mean daily
fosfomycin dose was 15 ± 5 g. Limb preservation was possible
in 48 patients (92 %, 95 % confidence interval 81 - 98 %). There
were three above-knee and another below-knee amputation.
The findings
from this observational study support the value of fosfomycin
in severe bone and soft-tissue infections, and form the basis
for designing a randomized controlled trial.
|
Einleitung
In den Industrienationen
werden 80 % aller Majoramputationen der unteren Extremitäten
durch diabetische Komplikationen wie Makro- und Mikroangiopathien
sowie Neuropathien[1]. Ausgangspunkt und gleichzeitig Indikator
für die Extremität (und potenziell das Leben) gefährdende
Komplikationen ist das Fußulkus, das sich bei Missachtung
oder inadäquater Behandlung rasch zu einer aggressiven,
destruierenden diabetischen Fußinfektion (DFI) mit Beteiligung
von Knochen und Gelenken entwickeln kann.
In der United
Kingdom Prospective Diabetes Study (UKPDS) No. 65 überstiegen
die durch Majoramputationen bedingten mittleren Fallkosten (€
12.257,95 % KI € 7.672 - 19.126) diejenigen nicht-tödlicher
Herzinfarkte und Schlaganfälle zusammen [2]. Leider sind
Maßnahmen der primären Prävention nicht so wirksam,
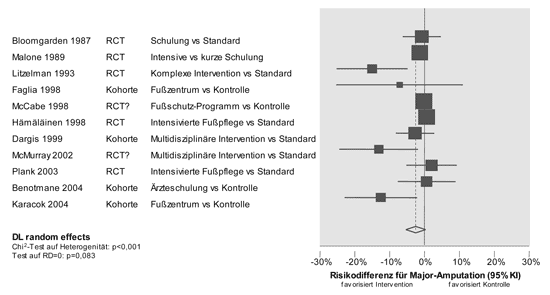
wie gemeinhin angenommen wird. Abbildung 1 fasst die verfügbaren
Daten aus randomisierten und Kohortenstudien zusammen (Literatur
bei den Verfassern).
Abbildung 1: Quantitative Synthese der Daten
zur Primärprävention von Amputationen bei diabetischen
Fußsyndromen. DL = DerSimonian und Laird. RCT =
randomized controlled trial (Fragezeichen deuten auf methodische
Unsicherheiten im Hinblick auf eine tatsächlich zufällige
Patientenzuteilung oder eine Maskierung des Randomisationsplans
hin). Die gepoolte Risikodifferenz beträgt 2,5 %
(95 % Kl -0,3 - 5,4 %) zugunsten der Interventionsgruppe,
das relative Risiko 0,98 (95 % Kl 0,95 - 1,01).
|
Der Sekundärprävention,
d.h. der adäquaten chirurgischen Sanierung und effektiven
antimikrobiellen Therapie kommt somit eine umso größere
Bedeutung zu. Dies gilt im besonderen Maß für DFI
mit Osteomyelitis.
Mit der
Infektion des Knochens (ab Wagner-Armstrong-Stadium 3B, s. Tabelle
1) gewinnt die DFI eine neue, therapeutisch nur schwer zu beherrschende
Qualität. In einer jüngeren Expertenumfrage wurde
von 353 Teilnehmern im Median eine Versagerquote von 18 % toleriert.
Über 60 % der Experten sahen 20 %, ein Drittel selbst 30
% als klinisch und wissenschaftlich akzeptabel an [3]. Der therapeutische
Nihilismus wird durch die zunehmende Verbreitung polyresistenter
Bakterien, insb. jedoch Methicillin-resistenter Staphylococcus
aureus (MRSA) spec. noch verstärkt.
Tabelle 1: Einteilung der DFI in Anlehnung an
das University of Texas Wound Classification Scheme [4]
Wagner-Klassifikation |
| Texas-Grad |
0 |
1 |
2 |
3 |
4 |
5 |
| A |
prä-/post-ulzerative
Läsion, komplett epithelisiert |
oberflächliche
Wunde |
Wunde
bis zur Ebene von Sehnen und Kapseln |
Wunde
bis zur Ebene von Knochen und Gelenken |
Gangrän
oder Nekrose von Fußteilen |
Gangrän
oder Nekrose des ganzen Fußes |
| B |
Infektion |
Infektion |
Infektion |
Infektion |
Infektion |
Infektion |
| C |
Ischämie |
Ischämie |
Ischämie |
Ischämie |
Ischämie |
Ischämie |
| D |
Infektion
und Ischämie |
Infektion
und Ischämie |
Infektion
und Ischämie |
Infektion
und Ischämie |
Infektion
und Ischämie |
Infektion
und Ischämie |
|
Obwohl die
adjuvante antimikrobielle Therapie als unverzichtbar gilt, existiert
bisher keine Evidenz aus randomisierten oder quasi-randomisierten
Studien für einen Behandlungsvorteil einer Substanz gegenüber
anderen. Abbildung 2 zeigt exemplarisch Studiendaten unter dem
Endpunkt der Major-Amputation (Literatur bei den Verfassern).
Abbildung 2: Quantitative Synthese der Daten
zur Sekundärprävention von Amputationen bei
diabetischen Fußsyndromen. MH = Mantel-Haenszel
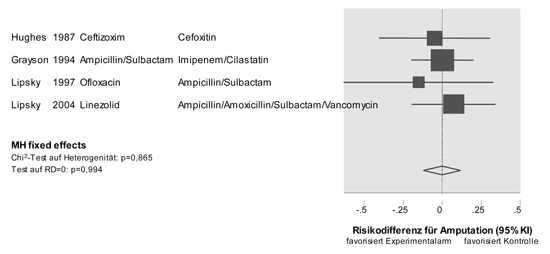
|
Die gesundheitsökonomische
Bedeutung von diabetischen Fußinfektionen, die dramatischen
Konsequenzen für die Betroffenen und die unsichere Datenlage
zwingen neben einer Neuentwicklung von Behandlungsstrategien
auch zu einer Evaluierung selten verwendeter Antibiotika.
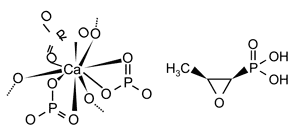
Eine interessante
Substanz ist das Epoxid Fosfomycin, das sich aufgrund seiner
strukturellen Analogie mit Hydroxylapatit im Knochen anreichert
(Abbildung 3).
Abbildung 3: Strukturformel von Hydroxylapatit
(li.) und Fosfomycin (re.)
|
Aktuelle
Ergebnisse von Mikrodilutions-Studien legen eine vergleichbar
hohe Penetration von Fosfomycin in entzündetes und nicht-entzündetes
Weichteilgewebe bei DFI [5] bzw. die interstitielle Flüssigkeit
im Skelettmuskel [6] nahe.
In einer
multizentrischen Untersuchung wurde die klinische Wirksamkeit
einer intravenösen Fosfomycin-Therapie bei extremitätengefährdenden
DFI mit Osteomyelitis getestet. Neben der Dokumentation der
Arzneimittelsicherheit sollte der Effekt auf die Rate von Major-Amputation
geprüft werden, um bei günstigem Nutzen-Risiko-Profil
verlässliche Daten zur Planung einer randomisierten Studie
zu erhalten.
|
| Material
und Methoden
Studiendesign
In eine
multizentrische Anwendungsbeobachtung wurden an fünf österreichischen
Zentren Patientinnen und Patienten > 18 Jahre mit insulinpflichtigem
oder nicht-insulinpflichtigem Diabetes mellitus und akuter einseitiger,
abszedierender Fußinfektion eingeschlossen. Das Protokoll
sollte ein pragmatisches Vorgehen entsprechend lokaler Standards
ermöglichen und sah keine Einschränkungen hinsichtlich
begleitender Behandlungen vor.
Fosfomycin
wurde als Kurzinfusion über 30 Minuten verabreicht. Als
empfohlene Mindestdosierung gelten 8 g zweimal täglich;
die tägliche Maximaldosis sollte 24 g nicht überschreiten.
Die Diagnose
wurde klinisch anhand von Infektionszeichen wie Sekretion, Schwellung,
Rötung und Fieber > 38,6°C gestellt. Eingeschlossen
wurden Patienten mit und ohne mikrobiologischen Keimnachweis.
Vorausgesetzt
wurde wenigstens eine tiefe, infizierte Ulzeration mit Knochenbeteiligung
(entsprechend Wagner-Armstrong-Stadium 3B und höher). Die
Diagnose der Osteomyelitis wurde radiologisch (Lyse und/oder
Sequester in konventionellen Röntgenaufnahmen in 2 Ebenen)
oder durch "probing to bone" (PTB) Prüfung gestellt.
Ausgeschlossen wurden Patienten, bei denen vor Einleitung der
Fosfomycin-Behandlung chirurgische Interventionen durchgeführt
wurden; Ausnahme war eine Exzision von Abszessen. Auch gefäßchirurgische
Eingriffe führten zum Studienausschluss. Zudem wurden schwangere
und stillende Frauen sowie Patienten mit bekannter Allergie
gegen Fosfomycin ausgeschlossen.
Endpunkte
Als primäres
Zielkriterium wurde die Rate von Amputationen oberhalb der Chopart-Gelenklinie
betrachtet. Aufgrund des beobachteten Charakters dieser Untersuchung
wurde keine explizite Nullhypothese formuliert. Die Fallzahlplanung
orientierte sich somit nicht an einer bestimmten statistischen
Mächtigkeit (power oder 1 - beta) für den Nachweis
einer Differenz. Die Stichprobe sollte groß genug sein,
um eine verlässliche Schätzpräzision der Mittelwerte
zu erzielen. Die Weite binomial-exakter 95 % Konfidenzintervalle
(KI) sollte ± 15 % der beobachteten Ereignisraten nicht
überschreiten. Dies wurde durch eine Fallzahl von wenigstens
50 auswertbaren Patienten gewährleistet.
Patientenzentrierte
Behandlungsergebnisse standen im Vordergrund dieser Untersuchung;
bakterielle Eradikationsraten wurden nicht analysiert. Unerwünschte
Arzneimittelwirkungen wurden dokumentiert; vorgesehen war auch
die behördliche Meldung eventueller schwerer Arzneimittel-Nebenwirkungen
(severe adverse events, SAE).
Statistische
Auswertung
Die Auswertung
erfolgte in explorativer Intention. Es wurden alle Patienten
ausgewertet, die wenigstens eine Fosfomycin-Dosis erhielten.
Demografische Details und Risikoprofile wurden je nach Verteilungsvoraussetzung
als Mittelwerte, Mediane oder prozentuale Anteile mit adäquaten
Streugrößen dargestellt. Für binäre Zielgrößen
wurden binomial-exakte 95 % KI berechnet. Bei ausreichendem
Stichprobenumfang wurde mittels univarianter logistischer Regression
der Einfluss von verschiedenen Risikovariablen auf die Behandlungsergebnisse
überprüft; diese Ergebnisse wurden als Chancenquotienten
(Odds Ratios [OR] mit 95 % KI angegeben.
|
| Ergebnisse
Population
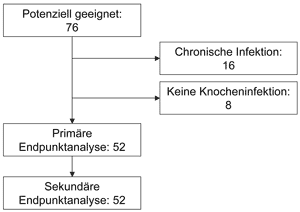
Das Studienprofil
ist in Abbildung 4 dargestellt. Tabelle 2 gibt eine Übersicht
über demografische Details und biologische Risikofaktoren.
Abbildung 4: Studienprofil
|
Lediglich
bei zwei Patienten wurden im Vorfeld geringfügige chirurgische
Eingriffe durchgeführt (Inzision und Drainage bzw. partielle
Resektion des ersten Mittelfußknochens). Ein weiterer
Patient hatte 33 Tage vor Therapiebeginn eine perkutane transluminale
Angioplastie und Stent-Implantation der A. femoralis erhalten.
Erfolglos vorbehandelt waren 22 Patienten. Positive bakteriologische
Befunde waren bei 41 Patienten zu erheben.
Tabelle 2: Demografische und biologische Eckdaten
| Mittleres
Alter, Jahre (Standardabweichung) |
63 |
(9) |
| Männer |
35 |
(67
%) |
| Frauen |
17 |
(33
%) |
| Mittlerer
Body Mass Index, kg/cm² (Standardabweichung)
|
25 |
(8) |
| Mittlere
Anamnesedauer, Jahre (Standardabweichung) |
13 |
(11) |
| Begleiterkrankungen |
|
|
| |
Arterielle
Hypertonie |
26 |
(50
%) |
| |
Hyperlipidämie |
23 |
(44
%) |
| |
Nikotinabusus |
11 |
(21
%) |
| |
Alkoholabusus |
9 |
(17
%) |
| Schweregrad |
|
|
| |
3A |
20 |
(39
%) |
| |
3B |
12 |
(23
%) |
| |
4A |
12 |
(23
%) |
| |
4B |
5 |
(10
%) |
| |
5 |
3 |
(6
%) |
| Mittlere
Vorbehandlungsdauer, Tage (Standardabweichung) |
15 |
(8) |
| Vorherige
Antibiotikatherapie |
|
|
| |
keine |
30 |
(58
%) |
| |
Monotherapie |
11 |
(21
%) |
| |
Mehrfachtherapie |
11 |
(21
%) |
| Mikrobiologie |
|
|
| |
kein
Keimnachweis |
11 |
(21
%) |
| |
monobakteriell |
17 |
(33
%) |
| |
Mischinfektion |
24 |
(46
%) |
|
|
Behandlungsregime
Die mittlere
Therapiedauer lag bei 14 (95 % KI 12 - 17) Tagen, die mittlere
verabreichte Fosfomycin-Dosis bei 15 g (95 % Ki 14 - 16). Als
Kombinationspartner wurden bei 41 Patienten Meropenem (n = 14),
Amoxicillin/Sulbactam (n = 12), Clindamycin (n = 10), Ceftriaxon
(n = 4) oder Imipenem (n = 2) verwendet.
Ein chirurgisches
Knochen- und Weichteildébridement wurde durchschnittlich
9 (95 % KI 4 - 15) Tage nach Einleitung der Fosfomycin-Behandlung
bei 35 Patienten erforderlich. Die topische Behandlung wurde
bei 20 Patienten mit Octenisept-Lösung, in 13 weiteren
Fällen mit PVP-Iod durchgeführt. Hydrokolloidverbände
kamen bei sieben Patienten zur Anwendung. Bettruhe wurde in
21 Fällen angeordnet; 38 Patienten erhielten therapeutisches
Schuhwerk.
Klinische
Erfolgsraten
Bei 13 Patienten
(25 %, 95 % KI 14 - 39 %) erfolgten transmetatarsale Vorfußamputationen;
zehn weiteren Patienten wurden Zehen amputiert.
Der Erhalt
einer belastungsfähigen unteren Extremität gelang
in 48 von 52 Fällen (92 %, 95 % KI 81 - 98 %). Es mussten
drei Oberschenkel- und einige Unterschenkelamputationen durchgeführt
werden.
Vier Patienten
wurden von den dokumentierenden Ärzten trotz Extremitätenerhalt
als Therapieversager gewertet. Unter der Annahme des Szenarios
des schlechtesten Falls und einer bei diesen Patienten im weiteren
Verlauf notwendig werdenden Major-Amputation ist von einer klinischen
Erfolgsrate von 85 % (95 % KI 72 - 93 %) auszugehen.
Relative
Chance eines Extremitätenerhaltes
Patienten
mit Wagner-Armstrong-Stadium 4 und 5 hatten gegenüber Patienten
mit Stadium 3 erwartungsgemäß eine geringere Chance
für einen Extremitätenerhalt (OR 0,57, 95 % KI 0,45
- 2,03). Eine über 12 g täglich hinausgehende Fosfomycin-Dosis
hatte keinen eindeutig günstigen Einfluss auf die klinische
Erfolgsrate (OR
0,88, 95 % KI 0,60 - 1,30). Die Ergebnisse der univarianten
logistischen Regression sind in Abbildung 5 dargestellt. Aufgrund
der geringen Ereignisraten und der Breite der Konfidenzintervalle
sind die Resultate mit Vorsicht zu interpretieren.
Abbildung 5: Ergebnisse der univarianten logistischen
Regressionsanalyse
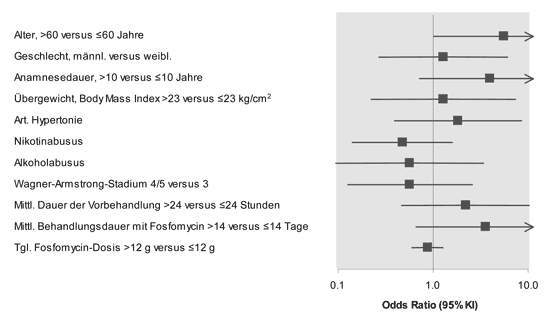
|
Arzneimittelsicherheit
Unter der
Behandlung mit Fosfomycin traten keine schweren Arzneimittel-Nebenwirkungen
auf (obere 97,5 % Konfidenzgrenze für Nullereignis 7 %).
Exzellente Verträglichkeit war bei 36 Patienten (69 %,
95 % KI 55 - 81 %), gute Verträglichkeit bei 12 Patienten
(23 %, 95 % KI 13 - 37 %) gegeben. Vier Patienten klagten über
leichte Übelkeit und Hautausschlag. Die Behandlung wurde
bei einem dieser Patienten nach Gabe von 88 g Fosfomycin über
8 Tage abgebrochen. Bei einem weiteren Patienten wurde die Behandlung
für fünf Tage ausgesetzt und danach in einer Dosierung
von 3 x 8 g täglich ohne erneutes Auftreten von unerwünschten
Wirkungen fortgeführt. |
| Diskussion
Die intravenöse
Therapie mit Fosfomycin führt auch in der Second-Line-Situation
bei Patienten mit schweren DFI zu einer günstigen klinischen
Ausheilungsrate unter Erhalt einer belastungsfähigen Extremität.
Die hier
beobachteten Amputationsraten, die natürlich im Kontext
eines multimodalen Behandlungsregimes betrachtet werden müssen,
sind gut mit publizierten Daten aus Vorstudien vereinbar. Unter
Berücksichtigung der unteren 95 % Konfidenzgrenze sind
die Daten aus dieser Stichprobe mit einer Extremitäten-Erhaltungsrate
unter Fosfomycin-Therapie von wenigstens 81 % vereinbar.
Aus klinisch-infektiologischer
Sicht mag der Verzicht auf eine Betrachtung bakterieller Eradikationsraten
eine Schwäche dieser Untersuchung sein. Unter gesundheitsökonomischen
Kriterien wird derartigen Surrogaten zukünftig jedoch nur
noch untergeordnete Bedeutung zukommen. Für die Nutzenbewertung
von Arzneimitteln sollten lediglich harte Endpunkte mit gesichertem
Einfluss auf Kosten, Qualität und Quantität des Lebens
Berücksichtigung finden - ein härteres und reproduzierbareres
Kriterium als der Extremitätenverlust ist für das
DFI-Szenario kaum denkbar.
Zu unterstreichen
ist der beobachtende Charakter dieser Untersuchung; der Einfluss
einzelner Risikovariablen auf die Behandlungsergebnisse kann
nur unzureichend beschrieben werden. Das Behandlungskonzept
ist viel versprechend und wird in einer randomisierten Prüfung
weiterverfolgt.
|
Literatur:
| 1.
Centers for Diesease Control and Prevention: "History
of foot and ulcer among persons with diabetes - United States,
2000-2002." Morb. Mortal. Wkly Rep. 52 (2003) 1098-102. |
| 2.
Clarke P., Gray a., Legood R., Briggs A., Holman R.,: "The
impact of diabetes-related complications on healthcare costs:
results from the United Kingdom Prospective Diabetes Study
(UKPDS Study No. 65)." Diabet. Med. 20 (2003) 442-50.
|
| 3.
Perencevich E.N., Kaye K.S., Strausbaugh L.J., Fisman D.N.,
Harris A.D.: "Acceptable rates of treatment failure
in osteomyelitis involving the diabetic foot: a survey of
infectious diseases consultants." Clin. Infect. Dis.
38 (2004) 476-82. |
| 4.
Oyibo S.O., Jude E.B., Tarawneh I., Nguyen H.C., Harkless
L.B., Boulton A.J.: "A comparison of two diabetic foot
ulcer classification systems: the Wagner and the University
of Texas wound classification systems." Diabetes Care
24 (2001) 84-88. |
| 5.
Zeitlinger M.A., Marsik C., Georgopoulos A., Muller M.,
Heinz G., Joukhadar C.: "Target site bacterial killing
of cefpirome and fosfomycin in critically ill patients."
Int. J. Antimicrob. Agents 21 (2003) 562-567. |
| 6.
Legat F.J., Maier A., Dittrich P. et al: "Penetration
of fosfomycin into inflammatory lesions in patients with
cellulitis or diabetic foot syndrome." Antimicrob.
Agents Chemother. 47 (2003) 371-374. |
Anschrift des Verfassers:
Dr. med. Dirk Stengel, MSc (Epi)
Abteilung für Klinische Epidemiologie, Klinik für
Unfall- und Wiederherstellungschirurgie
Unfallkrankenhaus Berlin
D-12683 Berlin, Warener Str. 7
E-Mail:
stengeldirk@aol.com
|
|
|